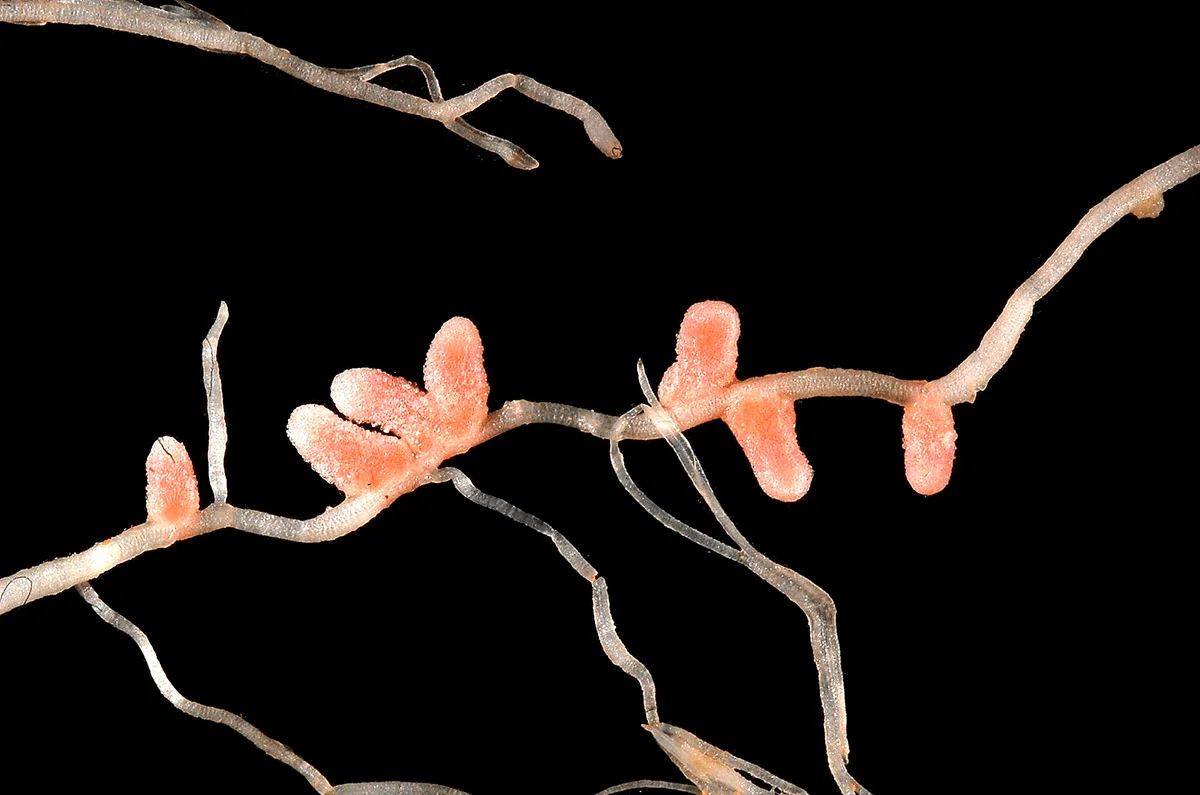
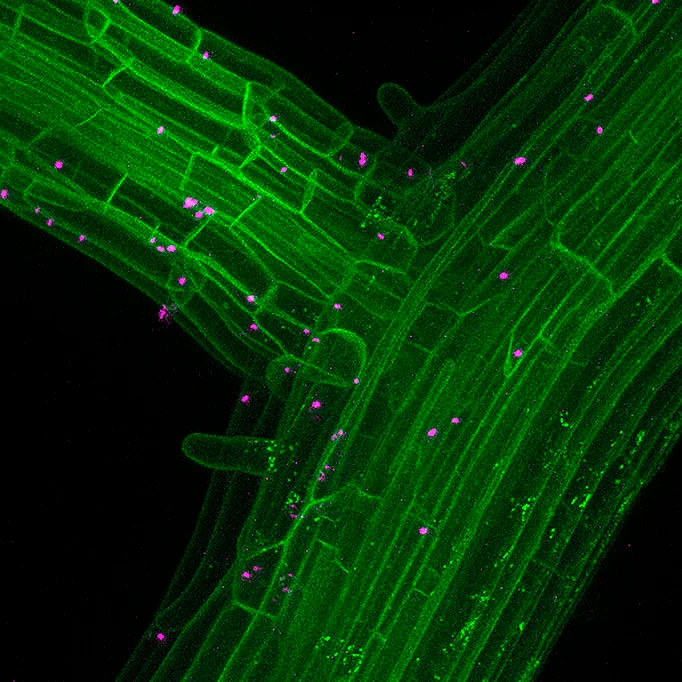
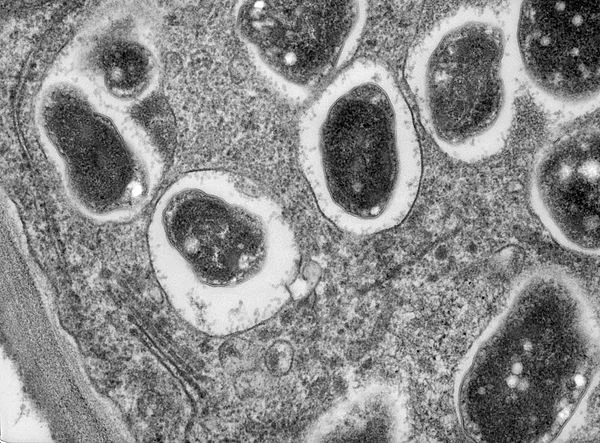
Пробиотики для растений: как накормить растущий мир
08 сентября 2020
Пробиотики для растений: как накормить растущий мир
- 5335
- 2
- 2
Пробиотики для растений — будущее «зеленого» сельского хозяйства!
иллюстрация Александра Быкова
-
Автор
-
Редакторы
-
Рецензент
Темы
Один из способов повышения урожайности растений — подселение к ним «правильной» микробиоты. Симбионты-бактерии, грибы, археи и вирусы (про последних часто забывают) нужны растениям не меньше, чем кишечная микробиота — человеку. «Правильный» микробиом помогает растениям разными способами: добывает так остро необходимый азот, увеличивает растворимость и доступность минеральных удобрений, защищает от патогенов, синтезирует полезные для растений вещества и стимуляторы роста, очищает почву от вредных веществ. Микробиота может даже защитить от резкого перепада температур, что особенно важно в условиях меняющегося климата. В этой статье мы поговорим о механизмах работы пробиотиков для растений и о том, какую пользу они могут принести современному сельскому хозяйству.

Ассоциация коммуникаторов в сфере образования и науки (АКСОН) при поддержке компании Bayer провела грантовый конкурс для российских научных журналистов «Life Science глазами журналистов». Одним из победителей конкурса стала Наталия Солнцева из «Биомолекулы» с материалом о создании микроорганизмов-симбионтов для сельскохозяйственных культур.
Жизнь всех людей на планете (а сегодня нас 7,8 млрд человек [1]) зависит от сельского хозяйства. Население Земли неуклонно растет и, по расчетам Департамента по экономическим и социальным вопросам ООН (United Nations, Department of Economic and Social Affairs), к 2050 году достигнет 9,8 млрд человек. С увеличением числа людей неизбежно будет изменяться и их рацион; особенно сильно это затронет жителей развивающихся стран, которые начнут потреблять больше калорий животного происхождения, так как для них мясо будет становиться всё более доступным [2]. Растущая животноводческая отрасль, в свою очередь, нуждается в земле, воде и кормах. При таком сценарии развития событий существует риск глобальной нехватки ресурсов, поэтому поиск более эффективных способов ведения сельского хозяйства — актуальная задача, над которой по всему миру работают тысячи ученых и даже целые институты.
Интенсивное (или традиционное) сельское хозяйство основано на применении колоссальных объемов химических удобрений и пестицидов. При чрезмерном использовании эти вещества пагубно влияют на здоровье людей и животных, а также накапливаются в почве и воде, загрязняя экосистемы , [3].
Подробнее о пестицидах и всех рисках, которые они несут, можно узнать из статей «Коварные помощники человечества: пестициды» [4] и «Контроль за пестицидами. Полиция в белых халатах» [5] из спецпроекта «Пестициды».
Существует тесная взаимосвязь между чрезмерным применением азотных удобрений и проблемами окружающей среды, такими как эвтрофикация (насыщение водоемов биогенными элементами, приводящее к бурному развитию водорослей), парниковый эффект, истощение озонового слоя и кислотные дожди [6]. Кроме того, производство химических удобрений и пестицидов сопряжено с высокими энергозатратами. Поэтому критически важно, чтобы новые подходы оставались «зелеными» — не нарушали баланса с окружающей средой, но при этом были достаточно эффективными, составляя конкуренцию традиционным методам в решении непростой задачи — «Как накормить растущий мир?».
Одним из способов повышения урожайности растений является подселение к ним «правильной», или «стимулирующей» микробиоты. «Стимулирующее» сообщество микроорганизмов может увеличить размер семян, повысить сопротивляемость растения паразитам (например, паразитическим нематодам) и даже улучшить вкусовые свойства плодов (да-да, такое тоже возможно!) [7–9]. Подбирать «стимулирующую» микробиоту традиционной селекцией очень долго: на это могут уйти годы или даже десятилетия, поэтому лучше сразу обратиться к современным технологиям: генетическому анализу, поиску нужных микробов через базы данных и генной инженерии — инструменту куда более точному и быстрому .
Чтобы понять, как работают эти методы, необходимо разобраться с основами генной инженерии. В этом вам помогут статьи: «От ГМО к растениям будущего. Всё самое интересное о сложной работе современного селекционера» [10], «Модельные организмы: арабидопсис» [11], «12 методов в картинках: генная инженерия. Часть I, историческая» [12] и «...Часть II: инструменты и техники» [13].
С помощью генной инженерии получить микроорганизмы и растения с заданными свойствами можно всего за несколько поколений. Этот способ настолько мощный, что можно даже сделать их подходящими строго друг к другу, и не бояться, что полезные микробы «перебегут» к сорнякам и будут «работать» на них. Несмотря на внушительные успехи генной инженерии и развитие синтетической биологии [14], собрать полностью нового микроба с заданными свойствами мы пока не можем. Более реалистичный вариант — дополнить геном микроба нужными нам генами (для синтеза защитных веществ, факторов роста и т. д.) и использовать его для улучшения роста определенных с/х культур.
Где обитает полезная микрофлора?
Микроорганизмы-симбионты обитают на всей поверхности надземных органов растения, в ризосфере и даже в его внутренних тканях (рис. 1). Исходя из этого, их можно условно разделить на две группы:
- Свободноживущие, которые живут вне клеток растения и усиливают его рост, высвобождая полезные метаболиты в околокорневое пространство (ризосферу), на поверхность корней (в ризоплану) или наземных частей растения. Именно бактерии ризосферы вносят наибольший вклад в улучшение роста растений.
- Эндофиты, которые живут внутри растительных тканей и/или клеток и напрямую обмениваются метаболитами с растением-хозяином [15].
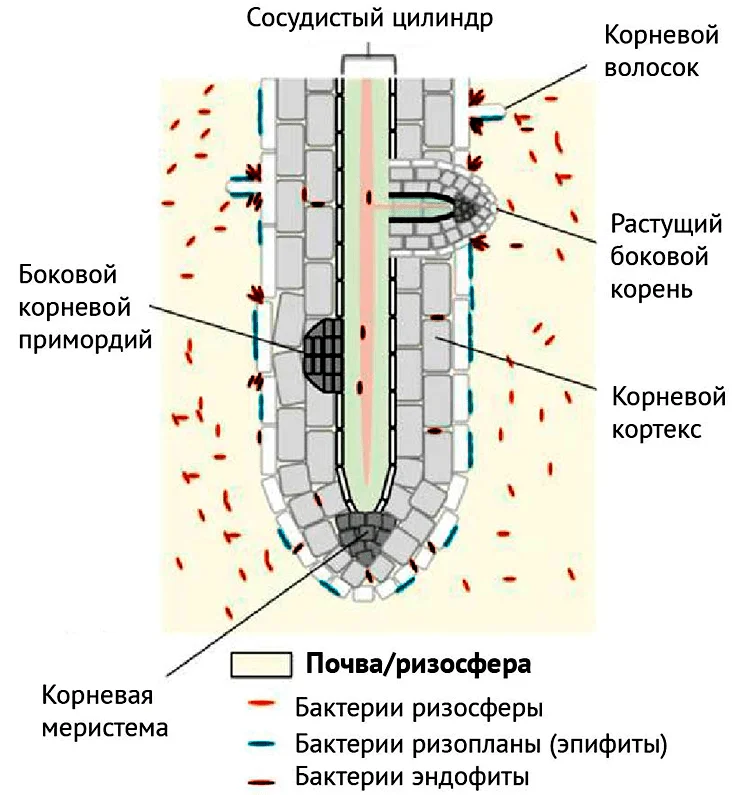
Рисунок 1. Ниши колонизации микроорганизмами корня растения. Бактерии ризосферы (оранжевые клетки) колонизируют зону почвы, прилегающую к корням, не проникая при этом во внутренние ткани растения. Бактерии ризопланы, или эпифитные бактерии (синие клетки) находятся в тесном взаимодействии с поверхностью корня и иногда могут быть обнаружены в тканях растения. Эндофитные бактерии (красные клетки) колонизируют различные области в эпидермисе корня и могут находиться в апопластических межклеточных пространствах и апопласте сосудов ксилемы. Эндофиты проникают во внутренние ткани растения через места повреждений в эпидермисе, кончиках корней и в местах появления боковых корешков. Некоторые эндофитные бактерии могут распространяться в отдаленные органы растений (стебель, листья, семена и плоды).
[16], рисунок модифицирован
Большинство эндофитных бактерий обитает в апопласте (межклеточном прострастве и клеточных стенках) растения-хозяина, чаще всего в корнях. Однако есть некоторые бактерии, способные вступать в настоящие мутуалистические взаимодействия со своими хозяевами — проникать внутрь его клеток. Самым хорошо изученным примером такого взаимодействия являются корневые клубеньки — особые образования на корнях растений, преимущественно бобовых, ассоциированные с симбиотическими азотфиксирующими бактериями отряда Rhizobiales (рис. 2) [17].
Давайте разберемся в терминах!
Полезную микрофлору растений называют по-разному. В английском научном языке фигурирует несколько терминов: plant growth promoting microorganisms (PGPM — микроорганизмы, усиливающие рост растений [18]), plant growth promoting bacteria (PGPB, бактерии, усиливающие рост растений [4]) и наиболее конкретный — plant growth promoting rhizobacteria (PGPR, ризобактерии, усиливающие рост растений), потому что большая часть бактерий-симбионтов растений обитает именно в ризосфере [19–21]. Специально приготовленную для сельскохозяйственного использования смесь таких микроорганизмов называют biofertilizers — «биоудобрения», или plants probiotics — «пробиотики растений» [22].
С терминами на русском языке всё немного сложнее. Среди них можно встретить, например, такие: стимулирующие рост растений бактерии [23], агрономически полезная микрофлора и пробиотики для растений [24].
Пробиотики — это смесь живых микроорганизмов, приносящих пользу хозяину при введении. Чаще всего этот термин употребляют в контексте «прокачки» микробиоты человека и высших животных, однако с недавнего времени ведутся активные работы по разработке пробиотиков для растений и даже для кораллов [25]!
Чтобы избежать путаницы, далее в статье мы будем чаще всего использовать именно последний вариант — пробиотики для растений!
От микроба к пробиотику
Вот как сегодня выглядит стратегия подбора растительных пробиотиков поэтапно:
- выделение штаммов почвенных микроорганизмов из различных мест обитания;
- тестирование их свойств (способности солюбилизировать фосфаты, фиксировать азот, синтезировать растительные гормоны и их предшественники) в лабораторных экспериментах;
- наработка биомассы перспективных штаммов и их последующее подселение к модельным растениям (чаще всего агрономически важным: рису, сое, пшенице).
Самые перспективные кандидаты затем используют для дальнейших более глубоких исследований и полевых испытаний. Часть микроорганизмов подвергают генетическим модификациям, чтобы усилить полезные свойства или добавить в систему дополнительные рычаги контроля [26].
С помощью такой схемы были выделены и описаны десятки штаммов бактерий-пробиотиков, в основном из родов Azospirillum, Azotobacter, Beijerinckia, Bacillus, Burkholderia, Paenibacillus, Pseudomonas, Enterobacter, Klebsiella, Serratia и Streptomyces [27]. Их способность усиливать рост и увеличивать урожайность агрономически важных культур была показана во множестве полевых испытаний, о которых мы подробнее поговорим далее.
Как подселить полезных микробов к растению?
В естественной среде все растения обладают уникальной микробиотой. Задача ученого и идущего по его стопам «зеленого» фермера состоит в том, чтобы успешно подселить «полезные» микроорганизмы к растению и создать максимально комфортные условия для массовой колонизации. Чтобы заселить растение полезными микробами, используют три основных способа: инокуляцию семян, корней и/или почвы (рис. 3).
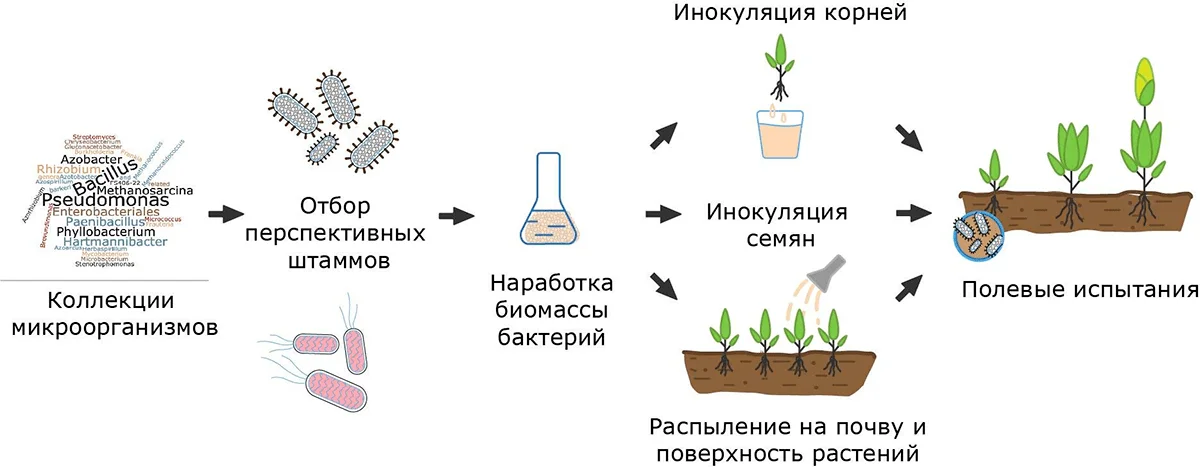
Рисунок 3. Отбор перспективных штаммов и способы колонизации растений пробиотиками: инокуляция семян, корней и/или почвы
иллюстрация автора статьи
Чаще всего для колонизации растения его корни, предварительно очистив от земли, инкубируют в суспензии клеточной культуры с полезными свойствами (рис. 3) [9], [28]. После инкубации, в ходе которой происходит колонизация корней, растения сажают обратно в почву. Эффективность этого способа чрезвычайно высока и приводит к массовой колонизации корней полезными микробами, которые часто остаются с растением на протяжении всей его жизни [9].
Другой метод — распыление суспензии живых бактерий на почву и поверхность растений или предшествующая посадке колонизация стерильных семян [29]. Эффективность колонизации при этом меньше, чем при окунании, но может быть увеличена с помощью разных приемов. Например, покрытие семян сои ризобактериями, иммобилизованными на нановолокнах, улучшает выживаемость этих бактерий на семенах в течение 30 дней, а также способствует успешной колонизации развивающихся корней микроорганизмами после прорастания [30].
Механизмы, стимулирующие рост растений
Итак, удачно подобранная микрофлора крайне полезна для растений и может значительно улучшить эффективность сельского хозяйства. Но каким образом микроорганизмы помогают растению? В каких процессах они участвуют и где обитают? Как и где применяются растительные пробиотики?
Механизмы, благодаря которым бактерии стимулируют рост и урожайность самых разных культур, можно условно разделить на несколько типов:
- биофертилизация почв: участие в азотфиксации, солюбилизация фосфатов и других солей;
- синтез сидерофоров;
- биосинтез фитогормонов и других биологически активных веществ;
- повышение устойчивости растения к патогенам или их угнетение;
- защита от абиотических стрессов;
- биоремедиация загрязненных почв.
Давайте подробнее поговорим о каждом из них.
Биофертилизация почв
Почва — залог успешного растениеводства, ведь именно из нее растение получает бóльшую часть минеральных веществ. Ее состав динамичен и определяется не только уже имеющимися компонентами и вносимыми удобрениями, но и во многом зависит от населяющих ее микроорганизмов. Об их влиянии на почву и рост растений мы и поговорим далее.
Бактерии-азотфиксаторы
Около ста лет назад был изобретен химический процесс Габера—Боша , который изменил мир до неузнаваемости.
Процесс Габера—Боша назван в честь двух немецких химиков-инженеров, внесших наибольший вклад в его разработку в 1904–1913 годах.
В его основе лежит простая химическая реакция: N2 + 3H2 ⇄ 2NH3, — атмосферный азот при высоком давлении и температуре реагирует с водородом на специальном катализаторе с образованием аммиака. Предложенный в начале ХХ века, этот процесс открыл возможность производства аммонийных удобрений в большом количестве, и недостаток азота в почве перестал быть ограничивающим фактором для развития сельского хозяйства. По сей день модифицированные варианты этой реакции остаются главным источником азота для человечества (по-видимому, около половины атомов азота в нашем теле ведут свое происхождение именно из нее) [31].
Однако всё имеет свою цену: процесс Габера–Боша глубоко изменил глобальный цикл азота [32], что привело к некоторым опасным последствиям.
Биологическая фиксация азота может стать «зеленой» альтернативой использованию химических азотных удобрений и, по крайней мере, частично заменить их. Кроме того, применение живых азотфиксаторов поможет уменьшить потери химически произведенного азота из-за выщелачивания и предотвратить его накопление в окружающей среде.
Фиксировать атмосферный азот умеют только прокариоты: бактерии и метаногенные археи (рис. 4) [35], [36]. При этом использование в качестве пробиотиков растений метаногенных архей — сомнительная идея. Несмотря на то, что они довольно часто встречаются в почве и даже являются частью нормальной растительной флоры, в ходе своей жизнедеятельности археи выделяют метан — опасный парниковый газ. Выделение дополнительного метана в атмосферу не входит в планы современных фермеров. Получается, что наиболее перспективные добытчики остро необходимого растениям азота — диазотрофные бактерии (то есть бактерии, способные фиксировать азот из атмосферы).
Способностью фиксировать азот обладает огромное количество микробов, как бактерий, так и архей. Эта черта важна не только для симбиоза с растениями, но с многими другими формами жизни — например, она есть у хемосинтетических симбионтов морских беспозвоночных [37].
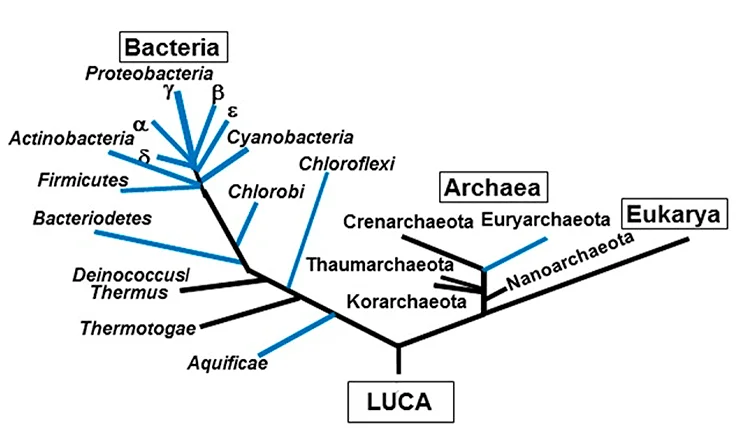
Рисунок 4. Трехдоменное древо жизни. Синим цветом выделены группы бактерий и архей, представители которых содержат гены кластера азотфиксации (nifHDKENB) и теоретически способны фиксировать атмосферный азот.
Симбиотическая азотфиксация
Пример симбиоза между клубеньковыми бактериями и бобовыми хорошо знаком нам со школы. Эти бактерии (например Rhizobia, Frankia) усваивают неорганический азот из атмосферы и передают его растению в доступной форме — органических азотсодержащих веществ (рис. 5, справа). Эффективность этого процесса очень велика [38], [39]. Кажется логичным взять клубеньковые бактерии и пересадить их на другие виды сельскохозяйственных небобовых культур — пшеницу, томаты, огурцы. Однако это не так просто. Проблема в том, что бактерии, способные к такому тесному симбиозу с растением, чрезвычайно видоспецифичны [38]. Они прошли миллионы лет эволюции, чтобы приспособиться к своим хозяевам. С другой стороны, изменять геном бактерий или растений, чтобы подружить их, очень трудозатратно. Это требует настолько огромных модификаций обоих участников симбиоза, что становится нецелесообразным и, вероятно, даже невозможным на данном этапе развития генной инженерии.
К счастью, делать этого совершенно не нужно, ведь помимо клубеньковых бактерий в почве есть огромное число свободноживущих диазотрофов, которые с радостью вступают в симбиоз с сельскохозяйственными культурами. Для растениеводов они интересны тем, что заменяют химические азотные удобрения, потенциально снижая производственные затраты и смягчая негативное воздействие удобрений на окружающую среду.
Свободноживущие азотфиксаторы
Свободноживущие азотфиксаторы (по-английски они называются FLNFB — free-living nitrogen fixing bacteria) — это бактерии, живущие около и/или на поверхности корней, реже в тканях. Именно эти диазотрофы являются основным источником азота в большинстве наземных экосистем [17].
Жизнь свободноживущих азотфиксаторов в почве обеспечивается растворенным органическим углеродом, в то время как клубеньковые бактерии напрямую зависят от простых углеродных соединений (например сукцината), синтезируемых и выделяемых растением (рис. 5). Концентрация кислорода в ризосфере сильно варьирует и определяется структурой и текстурой почвы, а также дыханием микробов и корней, поэтому свободноживущие диазотрофы чаще всего способны жить в большом диапазоне концентраций кислорода, что делает их более удобными объектами для промышленного применения. Симбиотические азотфиксаторы, в свою очередь, получают кислород в низких концентрациях и исключительно от растения-хозяина. Другое преимущество свободноживущих диазотрофов состоит в способности самостоятельно получать микроэлементы, необходимые для процессов азотфиксации, — P, Fe, Mo и V. Диазотрофов-симбионтов этими элементами обеспечивает растение-хозяин [17].
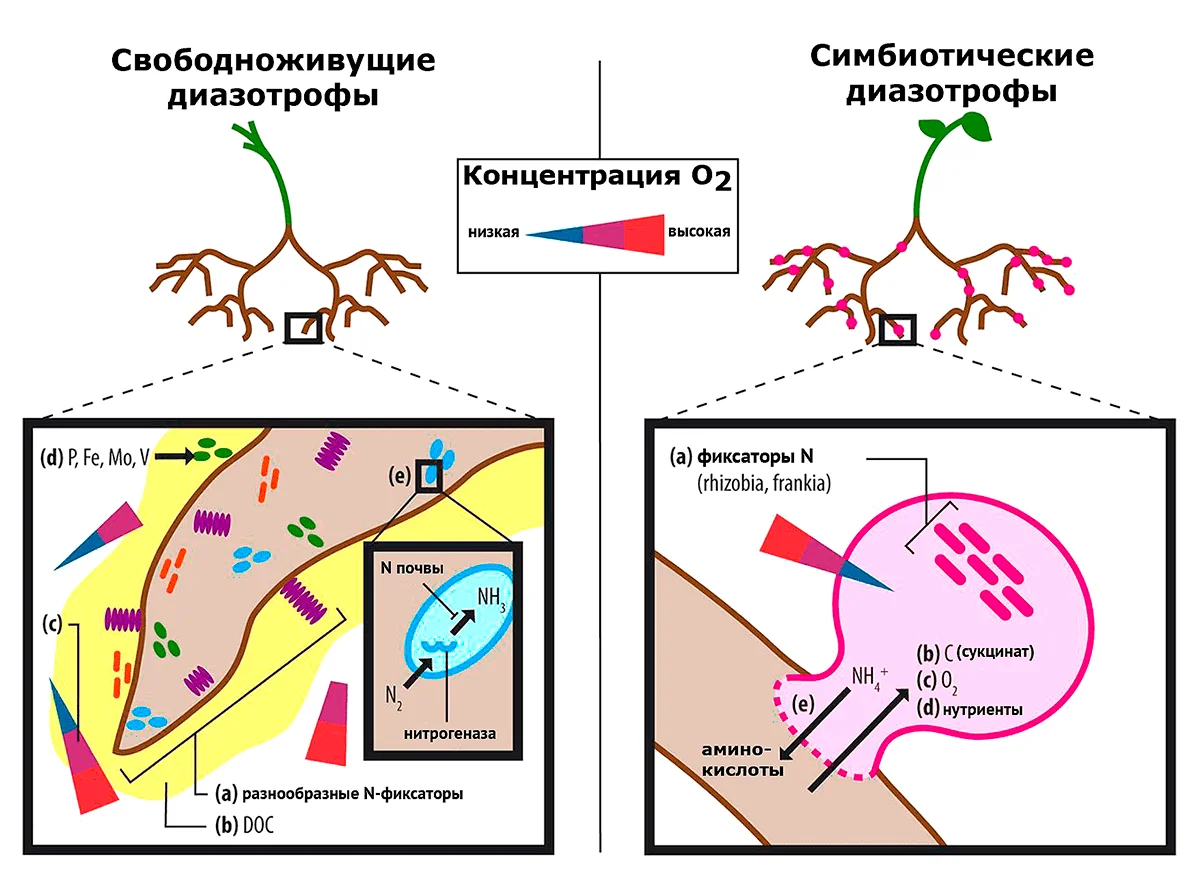
Рисунок 5. Основные отличия в экофизиологии свободноживущих и симбиотических диазотрофных бактерий. Свободноживущие диазотрофы (слева), в отличие от симбиотических (справа), способны жить в широком диапазоне концентраций кислорода, самостоятельно добывают необходимые микроэлементы и питаются растворенным в почве органическим углеродом.
[17], рисунок модифицирован
Как мы видим, физиологические и биохимические особенности свободноживущих диазотрофов делают их гораздо более удобными и пластичными для применения в сельском хозяйстве по сравнению с азотфиксаторами-симбионтами. Это работает не только в теории: в многочисленных экспериментах и полевых испытаниях свободноживущие диазотрофы очень хорошо себя показали.
Среди свободно живущих диазотрофных ризобактерий представители таксонов Azoarcus, Azospirillum, Azotobacter, Beijerinckia, Bacillus, Enterobacteria, Paenibacillus, Burkholderia, Gluconoacetobacter и Herbaspirillum были описаны как стимулирующие рост сельскохозяйственных культур [40]. Особенно много азотфиксаторов-симбионтов растений можно встретить среди Bacilli и Proteobacteria. Например, некоторые из наиболее хорошо изученных и часто используемых штаммов растительных пробиотиков относятся к роду Azospirillum (Proteobacteria). Во множестве экспериментов показано, что Azospirillum улучшает рост таких культур, как пшеница, кукуруза и рис [41].
Отличиться смогли и энтеробактерии (Enterobacteria — группа грамотрицательных протеобактерий, которая получила свое название из-за большого числа патогенов, которые в нее входят). Enterobacteria не только обитают в кишечнике человека и животных, но также в большом количестве встречаются и в почве, где некоторые штаммы способны фиксировать азот. Этой способностью воспользовались ученые, показав, что Enterobacter sp. стимулирует рост побегов кукурузы (рис. 6) и многих других культурных растений [42].

Рисунок 6. Добавление пробиотика — культуры Enterobacter sp. — стимулирует рост побегов и корней двухнедельных сеянцев кукурузы
Бактерии-солюбилизаторы
Фосфор (P) является вторым по необходимости питательным веществом для растений после азота. Снижать его потери при внесении фосфорных удобрений, не давая фосфатам быстро перейти в нерасторимую недоступную для растения форму, — еще одна задача, с решением которой могут помочь бактерии!
Бактерии почвы способны значительно повышать солюбилизацию фосфатов. В этом случае их называют фосфор-солюбилизирующими (phosphate solubilizing bacteria, PSB). Применение PS-бактерий может покрывать около 50% потребности посевов в фосфатах, значительно снижая использование вредных для среды химических удобрений. Среди почвенных бактерий эффективными солюбилизаторами фосфатов являются представители родов Micrococcus, Pseudomonas, Bacillus, Paenibacillus, Deftia, Azotobacter, Klebsiella, Rhizobium, Pantoea и Flavobacterium [40]. Например, показано, что штаммы Rhizobium leguminosarum с выраженными фосфор-солюбилизирующими свойствами — подходящие пробиотики для повышения урожайности перца и томата [40], а бактерии из рода Mesorhizobium, также эффективные P-солюбилизаторы, способствуют росту нута и ячменя [43], [44].
Наконец, третий по необходимости минеральный элемент, важный для здоровья растений, — это калий (К). И здесь нам опять на помощь приходят бактерии!
Существует довольно много ризобактерий, которые способны превращать нерастворимые соли калия в доступные для растений соединения. К наиболее перспектиыным K-солюбилизаторам относятся представители Firmicutes, в особенности роды Bacillus и Paenibacillus [45].
Бактерии и сидерофоры
Сидерофоры — это органические соединения, которые синтезируются микроорганизмами (бактериями, археями или грибами) с целью «захвата» трехвалентного железа из окружающей среды и его передачи в клетку по специальным каналам [46]. В случаях, когда почва обеднена ионами трехвалентного железа, сидерофоры почвенных микроорганизмов помогают растению более эффективно их добывать. Пока точные механизмы того, как бактерии снабжают железом растения, мало изучены [47]. Однако уже существуют многочисленные экспериментальные данные о важности этого феномена в стимуляции роста. Так, сидерофоры эндофитных штаммов Streptomyces способны стимулировать рост нима (Azadirachta indica), томатов и шоколадного дерева (Theobroma cacao) [48], [49], а продуцирующий сидерофоры штамм Phyllobacterium endophyticum PEPV15 способствует росту и повышает качество клубники [50].
Бактерии и фитогормоны
Многие бактерии-эндофиты способны синтезировать фитогормоны — «родные» для растений молекулы, которые регулируют их рост и развитие. В некоторых случаях бактерии синтезируют гормоны ради того, чтобы «захватить» растение и питаться его полезными «соками». Однако довольно широкий спектр условно полезных бактерий за счет гормонов повышает урожайность сельхозкультур [51].
Среди фитогормон-продуцирующих бактерий наиболее распространены и хорошо изучены штаммы, синтезирующие ауксины, цитокинины, гиббереллины и этилен. Каждый из этих фитогормонов по-разному участвует в процессах развития растений .
На «Биомолекуле» есть целый раздел со статьями про фитогормоны, где можно почитать интересные подробности о каждом из них.
Например, ауксины (группа растительных гормонов — производных индола) обладают высокой физиологической активностью: стимулируют рост плодов и побегов растений, верхушечный рост, фототропический рост (к свету), положительный геотропизм корней (рост вниз). Кроме того, они способны усиливать рост клеток камбия и придаточных корней, влиять на рост клеток в фазе растяжения и дифференцировку. Уменьшение концентрации ауксина в растении приводит к увяданию листьев. Среди акусинов 3-индолилуксусная кислота является наиболее известным и наиболее активным растительным гормоном.
У бактерий ауксины играют роль ключевых сигнальных молекул для коммуникации и координации своей деятельности. Среди ауксин-продуцирующих бактерий можно выделить представителей родов Bacillus, Paenibacillus, Enterobacter, Sphingomonas и многих других (рис. 7) [52].
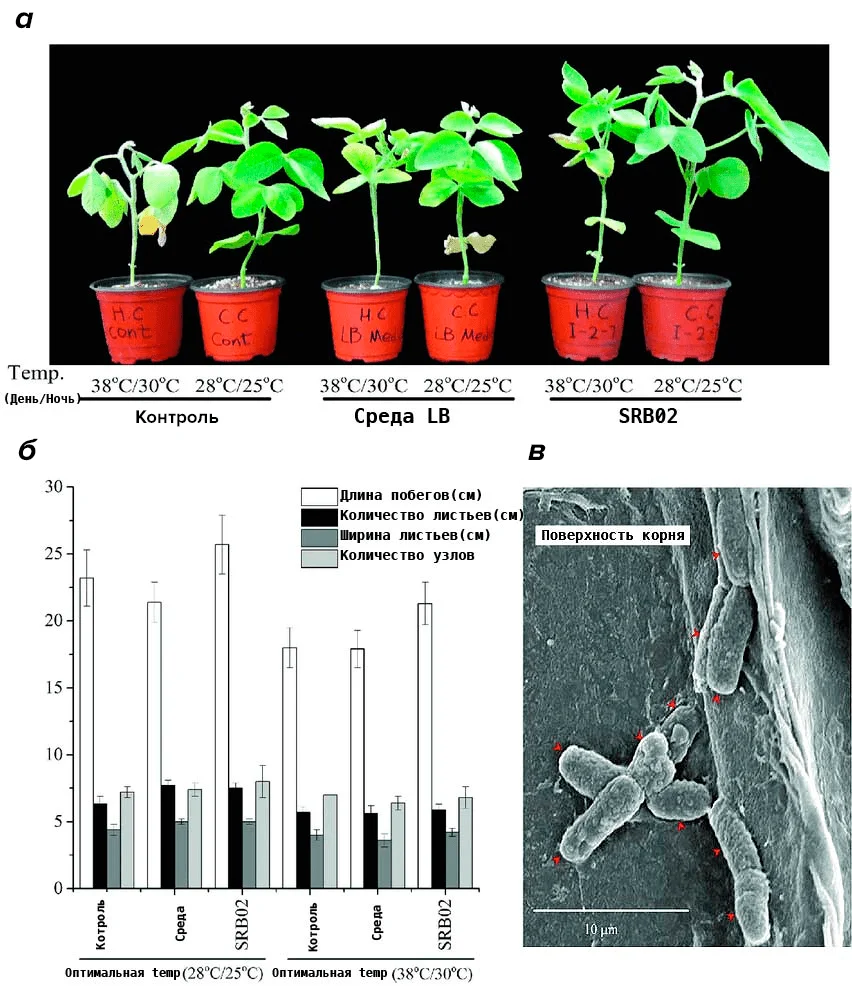
Рисунок 7. Применение Bacillus aryabhattai SRB02 в качестве пробиотика для увеличения урожайности сои. На вегетативной стадии развития сои в почву вносили культуру B. aryabhattai SRB02, стерилизованную питательную среду или дистиллированную воду (в качестве контроля). Дальнейшие эксперименты показали, что применение культуры SRB02 способствовало росту сои при всех температурных режимах и значительно увеличивало длину побегов, ширину листьев и количество узлов (а, б) после успешной колонизации корней в течение двух дней после инокуляции (в). Газовая хроматография и масс-спектрометрический анализ показали, что SRB02 продуцировал в культуре значительные количества абсцизовой кислоты, индолуксусной кислоты, цитокинина и различных гиббереллинов.
Помимо ауксинов, есть целый ряд других важных фитогормонов. Цитокинины способствуют цитокинезу, дифференцировке сосудов и доминированию верхушек корней. Гиббереллины участвуют в прорастании семян, росте стеблей и листьев, активируют цветение и развитие плодов. Наконец, растительный гормон этилен, как известно, регулирует созревание плодов, цветение и опадание листьев. Также было показано, что этилен способствует прорастанию семян, образованию вторичных корней и удлинению корневых волосков [40].
Все эти фитогормоны синтезируются огромным количеством растительных бактерий-симбионтов. Нам осталось только «приручить» их, заставить работать в наших интересах на благо «зеленого» сельского хозяйства. Здесь кстати придутся методы генной инженерии [13]. В частности, с их помощью можно «настроить» производство фитогормонов в необходимых количествах и даже активировать их синтез по специальному сигналу.
Защита от абиотических стрессов и биоремедиация почв
Причины абиотического стресса у растений могут быть самые разные: засуха, излишнее обводнение, экстремальные температуры, засоленность почвы, загрязнение тяжелыми металлами или сильный окислительный стресс. Всё это негативно сказывается на урожае [53].
Пагубное влияние внешних условий можно скорректировать с помощью бактерий. Например, штаммы Pseudomonas усиливают прорастание семян спаржи и рост ее саженцев в условиях водного стресса в режиме теплицы [54]. Штамм P. fluorescens MSP-393 действует в качестве стимулятора роста для нескольких культур, выращиваемых в засоленных почвах прибрежных экосистем, в то время как P. putida Rs-198 способствует росту проростков хлопчатника и увеличивает скорость их прорастания в условиях солевого стресса. Эти виды Pseudomonas увеличивают поглощение ионов Mg2+, K+ и Ca2+, уменьшая при этом поглощение Na+ и улучшая выработку эндогенной 3-индолилуксусной кислоты, что приводит к таким выгодным человеку последствиям [55], [56]. В другом эксперименте было показано, что инокуляция кукурузы различными ризосферными штаммами в условиях солевого стресса настолько эффективна, что ее можно сравнить с применением азотных удобрений [57].
Борьба с засухами, наводнениями и загрязнением почв с помощью бактерий — давно не фантастика, а реальность!
Бактерии против фитопатогенов
Бактерии-фитосимбионты играют огромную роль в патогенезе различных болезней растений. Механизмы предотвращения болезней бактериями могут быть прямыми или косвенными, в зависимости от того, ингибируются ли патогены в результате метаболизма бактерий-пробиотиков или их представители конкурируют друг с другом.
Производство антибиотиков, сидерофоров и ферментов, разрушающих клеточную стенку патогенов, — основные механизмы участия «полезных» бактерий в этой борьбе.
Патогенный гриб Gaeumannomyces graminis — возбудитель офиоболезной корневой гнили — опасной болезни, поражающей злаки и приводящей к значительным потерям урожая по всему миру [58]. Симптомы этого заболевания проявляются так: молодые растения выглядят низкорослыми, их наружные листья желтеют, а корни становятся темными и ломкими, в конечном итоге чернеют и отмирают (рис. 8). У взрослых злаков появляются пятна на листьях, колосья окрашиваются в серый или белый цвета. Пораженные растения слабо кустятся, к началу цветения листья увядают, а продуцирующие стебли отмирают. На сохранившихся стеблях формируется щуплое зерно или полное белоколосие. Продуктивность пораженных растений может снизиться на 50%.
Победить этот недуг может широко известная и хорошо изученная бактерия Pseudomonas spp. Штаммы Pseudomonas производят антибиотик 2,4-диацетилфлороглюцинол (2,4-DAPG), который подавляет рост патогенного гриба Gaeumannomyces graminis и позволяет сохранить урожай [59]. Гены, отвечающие за синтез 2,4-DAPG, распространены весьма широко — они найдены в 22 генотипах Pseudomonas spp. Из этого следует, что можно использовать не только ранее описанные штаммы псевдомонад, а также и естественные, обитающие в данной почве, предварительно сделав скрининг на гены синтеза 2,4-DAPG. Чаще всего нативные штаммы лучше приживаются и способны выдержать конкуренцию с «соседями» в среде, из которой они были выделены.
Но не только штаммы Pseudomonas эффективны в борьбе с Gaeumannomyces graminis. Различные виды родов Klebsiella, Bacillus, Acinetobacter и Paenibacillus также активно действуют против этого грибка [60].
Штаммы, принадлежащие к роду Bacillus — вообще рекордсмены по борьбе с патогенами! Большое количество штаммов Bacillus способны вырабатывать антибиотики, которые активны в отношении как грамположительных, так и грамотрицательных бактерий, а также многих патогенных грибов (рис. 9) [33], [61].

Рисунок 9. Обработка плодов клубники суспензией живых бактерией Bacillus contaminans B-1 оказывает ингибирующий эффект на развитие серой гнили. «Раны» на плодах созданы искусственно с помощью стерильной иглы.
[33], рисунок модифицирован
Пробиотики растений могут помочь в борьбе не только с патогенными микробами, но и с более крупными паразитами — нематодами и насекомыми. Например, специально подобранный комплекс стимулирующей микрофлоры для томатов значительно повышает их устойчивость к паразитической нематоде Meloidogyne sp. — разрушительному и широко распространенному возбудителю болезней у томатов [62], [63].
Meloidogyne incognita — паразит, который приводит к формированию галлов на корнях более чем 3000 видов растений. В результате ее жизнедеятельности сосуды корня закупориваются, что препятствует поступлению в растение воды и питательных веществ, из-за чего растение чахнет и погибает. Против нематоды Meloidogyne incognita особенно эффективна бактерия Bacillus firmus, вырабатывающая сериновую протеазу Sep1. В эксперименте Escherichia coli (рабочая лошадка биотехнологии [64]) была трансформирована геном sep1 Bacillus firmus и, таким образом, сама начала производить не свойственную ей протеазу. В результате показали, что протеаза Sep1 эффективно разрушает поверхностную кутикулу, «рот» и кишечник нематоды, что приводит к ее гибели. Кроме того, Bacillus firmus может быть использована и для борьбы с насекомыми, ведь их тела также покрыты кутикулой.
Вездесущая бактерия Brevibacillus lateosporus, которая часто обнаруживается в почве и непосредственно в ризосфере растений, — еще один штамм, с помощью которого можно бороться с насекомыми-вредителями с/х растений. Brevibacillus за счет своих инсектицидных свойств эффективна против большого числа жесткокрылых, чешуекрылых и двукрылых насекомых (рис. 10). Этот энтомопатогенный вид синтезирует антибиотики, различные хитиназы и токсины. Бóльшая часть этих инсектицидных генов уже найдена и изучена, а значит, мы можем применить методы генной инженерии и, при необходимости, «вставить» интересующие нас гены в другой перспективный штамм [63], [65].
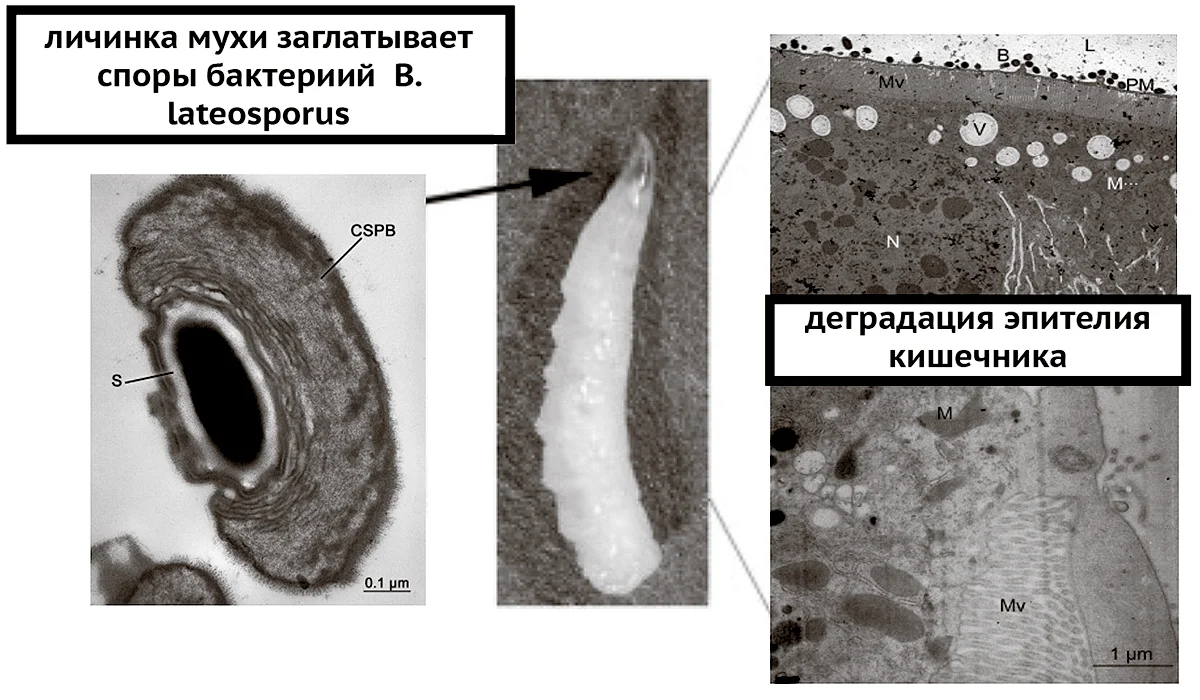
Рисунок 10. Обработка личинок мух бактерией Brevibacillus lateosporus первоначально приводила к их вялости, а в дальнейшем — к разрушению кишечника и смерти. На правой части иллюстрации виден разрыв клеток с высвобождением цитоплазмы в просвет кишечника личинки.
[65], рисунок модифицирован
Вирусы на службе у сельского хозяйства
Несмотря на то, что вирусные препараты не являются пробиотиками в классической трактовке этого термина (они не бактерии), мы всё же рассмотрим некоторые примеры их применения.
Использование вирусов в сельском хозяйстве насчитывает уже многие десятилетия. Первое зарегистрированное полевое испытание провели еще в далеком 1935 году: обработка семян кукурузы фагами предотвращала развитие болезни Стюарта (увядания Стюарта), вызываемой бактерией Pantoea stewartii [66].
Прежде всего, бактериофаги — это перспективный метод борьбы с патогенными бактериями — возбудителями различных заболеваний культурных растений. К сожалению, антибиотики, часто применяемые в растениеводстве для борьбы с микроорганизмами [67], [68], неспецифичны — они уничтожают не только «вредителей», но и представителей полезной микрофлоры растения, а также важных почвенных бактерий. Кроме того, применение антибиотиков неизбежно приводит к проблеме — распространению множественной микробной антибиотикорезистентности . От инфекций, связанных с бактериями с множественной лекарственной устойчивостью, во всем мире ежегодно умирает около 700 000 человек, и эта цифра может возрасти до десяти миллионов к 2050 году, если текущая тенденция сохранится [69].
У «Биомолекулы» есть спецпроект, посвященный антибиотикорезистентности бактерий. Почитайте, например, статью «Антибиотики и антибиотикорезистентность: от древности до наших дней» [70]. — Ред.
В отличие от антибиотиков, бактериофаги высокоспецифичны, и их использование никак не связано с распространением множественной лекарственной устойчивости среди бактерий.
Человечество пыталось бороться с помощью фаговой терапии со многими опасными возбудителями растений. К сожалению, не все эти попытки были успешными — многие исследования не привели к созданию действенных препаратов. Однако есть и удачные примеры. Так, в 2005 году в Агентстве по охране окружающей среды США был зарегистрирован первый фагосодержащий пестицид AgriPhageTM. Этот биопестицид содержит фаги, используемые для борьбы с болезнями томатов и перцев, вызываемыми бактериями Xanthomonas campestris и Pseudomonas syringae [71].
В растениеводстве используются не только бактериофаги. В индустрии декоративных растений применяется целый ряд вирусов, поражающих растения. Мозаичное инфицирование клеток листьев, плодов или цветков такими вирусами приводит к появлению пятен самых разных цветов и размеров, некоторые из которых интересны селекционерам (рис. 11а и 11б). Неожиданно много сортов декоративных растений обязаны своей ценностью именно вирусам, которые их заражают [72].
Помимо «декоративных» вирусов в некоторых работах были описаны вирусы, улучшающие рост растений, особенно в экстремальных условиях. Такие вирусы могут повышать устойчивость к засухе и заморозкам [73]. Кроме того, штаммы патогенных вирусов с легкими симптомами используются для перекрестной защиты от более тяжелых штаммов: это явление называется стратегией трансгенной устойчивости [73].
Пробиотики для растений: применение и перспективы
Пробиотики для растений уже внедрены в повседневную практику во многих фермерских хозяйствах по всему миру. Сегодня существует целый ряд коммерческих штаммов с самыми разнообразными полезными для растений свойствами. Их можно заказать у различных зарубежных компаний: TRICHODEX, AgroLiquid, Sigma AgriScience.
Рынок пробиотиков для растений в России не отстает от мирового! Он существует на протяжении уже многих десятилетий и активно развивается вместе с увеличением спроса на подобную продукцию от крупных фермеров и рядовых садоводов. В справочнике пестицидов и агрохимикатов 2020 можно найти десятки различных препаратов, достаточно просто указать название штамма в поисковой строке. Например, по запросу Bacillus система выдает ссылки на тридцать препаратов от различных производителей, которые имеют в своем составе различные штаммы этого рода.
Среди российских производителей пробиотиков для растений можно назвать, например, ООО НПФ «Исследовательский центр-17». Эта компания производит комплекс БАВов для растений под коммерческим названием «Фитоп». Например, «Фитоп 8.1» содержит споровую биомассу бактерий Bacillus subtilis DSM 32424, Bacillus amyloliquefaciens ВКПМ В-10642 (DSM 24614) и Bacillus amyloliquefaciens ВКПМ В-10643 (DSM 24615). Использование этого препарата, по обещанию производителя, приводит к улучшению роста, формированию оптимальной корневой системы и защите от различных патогенов.
Другими популярными на отечественном рынке препаратами являются «Азотовит», «Фосфатовит» и «Калийвит» от российской компании «Промышленные инновации». В их основе находятся микроорганизмы, обогащающие почву азотом, фосфатами и калием. Так, в состав «Азотовита» входит культура Azotobacter chroococcum — уже известный нам свободноживущий диазотроф, фиксирующий атмосферный азот и превращающий его в доступную для растений форму.
Другая российская компания, ООО «Бисолби-СК», разработала необычный способ доставки растительных пробиотиков — на микрогранулах органических и минеральных удобрений. В препарате «БисолбиФит»® споры Bacillus subtilis (штамм Ч-13+) и метаболиты, полученные в процессе культивирования штамма и нанесенные на тонкоизмельченный органический кремний. Кремний способствует лучшему обмену азота и фосфора в тканях растений, исполняет важную роль в формировании устойчивости к различным стрессам, в том числе биотическим.
Подводя итог, хочется подчеркнуть, что в сфере растительных пробиотиков нерешенными по-прежнему остаются несколько проблем. Во-первых, способы эффективной инокуляции растений пробиотками не разработаны, либо очень сложны. К примеру, погружение корней (рис. 3 — процедура, о которой мы говорили ранее) требует специального оборудования, а также наличия некоторых знаний и умений для культивирования бактерий, что часто невозможно в условиях ферм. Технологии инокуляции продолжают развиваться, и в ближайшем будущем мы, скорее всего, увидим специальные экспресс-наборы для наработки бактериальной биомассы в полевых условиях, с которыми будет легко обращаться даже непрофессионалу.
Во-вторых, пока не все из известных микробов поддаются генетической модификации. Более того, мы не знаем функций многих генов, из-за чего некоторые метаболические пути и способы их регуляции остаются не расшифрованными, а значит, мы не можем ими эффективно манипулировать. Эту проблему (причем весьма успешно!) продолжает решать фундаментальная наука — в базах данных сейчас находятся сотни тысяч расшифрованных генов.
В-третьих, существует такая проблема, как вытеснение штаммов-пробиотиков более конкурентоспособными природными штаммами. Частично эту проблему можно решить, подбирая пробиотики, эндемичные данному растению, региону и типу почвы.
Применение пробиотиков для растений не подразумевает полный отказ от использования химических удобрений. Отказаться от них мы, вероятнее всего, не сможем никогда, но это и не нужно. Грамотно применяя полезные микроорганизмы, используя методы их генетической модификации и нанотехнологические подходы для улучшения колонизации ими семян и проростков, мы сможем значительно снизить использование химических удобрений, повысить их эффективность, а значит, и уменьшить их пагубное воздействие на здоровье людей и экосистем.
Литература
- 7 000 000 000;
- Salah Eddin Khabbaz, D. Ladhalakshmi, Merin Babu, A. Kandan, V. Ramamoorthy, et. al.. (2019). Plant Growth Promoting Bacteria (PGPB) - A Versatile Tool for Plant Health Management. Can. J. Pestic. Pest Manag.. 1, 1;
- Tjeert T Mensinga, Gerrit J A Speijers, Jan Meulenbelt. (2003). Health Implications of Exposure to Environmental Nitrogenous Compounds. Toxicological Reviews. 22, 41-51;
- Коварные помощники человечества: пестициды;
- Контроль за пестицидами. Полиция в белых халатах;
- Cheng-Wei Liu, Yu Sung, Bo-Ching Chen, Hung-Yu Lai. (2014). Effects of Nitrogen Fertilizers on the Growth and Nitrate Content of Lettuce (Lactuca sativa L.). IJERPH. 11, 4427-4440;
- Md Mohibul Alam Khan, Effi Haque, Narayan Chandra Paul, Md Abdul Khaleque, Saleh M.S. Al-Garni, et. al.. (2017). Enhancement of Growth and Grain Yield of Rice in Nutrient Deficient Soils by Rice Probiotic Bacteria. Rice Science. 24, 264-273;
- Sidhu H.S. (2018). Potential of plant growth-promoting rhizobacteria in the management of nematodes: A review. J. Entom. Zool. Stud. 6, 1536–1545;
- Mosaddiqur Rahman, Abdullah As Sabir, Julakha Akter Mukta, Md. Mohibul Alam Khan, Mohammed Mohi-Ud-Din, et. al.. (2018). Plant probiotic bacteria Bacillus and Paraburkholderia improve growth, yield and content of antioxidants in strawberry fruit. Sci Rep. 8;
- От ГМО к растениям будущего. Всё самое интересное о сложной работе современного селекционера;
- Модельные организмы: арабидопсис;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Синтетическая биология: от наблюдения к вмешательству;
- Chandra R. and Sobti R.C. Microbes for sustainable development and bioremediation. CRC Press, 2020. — 386 p.;
- T. L. G. Carvalho, E. Balsemao-Pires, R. M. Saraiva, P. C. G. Ferreira, A. S. Hemerly. (2014). Nitrogen signalling in plant interactions with associative and endophytic diazotrophic bacteria. Journal of Experimental Botany. 65, 5631-5642;
- Darian N. Smercina, Sarah E. Evans, Maren L. Friesen, Lisa K. Tiemann. (2019). To Fix or Not To Fix: Controls on Free-Living Nitrogen Fixation in the Rhizosphere. Appl Environ Microbiol. 85;
- Ryan P. Bartelme, Ben O. Oyserman, Jesse E. Blom, Osvaldo J. Sepulveda-Villet, Ryan J. Newton. (2018). Stripping Away the Soil: Plant Growth Promoting Microbiology Opportunities in Aquaponics. Front. Microbiol.. 9;
- Pandey A., Tripathi A., Srivastava P., Choudhary K.K., Dikshit A. Chapter 1. Plant growth-promoting microorganisms in sustainable agriculture. In: Role of plant growth promoting microorganisms in sustainable agriculture and nanotechnology / ed. by Kumar A., Singh A.K., Choudhary K.K. Elsevier, 2019. — 352 p.;
- Bernard R. Glick. (2012). Plant Growth-Promoting Bacteria: Mechanisms and Applications. Scientifica. 2012, 1-15;
- Rachel Backer, J. Stefan Rokem, Gayathri Ilangumaran, John Lamont, Dana Praslickova, et. al.. (2018). Plant Growth-Promoting Rhizobacteria: Context, Mechanisms of Action, and Roadmap to Commercialization of Biostimulants for Sustainable Agriculture. Front. Plant Sci.. 9;
- Alejandro Jiménez-Gómez, Paula García-Fraile, José David Flores-Félix, Raúl Rivas. (2018). Plants Probiotics as a Tool to Produce Highly Functional Fruits. Reference Series in Phytochemistry. 1-13;
- И. В. Максимов, С. В. Веселова, Т. В. Нужная, Е. Р. Сарварова, Р. М. Хайруллин. (2015). Стимулирующие рост растений бактерии в регуляции устойчивости растений к стрессовым факторам. Физиол. раст.. 62, 763-775;
- Яруллина Д.Р., Асафова Е.В., Картунова Ю.Е., Зиятдинова Г.К., Ильинская О.Н. (2014). Пробиотики для растений: NO-продуцирующие лактобациллы защищают растения от засухи. «Прикладная биохимия и микробиология». 2, 189–192;
- Phillipe M. Rosado, Deborah C. A. Leite, Gustavo A. S. Duarte, Ricardo M. Chaloub, Guillaume Jospin, et. al.. (2019). Marine probiotics: increasing coral resistance to bleaching through microbiome manipulation. ISME J. 13, 921-936;
- Ma del Carmen Orozco-Mosqueda, Ma del Carmen Rocha-Granados, Bernard R. Glick, Gustavo Santoyo. (2018). Microbiome engineering to improve biocontrol and plant growth-promoting mechanisms. Microbiological Research. 208, 25-31;
- Esther Menendez, 1 Instituto de Ciências Agrárias e Ambientais Mediterrânicas (ICAAM), Universidade de Évora, Évora, Portugal, Paula Garcia-Fraile, 2 Laboratory of Fungal Genetics and Metabolism, Institute of Microbiology, Academy of Sciences of the Czech Republic, Prague, Czech Republic, 3 Department of Microbiology and Genetics, University of Salamanca, Salamanca, Spain. (2017). Plant probiotic bacteria: solutions to feed the world. AIMS Microbiology. 3, 747-748;
- Channratha Prum, Rujira Dolphen, Paitip Thiravetyan. (2018). Enhancing arsenic removal from arsenic-contaminated water by Echinodorus cordifolius−endophytic Arthrobacter creatinolyticus interactions. Journal of Environmental Management. 213, 11-19;
- Arturo Ramírez-Ordorica, Eduardo Valencia-Cantero, Idolina Flores-Cortez, María Teresa Carrillo-Rayas, Ma. Isabel Cristina Elizarraraz-Anaya, et. al.. (2020). Metabolomic effects of the colonization of Medicago truncatula by the facultative endophyte Arthrobacter agilis UMCV2 in a foliar inoculation system. Sci Rep. 10;
- Priscilla Romina De Gregorio, Gabriela Michavila, Lenise Ricciardi Muller, Clarissa de Souza Borges, María Fernanda Pomares, et. al.. (2017). Beneficial rhizobacteria immobilized in nanofibers for potential application as soybean seed bioinoculants. PLoS ONE. 12, e0176930;
- Roger Tim Haug Lessons in Environmental Microbiology — CRC Press, 2019;
- Одиссея азота;
- Wang X., Shi J., Wang R. (2018). Effect of Burkholderia contaminans on postharvest diseases and induced resistance of strawberry fruits. Plant Pathol. J. 34, 403–411;
- Cheng-Wei Liu, Yu Sung, Bo-Ching Chen, Hung-Yu Lai. (2014). Effects of Nitrogen Fertilizers on the Growth and Nitrate Content of Lettuce (Lactuca sativa L.). IJERPH. 11, 4427-4440;
- Cory C. Cleveland, Benjamin Z. Houlton, Christopher Neill, Sasha C. Reed, Alan R. Townsend, Yingping Wang. (2010). Using indirect methods to constrain symbiotic nitrogen fixation rates: a case study from an Amazonian rain forest. Biogeochemistry. 99, 1-13;
- Hee-Sung Bae, Elise Morrison, Jeffrey P. Chanton, Andrew Ogram. (2018). Methanogens Are Major Contributors to Nitrogen Fixation in Soils of the Florida Everglades. Appl Environ Microbiol. 84;
- Jillian M. Petersen, Anna Kemper, Harald Gruber-Vodicka, Ulisse Cardini, Matthijs van der Geest, et. al.. (2017). Chemosynthetic symbionts of marine invertebrate animals are capable of nitrogen fixation. Nat Microbiol. 2;
- Florence Mus, Matthew B. Crook, Kevin Garcia, Amaya Garcia Costas, Barney A. Geddes, et. al.. (2016). Symbiotic Nitrogen Fixation and the Challenges to Its Extension to Nonlegumes. Appl. Environ. Microbiol.. 82, 3698-3710;
- Bhattacharya A. Chapter 4. Nitrogen-use efficiency under changing climatic conditions. In: Changing climate and resource use efficiency in plants. Elsevier, 2019. — P. 181–240;
- Esther Menendez, 1 Instituto de Ciências Agrárias e Ambientais Mediterrânicas (ICAAM), Universidade de Évora, Évora, Portugal, Paula Garcia-Fraile, 2 Laboratory of Fungal Genetics and Metabolism, Institute of Microbiology, Academy of Sciences of the Czech Republic, Prague, Czech Republic. (2017). Plant probiotic bacteria: solutions to feed the world. AIMS Microbiology. 3, 502-524;
- Florence Mus, Matthew B. Crook, Kevin Garcia, Amaya Garcia Costas, Barney A. Geddes, et. al.. (2016). Symbiotic Nitrogen Fixation and the Challenges to Its Extension to Nonlegumes. Appl. Environ. Microbiol.. 82, 3698-3710;
- Li Lin, Zhengyi Li, Chunjin Hu, Xincheng Zhang, Siping Chang, et. al.. (2012). Plant Growth-Promoting Nitrogen-Fixing Enterobacteria Are in Association with Sugarcane Plants Growing in Guangxi, China. Microb. Environ.. 27, 391-398;
- Clarisse Brígido, Francisco X. Nascimento, Jin Duan, Bernard R. Glick, Solange Oliveira. (2013). Expression of an exogenous 1-aminocyclopropane-1-carboxylate deaminase gene inMesorhizobiumspp. reduces the negative effects of salt stress in chickpea. FEMS Microbiol Lett. n/a-n/a;
- A. Peix, A.A. Rivas-Boyero, P.F. Mateos, C. Rodriguez-Barrueco, E. Martı́nez-Molina, E. Velazquez. (2001). Growth promotion of chickpea and barley by a phosphate solubilizing strain of Mesorhizobium mediterraneum under growth chamber conditions. Soil Biology and Biochemistry. 33, 103-110;
- Jaiswal D.K., Verma J.P., Prakash S., Meena V.S., Meena R.S. Potassium as an important plant nutrient in sustainable agriculture: a state of the art. In: Potassium solubilizing microorganisms for sustainable agriculture / ed. by Meena V.S., Maurya B.R., Prakash Verma J., Meena R.S. Springer India, 2016. — P. 21–29;
- J. B. Neilands. (1995). Siderophores: Structure and Function of Microbial Iron Transport Compounds. J. Biol. Chem.. 270, 26723-26726;
- Maumita Saha, Subhasis Sarkar, Biplab Sarkar, Bipin Kumar Sharma, Surajit Bhattacharjee, Prosun Tribedi. (2016). Microbial siderophores and their potential applications: a review. Environ Sci Pollut Res. 23, 3984-3999;
- Abdul Latif Khan, Muhammad Waqas, Sang-Mo Kang, Ahmed Al-Harrasi, Javid Hussain, et. al.. (2014). Bacterial endophyte Sphingomonas sp. LK11 produces gibberellins and IAA and promotes tomato plant growth. J Microbiol.. 52, 689-695;
- V. C. Verma, S. K. Singh, Satya Prakash. (2011). Bio-control and plant growth promotion potential of siderophore producing endophytic Streptomyces from Azadirachta indica A. Juss.. J. Basic Microbiol.. 51, 550-556;
- José David Flores-Félix, Luis R. Silva, Lina P. Rivera, Marta Marcos-García, Paula García-Fraile, et. al.. (2015). Plants Probiotics as a Tool to Produce Highly Functional Fruits: The Case of Phyllobacterium and Vitamin C in Strawberries. PLoS ONE. 10, e0122281;
- Spaepen S. Plant hormones produced by microbes. In: Principles of plant-microbe interactions / ed. by Lugtenberg B. Switzerland: Springer International Publishing, 2015. — P. 247–256;
- Yeon-Gyeong Park, Bong-Gyu Mun, Sang-Mo Kang, Adil Hussain, Raheem Shahzad, et. al.. (2017). Bacillus aryabhattai SRB02 tolerates oxidative and nitrosative stress and promotes the growth of soybean by modulating the production of phytohormones. PLoS ONE. 12, e0173203;
- Wangxia Wang, Basia Vinocur, Arie Altman. (2003). Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance. Planta. 218, 1-14;
- Scott M. Liddycoat, Bruce M. Greenberg, David J. Wolyn. (2009). The effect of plant growth-promoting rhizobacteria on asparagus seedlings and germinating seeds subjected to water stress under greenhouse conditions. Can. J. Microbiol.. 55, 388-394;
- Nazanin Ghavami, Hossein Ali Alikhani, Ahmad Ali Pourbabaei, Hossein Besharati. (2017). Effects of two new siderophore-producing rhizobacteria on growth and iron content of maize and canola plants. Journal of Plant Nutrition. 40, 736-746;
- Diby Paul, Sudha Nair. (2008). Stress adaptations in a Plant Growth Promoting Rhizobacterium (PGPR) with increasing salinity in the coastal agricultural soils. J. Basic Microbiol.. 48, 378-384;
- Dilfuza Egamberdiyeva. (2007). The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils. Applied Soil Ecology. 36, 184-189;
- M Mazzola, D K Fujimoto, L S Thomashow, R J Cook. (1995). Variation in Sensitivity of Gaeumannomyces graminis to Antibiotics Produced by Fluorescent Pseudomonas spp. and Effect on Biological Control of Take-All of Wheat.. Applied and environmental microbiology. 61, 2554-2559;
- Youn-Sig Kwak, David M. Weller. (2013). Take-all of Wheat and Natural Disease Suppression: A Review. The Plant Pathology Journal. 29, 125-135;
- Paola Durán, Jacquelinne J. Acuña, Milko A. Jorquera, Rosario Azcón, Cecilia Paredes, et. al.. (2014). Endophytic bacteria from selenium-supplemented wheat plants could be useful for plant-growth promotion, biofortification and Gaeumannomyces graminis biocontrol in wheat production. Biol Fertil Soils. 50, 983-990;
- I. V. Maksimov, R. R. Abizgil’dina, L. I. Pusenkova. (2011). Plant growth promoting rhizobacteria as alternative to chemical crop protectors from pathogens (review). Appl Biochem Microbiol. 47, 333-345;
- Lihong Zhou, Gary Yuen, Yang Wang, Lanfang Wei, Guanghai Ji. (2016). Evaluation of bacterial biological control agents for control of root-knot nematode disease on tomato. Crop Protection. 84, 8-13;
- Luca Ruiu. (2020). Plant-Growth-Promoting Bacteria (PGPB) against Insects and Other Agricultural Pests. Agronomy. 10, 861;
- Модельные организмы: кишечная палочка;
- Luca Ruiu, Alberto Satta, Ignazio Floris. (2012). Observations on house fly larvae midgut ultrastructure after Brevibacillus laterosporus ingestion. Journal of Invertebrate Pathology. 111, 211-216;
- Thomas R. (1935). A bacteriophage in relationto Stewart’s disease of corn. Phytopathology. 25, 371–372;
- K. A. Tancos, S. Villani, S. Kuehne, E. Borejsza-Wysocka, D. Breth, et. al.. (2016). Prevalence of Streptomycin-Resistant Erwinia amylovora in New York Apple Orchards. Plant Disease. 100, 802-809;
- Patricia S. McManus, Virginia O. Stockwell, George W. Sundin, Alan L. Jones. (2002). ANTIBIOTICUSE INPLANTAGRICULTURE. Annu. Rev. Phytopathol.. 40, 443-465;
- O’Neil J. Tracking a global health crisis: initial steps. London: Welcome Trust and UK Government, 2015;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Judit Nagy, Lóránt Király, Ildikó Schwarczinger. (2012). Phage therapy for plant disease control with a focus on fire blight. Open Life Sciences. 7, 1-12;
- Rodrigo A. Valverde, Sead Sabanadzovic, John Hammond. (2012). Viruses that Enhance the Aesthetics of Some Ornamental Plants: Beauty or Beast?. Plant Disease. 96, 600-611;
- Marilyn J. Roossinck. (2011). The good viruses: viral mutualistic symbioses. Nat Rev Microbiol. 9, 99-108;
- Eric S. Boyd, John W. Peters. (2013). New insights into the evolutionary history of biological nitrogen fixation. Front. Microbiol.. 4.