
От ГМО к растениям будущего. Всё самое интересное о сложной работе современного селекционера
10 ноября 2017
От ГМО к растениям будущего. Всё самое интересное о сложной работе современного селекционера
- 6515
- 0
- 17
-
Авторы
-
Редакторы
Статья на конкурс «био/мол/текст»: Уже давно растениеводство во всем мире радуется многочисленным подаркам генной инженерии: устойчивым к вредителям и холоду растениям, быстрому росту и обильному урожаю новых культур. Однако большинство потребителей относится к растениям с измененным геномом (ГМ-растениям, или ГМО) крайне отрицательно. Закон в данном случае на стороне консерваторов и что есть силы оберегает общество от ГМ-продуктов. Действительно ли ГМО таят в себе угрозу, или же селекционеров просто вынуждают тратить время на борьбу с запретами вместо того, чтобы спокойно вести полезную работу? С другой стороны, барьеры на пути распространения ГМО могут побуждать отрасль к активному развитию. Если вы хотите как следует разобраться в тернистых путях современной селекции растений, то этот обзор — то, что вам нужно!
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Путь, пройденный современными учеными и фермерами, занятыми получением тех культурных растений, которые мы употребляем в пищу, поистине огромен. Началось это путешествие примерно 10 тысяч лет назад [1], когда человек устал ходить в лес за грибами и ягодами и изобрел сельское хозяйство. Сперва он сажал и ждал, иногда напрасно, ведь растения — создания привередливые, а потом взял дело в свои руки, выбрал самые здоровые и сильные пригодные в пищу побеги и стал планомерно их выращивать, со временем приспосабливая в соответствии со своими нуждами.
Так природные поля и долины превратились в орошаемые и удобряемые пашни, где люди столетиями вели жестокий бой с эволюцией, ведь в сельском хозяйстве нет места закону естественного отбора. Человек провозгласил свой закон: выживает то растение, которое отвечает его запросам. Ярким примером расхождения целей естественного отбора и селекции служит кукуруза. У ее предка зерна при созревании легко отделялись от початка и падали на землю (рис. 1) [2]. Природа ратовала за размножение растения, и кукуруза не знала горя. Человек же, выращивая такую кукурузу, неизбежно терял бóльшую часть урожая. И что же мы видим теперь? Ядра современной кукурузы на момент зрелости прочно прикреплены к початку, потому что это было выгодно человеку, а кукурузу никто не спрашивал. Так же обстоит дело с другими зерновыми культурами — рисом, ячменем, пшеницей.
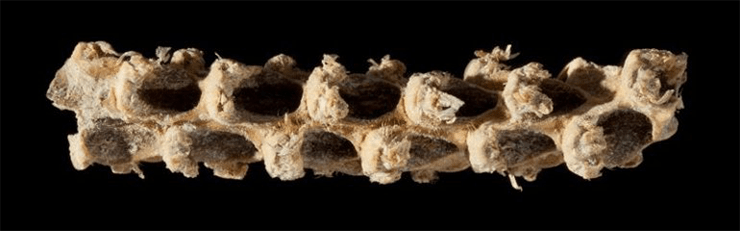
Рисунок 1. Початок кукурузы, найденный археологами в долине Теуахан в Мексике. Возраст растения оценивают в 5310 лет.
Человеческое упорство в выращивании растений, таким образом, с давних пор неуклонно приносило свои плоды. Но есть в современной истории селекции две особенно значительные вехи. Первое очень важное событие — Грегор Мендель в конце 19 века открыл законы наследования: появились понятия гибридизации (скрещивания) и отбора. Вторая точка отсчета — открытие структуры ДНК Джеймсом Уотсоном и Френсисом Криком в 1953 году (рис. 2) и последующее принятие центральной догмы молекулярной биологии.

Рисунок 2. Джеймс Уотсон (справа) и Френсис Крик (слева) позируют рядом с моделью структуры ДНК.
сайт molbiol.ru
Именно с этого момента мы начали путь к глубокому пониманию механизмов хранения, воспроизведения и передачи генетического материала в живых организмах. Были обнаружены способы прямого воздействия на ДНК растений: сперва в виде провоцирования мутаций в 1960-х годах, затем — получением искусственно созданной ДНК в 1983 году. Традиционные методики селекции, например скрещивание, также изменились, но продолжают применяться на равных с новейшими методами. Во многом именно разнообразие существующих подходов дает сегодня селекционерам эффективный набор «инструментов» практически для любой работы.
Магия селекции. Куда нажать?
Набор инструментов современного селекционера весьма велик, и разобраться в нем непросто. При этом все новейшие методы селекции тяготеют к внесению изменений в структуру растительной ДНК. Для удобства мы разделили активно используемые технологии создания новых сортов растений на группы в зависимости от глубины воздействия на геном — «святую святых» живых клеток (рис. 3).
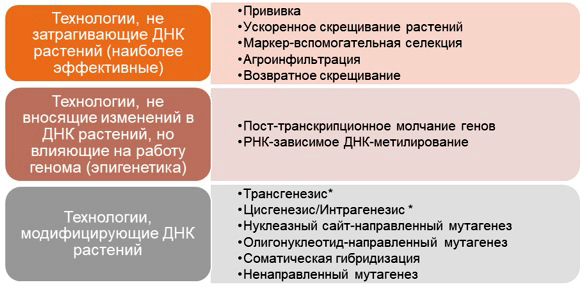
Рисунок 3. Распространенные методы селекции растений, ориентированные на различную степень воздействия на ДНК организма. * — Не являются методиками как таковыми, а представляют собой концепции, подчиняющие процессы трансформирования ДНК определенным правилам.
Что ж, в третьей группе методов на рисунке собраны самые пугающие. С них и начнем.
Организм, который нельзя называть
Никто не любит генетически измененные растения. Разумеется, кроме работников сельского хозяйства, ежегодно получающих отличный урожай без использования тонн пестицидов — стойких органических загрязнителей, способных накапливаться в тканях животных и растений, вызывать отравления, аллергии, рак и другие заболевания [3].
Так почему же ГМО так всех пугают? Ответ лежит на поверхности. Генные инженеры делают сегодня то, чего природа не смогла бы сделать никогда (или, по крайней мере, — очень нескоро). Это действительно впечатляет. Кроме того, полностью исключать риск каких бы то ни было негативных последствий распространения ГМО сами их создатели пока не торопятся. Чтобы лучше понять причины неприятия ГМО обществом и все за и против их использования, предлагаем вам ознакомиться с интересной статьей «Трансгенные растения — спасители планеты или бомбы замедленного действия?» [4], опубликованной ранее на «Биомолекуле».
Итак, всякий раз, когда речь заходит о биотехнологии растений, дискуссия, как правило, сводится к спору о безопасности так называемых генетически модифицированных культур, полученных методами, вошедшими в третью группу нашей классификации. Любопытно, что в изменении генома растений на самом деле нет ничего нового и революционного. Человек всегда так или иначе оказывал влияние на генетику растений, которые выращивал, хотя и не понимал этого. Так, скрещивание различных сортов приводит к появлению совершенно новых культурных форм.
Кроме того, в природе спонтанные мутации в ДНК растений происходят постоянно, например, из-за солнечного излучения. Раньше, когда такие мутации приводили к появлению новых растений с видимыми положительными отличиями, людям оставалось только выбрать нужные образцы для выращивания, — вот и вся селекция. Большое разнообразие овощей семейства крестоцветных, которое мы наблюдаем сегодня, является прекрасным примером этого процесса. Так, цветная капуста, белокочанная и брокколи происходят от одного общего предка [9].
Дальше — больше. За последние 80 лет люди получили более трех тысяч новых сортов растений, облучая природные формы и посыпая их химическими реагентами, чтобы вызвать спонтанные мутации в ДНК. Сорта культур, полученные таким образом, возделывают и сейчас. Как ни парадоксально, ненаправленный мутагенез, использующийся селекционерами многие годы и вызывающий в организмах сотни непредсказуемых мутаций, никогда не относился к методам получения генетически модифицированных организмов. По этой причине мнение, будто недавно открытые методы селекции, точечно воздействующие на ДНК растений, внезапно пересекли черту, разделяющую «натуральные растения» и «искусственно полученные в лаборатории» — крайне ошибочно. А значит, будет правильнее оценивать безопасность новых сортов, исходя из их состава, то есть из конечного результата действия того или иного пути селекции.
Однако, мы думаем, все согласятся: чтобы составить собственное мнение об опасности ГМО, нужно как минимум понимать, откуда ГМО берутся.
Рецепт ГМО: режь, исправляй, сшивай
Так как же сделать ГМО из обычного растения? Рецепт довольно прост. Возьмите геном клетки-хозяина и добавьте «генетическую конструкцию»: последовательность ДНК, кодирующую производство необходимого белка и встроенную в вектор. Векторами в молекулярной биологии называют молекулы ДНК или РНК, которые способны к репликации в определенных клетках и могут акцептировать и переносить чужеродную ДНК или РНК. При необходимости можно добавить несколько генов, например, с помощью вектора на основе кольцевой бактериальной плазмиды (рис. 5).
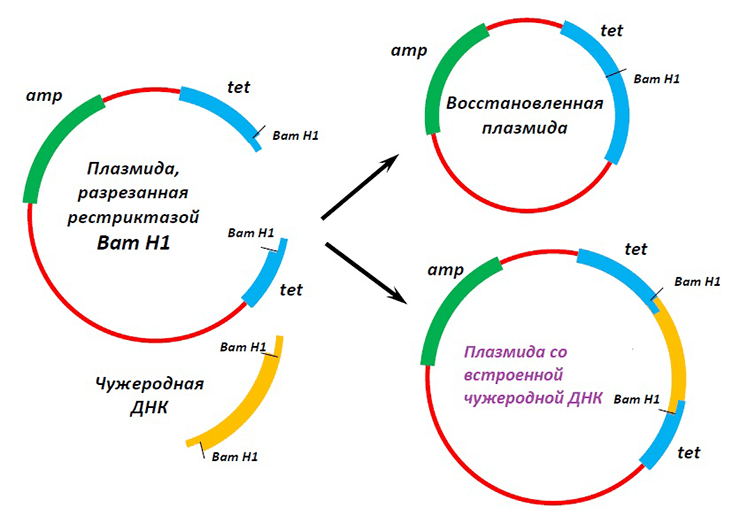
Рисунок 5. Взаимодействие искусственной плазмиды, способной реплицироваться в клетках Escherichia coli, с чужеродной ДНК. Полученная генетическая конструкция служит для переноса генетического материала от одной клетки к другой.
Звучит понятно, если не задумываться о том, как вставить новый ген именно в то место ДНК-цепи, которое мы хотим. А ведь в этом и заключается самая сложная задача современных методов точного редактирования генома, результатом которых и являются ГМО.
Для успешного изменения наследственного материала клетки ученым пришлось придумывать такие методики, которые позволили бы расщеплять и соединять молекулы ДНК точно в заданных участках. Первыми для этой цели стали использовать рестриктазы — ферменты, способные узнавать определенные последовательности нуклеотидов (строительных блоков ДНК) и разрезать по ним молекулу. При этом для соединения фрагментов разрезанной цепи можно использовать другие ферменты — ДНК-лигазы, входящие в состав природных ферментных комплексов. Эти ферменты призваны исправлять (репарировать) повреждения в структуре ДНК. Функцию сшивки ДНК-цепи способны выполнять и ферменты системы рекомбинации, с помощью которой происходит обмен фрагментов ДНК в процессе образования половых клеток. Итак, благодаря описанным ферментам, стало возможно разрезать ДНК на заданные фрагменты и вновь сшивать их, создавая новые генетические конструкции. Сегодня, как и 30–40 лет назад, эти механизмы активно используют при получении новых вариантов бактериальных и вирусных геномов.
А вот для успешной работы с геномами высших организмов (таких, как растения, животные и мы с вами) этих инструментов оказалось недостаточно. Дело в том, что рестриктазы способны узнавать лишь короткие последовательности ДНК. Такого уровня специфичности вполне достаточно для эффективного расщепления коротких ДНК-цепей бактерий на два или несколько фрагментов, ведь узнаваемые рестриктазами участки встречаются в коротких цепях не так часто. Геномы же высших организмов содержат огромное множество коротких последовательностей нуклеотидов, узнаваемых рестриктазами, поэтому воздействие на один выбранный участок становится невозможным. Для изменения геномов сложных организмов придумали свои инструменты точечного воздействия на определенные участки ДНК: сперва олигонуклеотид-направленный мутагенез растений [10], [11], потом — нуклеазный сайт-направленный мутагенез с использованием нуклеаз с «цинковыми пальцами» [12], TALENs-нуклеаз [13] и даже мегануклеаз [14]. Наконец, открыли прокариотические иммунные системы CRISPR/Cas [15].
Насколько остры генетические ножницы?
С открытием в 2012–2013 годах знаменитой технологии CRISPR/Cas9, вызвавшей огромный резонанс в обществе [16], ученые вплотную подошли к новому рубежу — точному исправлению или редактированию генов и геномов. Возможность для ученых с очень высокой точностью вызывать заданные, контролируемые изменения в геноме живых клеток стала настоящим прорывом и повлекла за собой глобальные изменения как в медицине, так и в селекции.
Что представляет собой система CRISPR/Cas9 и как она повлияет на будущее человека?
Основой этой системы стал своеобразный механизм защиты бактерий от бактериофагов: при проникновении вируса в бактерию запускается иммунная реакция, приводящая к расщеплению геномной ДНК неприятеля. На основе бактериальных CRISPR/Cas-систем ученые синтезировали упрощенные искусственные конструкции, включающие белок-киллер Cas9 и обеспечивающие невероятно точную работу по разрезанию ДНК-цепей (рис. 6) [12].
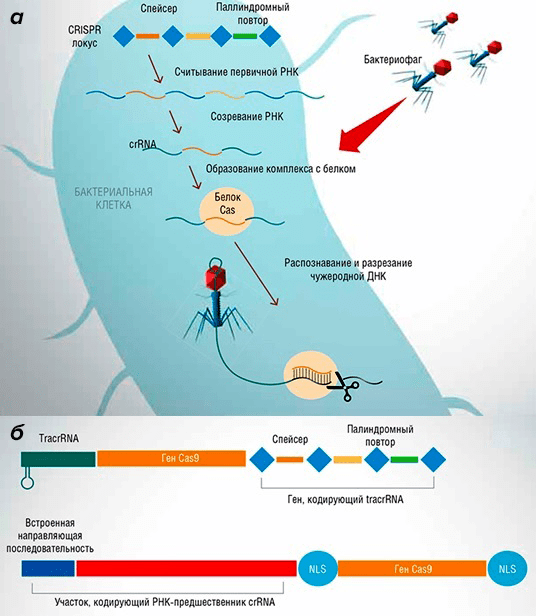
Рисунок 6. Работа и устройство CRISPR/Cas-системы. а — Принцип работы защитного CRISPR/Cas-механизма бактерии при попадании в клетку бактериофага. б — CRISPR/Cas-система типа II-A бактерии Streptococcus pyogenes (вверху) и созданная на ее основе упрощенная конструкция (внизу).
При помощи CRISPR/Cas9-конструкций стало возможным успешно проводить все виды модификаций генома: вносить точечные мутации, встраивать, исправлять, заменять или удалять крупные ДНК-последовательности и фрагменты выбранных генов (рис. 7).
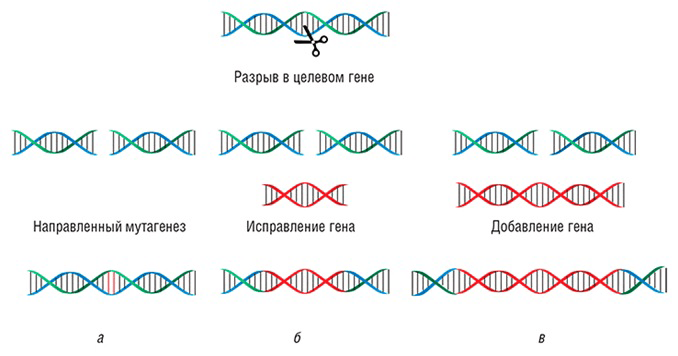
Рисунок 7. Виды различных воздействий, проводимых с помощью CRISPR/Cas9-конструкции. а — Направленный точечный мутагенез. б — Замена фрагмента выбранного гена. в — Встраивание нового гена.
Систему редактирования геномов CRISPR/Cas9 применяют во множестве лабораторий и компаний развитых стран. Уже опубликованы сотни результатов работ, проводимых с применением этой системы, описаны десятки удачных экспериментов по редактированию геномов дрожжей, растений, насекомых и животных, которые подтверждают безопасность ГМ-продуктов CRISPR/Cas9-технологии. Здесь главное — планировать заранее все последствия смешения генов.
С помощью системы CRISPR/Cas9 успешно внесли точные модификации в геном пшеницы и табака, получили новые сорта риса. Решена другая интересная задача — получение растений, способных синтезировать белки человека: инсулин, необходимый для больных сахарным диабетом, и альбумин, применяемый при лечении ожогов и цирроза. Такие растения называют «биофабриками», подробно о них можно прочитать в статье «Растения-биофабрики» [20]. Путем направленного воздействия на геном риса и крупного рогатого скота в их ДНК уже введен ген человеческого альбумина [21].
Тем не менее, несмотря на подтвержденную эффективность системы CRISPR/Cas9, риск неспецифичного воздействия разработанными конструкциями на ДНК и нарушения последовательности кодирующих генов все еще существует и в некоторых случаях вызывает реальные опасения. Так, настоящий взрыв в мировом сообществе несколько лет назад вызвала публикация китайских ученых из Университета Сунь Ятсена в Гуанджоу, применивших CRISPR/Cas9 для исправления генома эмбрионов человека с целью лечения генетического заболевания талассемии. Важно отметить, что из 86 подопытных зигот положительного результата достигли только для 4-х [22]. Неудивительно, что ряд специалистов призывает к мораторию на любые эксперименты, связанные с редактированием генов человеческих эмбрионов или половых клеток [18]. Когда речь идет о геноме человека, успех должен быть гарантирован. И все же прогресс не остановить: недавно Великобритания стала второй страной, где исследователям позволено экспериментировать с ДНК человеческих эмбрионов [23].
Итак, генные инженеры бодро шагают по планете, и в руках у них — арсенал первосортных инструментов. Вот только страх человека перед вмешательством в геном живых организмов все еще очень высок, а в некоторых аспектах даже продолжает расти. Вследствие этого оборот и потребление продуктов редактирования генома строго контролируются на законодательном уровне, что препятствует полному переходу мирового сельского хозяйства на использование продвинутых методов селекции. Ученые все же не сдаются, а вместо этого предлагают сократить до минимума и даже исключить возможные риски негативных последствий введения новых генов в организм растений.
Снижаем риски: от ТРАНС к ЦИС и еще дальше
К ГМО сегодня относят все организмы, включая и растения, в геном которых искусственно внесены изменения. Прохождение всех тестов на безопасность и вывод генетически модифицированных организмов на рынок жестко регулируется на международном уровне во избежание негативного воздействия на окружающую среду и здоровье человека. В этом вопросе правовая база ЕС в области распространения и использования ГМО опирается на директиву Европейского Парламента и Совета Европейского Союза 2001/18/ЕС от 12 марта 2001 года «О преднамеренном выпуске в окружающую среду генетически модифицированных организмов». Интересно, что данный нормативный документ исключает из перечня ГМО организмы, полученные путем скрещивания, экстракорпорального оплодотворения, полиплоидной индукции, возникновения мутаций и слияния протопластов скрещиваемых видов (соматическая гибридизация). Законодательство РФ в области ГМО растительного происхождения регулируют четыре федеральных закона и шесть постановлений правительства РФ, среди которых федеральный закон № 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» от 5 июля 1996 года. Также ожидается вступление в силу постановления, которое узаконило бы выращивание ГМ-культур на территории России. Сегодня 22 линии ГМ-растений, среди которых кукуруза, картофель, соя, сахарная свекла, рис, разрешены для ввоза в Россию для пищевых и кормовых целей. Выращивать ГМ-культуры в нашей стране можно только на опытных участках.
Мировое ученое сообщество, в свою очередь, считает, что нужно различать ГМО в зависимости от того, какие манипуляции с геномом проводились, и делать послабления для продуктов, полученных умеренным вмешательством. Так появилась система деления всех ГМО на три вида: ТРАНС, ЦИС и ИНТРА.
Трансгенными сегодня называют те организмы, в геном которых искусственно введены ген или гены, которые не могут быть приобретены этими организмами при естественном скрещивании. Это могут быть гены растений других видов, нескрещиваемых с растением, подвергнутым модификации, или даже гены животных. Например, рис, в геном которого встроен ген кукурузы, является трансгенным. Для трансгенных экспериментов запретов нет, тут можно все. Потенциальная опасность создания трансгенных культур в том, что новые приобретенные такими растениями черты могут повлиять на пригодность растения к его использованию в пищевых или кормовых целях. Затем эти качества могут распространиться от ГМ-культуры к ее диким родственникам, создав сдвиг в естественной растительной экосфере. По этой причине законодатели и регулирующие органы развитых стран уделяют большое внимание безопасности ввода в окружающую среду и выращивания трансгенных культур и создают строгие рамки биобезопасности, минимизирующие риск экологических сдвигов.
Цисгенными растениями считают те ГМ-растения, в геном которых введен ген или гены организмов одного с ними вида или близких видов, с которыми изменяемые растения способны скрещиваться в естественных условиях. При этом сам целевой ген не должен быть видоизменен или оторван от своих регуляторных последовательностей. К цисгенезису относится, например, получение картофеля, не подверженного картофельной гнили благодаря встраиванию генов из диких видов картофеля Мексики и Анд, устойчивых к этому заболеванию. Такой картофель сейчас разрабатывают в Бельгии [24]. Цисгенезис не изменяет генофонд вида и не привносит в организм растения принципиально новых для него признаков. Никаких изменений, которые не могли бы произойти с растением при традиционном скрещивании с родственными ему дикими формами, не происходит.
Интрагенезис можно считать продолжением концепции цисгенезиса, но в этом случае в ДНК растения встраивают генетическую конструкцию, состоящую из гена самого растения, совмещенного с регуляторными последовательностями других его генов. В ходе такой модификации искусственно создаются новые комбинации из уже существующих участков ДНК растений [25]. Интрагенезис позволяет усиливать определенные признаки у растений, например, способность накапливания витаминов в листьях или, наоборот, устранять или сводить к минимуму нежелательные свойства путем изменения регуляции отвечающих за них генов.
О существенной разнице между транс-, цис- и интрагенными растениями можно прочитать на «Биомолекуле», обратившись к статье «Цисгеномика: новое слово в селекции растений» [26]. Между тем, сегодня регулирование оборота ГМО ориентировано на все ГМ-организмы и не делает различий между трансгенными и цисгенными растениями, базируясь на рисках передачи трансгенов. В противовес исследователи, занятые в получении цисгенных растений, убеждены, что данный тип ГМО кардинально отличается. Из-за строгих рамок, установленных законодательством, использование цисгенных растений серьезно затруднено. Любые ограничения, накладываемые на получение и оборот продуктов цисгенезиса, могут заблокировать или значительно отсрочить проведение дальнейших исследований по улучшению сортов сельскохозяйственных культур. Пока только в Канаде контроль за цисгенными растениями менее строг по отношению к трансгенным [27].
Соматический Франкенштейн
Что ж, законодательства развитых стран стоят на страже нашего здоровья, и можно было бы сказать, что «ГМО не пройдет», если бы не ряд парадоксов и допущений, которые на руку смелым селекционерам. Один из примеров — соматическая гибридизация. Селекция растений через слияние соматических клеток (cell fusion) заключается в создании новых форм растений с помощью комбинирования ядерных, митохондриальных и пластидных генов путем культивирования и слияния соматических клеток — протопластов. Этот тип гибридизации растений достаточно широко распространен. Кроме того, на территории ЕС соматические гибриды не считаются генетически модифицированными организмами, следовательно, их оборот не подвергается строгому контролю и осуществляется гораздо проще.
Что же это за волшебный способ селекции? На первом этапе создания нового растения получают протопласты клеток (содержимое клеток без клеточной оболочки) двух разных видов растений. Как правило, это культурное растение и дикорастущее. Чтобы получить протопласт, клетки обрабатывают специальными агентами, разрушающими клеточную оболочку. Далее химическим или механическим способом провоцируют слипание и слияние протопластов, которые в дальнейшем регенерируют клеточную оболочку и образуют новый живой организм — регенерант, или соматический гибрид.
Соматические клетки растений — это клетки, составляющие ткань растения и не принимающие участия в его половом размножении. Их использование при гибридизации дает возможность успешно работать с отдаленными, нескрещиваемыми видами и полностью стерильными растениями. Иными словами, метод слияния протопластов используют при необходимости преодоления несовместимости культурных и дикорастущих видов. Таким способом можно получать межклассовые гибридные клеточные колонии: рис + соя, ячмень + табак и даже табак + мышь [28]. Правда, большинство регенерантов сами размножаться уже не способны, а иногда и вовсе представляют собой скорее скопление клеток, а не растение.
Интересно, что, хотя этот метод влечет за собой значительную «перетасовку» генов, а также является крайне неточным, он все равно открыт для широкого использования в сельском хозяйстве в отличие от методов направленного мутагенеза. Как вам такой поворот?
Бережём зеленый геном
Раз уж мы разобрались в том, что запрещено и что разрешено не везде, пришло время обратиться и к методам, которые уж точно должны соответствовать стандартам даже самых ярых приверженцев натуральных продуктов. Ведь методы эти используют уже очень давно, и они не встречают общественного или законодательного сопротивления. Отметим заранее, что комбинация этих методов с новейшими подходами связана с перспективами, о которых, возможно, вы и не подозревали.
Прививка — давно известный способ размножения растений, с которым повсеместно сталкиваются садоводы-любители. В ходе прививки стебель одного растения — привой, пересаживают на корень другого — подвой (рис. 8).
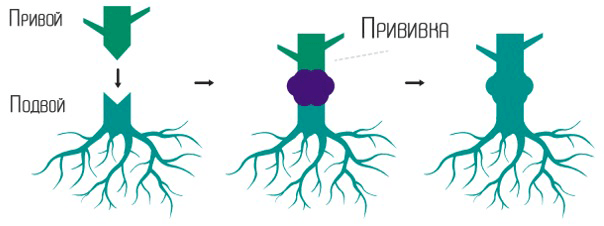
Рисунок 8. Прививка растения.
Зачем это нужно? В конце 19 века этот метод помог спасти европейские сорта винограда Vitis vinifera от нашествия филлоксеры — насекомого, повреждающего корни растения. Прививку осуществляли на североамериканский виноград Vitis labrusca, устойчивый к этому вредителю [29].
Не так давно прививка растений оказалась связана еще и с мультсериалом «Симпсоны». В одной из серий Гомер занялся мутациями томатов, содержащими никотин (рис. 9). История из «Симпсонов» получила продолжение: фермер из Орегона Роб Баур в 2003 году получил настоящий томак (томат + табак), но уже путем прививания. Пробы показали наличие в томаке никотина, правда, в листьях, а не в плодах [30].

Рисунок 9. Томаки, выращенные Гомером из мультсериала «Симпсоны». Кадр пятого эпизода E-I-E-I-(Annoyed Grunt) 11-го сезона мультсериала.
Что же происходит с растением во время прививки, если геномы подвоя и привоя не меняются? Во-первых, могут увеличиваться или уменьшаться сила роста, размер плодов, сроки созревания. При этом новые признаки не передаются потомству в случае размножения семенами и не являются наследственными. Во-вторых, в результате использования прививки возможны «химерные» изменения, когда получаемое растение состоит из генетически разнородных клеток. Этот эффект также не наследуется. Его часто используют в декоративном цветоводстве и садоводстве для получения растений с мозаичной окраской листьев или соцветий (рис. 10).

Рисунок 10. Пестролистный фикус Бенджамина — периклинальная химера, образованная двумя линиями клеток с разным содержанием хлоропластов.
В ходе прививки возможны и настоящие мутации, спровоцированные переходом от подвоя к привою специфических веществ (этилметансульфоната, этилимина, различных алкалоидов). Однако частота появления мутаций после прививок крайне низка. Неоспоримым преимуществом прививок является возможность размножать мутации, не передающиеся по наследству, а основным недостатком — большое количество требуемого исходного материала.
Тайна прививки: снова в бой, ГМО-подвой!
Прививка растений, это, безусловно, метод проверенный и безопасный. Но что произойдет, если привой трансплантировать на подвой растения, перенесшего генетическую модификацию? Будет ли полученное растение генетически модифицированным? Оказывается — нет, не будет. Согласно законам, регулирующим эту область в сельском хозяйстве, плоды таких гибридов не входят в перечень ГМО, так как ДНК привоя остается неизмененной. Однако мы не можем быть уверены в том, что никакого обмена наследственной информацией между привоем и подвоем не происходит. Например, от корневища к привою могут быть переданы молекулы РНК, регулирующие работу генома, а значит, нельзя предсказать и уровень производства тех или иных белков в новом растении.
Единственный ли это окольный путь создания новых сортов с измененным функционированием ДНК? Тоже нет, и скоро вы в этом убедитесь.
Ускоренное скрещивание деревьев и кустарников (fast-track breeding) — это не метод, а целый комплекс методик, направленных на сокращение сроков получения новых сортов. Он повсеместно используется в селекции многолетних культур, так как она занимает много времени. Цикл размножения деревьев с крупными плодами (ореха или сливы) может доходить и до 10 лет [31]. Это означает, что после посадки первого гибрида селекционер, чтобы продолжить работу, вынужден ждать 5–10 лет, пока тот вырастет и повзрослеет. Если же необходимо провести несколько последовательных скрещиваний, выведение нового сорта дерева может занять и 30 лет.
Очевидно, что в современных условиях никто не готов столько ждать. Чтобы максимально ускорить процесс, ученые давно поливают своих подопытных гормонами роста, растят их при высоких температурах и прибегают к другим уловкам, например, к ДНК-технологиям.
Среди безобидных можно отметить маркер-вспомогательный отбор. Эта технология заключается в анализе генома новых ростков или даже семян и отборе лучших гибридов задолго до того, как они превратятся во взрослые растения. Теперь растение уже не нужно обрабатывать патогеном, чтобы понять, насколько оно к нему устойчиво, — достаточно найти нужный ген в семечке. Основной недостаток маркер-вспомогательной селекции — ее высокая стоимость, поскольку скрининг ДНК — вещь недешевая.
Берем генетический разбег!
Для того чтобы растение быстрее повзрослело, селекционеры иногда хитрят, обращаясь к зеленому геному. Гены, отвечающие за запуск механизма размножения, искусственно активизируют, после чего молодое растение начинает цвести и приносить плоды. Иногда в геном дерева вводят дополнительные гены, которые ускоряют процессы цветения и плодоношения, и время ожидания первого цветения саженцев сокращается до 1 года.
При сочетании методик ускоренного и возвратного (когда гибрид скрещивают с одним из его родителей) скрещиваний, ген быстрого цветения можно ввести в исходный сорт, а на последнем этапе селекции вывести его путем скрещивания генетически измененного гибрида с родительским растением (рис. 11а).
Ускоренное скрещивание осуществляют также путем прививания на ГМ-подвой (рис. 11б). Секрет получения природного растения, которое быстро цветет, в этом случае кроется в привое к генетически измененному корневищу с усиленно вырабатываемыми генами цветения. При этом из корневища к листьям поступают специфические белки, запускающие механизм взросления, и привой начинает цвести.
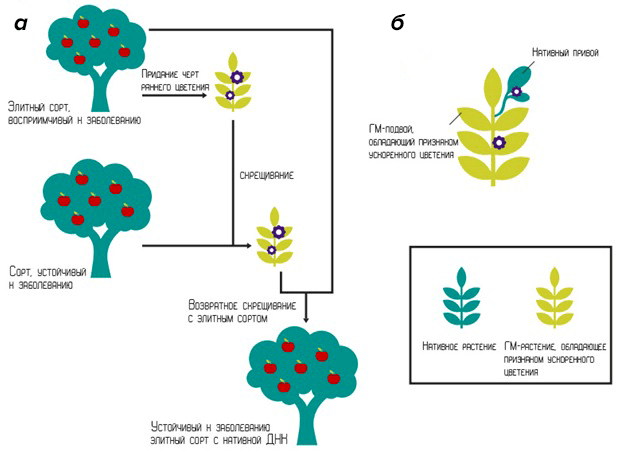
Рисунок 11. Различные методики скрещивания растений. а — Использование ускоренного и возвратного скрещиваний для получения устойчивого к заболеванию гибрида. б — Прививка на ГМ-растение.
Таким образом, современные методы прививки и ускоренного скрещивания растений таят в себе генетические секреты. В то же время ученые, сталкиваясь с барьерами общественного мнения и жесткого регулирования распространения ГМО, все чаще пытаются избежать внесения изменений непосредственно в растительную ДНК. И теперь мы вплотную подошли к самой загадочной группе методов.
Эпигенетика. Чуть-чуть не считается
Одной из самых молодых и суперсовременных альтернатив для селекционеров стали подходы эпигенетики — науки о наследуемых механизмах управления экспрессией генов [32].
Все мы знаем, как работает наш генетический код, а вот тонкости эпигенома пока остаются для нас загадкой. Инициация производства белков регулируется множеством факторов. Кроме того, для предотвращения производства какого-либо белка у клетки также припасены приемы, заставляющие замолчать нужный ген. Это и разрушение незрелых молекул РНК, которые еще не готовы к формированию белков, и обеспечение невозможности считывания ДНК для построения РНК-цепей [33].
Итак, эпигенетических сигналов в клетке очень много, они не до конца изучены, но некоторые из них уже находятся на службе у селекции растений, которые мы едим каждый день.
Блокируй ДНК, если осмелишься
Подавить работу генов живых клеток можно с помощью природного механизма — РНК-зависимого ДНК-метилирования. В этом случае блокируется процесс считывания кода ДНК [34].
РНК, отвечающие за специфичность действия метилтрансфераз в клетках организма, могут быть введены в растение с использованием различных методик. Например, посредством ввода растительных вирусов или с помощью техник генной инженерии [36]. Если ученый изменяет признак растения с помощью ДНК-метилирования и при этом не вносит мутаций в ДНК растения, то такое растение не является ГМО. В случае редактирования генома для производства некодирующих РНК самим растением, получаемое растение считается ГМО, но и тут можно схитрить.
Дело в том, что у растений метилирование определенных областей ДНК может наследоваться [37]. То есть сами черты, вызванные метилированием ДНК, могут передаваться от родителей к следующим поколениям. Благодаря ряду скрещиваний ГМ-растения с его природной формой, можно получить гибрид, у которого отсутствует измененная ДНК, но само метилирование сохраняется. Следовательно, такое растение не будет считаться генетически модифицированным.
Насколько метилирование безопасно? Достаточно. Ведь при использовании этого метода вносимые метильные группы не добавляются в случайных местах. Это означает, что, в отличие от традиционных методов селекции, результаты такого воздействия предсказуемы. Можно преднамеренно выбрать ген растения, кодирующий определенный белок, и заставить его замолчать. А вот выбирать гены нужно аккуратно, так как механизмы метилирования ДНК довольно сложны, и их нарушение может быть чревато для организма заболеваниями или преждевременным старением.
Молчи, РНК, молчи
Если ген считался и превратился в мРНК, это еще не значит, что белок будет построен, потому что его мРНК может быть разрушена в цитоплазме клетки. Такое часто происходит при внесении учеными дополнительных генов в ДНК растений. Называют это явление посттранскрипционным молчанием. Оно резко ограничивает эффективность работы генных инженеров, занятых созданием новых форм с увеличенным числом определенных генов. С другой стороны, посттранскрипционное молчание можно использовать для создания растений, устойчивых к растительным вирусам. В этом случае механизм замолкания генов может способствовать разрушению вирусных мРНК.
Впервые молчание генов у генетически измененных организмов описали еще в 1990 году. Тогда введение в геном петунии дополнительных копий гена, отвечающего за красную окраску цветков, значительно снизило количество красного пигмента в растении. Судя по всему, механизмов замолкания РНК несколько, и ученые пока не вполне понимают, как они работают и как они связаны между собой. Есть предположение, что отдельные молекулы мРНК активно деградируют при достижении определенного порога их количества [38]. Другая теория основана на изменениях в регуляции работы генома, связанных с метилированием ДНК, в результате которых среди нормальных РНК синтезируется некоторое количество ненормальных, которые запускают распад мРНК в цитоплазме [39].
Среди механизмов посттранскрипционного молчания сегодня достаточно подробно описано явление РНК-интерференции, например в статье «Обо всех РНК на свете, больших и малых» [40].
В связи с прогрессом в изучении молчания генов в последние годы все большее внимание уделяют прикладным исследованиям, направленным на получение нокаутных (содержащих молчащие гены) клеток, тканей и организмов при помощи РНК-интерференции. Ведь теоретически, грамотно используя этот механизм, можно выключить образование любого белка клетки. И действительно, успешных экспериментов уже много. Например, с помощью РНК-интерференции в двух видах кофе (Coffea arabica и C. canephora) успешно снизили содержание кофеина на 30–50%. Схожий эксперимент провели и с табаком с целью снижения в нем количества никотина [41].

Рисунок 14. Кот Pusheen в костюме шоколадно-ореховой пасты «Нутелла».
сайт pic-collage.com
Другая возможность использования вмешательства РНК в процесс экспрессии белков — подавление синтеза аллергенов. Это уже не сказка: генетики испанского Института сельского хозяйства в Кордове смогли почти полностью очистить пшеницу от глиадина, из-за которого у многих людей глютен пшеницы вызывает иммунную реакцию. Правда, и без CRISPR/Cas9 тут не обошлось [42]. Конечно, в этом направлении ученым еще работать и работать, но уже есть надежда, что совсем скоро любой сможет вдоволь поесть арахисового масла и не умереть от анафилактического шока (рис. 14)!
Важно отметить, что подобное вмешательство генной инженерии в метаболизм растения отличается от традиционного. В геном не встраивается чужеродный ген, а значит, не происходит синтез чужеродного белка. Это делает РНК-интерференцию вмешательством со сниженным экологическим риском. Даже формально такое вмешательство не несет на себе печати «ГМО». Стоит также сказать, что многие механизмы распада молекул РНК до сих пор не ясны, и белые пятна в этой области только начинают заполняться [43].
Особое мнение
Какой итог мы можем подвести? Вероятно, если бы мы и могли сделать выбор в пользу «натуральных» злаков, овощей и фруктов, то мы давно упустили этот шанс. Но, несмотря на то, что прогресс остановить уже невозможно, осознавать и правильно оценивать риски распространения и употребления генетически модифицированных продуктов необходимо.
Мы показали, что сегодня, когда общество проявляет большую озабоченность безопасностью пищевых продуктов, селекционеры находятся в ситуации, вынуждающей их использовать альтернативные пути получения новых сортов растений. В силу тех или иных причин эти методы являются разрешенными, но в ряде случаев не менее рискованными, чем методики получения ГМО. Не стоит также забывать, что грамотный подход к селекции растений с помощью редактирования растительного генома доказанно приводит к снижению давления на экологию за счет минимизации использования пестицидов и удобрений, а это немаловажно. В любом случае, какие продукты мы будем есть завтра, зависит только от нас самих.
Литература
- Готовим ГМ-рис вместе;
- Jazmín Ramos-Madrigal, Bruce D. Smith, J. Víctor Moreno-Mayar, Shyam Gopalakrishnan, Jeffrey Ross-Ibarra, et. al.. (2016). Genome Sequence of a 5,310-Year-Old Maize Cob Provides Insights into the Early Stages of Maize Domestication. Current Biology. 26, 3195-3201;
- Pesticides are “global human rights concern”, say UN experts urging new treaty. (2017). UN Human Rights;
- Трансгенные растения — спасители планеты или бомбы замедленного действия?;
- Gilles-Eric Séralini, Emilie Clair, Robin Mesnage, Steeve Gress, Nicolas Defarge, et. al.. (2014). Republished study: long-term toxicity of a Roundup herbicide and a Roundup-tolerantgenetically modified maize. Environ Sci Eur. 26;
- Walker S. Biotechnology demystified. McGraw-Hill Professional, 2006. — 276 p.;
- Philp J. (2014). Emerging policy issues in synthetic biology. Ministry of science and higher education (Republic of Poland);
- В Казани 73% опрошенных горожан считают, что ГМО опаснее обычных продуктов. (2015). «Бизнес Online»;
- S. Kempin, B. Savidge, M. Yanofsky. (1995). Molecular basis of the cauliflower phenotype in Arabidopsis. Science. 267, 522-525;
- From plant to crop: the past, present and future of plant breeding. (2016). VIB’s fact series;
- H. Saika, A. Oikawa, F. Matsuda, H. Onodera, K. Saito, S. Toki. (2011). Application of Gene Targeting to Designed Mutation Breeding of High-Tryptophan Rice. PLANT PHYSIOLOGY. 156, 1269-1277;
- Закиян С.М., Власов В.В., Медведев С.П. (2014). «Редакторы геномов». От «цинковых пальцев» до CRISPR. «Наука из первых рук»;
- Christian M. and Voytas D.F. Engineered TAL effector proteins: versatile reagents for manipulating plant genomes. In: Advances in new technology for targeted modification of plant genomes / ed. by Zhang F., Puchta H., Thomson J. NY: Springer, 2015;
- Daboussi F., Stoddard T.J., Zhang F. Engineering meganuclease for precise plant genome modification. In: Advances in new technology for targeted modification of plant genomes / ed. by Zhang F., Puchta H., Thomson J. NY: Springer, 2015;
- L. Cong, F. A. Ran, D. Cox, S. Lin, R. Barretto, et. al.. (2013). Multiplex Genome Engineering Using CRISPR/Cas Systems. Science. 339, 819-823;
- Елмуратов А. и Коростин Д. (2016). CRISPR/CAS9: что значит для человечества переход от чтения генома к его редактированию? Forbes;
- CRISPR-эпопея и ее герои;
- Еще раз про ГМО;
- Просто о сложном: CRISPR/Cas;
- Растения-биофабрики;
- Shaida Moghaddassi, Will Eyestone, Colin E. Bishop. (2014). TALEN-Mediated Modification of the Bovine Genome for Large-Scale Production of Human Serum Albumin. PLoS ONE. 9, e89631;
- Китайские ученые генетически модифицировали эмбрионы человека. (2015). N+1;
- Ершов А. (2016). Великобритания разрешила редактировать геном человеческих эмбрионов. N+1;
- A late blight resistant potato for Europe. (2015). VIB’s fact series;
- Inger Baeksted Holme, Toni Wendt, Preben Bach Holm. (2013). Intragenesis and cisgenesis as alternatives to transgenic crop development. Plant Biotechnol J. 11, 395-407;
- Цисгеномика: новое слово в селекции растений;
- Henk J Schouten, Frans A Krens, Evert Jacobsen. (2006). Cisgenic plants are similar to traditionally bred plants: International regulations for genetically modified organisms should be altered to exempt cisgenesis. EMBO Rep. 7, 750-753;
- Makonkawkeyoon S., Smitamana P., Hirunpetcharat C., Maneekarn N. (1995). Production of mouse immunoglobulin G by a hybrid plant derived from tobacco-mouse cell fusions. Experientia. 51, 19–25;
- Трошин Л.П. Ампелография и селекция винограда. Краснодар: Издательский цех «Вольные мастера», 1999. — 138 с.;
- Philipkoski K. (2003). Simpsons plant seeds of invention. Wired;
- Steve van Nocker, Susan E Gardiner. (2014). Breeding better cultivars, faster: applications of new technologies for the rapid deployment of superior horticultural tree crops. Hortic. Res.. 1, 14022;
- Marjori A. Matzke, Tatsuo Kanno, Antonius J.M. Matzke. (2015). RNA-Directed DNA Methylation: The Evolution of a Complex Epigenetic Pathway in Flowering Plants. Annu. Rev. Plant Biol.. 66, 243-267;
- Marjori A. Matzke, Rebecca A. Mosher. (2014). RNA-directed DNA methylation: an epigenetic pathway of increasing complexity. Nat Rev Genet. 15, 394-408;
- Heng Zhang, Xinjian He, Jian-Kang Zhu. (2013). RNA-directed DNA methylation in plants. RNA Biology. 10, 1593-1596;
- Laufer D. (2013). Long-lasting alterations to DNA methylation and ncRNAs could underlie the effects of fetal alcohol exposure in mice. Slideshare.net;
- Shulin Deng, Hongzheng Dai, Catalina Arenas, Huan Wang, Qi-Wen Niu, Nam-Hai Chua. (2014). Transcriptional Silencing of Arabidopsis Endogenes by Single-Stranded RNAs Targeting the Promoter Region. Unknown journal title.. 55, 823-833;
- Louise Jones, Frank Ratcliff, David C Baulcombe. (2001). RNA-directed transcriptional gene silencing in plants can be inherited independently of the RNA trigger and requires Met1 for maintenance. Current Biology. 11, 747-757;
- Abler M.L. and Green P.J. (1996). Control of mRNA stability in higher plants. Plant. Mol. Biol. 32, 63–78;
- Hoofvan A. and Green P.J. Control of mRNA decay in plants. In: mRNA metabolism and posttranscriptional gene regulation / ed. by Harford J.B. and Morris D.R. NY: Wiley-Liss, 1997. P. 201–216;
- Обо всех РНК на свете, больших и малых;
- Рябушкина Н.А. и Галиакпаров Н.Н. (2009). Молчание генов в растениях. Как это явление можно использовать в биотехнологии. Eurasian Journal of Applied Biotechnology. 1, 15–31;
- Голованов Г. (2017). Генетики очистили глютен от вызывающего аллергию глиадина. «Хайтек»;
- Плотников В.К. (2007). Закономерный распад РНК in vivo и in vitro — основа новых методов биотехнологии. Наука Кубани. 4, 4–15.






