
Поиск новых антибиотиков с помощью машинного обучения
17 марта 2020
Поиск новых антибиотиков с помощью машинного обучения
- 1244
- 1
- 5
Применение методов машинного обучения для определения веществ с антибактериальными свойствами может стать перспективной стратегией поиска новых антибиотиков
-
Автор
-
Редактор
Проблема стремительного распространения устойчивости к антибиотикам среди патогенных бактерий — одна из самых острых проблем современной медицины, поэтому разработка новых антибиотиков сейчас является очень важной задачей. Недавно на страницах журнала Cell американские исследователи сообщили, что сумели найти новый потенциальный антибиотик широкого спектра в базе данных соединений Drug Repurposing Hub с помощью машинного обучения. Обнаруженное вещество получило название галицин. Авторы работы экспериментально показали, что галицин обладает бактерицидной активностью против бактерий разных филогенетических групп, включая такие патогены человека, как возбудитель туберкулеза Mycobacterium tuberculosis и возбудитель колита Clostridioides difficile. Наша статья посвящена новой стратегии поиска потенциальных антибиотиков с помощью машинного обучения.
Во второй половине XX века в связи с открытием пенициллина, стрептомицина и других антибиотиков стало казаться, что инфекционные болезни больше не представляют серьезную угрозу человечеству. Ситуация стала меняться, когда выяснилось, что патогенные бактерии удивительно быстро приобретают механизмы, обеспечивающие им устойчивость к антибиотикам из арсенала медиков. Более того, благодаря горизонтальному переносу генов, широко распространенному среди прокариот, они с поразительной скоростью обмениваются генами, обеспечивающими защиту от действия антибиотиков.
Ситуация осложняется еще и тем, что поиск антибиотиков в последние годы практически зашел в тупик. Большинство антибиотиков, применяющихся сейчас в клинической практике, были обнаружены путем скрининга вторичных метаболитов, выделяемых почвенными микроорганизмами. Таким путем открыли β-лактамные антибиотики, аминогликозиды, полимиксины и гликопептиды. Ряд антибиотиков имеет полусинтетическое происхождение: их получили посредством навешивания различных химических групп на уже известные антибиотики. Есть в арсенале врачей и полностью синтетические антибиотики, например, антибиотики пиримидинового и хинолонового рядов.
Однако за последние десятилетия прогресс в получении новых антибиотиков стал удручающе низок. Скрининг природных метаболитов чаще всего приводит к повторному обнаружению уже известных антибиотиков. Не приносят успеха и попытки получить новые антибиотики, к которым бактерии не выработали устойчивости, посредством химической модификации известных антибиотиков. По некоторым прогнозам, если текущая ситуация с разработкой новых антибиотиков не изменится, к 2050 году на долю инфекционных заболеваний будет приходиться 10 миллионов смертей ежегодно [1]. Есть ли выход из этого кризиса?
Подробнее о проблеме антибиотикорезистентности читайте в спецпроекте «Биомолекулы» «Антибиотики и антибиотикорезистентность», а также в статьях [2–4].
Сила машинного обучения: потенциальный препарат от диабета оказался мощным антибиотиком
В отличие от поиска антибиотиков традиционными методами, развитие искусственного интеллекта в последние десятилетия совершило колоссальный рывок. По этой причине многие программы по поиску антибиотиков переключились на принципиально новый подход — широкомасштабный автоматизированный скрининг библиотек искусственных органических соединений на предмет наличия у них бактерицидной активности. Библиотеки синтетических соединений содержат сотни тысяч молекул, поэтому для работы с ними необходимы специальные алгоритмы. Авторы недавней публикации в Cell создали нейронную сеть, способную предсказывать бактерицидные свойства соединений in silico [1]. В качестве бактерии, на которой экспериментально проверяли бактерицидные свойства потенциальных антибиотиков, была выбрана всем известная кишечная палочка Escherichia coli (штамм BW25113).
Первоначально исследователи обучили нейронную сеть предсказывать способность веществ ингибировать рост E. coli на молекулах, бактерицидное действие которых на клетки E. coli уже хорошо известно. Тренировочная выборка включала 2335 веществ разнообразной химической структуры, причем соединение считалось успешно прошедшим скрининг, если оно ингибировало рост E. coli на 80% и более. Далее исследователям предстояло научить алгоритм выявлять соединения с потенциальной бактерицидной активностью на основании их химической структуры. Не вдаваясь в тонкости машинного обучения, можно сказать, что на этапе предсказания химические связи в молекуле представляли как векторы, соединяющие между собой различные функциональные группы и атомы. Итеративно проходя по всем векторам (то есть связям в молекуле), модель ищет в молекуле мотивы, которые могут придавать ей бактерицидные свойства. В конечном счете, исследователи получили модель, которая способна более-менее успешно предсказывать бактерицидные свойства веществ по их структурной формуле (рис. 1).

Рисунок 1. Машинное обучение и поиск новых антибиотиков: сначала алгоритм поиска обучают на выборке соединений, для которых известны антибактериальные свойства. Далее обученный алгоритм ищет соединения с «бактерицидными» структурными мотивами в базах данных, и самые перспективные соединения проходят экспериментальную проверку.
Теперь ученые пустили обученную нейросеть в бой, применив ее для предсказания антибактериальных свойств соединений библиотеки Drug Repurposing Hub. В процессе обработки содержимого библиотеки каждому соединению присваивался некий балл, отражающий его потенциальные свойства как антибиотика. После обработки ученые отобрали 99 соединений с лучшими баллами, которые содержались только в библиотеке Drug Repurposing Hub. Их экспериментально проверили на способность подавлять рост E. coli. Проверка показала, что 51 вещество действительно способно ингибировать рост E. coli. Но хороший антибиотик не только должен подавлять рост бактерий — он должен быть минимально токсичен для человека. Поэтому 51 потенциальный антибиотик проверили на токсичность для человека, опять же используя методы машинного обучения, причем предпочтения отдавали соединениям, которые уже находятся на стадии доклинических или клинических испытаний и минимально близки структурно к веществам, которые входили в тренировочную выборку, чтобы снизить риск переоткрытия уже описанного антибиотика. Всем этим критериям, как оказалось, удовлетворяет только одно вещество — ингибитор N-концевой киназы c-Jun с кодовым названием SU3327, который проходил клинические испытания как препарат для лечения диабета. Авторы работы дали ему название галицин. Структурно галицин наиболее близок к азотсодержащим антипаразитарным препаратам и антибиотику метронидазолу (рис. 2).
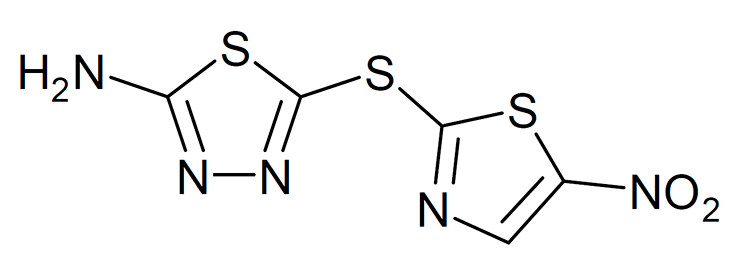
Рисунок 2. Структурная формула галицина
Иголка в стоге сена: галицин
Далее исследователи начали со всех сторон изучать свойства новоявленного антибиотика. Выяснилось, что галицин способен убивать клетки E. coli, находящиеся в состоянии покоя. Такие клетки с подавленным метаболизмом нечувствительны ко многим антибиотикам, мишенями которых служат процессы, происходящие в метаболически активных клетках (например, синтез белков) или делящихся клетках (синтез клеточной стенки). Галицин показал эффективность против штаммов E. coli, имеющих гены устойчивости ко многим известным антибиотикам — β-лактамным, полимиксинам, хлорамфениколу, аминогликозидам, фторхинолонам и нитрофурановому антибиотику нитрофурантоину. Против галицина оказались бессильны и антибиотикорезистентные штаммы других бактерий, таких как Mycobacterium tuberculosis и Acinetobacter baumannii. По данным ВОЗ, именно эти болезнетворные бактерии чаще всего оказываются устойчивыми к имеющимся в арсенале врачей способам лечения [1].
Так каков же механизм действия галицина? Чтобы найти хоть какие-то зацепки, ученые пытались получить мутантные бактерии, устойчивые к галицину. Для этого бактерии выращивали в среде, содержащей галицин, в надежде на то, что рано или поздно появится-таки мутантная клетка, резистентная к новому антибиотику. Однако попытки получить устойчивые к галицину клетки провалились. Тогда исследователи прибегли к секвенированию РНК клеток, подвергшихся действию галицина, чтобы узнать, какие метаболические изменения происходят в них перед гибелью. Оказалось, что под действием галицина быстро подавляется экспрессия генов, связанных с подвижностью клетки, а при концентрациях галицина, близких к летальным, повышалась экспрессия генов, необходимых для гомеостаза железа. Предыдущие исследования показали, что снижение экспрессии гена флагеллина (белка, образующего бактериальные жгутики) и понижение подвижности клеток бактерий может быть результатом исчезновения трансмембранного потенциала и, следовательно, протондвижущей силы в мембране бактериальной клетки, что приводит к ее гибели. Может быть, галицин нарушает трансмембранный потенциал клетки и тем самым вызывает ее гибель, даже если она находится в метаболически неактивном состоянии?
Для проверки этого предположения ученые культивировали E. coli в средах с разными значениями pH и изучали их ответ на воздействие галицина. Выяснилось, что по мере увеличения pH сила действия галицина ослабевала, поэтому был сделан вывод, что галицин может нарушать ΔpH клетки. Для оценки изменения трансмембранной разности потенциалов под действием галицина авторы исследования использовали потенциометрический флуорофор DISC3(5). Когда трансмембранный потенциал клетки или целостность ее мембраны нарушены, DISC3(5) находится во внеклеточной среде, где и флуоресцирует. В ответ на изменения ΔpH клетка по компенсаторному механизму повышает трасмембранную разность потенциалов, из-за чего DISC3(5) переходит в клеточную мембрану, и уровень флуоресценции снижается. Именно такую картину ученые пронаблюдали в клетках, подвергнутых воздействию галицина, причем, чем выше была доза галицина, тем сильнее снижалась флуоресценция. Таким образом, галицин нарушает ΔpH клетки и за счет этого вызывает ее смерть. Любопытно, что галицин действует как антагонист антибиотика тетрациклина, поскольку поступление тетрациклина в клетку E. coli зависит от ее ΔpH.
Но с чем же связана повышенная экспрессия генов гомеостаза железа под действием галицина в концентрации, близкой к смертельной? Оказалось, что галицин формирует комплексы с ионами железа в растворе и именно этим нарушает ΔpH клетки, подобно другим антибактериальным ионофорам (например, даптомицину).
Галицин в боевых условиях
Описанные выше эксперименты с галицином проводили на клетках, растущих в культуральной среде. А что насчет эффективности галицина в реальном организме? Для оценки терапевтического потенциала галицина авторы исследования использовали мышей, инфицированных бактерией Acinetobacter baumannii штамма 288. Клетки этого штамма устойчивы ко всем антибиотикам, применяющимся сейчас в клинической практике. Галицин оказался весьма эффективен и в этом случае: пять из шести мышей, инфицированных A. baumannii, после лечения галицином были почти полностью очищены от этого возбудителя. Примечательно, что галицин эффективно подавлял инфекцию, вызванную бактерией, очень далекой от A. baumannii филогенетически — Clostridioides difficile (эта бактерия вызывает одну из форм колита).
Не галицином единым...
После успешных экспериментов с галицином авторы исследования не успокоились и приступили к поиску новых антибиотиков в других библиотеках, в частности, ZINC15, которая содержит около 1,5 млрд молекул, созданных для скрининга in silico. Адаптированный вариант модели, разработанный для скрининга базы Drug Repurposing Hub, позволил идентифицировать в этой библиотеке еще 23 соединения, предположительно обладающих антибактериальными свойствами. Каждое из них экспериментально протестировали на E. coli, Staphylococcus aureus, Klebsiella pneumoniae, A. baumannii и P. aeruginosa. Восемь веществ оказались действенными ингибиторами роста по крайней мере одной из перечисленных бактерий, а два вещества обладали действием широкого спектра.
Несмотря на блестящие результаты, полученные в экспериментах с галицином, этому препарату еще предстоит пройти долгий и мучительный путь клинических испытаний, прежде чем появиться на полках аптек. Однако успех применения методов машинного обучения в поиске новых соединений с антибактериальными свойствами, несомненно, дает надежду на то, что мы будем способны сдержать бурный всплеск инфекционных заболеваний, возбудители которых приобрели резистентность к современным антибиотикам, применяющимся в клинической практике.
Литература
- Jonathan M. Stokes, Kevin Yang, Kyle Swanson, Wengong Jin, Andres Cubillos-Ruiz, et. al.. (2020). A Deep Learning Approach to Antibiotic Discovery. Cell. 180, 688-702.e13;
- По следам антибиотиков: что могло пойти не так и как это исправить?;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Эволюция наперегонки, или Почему антибиотики перестают работать.





