Помочь тем, кого нельзя обнять
17 ноября 2015
Помочь тем, кого нельзя обнять
- 2565
- 0
- 3
Мальчику Роме почти 5 лет. Он — «ребенок-бабочка». На его руках специальные бинты — только так он может есть, играть и рисовать.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: «Мальчик, который остался без кожи». Это не название очередного фильма ужасов. Это документальный фильм режиссера Патрика Коллертона, запечатлевшего последние месяцы жизни 36-летнего Джонни Кеннеди, страдавшего редким генетическим заболеванием — дистрофическим буллезным эпидермолизом. Фильм привлек внимание пяти миллионов зрителей по всей Великобритании и помог собрать 500 000 фунтов стерлингов на благотворительность для международной ассоциации DEBRA, чья деятельность направлена на изучение и лечение буллезного эпидермолиза. Жизнь людей с этим диагнозом и их родных — это путь, который осилит не каждый: он тяжел как физически, так и морально, и требует мужества и невероятной воли к жизни. Детей, страдающих этим недугом, называют детьми-бабочками, сравнивая хрупкость их кожи с хрупкостью крыла бабочки. Что же такое буллезный эпидермолиз и каковы прогнозы на будущее?
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Я знаю только один способ быть в ладу с собственной совестью:
этот способ — не уклоняться от страдания.
Антуан де Сент-Экзюпери
Что такое буллезный эпидермолиз?
Буллезный эпидермолиз (БЭ) — группа редких генетически и клинически гетерогенных заболеваний, характеризующихся образованием пузырей и эрозий на коже и слизистых оболочках в результате незначительной механической травмы [1].
Кожа человека состоит из трех слоев: наружного — эпидермиса, среднего — дермы — и самого нижнего — подкожно-жировой клетчатки (гиподермы) (рис. 1).
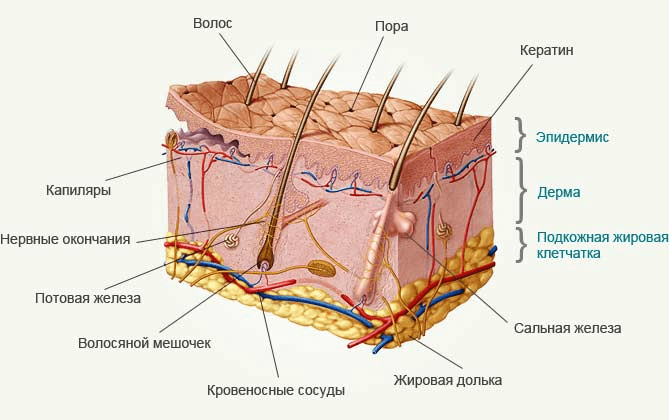
Рисунок 1. Строение кожи человека.
Эпидермис кожи человека состоит из пяти различных слоев эпителиальных клеток, или кератиноцитов, самый нижний из которых — базальный эпителий — прикрепляется к дерме с помощью множества разных белков (рис. 2). Эти белки не только определяют стабильность соединения клеток базального эпителия с дермой, но и их собственную прочность. Мутации в генах, кодирующих эти белки, приводят к снижению прочности этого соединения, делая кожу чрезвычайно чувствительной к механическим воздействиям. Даже самое легкое надавливание — трение швов одежды, нежные объятия матери — может привести к образованию пузырей и причинить нестерпимую боль (рис. 3) [1].
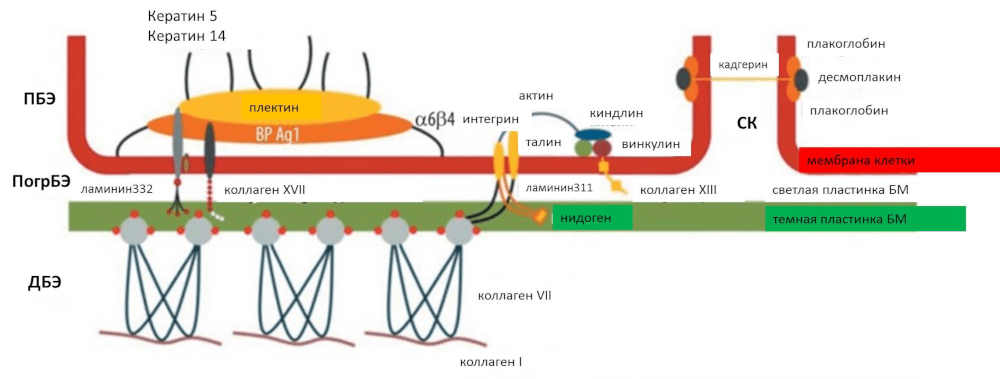
Рисунок 2. Белки, участвующие в патогенезе различных типов наследственного БЭ. ПБЭ — простой БЭ; ПогрБЭ — пограничный БЭ; ДБЭ — дистрофический БЭ; СК — синдром Киндлера; БМ — базальная мембрана.
[1], рисунок адаптирован
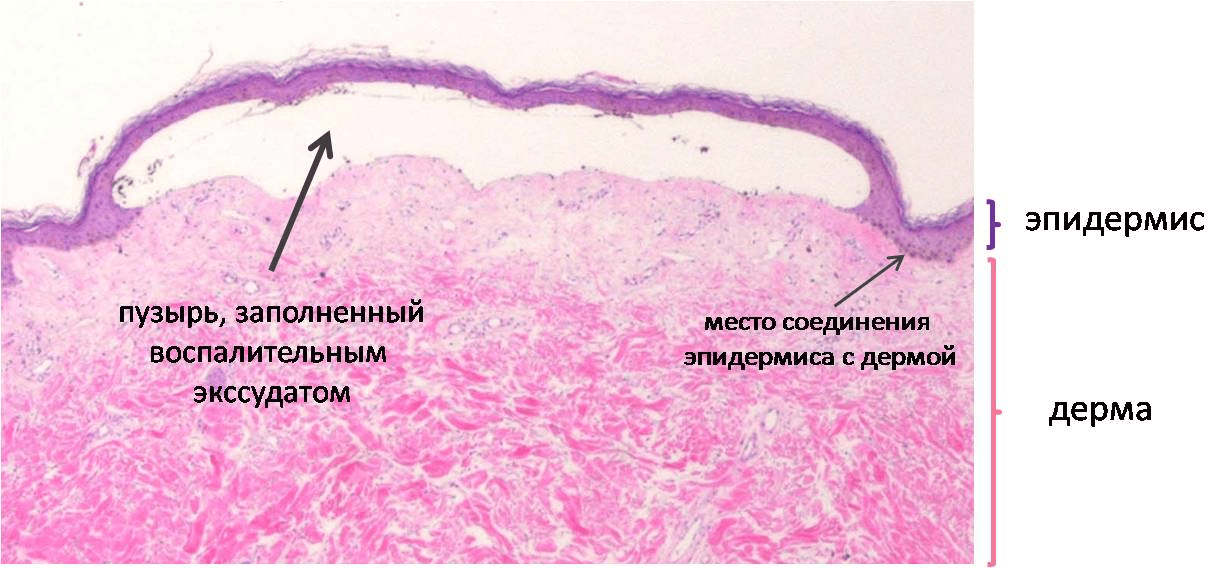
Рисунок 3. Микроструктура образца кожи больного БЭ. При БЭ соединение между эпидермисом и дермой непрочное. В результате механического воздействия эпидермис отслаивается от дермы. В месте повреждения увеличивается проницаемость капилляров, и жидкая часть крови (плазма), а также клетки, участвующие в воспалении (лейкоциты), выходят в рану — образуется воспалительный экссудат. В месте отслоения формируется пузырь, который увеличится в размерах, если его вовремя не проткнуть стерильной иглой.
DermaAmin, рисунок адаптирован
Как правило, заболевание заметно сразу после рождения ребенка или в первые месяцы его жизни. Каждый новый день — настоящее испытание для больных БЭ и их опекунов: смена повязок, защищающих хрупкую кожу от повреждений и закрывающих уже существующие раны, обработка ран антисептиками — эти жизненно важные, чрезвычайно болезненные и изнурительные процедуры являются практически единственной составляющей современного лечения БЭ. При тяжелых формах заболевание поражает помимо кожных покровов слизистые оболочки и даже внутренние органы. БЭ относится к так называемым орфанным, то есть редким, заболеваниям. Частота встречаемости различных типов БЭ варьирует от 1:30 000 до 1:1 000 000 и зависит от популяции [2].
Классификация
В зависимости от уровня, на котором происходит повреждение кожи, выделяют четыре типа БЭ: простой, пограничный, дистрофический и синдром Киндлера.
Простой БЭ относится к так называемому интраэпидермальному типу БЭ, то есть повреждения затрагивают только эпидермис. Простой БЭ развивается в результате мутаций в генах белков, обеспечивающих прочность клеток базального слоя эпителия (рис. 2). Пузыри образуются ближе к поверхности кожи. Это самая легкая форма БЭ, при которой происходит полноценное заживление ран. Пограничный и дистрофический БЭ относятся к субэпидермальным типам БЭ, поскольку затрагивают не только эпидермис, но и дерму. При этих типах БЭ поврежденными оказываются белки, участвующие непосредственно в соединении двух слоев кожи (рис. 4). Полноценного заживления ран не происходит — на месте нормальной кожи в конечном счете образуются рубцы. Пограничный БЭ, в свою очередь, подразделяется на два типа: Герлиц и не-Герлиц, первый из которых летален. Дистрофический же БЭ в зависимости от типа наследования подразделяется на доминантную и рецессивную формы. Синдром Киндлера относится к смешанному типу БЭ, поскольку пузыри образуются на разных уровнях [1].
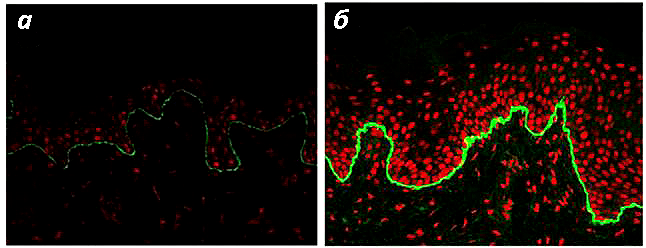
Рисунок 4. Иммунофлуоресцентное картирование образца кожи пациента с рецессивным дистрофическим БЭ. Для картирования использовали антитела к коллагену VII (зеленый цвет). а — Пониженное количество коллагена VII в биоптате от пациента с рецессивным дистрофическим БЭ. б — Кожа здорового донора. Ядра клеток окрашены йодидом пропидия (красный цвет).
[3], рисунок адаптирован
Диагностика
Для того чтобы подтвердить диагноз БЭ, необходимо провести тщательное обследование пациента. Самым важным этапом диагностики является исследование биоптата поврежденных участков кожи. Для этого используют такие методы, как световая, флуоресцентная и электронная микроскопия, а также генетический анализ.
Исследование с помощью световой микроскопии позволяет отличить интраэпидермальный тип БЭ от субэпидермальных. Для более точного определения уровня повреждения используют электронную и флуоресцентную микроскопии. С помощью электронной микроскопии можно отличить рецессивную форму дистрофического БЭ от доминантной (рис. 5). Так, при рецессивном дистрофическом БЭ наблюдается значительное снижение или полное отсутствие продукции коллагена VII типа, в то время как при доминантном дистрофическом БЭ дефектный белок вырабатывается в нормальном или слегка сниженном количестве. Однако из-за трудоемкости методов электронной микроскопии в настоящее время на первый план выходит микроскопия флуоресцентная. С помощью окрашивания флуоресцентными антителами этот метод позволяет визуализировать белки, участвующие в патогенезе заболевания, а также оценить их продукцию и распределение (рис. 4) [3].
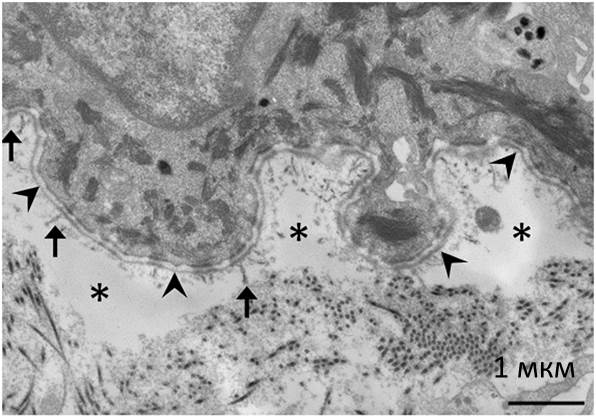
Рисунок 5. Ультраструктура образца поврежденного участка кожи пациента с рецессивным дистрофическим БЭ. Звездочками обозначены места разрывов, расположенные сразу под темной пластинкой базальной мембраны (бесклеточного слоя, отделяющего дерму от эпидермиса), на которую указывают «галочки». Стрелками обозначены участки с единичными фибриллами коллагена VII. Изображение получено методом электронной микроскопии.
Но только генетический анализ (ДНК-диагностику) можно назвать оптимальным методом для определения типа наследования и специфических мутаций, имеющихся у больных БЭ, а также наиболее точным методом различения клинических форм простого, пограничного и дистрофического БЭ [4].
Существует также пренатальная (до рождения) диагностика БЭ, материалом для которой служит ДНК из околоплодной жидкости, забираемая в первом триместре беременности (до 11 недель) [4].
Лечение
К сожалению, в настоящее время БЭ неизлечим. Основная терапия направлена на предотвращение образования новых пузырей и эрозий, лечение ран и предотвращение их инфицирования. Главные задачи лечения — защита хрупкой кожи пациентов от механических воздействий (использование специальных повязок) и обработка уже существующих ран (применение антисептиков, наложение повязок).
Но наука не стоит на месте, и ученые всего мира отчаянно ищут лекарство от страшного недуга. Наиболее проработаны три перспективных вида терапии БЭ: протеиновая, клеточная и генная. Рассмотрим эти подходы подробнее.
Протеиновая терапия
При этом подходе в организм пациента вводится достаточное количество нормального белка. Исследования показали, что внутридермальное введение мышам с рецессивным дистрофическим БЭ очищенного человеческого коллагена VII приводит к формированию нормальных коллагеновых фибрилл в зоне соединения эпидермиса с дермой. При внутривенном введении очищенного белка наблюдается системное отложение коллагена VII в коже. Также было показано, что подобная терапия не только улучшает функциональное состояние кожи, но и способствует заживлению ран. Основываясь на результатах доклинических исследований, компания Lotus Tissue Repair, впоследствии вошедшая в состав Shire Pharmaceuticals, начала проведение расширенных доклинических исследований внутридермальных и внутривенных инъекций коллагена VII на модели рецессивного дистрофического БЭ у собак, а также первую стадию клинических исследований [3], [5].
Клеточная терапия
При этом способе лечения в организм пациента вводится необходимое и достаточное количество клеток, содержащих нормальный ген, кодирующий нужный белок.
Одним из перспективных видов клеточной терапии является внутридермальная инъекция аллогенных (полученных от здоровых доноров) фибробластов. Так, было показано, что подобный подход восстанавливает синтез коллагена VII и стабилизирует соединение эпидермиса с дермой в мышиной модели рецессивного дистрофического БЭ. Следующий шаг на пути к реализации этого вида терапии уже предпринят: нескольким пациентам с рецессивным дистрофическим БЭ были введены аллогенные фибробласты. И хотя спустя две недели после инъекции введенные клетки не обнаруживались, уровень продукции коллагена оставался повышенным как через две недели, так и через три месяца. Ученые считают, что основной терапевтический эффект инъекции аллогенных фибробластов заключается в увеличении продукции эпидермального фактора роста HB-EGF, а также в увеличении экспрессии гена коллагена VII в кератиноцитах и фибробластах реципиента. Однако механизм этого явления пока не установлен [3], [6].
Аллогенная трансплантация костного мозга также может быть перспективным способом лечения БЭ. Так, на мышиной модели рецессивного дистрофического БЭ было показано, что трансплантация костного мозга приводит к облегчению симптомов болезни. Вслед за обнадеживающими результатами были начаты клинические испытания подобного метода терапии. Однако пока результаты неутешительны: пять из двадцати пациентов умерли от прогрессии заболевания или осложнений после трансплантации [3], [6].
Генная терапия
Наконец, последний и, пожалуй, самый перспективный подход — генная терапия (рис. 6). В этом случае пациентам пересаживаются аутологичные (сделанные из собственных клеток) трансплантаты, в клетках которых с помощью методов генетического редактирования дефектный ген заменяется нормальным. И хотя подобная процедура не приводит к полному исцелению, она способна временно устранить симптомы БЭ, а также является относительно простой в техническом отношении.
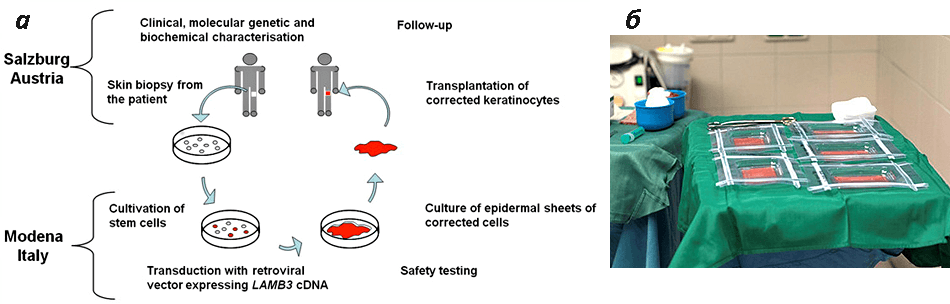
Рисунок 6. Редактирование собственной ДНК в лечении БЭ. а — Принцип генной терапии. На первом этапе культивируют эпидермальные стволовые клетки из биоптатов кожи пациента с БЭ. Затем стволовые клетки подвергают процедуре генетического редактирования, в результате которой дефектный ген замещается нормальным. После того как пласт из генетически отредактированных кератиноцитов будет проверен на безопасность, его трансплантируют пациентам. б — Трансплантаты, сформировавшиеся из «правильных» кератиноцитов пациента с рецессивным дистрофическим БЭ.
Первые успехи генной терапии были достигнуты в Италии в 2006 году, когда в эпидермальные стволовые клетки пациента с пограничным БЭ с помощью ретровирусной конструкции был доставлен нормальный ген LAMB3, кодирующий одну из субъединиц белка ламинина-332. Из «исправленных» клеток были созданы эпидермальные трансплантаты, которые затем были пересажены на ноги пациента. В результате из них образовалась полноценная в функциональном отношении кожа. Исследование показало, что выживание даже небольшого числа стволовых клеток в подобных трансплантатах приводит к успешному восстановлению нормальных функций кожи. Спустя восемь лет продукция целевого белка LAMB3 в коже пациентов все еще сохранялась. Не было обнаружено ни пузырей, ни признаков воспаления, опухолевого роста или какого-либо иммунного ответа в области трансплантата. В июле 2014 года в Австрии провели вторую подобную операцию. Профессор Альфред Лэйн из Стэнфордского университета (Калифорния) вместе с сотрудниками начал клинические испытания подобной технологии, нацеленной на восстановление синтеза коллагена VII в эпидермальных стволовых клетках пациента с рецессивным дистрофическим БЭ. Спустя 30 дней после операции в областях трансплантации не было отмечено никаких отклонений, а уровень продукции коллагена VII был гораздо выше исходного [7].
Конечно, и в случае генной терапии существует множество сложностей. Так, замена гена с использованием вирусных конструкций и невирусных систем редактирования ДНК (ZFN, TALEN и CRISPR/Cas9) связана с риском встраивания гена не в то место генома, которое являлось мишенью. Оценить последствия такого встраивания довольно сложно. Поэтому такой подход требует большой осторожности.
Методы ZFN, TALEN и CRISPR/Cas9 основаны на сайт-специфическом действии нуклеаз in vivo. Эти системы обычно состоят из двух модулей, один из которых распознает целевую олигонуклеотидную последовательность, а другой режет цепи ДНК: «А не замахнуться ли нам на... изменение генома?» [8], «CRISPR-системы: иммунизация прокариот» [9], «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [10]. — Ред.
Другая проблема подобной терапии — возможный риск развития иммунного ответа на экспрессируемый новый белок. Особенно велик риск для тех пациентов, чьи клетки несли мутации, полностью исключающие синтез определенного белка. В то же время известно, что у некоторых пациентов с БЭ есть участки кожи, на которых не образуются пузыри и продуцируется повышенный уровень белка. Это явление названо обратным мозаицизмом, или естественной генной терапией, и может предотвращать развитие иммунной реакции на синтезируемый в результате генной терапии белок. Более того, такие «самоизлечившиеся» клетки можно использовать для клеточной терапии, и тогда потребность в генной коррекции исчезнет. Однако до сих пор попытки создать трансплантаты на основе таких клеток у больных с пограничным БЭ не увенчались успехом из-за малого числа подобных клеток в пересаживаемом материале [11].
Заключение
С тех пор как в 1886 году немецкий врач Кебнер впервые употребил термин «буллезный эпидермолиз», многое стало известно о патогенезе этого заболевания. Тем не менее до сих пор основным инструментом терапии является правильный уход за такими больными. Все дело в том, что разработка и производство лекарств для лечения орфанных заболеваний представляет собой наукоемкий и дорогостоящий процесс, увы, невыгодный с коммерческой точки зрения из-за малого потребительского рынка. К сожалению, государство не в состоянии самостоятельно обеспечить решение этой проблемы. В 1978 году в Великобритании была основана ассоциация DEBRA, в настоящее время насчитывающая более 40 стран-участниц. Деятельность ассоциации направлена в первую очередь на медицинскую и социальную помощь пациентам с БЭ и их родным. Помимо этого, ассоциация финансирует исследования в области БЭ и занимается привлечением общественного внимания к данной проблеме. Представителем ассоциации в России является фонд «Б.Э.Л.А. Дети-бабочки». Именно благодаря совместным усилиям государства и ассоциации DEBRA стало возможным проведение масштабных исследований БЭ. В результате многолетней работы ученых всего мира появилось несколько перспективных подходов к терапии БЭ, а некоторые из них сейчас проходят первую фазу клинических испытаний. И хотя впереди еще несколько этапов тщательных исследований, первые положительные результаты дают надежду пациентам с этим редким генетическим заболеванием.
Литература
- Boeira V., Souza E., Rocha B., Oliveira P., Oliveira M., Rêgo V., Follador V. (2013). Inherited epidermolysis bullosa: clinical and therapeutic aspects. An. Bras. Dermatol. 88, 185–198;
- Fine J.D. (2010). Inherited epidermolysis bullosa. Orphanet. J. Rare Dis. 5, 12;
- Shinkuma S. (2015). Dystrophic epidermolysis bullosa: a review. Clin. Cosmet. Investig. Dermatol. 8, 275–284;
- Альбанова В.И., Чикин В.В., Епишев Р.В. (2014). К вопросу о диагностике врожденного буллезного эпидермолиза. Вестник дерматологии и венерологии. 3, 53–59;
- Bruckner-Tuderman L., McGrath J.A., Robinson E.C., Uitto J. (2013). Progress in epidermolysis bullosa research: summary of DEBRA International Research Conference 2012. J. Invest. Dermatol. 133, 2121–2126;
- Soro L., Bartus C., Purcell S. (2015). Recessive dystrophic epidermolysis bullosa. A Review of disease pathogenesis and update on future therapies. J. Clin. Aesthet. Dermatol. 8, 41–46;
- Murauer E.M., Koller U., Pellegrini G., De Luca M., Bauer J.W. (2015). Advances in gene/cell therapy in epidermolysis bullosa. Keio J. Med. 64, 21–25;
- А не замахнуться ли нам на... изменение генома?;
- CRISPR-системы: иммунизация прокариот;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Kiritsi D., Garcia M., Brander R., Has C., Meijer R., Jose Escámez M. et al. (2014). Mechanisms of natural gene therapy in dystrophic epidermolysis bullosa. J. Invest. Dermatol. 134, 2097–2104..