
Мутация, защищающая от всех известных прионных болезней
09 июля 2015
Мутация, защищающая от всех известных прионных болезней
- 2984
- 1
- 7
127-му кодону гена PRNP посвящается...
Потреблённый на обед, каннибалу мстит сосед:
По вербовке чемпионы, поражают мозг прионы.
Но иным аборигенам повезло с мутантным геном —
Не берёт их человечий, и коровий, и овечий, и любой другой прион.
А герой... один кодон.
Рисунок в полном размере.
рисунок с сайта prionk.narod.ru
-
Автор
-
Редакторы
Генетический вариант, найденный у аборигенов Новой Гвинеи, в эксперименте помог защитить мышей от всех известных прионных заболеваний, в том числе от недавно обнаруженных особо опасных штаммов прионов, вызывающих неклассическую болезнь Крейтцфельдта-Якоба. Чем выше была доля мутантного белка, нарабатываемого у подопытных мышей, тем лучше была их защита. У мышей с двумя мутантными аллелями, то есть производящих только мутантный белок, вырабатывался полный иммунитет ко всем исследованным прионным болезням.
Прионы — это обычные белки, которые сворачиваются в «заразную» форму . Молекула такой формы может заставить другую молекулу того же белка сложиться по своему образу и подобию. В результате возникает молекулярная эпидемия, в которой «заразная» конформация белка становится всё более распространенной. Плохо это тем, что молекулы, принявшие такую форму, соединяются в прочные и крупные агрегаты, которые могут мешать клетке нормально работать. Пример — амилоидные бляшки, которые образуются при болезни Альцгеймера. У пациентов с этим заболеванием по непонятным причинам нарезается на куски один из мембранных белков нейрона. Получившиеся обрезки способны принимать «заразную» конформацию, слипаться друг с другом и образовывать агрегаты, которые накапливаются в тканях мозга. Похожими причинами объясняется возникновение болезни Крейтцфельдта-Якоба, только в ее случае «образец» заразной формы обычно поступает в организм извне (хотя ген, кодирующий склонный к образованию агрегатов белок, можно получить и по наследству). Подробнее об этой опаснейшей болезни, случай которой недавно был зафиксирован в России, можно прочитать в статье «Самая опасная инфекция в мире. Как в России борются c редчайшей болезнью Крейтцфельдта-Якоба» [1]. Прионные инфекции могут пересекать межвидовые барьеры — человек, к примеру, может заразиться, употребив в пищу мясо больной коровы.
Познакомиться с прионами поближе — исключительно теоретически — можно прямо на биомолекуле: молекулярные основы конформационных болезней (инфекционных и «возрастных»), захватывающая история знакомства с ними учёных описаны в статьях «Прионы: исследования таинственных молекул продолжаются» [2] и «Разоблачитель белков-убийц» [3], о подвижках в познании механизмов конкретных болезней рассказано в материалах «Идентифицированы белки, „слипающиеся“ при болезни Гентингтона» [4], «Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона)» [5] и «Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета» [6]. — Ред.
Лечить прионные болезни мы не умеем. Даже теоретически трудно себе представить способ лечения, который мог бы помешать белкам животного менять конформацию на «заразную». Но есть и хорошая новость — оказывается, некоторые генетические варианты почти гарантируют устойчивость к прионным болезням. Одну из таких полезных мутаций обнаружили у аборигенов Новой Гвинеи, где из-за ритуального каннибализма было очень распространено прионное заболевание под названием куру. Несколько лет назад ученые проанализировали генетические варианты трех тысяч аборигенов и проследили за судьбой этих людей [7]. Выяснилось, что замена всего лишь одной аминокислоты в человеческом прионном белке (глицина в 127-м положении на валин — G127V) резко снижает вероятность умереть от куру. Ни у одного человека, который скончался от этой инфекции, «защитного» генетического варианта не было. Кроме того, члены семей, в которых встречался такой генетический вариант, намного реже заболевали куру.
Известна и другая полезная мутация, которая снижает вероятность заболеть прионной болезнью, — M129V — замена метионина на валин в 129-м положении аминокислотной последовательности прионного белка (PrP). Такая мутация встречается у людей по всему миру. Интересно, что она спасительна только в гетерозиготном состоянии — если на одной хромосоме у человека обычный вариант гена, а на другой — мутировавший. При этом часть молекул образующегося белка имеет стандартную последовательность, а часть — модифицированную. Ученые предполагают, что в такой ситуации агрегатам прионного белка сложнее образовываться: молекулам двух видов, немного отличающихся друг от друга, сложнее слипаться. Кстати, мутация G127V тоже встречалась у аборигенов Новой Гвинеи в гетерозиготном состоянии. Исследователи решили проверить, защищает ли «мутация аборигенов» от прионных болезней по такому же принципу, как и «общечеловеческая» — в позиции 129 [8], [9].
Для этого ученые получили мышей, у которых ген мышиного прионного белка был заменен человеческим. При этом мышиных линий было несколько, и все они несли разные сочетания аллелей — в 127-й («аборигенская») и в 129-й («общемировая») позициях PrP могли быть как обычные аминокислоты, так и варианты, возникающие из-за мутаций. Таких мышей ученые заражали самыми разными прионами и смотрели, какая комбинация генетических вариантов даст лучшую защиту от прионных болезней.
Оказалось, что «аборигенская» мутация эффективнее «общемировой»: если у мыши была хотя бы одна копия аллеля с «аборигенской» мутацией, это давало ей иммунитет к большинству прионных болезней. Даже если по 129-му положению у мыши была невыгодная комбинация аллелей (то есть они были одинаковыми), «аборигенская» мутация хорошо помогала. Но всё-таки не всегда.
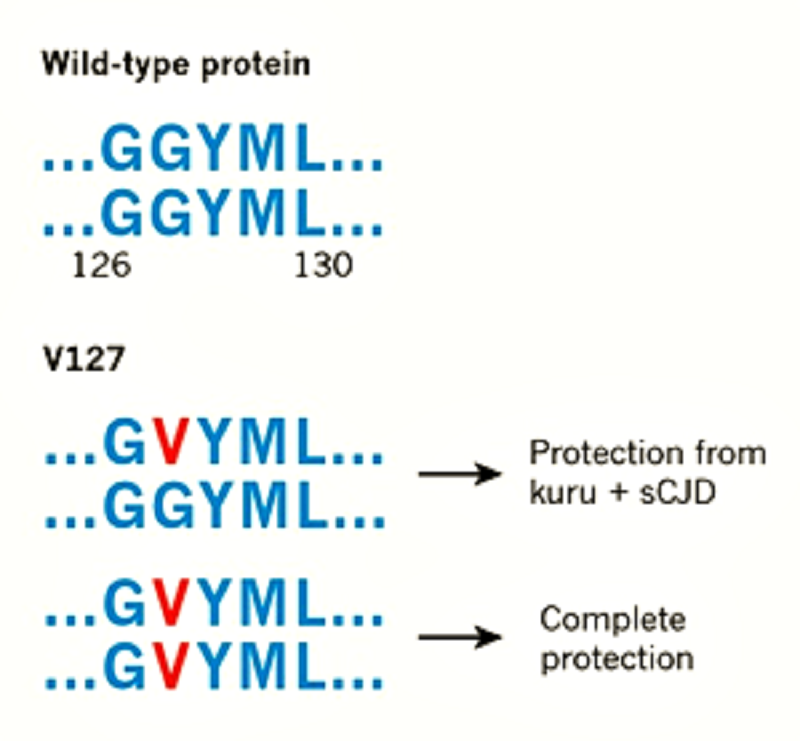
Рисунок 1. Мутация в гене прионного белка, найденная у аборигенов Новой Гвинеи, защищает от большинства известных прионных заболеваний. Если в 127-м кодоне изменяется всего одна копия гена (глицин замещается валином в 127-м положении у части молекул белка PrP), носитель мутации защищен от куру и классического варианта болезни Крейтцфельдта-Якоба. Если же повезло получить по наследству два мутантных аллеля, то их носитель защищен от всех использованных учеными штаммов прионов. Известна и вторая мутация, помогающая защититься от прионных болезней, — замена метионина в 129-й позиции PrP на валин (на рисунке не отмечена). Это мутация встречается по всему миру и работает только в гетерозиготном состоянии — то есть при изменении одной копии гена.
С двумя недавно возникшими прионными штаммами (возбудителями особого варианта болезни Крейтцфельдта-Якоба), с которыми аборигены Новой Гвинеи никогда не сталкивались, единственная копия мутантного гена не справлялась. Бóльшая часть мышей, у которых замена G127V в PrP определялась одним мутантным аллелем, заболела. Интересно, что доля заболевших мышей одной и той же линии зависела от того, в каком соотношении нарабатывались у них стандартный и «аборигенский» варианты белка. Чем больше была доля последнего, тем меньший процент мышей заболевал. А двух копий прионного гена с мутантным 127-м кодоном оказалось достаточно, чтобы полностью защититься от всех использованных в эксперименте штаммов прионов (рис. 1). Это говорит о том, что «аборигенская» мутация работает не так, как «общемировая».
«Общемировая» мутация полезна только в единственной копии, тогда у ее носителя образуются два разных варианта белка, которые хуже образуют агрегаты. «Аборигенская» же мутация работает даже лучше, если присутствует в двух аллелях. Получается, механизм ее действия основан не на том, что двум разным формам белка труднее слипаться. Скорее всего, «аборигенская» мутация затрудняет переход PrP в «заразное» состояние, и цепная реакция изменения конформации не запускается. Осталось только понять, почему единственная аминокислотная замена мешает прионному белку приобрести конформацию, склонную к агрегации.
Правда, как применить это знание на практике, пока не понятно. Разве что спроектировать для наших домашних животных белки, устойчивые к переходу в «заразное» состояние, и получить генетически модифицированные породы, защищенные от прионных болезней. А как обстоят дела с генетическими модификациями людей, сами знаете .
Особенно, если читали статью «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [10] и комментарии к ней. — Ред.
Литература
- Туровский Д. (2015). Самая опасная инфекция в мире. Как в России борются c редчайшей болезнью Крейтцфельдта-Якоба. Журнал Meduza;
- Прионы: исследования таинственных молекул продолжаются;
- Разоблачитель белков-убийц;
- Идентифицированы белки, «слипающиеся» при болезни Гентингтона;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Simon Mead, Jerome Whitfield, Mark Poulter, Paresh Shah, James Uphill, et. al.. (2009). A Novel Protective Prion Protein Variant that Colocalizes with Kuru Exposure. N Engl J Med. 361, 2056-2065;
- Emmanuel A. Asante, Michelle Smidak, Andrew Grimshaw, Richard Houghton, Andrew Tomlinson, et. al.. (2015). A naturally occurring variant of the human prion protein completely prevents prion disease. Nature. 522, 478-481;
- Glenn Telling. (2015). Evolved protection against human prions. Nature. 522, 423-424;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики.





