
Проще, чем вы думали, — за что вручили Нобелевскую премию по химии (2021)
07 октября 2021
Проще, чем вы думали, — за что вручили Нобелевскую премию по химии (2021)
- 1329
- 0
- 2
Дэвид Макмиллан (слева) и Беньямин Лист (справа) — лауреаты Нобелевской премии по химии 2021 года.
Рисунок в оригинальном разрешении.
-
Автор
-
Редакторы
Биологи немного удивились тому, что Нобелевской премией по химии наконец-то наградили двух химиков, сделавших химическое открытие. Последние премии по этому направлению выдавались за открытия на грани химии и биологии, а иногда и за этой гранью. Нынешние лауреаты, Беньямин Лист и Дэвид Макмиллан, разработали способ катализировать превращения органических соединений проще, эффективнее и экологичнее, чем это делали до них. В 2000 г. Лист и Дэвид предложили использовать для этого маленькие органические молекулы, которые заменяли собой целые белки — ферменты. Идея оказалась очень удачной, и теперь ее уже используют на многих производствах. В голосовании на сайте Нобелевской премии 52% посетителей признались, что не знали о применении органокатализа в фармацевтической промышленности. Пришло время рассказать о том, как отмеченное Нобелевкой открытие меняет медицину и делает органическую химию более независимой от биологии.
Химики стремятся к тому, чтобы синтезировать нужные человечеству соединения (например, пластмассу, лекарства) эффективнее и быстрее. С начала XIX века исследователи стали открывать, что некоторые металлы облегчают химические превращения, и назвали их катализаторами. Катализатор — это вещество, которое ускоряет химическую реакцию, потому что взаимодействует с молекулами, упрощая их преобразование. Сам катализатор в результате не изменяется. В XX веке ученые научились использовать ферменты — белки из клеток живых организмов, которые катализируют в них химические реакции. А сегодня с катализом связано около 35% мирового ВВП [1].
Мало синтезировать определенное соединение. Многие органические молекулы существуют в двух формах, состав и устройство которых идентичны друг другу. И только порядок, в котором расположены связанные с одним атомом углерода химические группы, у них разный. В результате у одного соединения два есть варианта, оптических изомера или энантиомера, которые по строению выглядят как зеркальное отражение друг друга (как правая и левая рука). Хоть такие молекулы очень похожи, биологический эффект у них может быть разный. Например, у каждого энантиомера лимонена свой запах: у S-лимонена — лимонный, у R-лимонена — апельсиновый (рис. 1). Поэтому при создании ароматизаторов или парфюма энантиомеры лимонена приходится разделять.
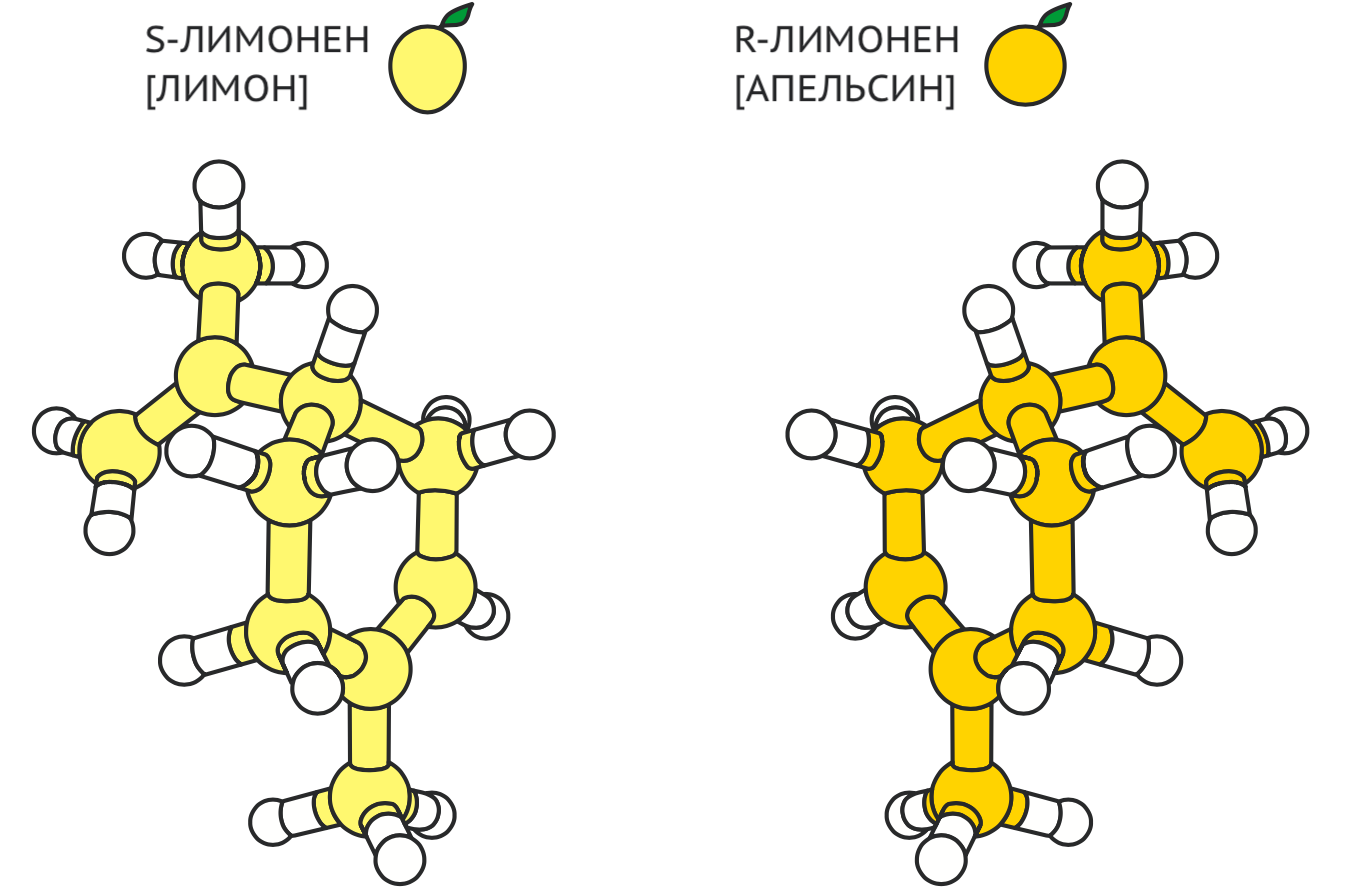
Рисунок 1. Модели двух энантиомеров лимонена выглядят как зеркальные отражения друг друга. S-лимонен имеет лимонный запах, R-лимонен — апельсиновый.
Press release: The Nobel Prize in Chemistry 2021, рисунок адаптирован
Синтезировать вещество в виде единственного энантиомера чаще всего очень затратно. Ведь производство занимает много стадий; на каждой приходится очищать продукт. В итоге, много ресурсов тратятся на это разделение. Поэтому химики активно разрабатывают асимметричный катализ. Так, многие ферменты катализируют невозможную в их отсутствие реакцию с образованием только одного энантиомера продукта. При этом ферменты — большие молекулы, которые очень чувствительны к условиям среды и живут недолго. Например, в клетке многие ферменты уничтожаются и синтезируются заново несколько раз в сутки. Поэтому обнаружение более простых по структуре асимметричных катализаторов из 2000 года заслужило Нобелевскую премию по химии.
Маленькие молекулы, решившие большие проблемы
В 2000 году первый лауреат Нобелевской премии Беньямин Лист вместе с коллегами сообщил о том, что небольшая аминокислота L-пролин может быть ассиметричным катализатором [2]. Результат ее работы был сопоставим с активностью целого фермента альдолазы. Речь шла о реакции альдольной конденсации между ацетоном и ароматическими альдегидами. Авторы статьи выдвинули свое объяснение механизма катализа и вскоре подтвердили его [3]. L-пролин стабилизировал промежуточный продукт реакции примерно так же, как это происходит в активном центре альдолазы, благодаря особому расположению атомов в своей молекуле (рис. 2).
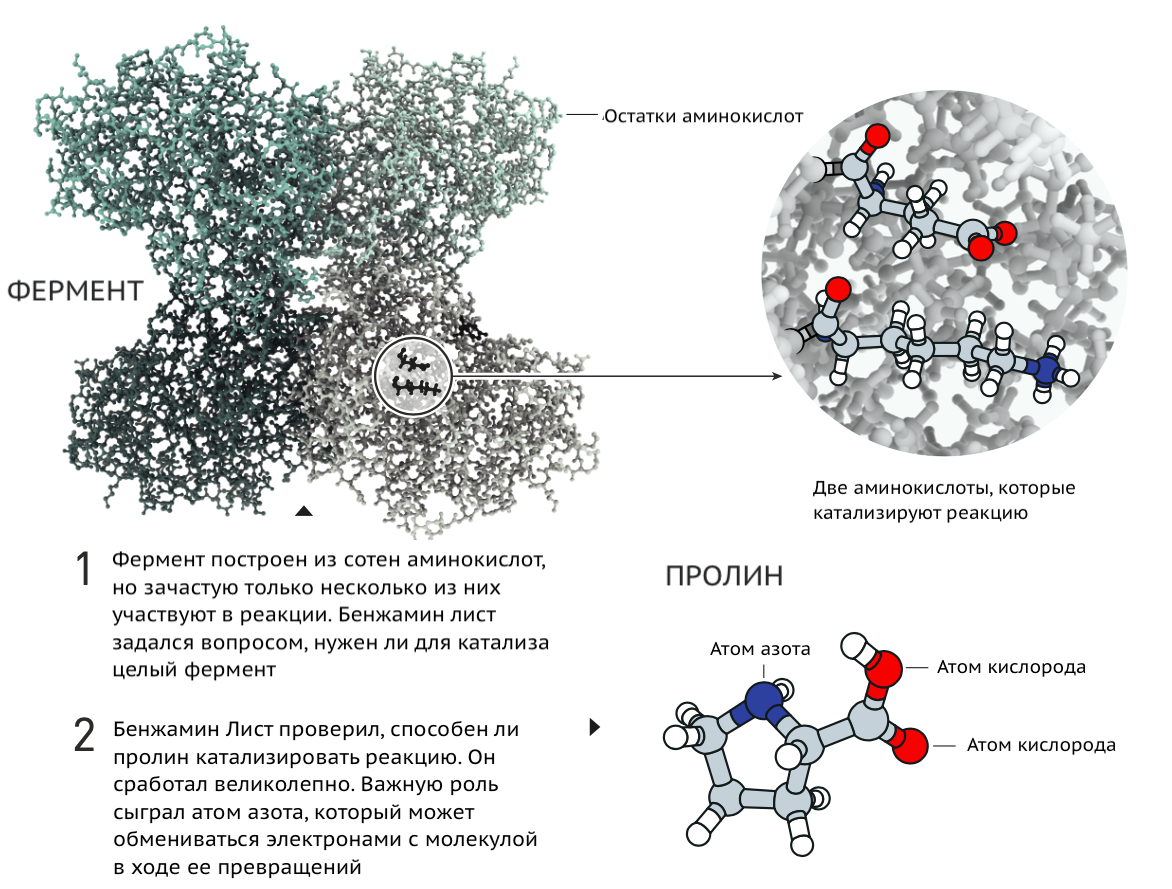
Рисунок 2. История работы Бенжамина Листа и соавторов. Пролин вместо фермента.
Press release: The Nobel Prize in Chemistry 2021, рисунок адаптирован
К этому же времени второй лауреат, Дэвид Макмиллан, уже устал работать с ионами металлов, которые казались ему недостаточно специфичными катализаторами. У него были на то основания: металлы слишком чувствительны к условиям среды и дороги для промышленных масштабов. Поэтому Макмиллан обратил внимание на органические молекулы, которые способны ионизироваться и за счет этого выполнять ту роль, которую в известных реакциях выполняли ионы металлов. В результате Дэвиду вместе с коллегами удалось подобрать подходящий органокатализатор, который в процессе реакции давал ион иминия (рис. 3). С таким катализатором авторы сразу получили в сходной реакции выход одного энантиомера больше 90% [4].
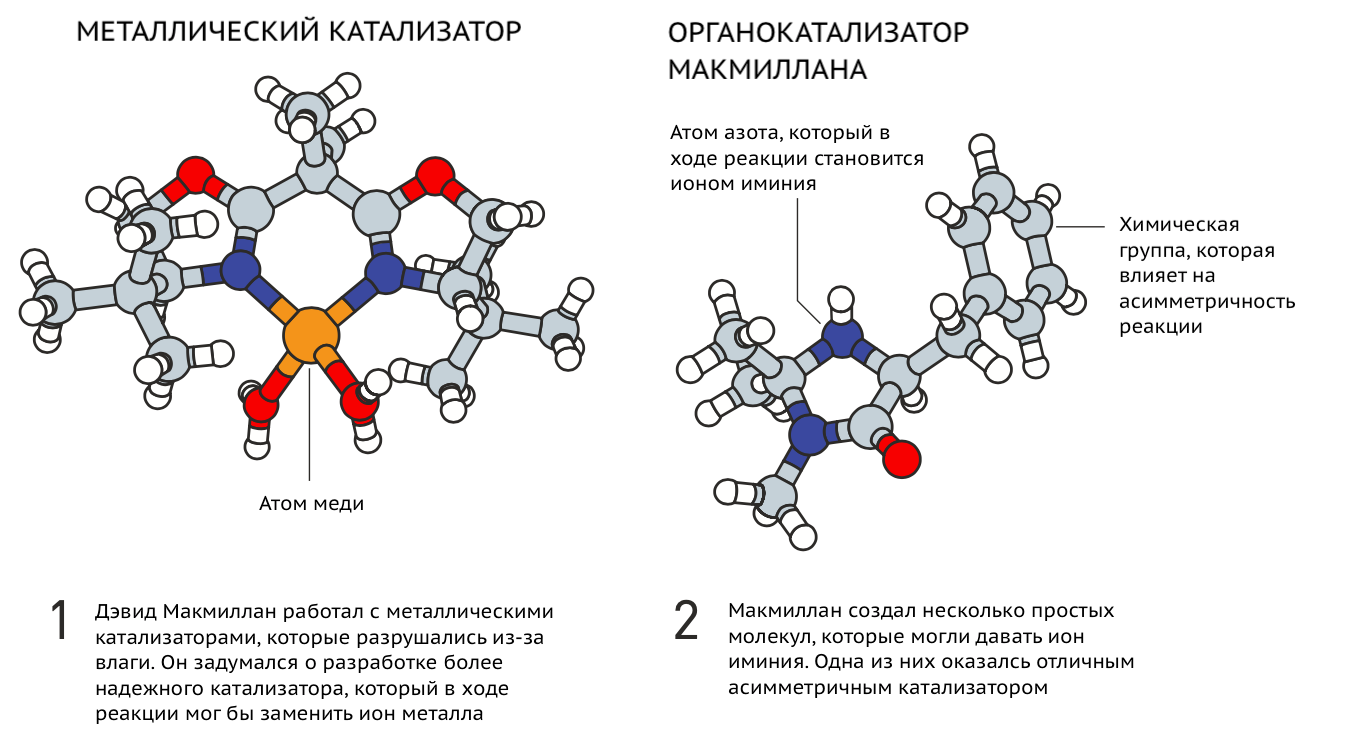
Рисунок 3. История работы Дэвида Макмиллана и соавторов. Ионы иминия вместо металлических катализаторов.
Press release: The Nobel Prize in Chemistry 2021, рисунок адаптирован
Случаи, когда небольшие органические молекулы катализировали реакции, описывали и раньше. Но тогда ученые воспринимали это скорее как исключение. Лист и Макмиллан стали искать механизмы реакций, не остановились на первых достижениях и выдвинули принципы разработки новых органокаталитических реакций. Так они дали начало асимметричному органокатализу — новому, третьему, подходу, равноправному с использованием для катализа ферментов и металлов.
Открытия научных групп Листа и Макмиллана спровоцировали бум исследований, который потом назовут «золотой лихорадкой органокатализа». Ведь органические катализаторы зачастую надежнее белков и металлов и дают хороший выход одного энантиомера. Вдобавок к этому органокатализаторы, в отличие от тяжелых металлов, не загрязняют окружающую среду. Кроме того, они могут катализировать несколько химических превращений, идущих друг за другом, как на конвейере. Благодаря таким каскадным реакциям производство не теряет деньги из-за очистки промежуточных соединений и потери части продукта.
На практике асимметричный органокатализ делает возможным производство биологически активных веществ, которые раньше только выделяли из редких растений или глубоководных организмов. Фармацевтические компании уже используют предложенные лауреатами методы для упрощения производства своих препаратов [5]. Например, в 2016 году японские ученые опубликовали статью, в которой переосмыслили синтез осельтамивира — препарата, нацеленного против вирусов гриппа A и B. С помощью двойного асимметричного органокатализатора они получили преимущественно один энантиомер (−) — осельтамивир. Пятиэтапный синтез провели в одном сосуде и уложились всего в один час, хотя ранее сходный процесс длился больше 30 часов [6].
Рисунок 4. Когда в органическую химию пришел ферментативный катализ, это показалось концом каменного века. Ведь биологические катализаторы — это белковые машины, которые прошли эволюцию, и уж они должны работать безупречно. На самом деле — нет. Зачастую природные ферменты работают с низкой эффективностью и допускают много ошибок. Да, в живых клетках другие молекулы помогают ферментам, но в реакционной смеси эти помощники отсутствуют. Поэтому более простой и эффективный органокатализ — это следующий шаг.
Нобелевская премия по химии 2021 может вызвать удивление: почему ученые пришли к более простому, дешевому и экологичному катализу так поздно? Видимо, это ловушка человеческого мышления: когда мы пользуемся чем-то сложным, но привычным, в голову не приходит, что процесс можно упростить. Беньямин Лист и Дэвид Макмиллан своими работами доказали, что простые идеи могут быть неочевидными, но самыми полезными.
Литература
- Jens Hagen Industrial Catalysis — Wiley-VCH Verlag GmbH & Co. KGaA, 2015;
- Benjamin List, Richard A. Lerner, Carlos F. Barbas. (2000). Proline-Catalyzed Direct Asymmetric Aldol Reactions. J. Am. Chem. Soc.. 122, 2395-2396;
- S. Bahmanyar, K. N. Houk. (2001). The Origin of Stereoselectivity in Proline-Catalyzed Intramolecular Aldol Reactions. J. Am. Chem. Soc.. 123, 12911-12912;
- Kateri A. Ahrendt, Christopher J. Borths, David W. C. MacMillan. (2000). New Strategies for Organic Catalysis: The First Highly Enantioselective Organocatalytic Diels−Alder Reaction. J. Am. Chem. Soc.. 122, 4243-4244;
- Ramarao Parella, Satish Jakkampudi, John C.‐G. Zhao. (2021). Recent Applications of Asymmetric Organocatalytic Methods in Total Synthesis. ChemistrySelect. 6, 2252-2280;
- Yujiro Hayashi, Shin Ogasawara. (2016). Time Economical Total Synthesis of (−)-Oseltamivir. Org. Lett.. 18, 3426-3429.






