
РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020
08 октября 2020
РНК, ножницы, геномы: объявлены лауреаты Нобелевской премии по химии 2020
- 2046
- 1
- 11
Эммануэль Шарпантье и Дженнифер Дудна, лауреаты Нобелевской премии по химии в 2020 году
-
Автор
-
Редакторы
Не секрет, что Нобелевская премия за разработку системы редактирования геномов CRISPR/Cas9 была лишь вопросом времени. Работы Эммануэль Шарпантье и Дженнифер Дудны послужили началом взрывного роста популярности CRISPR-системы. Метод так называемых молекулярных ножниц значительно расширил потенциал генной инженерии, на практике показал свою эффективность и даже успел стать предметом громкого скандала «за биоэтику». Эти и другие относящиеся к теме редактирования геномов вопросы неоднократно освещались в материалах «Биомолекулы». Так что сегодня мы радуемся как за CRISPR-систему, так и за двух прекрасных лауреатов, отмеченных Нобелевским комитетом.
Как водится, «пули свистели над головой» (с) идеи витали в воздухе. Стремительно развивающиеся методы секвенирования ДНК и РНК, а также цифровой обработки этих данных, значительно подстегнули все исследования, касающиеся белков и их функций. К 2012 году наука уже довольно много знала о CRISPR/Cas-системе [1]. О ее чрезвычайно широкой распространенности среди архей и бактерий [2]. О ее основной функции — адаптивном (приобретенном) иммунитете к бактериальным вирусам [3]. Были известны два типа CRISPR/Cas-системы и то, что они состоят из двух основных блоков: специфически устроенной CRISPR-кассеты (clustered regularly interspaced short palindromic repeats) и прилегающего к ней кластера генов cas, кодирующих белки нуклеазы, основной функцией которых является разрезание фаговой ДНК. А также что CRISPR-кассета хранит в себе генетические «фотографии» побежденных в прошлом фагов и по этим «фотографиям» вовремя устанавливает и устраняет новые заражения. Разумеется, с того момента, как обнаружилось, что Cas-белки «режут» не РНК, как ожидалось, а ДНК, участь CRISPR/Cas как будущего инструмента генной инженерии была предрешена [1], [4], [5].
Не хватало лишь маленького шага, который бы наконец обратил молекулярный механизм в биотехнологический метод. Как раз таким шагом и стали успешные эксперименты Эммануэль Шарпантье и Дженнифер Дудны с осуществлением реакции редактирования генома in vitro , [1].
А также последовавшие за этим «патентные бои» — «CRISPR-эпопея и ее герои» [1]. — Ред.
Шарпантье и возглавляемая ею научная группа занимались изучением генной регуляции патогенной бактерии Streptococcus pyogenes. Исследования позволили им обнаружить последний недостающий фрагмент так называемой CRISPR-системы II типа. Этим фрагментом оказалась tracrРНК (trans-activating CRISPR RNA), молекула-ассистент для crРНК (CRISPR RNA), того самого «шаблона», по которому нуклеазы Cas определяли, кого на этот раз «резать». «Маленькая, да удаленькая», tracrРНК умудрялась играть значительную роль и в «созревании» crРНК, и в непосредственной работе белков Cas.
В свою очередь, исследовательская группа Дудны занималась изучением регуляции генов с помощью РНК-интерференции (подробнее об РНК-интерференции вы можете прочитать в статье «Обо всех РНК на свете, больших и малых» [6]). В этой связи в их сферу внимания попала система CRISPR/Cas, механизм действия которой был пока не ясен, но косвенные признаки указывали на его схожесть с РНК-интерференцией [7]. Однако если последняя наблюдалась у эукариот и служила для уничтожения и деактивации нежелательных генных продуктов (РНК или белков), то CRISPR/Cas должна была аналогичным образом «крошить» вирусов прокариот.
Объединив свои наработки и сфокусировав усилия на более простой и компактной CRISPR/Cas-системе S. pyogenes, Шарпантье и Дудна впервые собрали в пробирке «полный рабочий комплект» редактирования генома. И даже оптимизировали его: сшили две РНК-участницы (tracrРНК и crРНК) в одну, тем самым заметно упростив методику (рис. 1) [1].
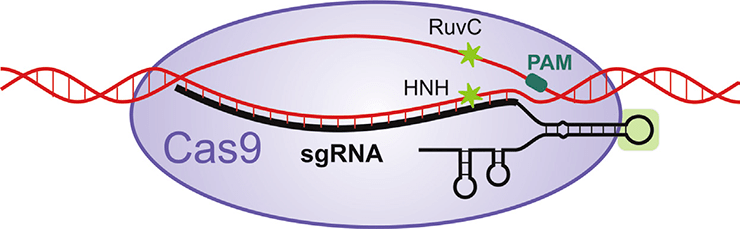
Рисунок 1. Работа системы CRISP/Cas9 в методе геномного редактирования, разработаном коллективами Шарпантье и Дудны. tracrРНК и crРНК объединяются в одну молекулу sgРНК. Эта объединенная молекула исполняет роль одновременно связывания Cas9-белка и поиска ДНК мишени. После обнаружения целевой последовательности ДНК происходит ее «плавление» и разрезание вблизи PAM-мотива — особой короткой последовательности ДНК. За разрезание отвечает белок Cas9, а точнее, его RuvC- и HNH-домены.
Все последующие восемь лет прошли в молекулярной биологии под знаком CRISPR/Cas9. Работоспособность этой системы опробовали на множестве геномов. Скорость изучения функций генов и белков возрастала стремительно. Были получены новые культуры растений, устойчивые к плесени, пестицидам и засухе. И, разумеется, наметились крупные сдвиги в генной терапии [8], [9]. Однако успешные эксперименты по лечению рака [10], ВИЧ [11], [12] и болезней крови были омрачены недавним громким скандалом с незаконным использованием CRISPR/Cas9 на человеческих эмбрионах и последующим рождением первых в мире генетически модифицированных детей [13], . Так что не исключено, что в ближайшие годы будет принят мораторий на редактирование генома человека [14].
О биоэтике в вопросах использования рекомбинантных ДНК и редактирования генома рассказывает отдельная глава статьи «12 методов в картинках: генная инженерия. Часть I, историческая» [18]. — Ред.
Впрочем, это не омрачает исследовательского оптимизма и позитивных надежд на то, что однажды мы действительно сможем прицельно и точно искоренять многие наследственные заболевания.
Не первые в своем роде
Человеческие мечты о возможности предсказуемо влиять на генетические программы нашли отражение в цепочке Нобелевских премий прошлых лет.
В 1978 году — Нобелевская премия по физиологии или медицине за обнаружение рестрикционных ферментов, сыгравших огромную роль в буме клонирования ДНК. В 1993-м — Нобелевская премия по химии за разработку олигонуклеотидного направленного мутагенеза. Напомним, что в том же 1993 году свою Нобелевскую премию получил Кэрри Мюллис, автор метода ПЦР [15], без которого сегодня не обходится ни одна биологическая лаборатория. А в 2007 году Нобелевскую премию вручают авторам методики нокаутирования генов мышей с использованием эмбриональных стволовых клеток [9], [14].
С каждым таким шагом растет точность, эффективность, простота и скорость манипуляций с ДНК. С начала 2000-х годов активно развиваются методы редактирования геномов, основанные на внесении двухцепочечных разрывов в строго определенных сайтах ДНК [5], [8]. Пытаясь починить такие разрывы, клетка берет кусочек хромосомы с гомологичной последовательностью. И в этот ответственный момент можно «подманить» ее частичной гомологией и подсунуть немного измененную ДНК. Идея, разумеется, не нова. Ряд методов генотерапии, а также, например, предшествующий «нобеленосный» метод нокаутирования генов с помощью эмбриональных стволовых клеток [8], тоже полагаются на гомологичную репарацию хозяйской ДНК с «подселенным» к ней ДНК-вектором. Однако в отсутствии возможности внести точные разрезы в ДНК-мишени приходится ждать, когда это произойдет само собой. Такое положение дел значительно ограничивает эффективность процедур, увеличивает фронт работ и, соответственно, влияет на скорость исследований.
Сейчас известно четыре типа методов редактирования генома с использованием четырех разных специфически спроектированных нуклеаз: мегануклеаз, ZF-нуклеаз, TALE-нуклеаз и, наконец, системы CRISPR/Cas (рис. 2) [5], [9].
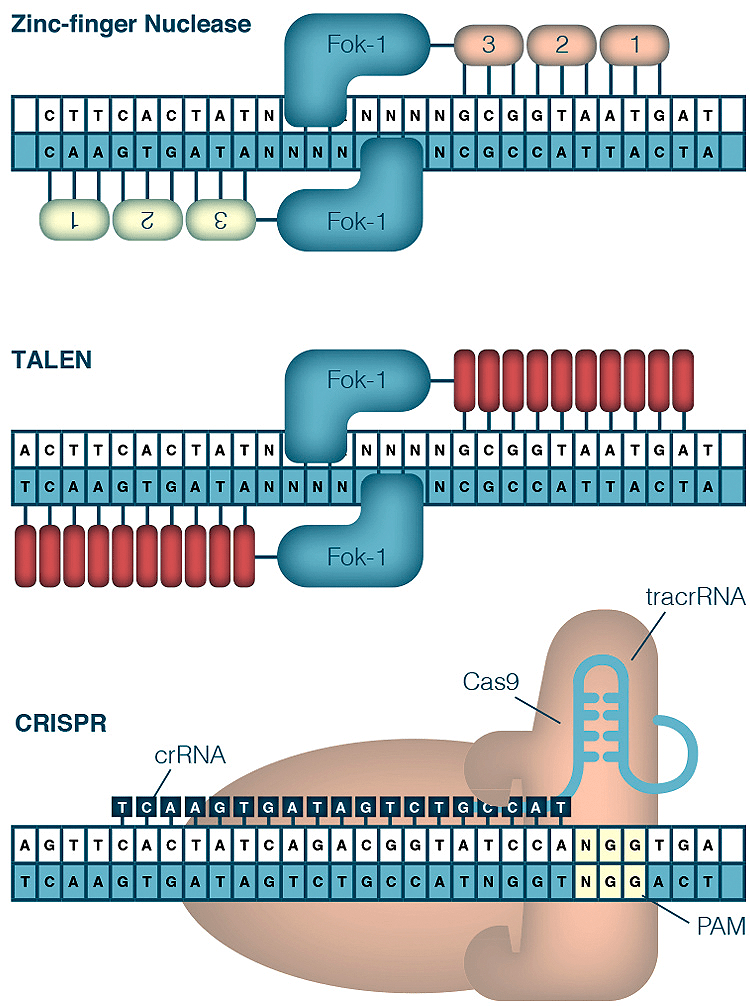
Рисунок 2. Устройство наиболее известных систем редактирования геномов: ZFN, TALEN и CRISPR. Первые две системы опираются на специфичность структуры белка, избирательно связывающегося с определенной последовательностью ДНК, тогда как CRISPR не требует специального дизайна нуклеазы для каждой конкретной последовательности. Достаточно подобрать комплементарную crРНК.
CRISPR/Cas отличается от остальных своей универсальностью и относительной простотой применения. Так, если в случае первых трех систем мы должны для каждой конкретной мишени изменять структуру белка, выполняющего функцию «молекулярных ножниц», то для работы системы CRISPR/Cas достаточно синтезировать новую РНК с необходимой последовательностью [4].
Впрочем, одним из главных вызовов в этой области по-прежнему остается недостаточная точность в определении мишеней, недостаточная аккуратность встраивания необходимой ДНК и недостаточная эффективность его применения in vivo. А значит, CRISPR/Cas все еще недостаточно хороша для полноценного генотерапевтического использования [17].
Так что... следим за развитием событий и ждем новых прорывов!
Литература
- CRISPR-эпопея и ее герои;
- Разнообразие и эволюция систем CRISPR/Cas;
- CRISPR-системы: иммунизация прокариот;
- Просто о сложном: CRISPR/Cas;
- А не замахнуться ли нам на... изменение генома?;
- Обо всех РНК на свете, больших и малых;
- Rogers K. (2020). Jennifer Doudna. American biochemist. Britannica;
- Генная терапия: познакомьтесь с лекарствами будущего;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- От слов к делу: технологию CRISPR-Cas впервые применили для лечения онкозаболеваний;
- CRISPR/Cas9 как помощник в борьбе с ВИЧ;
- Битва века: CRISPR vs ВИЧ;
- Изменение генома и... мировой науки?;
- Achenbach J. (2019). NIH and top scientists call for moratorium on gene-edited babies. Washingtonpost;
- 12 методов в картинках: полимеразная цепная реакция;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Смирнов А.В., Юнусова А.М., Лукьянчикова В.А., Баттулин Н.Р. (2016). Система CRISPR/Cas9 – универсальный инструмент геномной инженерии. «Вавиловский журнал генетики и селекции». 20, 493–510;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- Patrick Arbuthnot. (2015). Engineering Sequence-Specific DNA Binding Proteins for Antiviral Gene Editing. Gene Therapy for Viral Infections. 63-94.





