
Прожорливый мозг
20 апреля 2016
Прожорливый мозг
- 12314
- 7
- 14
Чтобы голова была светлой, а чистый разум воссиял, клеткам мозга пришлось освоить разные профессии, разделив функции уже на этапе утилизации источников энергии
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Мозг — признанный лидер по потреблению глюкозы среди внутренних органов. И это невзирая на свой достаточно скромный вес. Примерно четверть ежедневно поступающей в организм глюкозы используется мозгом. Каким образом нейроны мозга способны потреблять такой большой объем энергии? Является ли такая расточительность для организма эволюционно устаревшим механизмом? А может, природа давно уже подчинила энергетическую зависимость мозга, поставив ее под особый контроль? И как в итоге в клетках мозга протекают процессы энергетических превращений?

«Био/мол/текст»-2016
 Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2016.
Эта работа заняла первое место в номинации «Своя работа» конкурса «био/мол/текст»-2016.

Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Распределение «богатства»
Общеизвестно, что для нормального функционирования всех органов нашего тела необходима энергия. Бόльшую часть энергии при обычном рационе человек получает путем превращения поступающих в организм углеводов в глюкозу и разложения последней до углекислого газа и воды, что сопровождается запасанием необходимой для нас энергии в виде аденозинтрифосфатов (АТФ) или других макроэнергетических соединений.
Каким же образом осуществляется распределение полученного организмом «богатства» в виде источников энергии — согласно законам социализма (равное количество для каждого) или капитализма? Оказалось, что даже в условиях нашего организма запасы энергии расходуются среди всех органов неравномерно. И здесь это распределение скорее напоминает разделение «по заслугам». Обычно мозг использует до 50% всей глюкозы, поступающей из печени в кровь, что соответствует примерно 100 граммам глюкозы в день. Не так уж мало для мозга, вес которого равен приблизительно двум процентам от массы всего тела. Установление ведущей роли мозга в потреблении энергетических запасов легло в основу теории «эгоистичного мозга» («selfish brain» theory) [1].
Такое интенсивное расходование энергии мозгом обусловлено, с одной стороны, большими затратами общей энергии клеток на генерацию трансмембранных ионных градиентов [2] и нервных импульсов, а с другой — на ведение «домашнего хозяйства»: процесса, обеспечивающего целостность и нормальное функционирование клеток мозга. Соотношение между этими двумя процессами оценивается как 2:1 [3]. Самое активное участие в энергозависимых процессах мозга принимают две группы клеток — нейроны и астроциты.
Роли предопределены
Нейроны — это высокоспециализированные клетки, способные генерировать и проводить электрические импульсы. Это — клетки-специалисты, так как функция каждого нейрона строго определена. В течение долгого времени происходит так называемый процесс обучения нейрона выполняемой им функции. Средний человеческий мозг содержит около 100 миллиардов обученных нейронов, и в среднем каждый нейрон соединяется с 1000 других нейронов. Это приводит к образованию обширных и сложных нейронных сетей, которые служат основой для обработки и передачи мозгом информации. Ввиду сложных интегративных взаимодействий каждого нейрона замена этих клеток в нейронных сетях с сохранением целостности выполняемой ими функции почти (если не совсем) невозможна.
Астроциты — это специализированные глиальные клетки, чья функция заключается главным образом в обеспечении нейронов энергетическими ресурсами и в борьбе с активными формами кислорода (АФК) и азота [4]. При этом количество астроцитов в мозге в несколько раз превышает количество нейронов, и в результате получается, что каждый нейрон включен в целый ансамбль астроцитарных клеток.
Довольно разные функции нейронов и астроцитов определяют и разные пути использования энергетических ресурсов этими клетками. Глюкозо-6-фосфат, образующийся из глюкозы, нейронами по большей части направляется в цепь метаболических превращений пентозофосфатного пути (ПФП), а в астроцитах вовлекается в цепь гликолитических реакций [5]. И это принципиальное различие нейронов и астроцитов. Дело в том, что в пентозофосфатном пути образуются предшественники для синтеза нуклеотидов ДНК и РНК [6], а также восстановительные эквиваленты, необходимые нейрону для регенерации белка антиоксидантной защиты мозга — глутатиона. В ходе же гликолиза образуется большое количество энергии, которая используется в разных биосинтетических процессах как «универсальная валюта». Подобная свобода для возможных метаболических реакций в астроцитах и относительная консервативность путей в нейронах связаны с функциональным состоянием клеток. Нейроны генерируют потенциалы действия, проводят возбуждение, интегрируют информацию с разных рецепторов. Это довольно сложно устроенные клетки. И как любые клетки нашего мозга, они подвержены нарушениям в структуре ДНК и влиянию процессов окисления. Вновь напомним, что каждый нейрон оказывается еще и незаменимым. Вот и приходится нейронам всячески продлевать себе «молодость», то есть поддерживать себя в функционально активном состоянии. ПФП в этом смысле — путь, который обеспечивает возможность репарации поврежденных участков ДНК и функционирования в нейронах механизма борьбы с активными формами кислорода.
Задача астроцитов — это создание условий для нормальной активности нейронов (рис. 1). Ради этого астроциты готовы и энергией нейроны обеспечить в большом количестве, и защиту от окислительного стресса организовать. Единого пути для решения поставленных задач пока не сложилось. Поэтому приходится астроцитам сжигать всю глюкозу в гликолитической «печи», а уже потом использовать запасенную энергию для оплаты разных метаболических активностей. Такая последовательность реакций, например, обеспечивает синтез в астроцитах широкого спектра ферментов антиоксидантной защиты, включая оксидоредуктазу, глутаматцистеинлигазу, глутатионпероксидазу, глутатионредуктазу, глутатионтрансферазу, а также глутатион и витамин Е. Еще один важный исход протекания гликолиза в астроцитах — образование из глюкозы молочной кислоты (лактата), которая способна перемещаться во внеклеточное пространство. Что же в этом особенного? Дело в том, что лактат, оказавшись в нейронах, может сначала восстанавливаться до пирувата, а затем через цепь реакций цикла трикарбоновых кислот (ЦТК) и при помощи митохондриальной цепи образовывать целый «фейерверк» молекул АТФ. Благодаря такой сложно устроенной машинерии метаболических превращений, в итоге в нейронах образуется 38 молекул АТФ — против двух молекул АТФ, которые в ходе гликолиза образуются в астроцитах. Получается своеобразный аттракцион энергетической щедрости со стороны астроцитов. Строго говоря, астроциты и не нуждаются в таком количестве энергии, которую отдают нейронам. А вот нейронам такое энергетическое обеспечение оказывается крайне необходимым, потому как генерация импульсной активности и тонкая регуляция рецепторов и ионных каналов в мембране являются «дорогими» процессами и требуют высоких энергетических затрат.
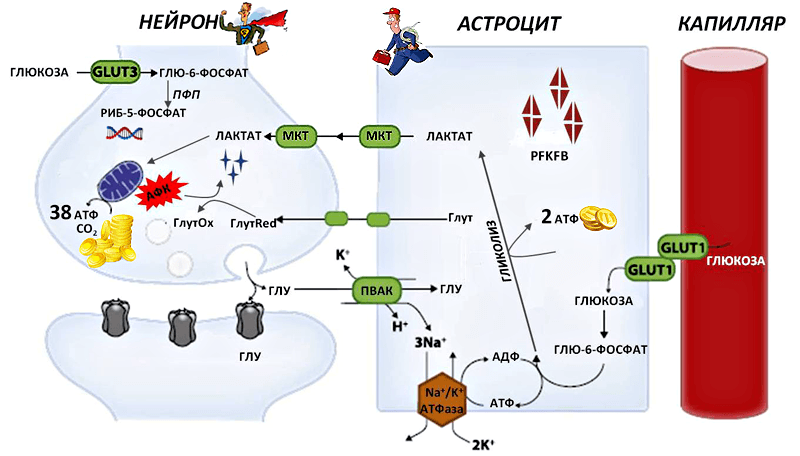
Рисунок 1. Схема метаболических взаимодействий между нейронами и астроцитами. Глутамат (ГЛУ) — нейромедиатор, высвобождающийся из синаптического окончания нейрона. Часть высвобожденного глутамата поглощается астроцитами с помощью переносчиков возбуждающих аминокислот (ПВАК) совместно с тремя ионами Na+. Ионы затем выталкиваются с помощью работы Na+/K+-АТФазы, потребляющей энергию в форме аденозинтрифосфата (АТФ). Это стимулирует поглощение глюкозы астроцитами. С помощью переносчиков (GLUT1) глюкоза из капилляра поступает в астроцит и в процессе гликолиза превращается в лактат. При этом освобождается две молекулы АТФ. Лактат (молочная кислота) посредством специальных переносчиков (МКТ) поступает в нейрон и после нескольких превращений, в том числе в митохондриях, дарит клетке 38 молекул АТФ. Сами нейроны тоже могут поглощать глюкозу — посредством рецепторов GLUT3. Глюкозо-6-фосфат, образовавшийся в нейроне из глюкозы, направляется в пентозофосфатный цикл, который поставляет предшественников для синтеза нуклеотидов ДНК и РНК. Регулирует гликолиз в нейронах и астроцитах фермент PFKFB. Предшественники антиоксидантной (глутатионовой) системы нейрона (Глут) также поступают в него от астроцитов и участвуют в обезвреживании АФК, превращаясь из восстановленной формы (ГлутRed) в окисленную (ГлутOx).
Строгий контроль
Для точной настройки скорости гликолиза (высокой в астроцитах и относительно низкой — в нейронах) во всех клетках мозга работает регуляторный фермент 6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза (PFKFB) [7]. Высокий уровень ферментативной активности PFKFB в астроцитах способствует высокой скорости в них гликолитических реакций. Однако что произойдет, если нейроны снизят скорость основного ПФП и, подобно астроцитам, наладят процессы гликолиза? Экспериментально показано: за этим последует катастрофа — гибель нейронов. Дело в том, что такое усиление гликолиза в нейронах ведет к сокращению образования фермента антиоксидантной системы — глутатиона (между прочим, единственного пептидного вещества, образующегося непосредственно в нейронах и спасающего их от окислительного стресса), усилению окислительного стресса и наконец к апоптотической гибели клетки. Таким образом, разделение энергетических путей оказывается процессом, строго приспособленным к повышению выхода энергии мозгом и одновременно очень консервативным с точки зрения возможности реализации в разных типах клеток.
Опасный «голод» мозга
Согласно наиболее популярной сейчас точке зрения, именно в изменении энергетического состояния мозга лежит причина (по крайней мере, одна из главных причин) судорожных состояний и гибели клеток в структурах мозга [8]. В результате снижения энергообеспечения клеток мозга из-за травм, ишемии или опухоли под ударом оказываются в первую очередь системы регуляции тормозных процессов в нервной ткани. Как ни странно, именно тормозные процессы требуют от нейронов мобилизации энергетических затрат. Недостаток энергии приводит к неспособности клеток затормозить возбуждение и к постепенному распространению возбуждающей волны во все области мозга. Неконтролируемая постоянная активация клеток вызывает еще большее истощение их энергетических запасов и приводит к окислительному стрессу. В результате падения активности антиоксидантной защиты ниже критического уровня происходят необратимые изменения в клетках. Формируется замкнутая цепь губительных событий: судорожная активность вследствие развившегося дефицита энергии в одних структурах мозга вызывает новые эпизоды приступов. И получается, что, однажды начавшись, судороги постоянно порождают новые судороги.
В исследованиях механизмов развития эпилептической активности было установлено, что судорожные приступы развиваются в первую очередь при наследственных заболеваниях, нарушающих нормальный метаболизм энергии в мозге [9]. Причем резкое снижение главного источника энергии — глюкозы — даже у людей, не страдающих эпилепсией, приводит к тяжелым судорожным припадкам [10]. Аналогичный эффект наблюдается у людей, страдающих эпилепсией, после сна, когда концентрация глюкозы в крови резко падает из-за длительного перерыва в поступлении пищи, то есть примерно восьмичасового голода [11].
Разделяй и «процветай»
Экономистами со времен А. Смита и А. Вебера было подмечено, что прогресс в развитии производительной силы от труда, искусства, умения или сообразительности — следствие разделения труда. Разделение труда в этом смысле является важнейшим и непременным условием прогрессивного развития экономики любого государства, любого общества. Этот принцип разделения «трудовых» обязанностей в полной мере можно отнести и к работе сложных биологических систем.
Эволюционно так сложилось, что принцип разделения функций клеток позволил «прокачать» каждую отдельную способность организма. Увеличивающаяся сложность и специализация функций в конце концов привели к потребности в их координировании и, как следствие, увеличению нагрузки на мозг. В результате нейроны полностью отказались от ведения «домашнего хозяйства» и увеличили объем полезной работы. А так как без домашней жизни и надежного тыла работать хорошо и долго не получается, постоянные хлопоты о состоянии нейронов перешли к астроцитам. Закрепление функций клеток произошло уже на уровне источников энергии. Отсутствие конкуренции за источники питания позволило астроцитам и нейронам сконцентрироваться на выполняемых ими функциях. В итоге получилось так здорово, что энергетических запасов стало хватать не только на координацию функций тела, обеспечивающих выживание, но и на «халтурку» в виде сознательной деятельности, сильно продвинувшей животных в эффективности их труда.
Литература
- A. Peters, U. Schweiger, L. Pellerin, C. Hubold, K.M. Oltmanns, et. al.. (2004). The selfish brain: competition for energy resources. Neuroscience & Biobehavioral Reviews. 28, 143-180;
- Формирование мембранного потенциала покоя;
- Рейхл М. (2010). Темная энергия мозга. В мире науки. 5, 22–27;
- Зачем клетки стареют;
- Juan P. Bolaños, Angeles Almeida, Salvador Moncada. (2010). Glycolysis: a bioenergetic or a survival pathway?. Trends in Biochemical Sciences. 35, 145-149;
- Chhabra N. (2013). Nucleotides- Animation (cAMP, pyrimidine biosynthesis and regulation). Biochemistry for medics;
- F Ventura, J L Rosa, S Ambrosio, J Gil, R Bartrons. (1991). 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase in rat brain. Biochem. J.. 276, 455-460;
- Christopher A. Reid, Saul Mullen, Tae Hwan Kim, Steven Petrou. (2014). Epilepsy, energy deficiency and new therapeutic approaches including diet. Pharmacology & Therapeutics. 144, 192-201;
- Arsov T., Mullen S.A., Damiano J.A., Lawrence K.M., Huh L.L., Nolan M. et al. (2012). Early onset absence epilepsy: 1 in 10 cases is caused by GLUT1 deficiency. Epilepsia. 53, 204–207;
- Malouf R. and Brust J.C. (1985). Hypoglycemia: causes, neurological manifestations, and outcome. Ann. Neurol. 17, 421–430;
- Reid C.A., Kim T.H., Berkovic S.F., Petrou S. (2011). Low blood glucose precipitates spike-and-wave activity in genetically predisposed animals. Epilepsia. 52, 115–120.





