Рак и его команда. Борьба во имя иммунотерапии
07 декабря 2021
Рак и его команда. Борьба во имя иммунотерапии
- 1553
- 3
- 11
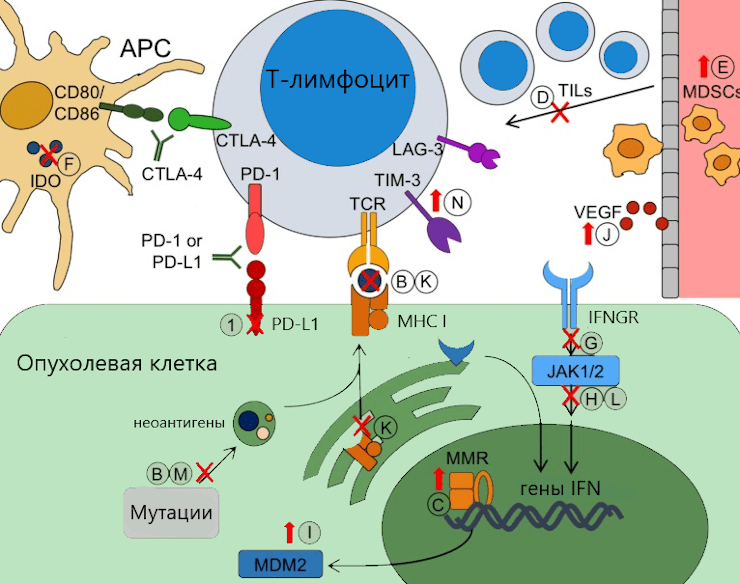
Опухолевая клетка и команда процессов, защищающих ее от воздействия иммунотерапии.
[22], рисунок адаптирован
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Если вам интересно, почему человечество до сих пор не может победить рак, тогда этот рассказ как раз для вас. Знаете ли вы, что совсем недавно ученые придумали, как ополчить против этой болезни самую могущественную армию организма? Иммунную систему! Иммунотерапия — относительно новый и довольно перспективный метод лечения. В некоторых случаях он оказывается более эффективным по сравнению с другими видами терапии рака. Однако и этот метод порой терпит поражение. Опухоли не сдаются, обманывая самые современные стратегии борьбы с ними. В чем же дело? Какими способами опухоль защищается от разных видов иммунотерапии, и возможно ли преодолеть ее оборону? Герой рассказа поможет нам разобраться в этой непростой истории.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Глава I Пролог
Было только 7 часов утра, когда Сережа Научников проснулся от резкого сигнала смс-сообщения. С неохотой протерев глаза, он устало посмотрел на экран телефона. Высветилось уведомление с почтового участка с повесткой: «Секретная миссия — Вас срочно вызывают в военкомат!» Тяжело соображая, Сережа с недоумением уставился в светящийся гаджет. «Вас срочно ожидают в военкомате!» — все так же настойчиво звучал призыв сообщения.
— Ничего не понимаю, я ведь только ученик 9-го химико-биологического класса, у меня же завтра контрольная по устройству иммунной системы, мне никак нельзя в армию… — с ужасом подумал Сережа.
С усилием поднявшись с кровати, он нервно умылся и наспех нацепил одежду.
— Что бы там ни было, определенно надо отправиться в военкомат и выяснить, что случилось.
Как только он вышел из подъезда, на него обрушилось промозглое осеннее утро, с ног до головы неприветливо окутав холодной сыростью.
— Ничего, — подумал Сережа, — мой организм находится под надежной защитой иммунитета, который непременно защитит меня от простуды и гриппа.
Пока он шел по залитому дождем тротуару, сверху на него сурово смотрели огромные плакаты об угрозе вирусных атак и опасных заболеваний XXI века. Тогда он еще не знал, что в этот день ему предстояло узнать, как его внутренняя защита может бороться с одними из самых устрашающих болезней — онкологическими.
Наконец, в конце улицы стало видно серое здание военкомата. Тяжело вздохнув, Сережа переступил порог и вошел внутрь. Там его ожидало странное зрелище… Прямо на входе его встретил серьезный человек в защитных очках, перчатках и белом халате и, вежливо пригласив следовать за ним, произнес сдержанным тоном:
— Это вы Сергей Научников, ученик средней школы естественнонаучного направления? Надеюсь, вы понимаете, для чего вы здесь. Вас выбрали для осуществления секретной миссии по спасению человечества. Вы, наверное, знаете, что мир страдает от «нашествия» онкологических заболеваний… Империя Рака поразила значительную часть населения и поработила многие человеческие органы и системы. Ученые борются за ее уничтожение, разрабатывая разные подходы к лечению рака. Один из них — иммунотерапия. Он направлен на усиление функций иммунной системы и помогает внутренним силам организма самостоятельно бороться с опухолью. Однако, к сожалению, не все так просто… Опухоль имеет способность защищаться от воздействия на нее различных препаратов, в том числе и самых передовых методов иммунотерапии! Ученые называют это явление устойчивостью. В связи с этим войску иммунитета срочно требуется помощь в сражении с раком! Поэтому вам необходимо немедленно телепортироваться в искусственную модель тела человека и вступить в ряды армии иммунной системы для борьбы во имя иммунотерапии и здоровья людей. Немедленно! Время не ждет!
— Но как я объясню свое отсутствие родителям и учителю биологии, который собирается провести у нас... — не успев сказать о предстоящей контрольной работе, Сережа очутился в комнате, обставленной громоздкой, сложной аппаратурой. Человек в белом халате завел его в маленькую стеклянную кабину, выдал ему запас еды, маску и ласты, чтобы плавать по кровотоку, и без промедления нажал на кнопку телепортации, вдохновенно сказав:
— Удачи! Уверен, у вас все получится! А родителей мы непременно предупредим.
Глава II Арсенал иммунотерапии
Если близко воробей — мы готовим пушку
Последние слова ученого Сережа уже не слышал. Он во мгновение ока оказался внутри человеческого организма, в котором его уменьшенную в тысячи раз фигуру тут же подхватил размеренный капиллярный поток крови и понес навстречу невероятным приключениям. На пути ему начали встречаться объекты причудливой формы, как мы уже догадываемся — кровяные тельца — клетки и клеточные фрагменты, эритроциты, лейкоциты и тромбоциты. Он с удивлением заглядывался на процессы диффузии газов и поглощения клетками необходимых веществ, однако вскоре он вспомнил, что его задача заключается вовсе не в этом…
— Это даже хорошо, что меня сюда занесло, может, сделаю значительный вклад в науку, и мама с папой точно будут мной гордиться! — рассуждал Сережа.
Недолго думая, он отправился на поиски армии иммунитета. Однако, вопреки ожиданиям, это оказалось задачей не из легких. Сереже пришлось хорошенько напрячь голову, чтобы вспомнить, какие замысловатые процессы осуществляет иммунная система. Так он долго дрейфовал по разветвленному кровеносному руслу, пока, наконец, его не осенило, что всю необходимую информацию можно узнать в этой интересной статье [1]! Она послужила ему прекрасным путеводителем по сложным законам и многочисленным «подразделениям» иммунной армии. Благодаря этой статье он скоро оказался в строю.
— Здравия желаю, товарищ Старший Лимфоцит! — поприветствовал он командира армии иммунитета.
— Рад видеть тебя в нашем доблестном полку! Мне сообщили, что ученые отправили тебя к нам на службу. Ты уже знаешь, что иммунные клетки распознают и уничтожают все, что является чужеродным и опасным для организма. Сейчас мы сражаемся с опухолью, нашим злейшим врагом. Поэтому здесь твое основное задание будет заключаться в том, чтобы вместе с «солдатами» иммунной системы исследовать «повадки» опухолевых клеток и осваивать методы борьбы с ними.
— Я готов! — радостно ответил Сережа.
— Отлично! Тогда сейчас же приступаем к работе.
Сказано — сделано. Почти сразу Сережа и иммунные клетки Т-лимфоциты, «оседлав кровоток», отправились патрулировать организм, чтобы обнаружить и вовремя обезвредить все, что представляет для него угрозу. Работа эта была непростой и требовала от бойцов иммунитета больших усилий. Поэтому через некоторое время единогласно было решено сделать привал и немного подкрепиться энергией АТФ. Во время отдыха иммунные клетки заметно подобрели и стали рассказывать Сереже занимательные солдатские байки о приключениях на службе иммунитета.
Из них мальчику стало понятно, что иммунной системе ежедневно приходится бороться с появляющимися тут и там аномальными клетками, осуществляя так называемый иммунный надзор. В большинстве случаев армия иммунитета успешно справляется с единичными «бунтовщиками», но если восстание по каким-то причинам принимает более крупные масштабы, то тогда беды не миновать. «Сильные» опухолевые клетки способны успешно уклоняться от воздействия на них естественных сил организма [2]. Именно поэтому, как и в любых войсках, в армии иммунной системы нужно проходить дополнительную подготовку, чтобы стать настоящим «иммунотерапевтическим солдатом».
— Тебя, рядовой, это тоже не обойдет, — заверил Сережу Старший Лимфоцит, — и вообще хватит нам тут бездельничать, пора за работу. Как раз сейчас мы и покажем тебе наш арсенал иммунотерапии! (рис. 1.)
И они вновь влились в кровеносное русло и понеслись на «склад» своих иммунотерапевтических «боеприпасов».
На самом деле, никакого «склада» в организме человека, конечно же, нет, но давайте немного пофантазируем и представим, что нашему герою все же удалось на нем побывать.
Ужесточить охрану!
По прибытии на «склад» Т-лимфоциты решили организовать для Сережи обзорную экскурсию по различным методам иммунотерапии. Немного посовещавшись, они договорились начать свой рассказ с так называемой терапии иммунных контрольных точек (ИКТ).
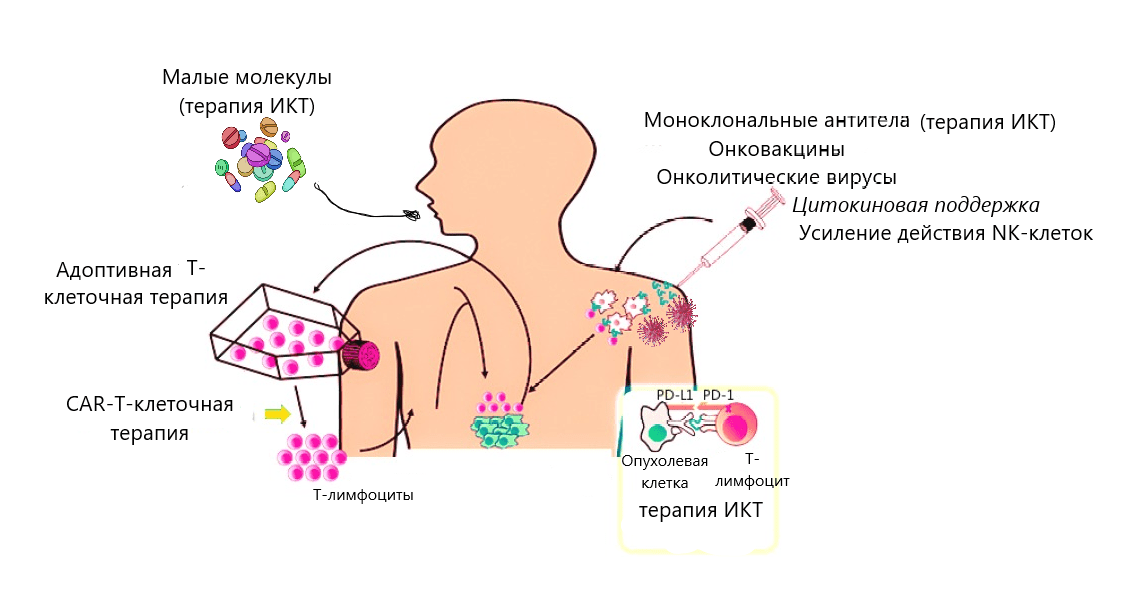
Рисунок 1. Виды иммунотерапии. На рисунке приведены основные методы иммунотерапии и показано, как реализуются и работают некоторые из них (подробнее см. в тексте) (терапия иммунных контрольных точек — здесь сокращенно терапия ИКТ).
[15], рисунок адаптирован
Для того чтобы понять принцип ее работы, Сереже нужно было усвоить, что любая клетка в организме должна проходить контрольно-пропускной пункт (КПП) иммунной системы. «Солдаты» рассказали ему, что для этого у каждой клетки имеется специальный пропуск — особые поверхностные белки с кодовым названием PD-L1, с помощью которых клетки организма взаимодействуют с PD-1 (контрольными рецепторами) иммунных клеток. При таком взаимодействии иммунные агенты распознают нормальные клетки и мирно обходят их стороной. Упомянутые выше белки, которые осуществляют этот процесс узнавания «своих», и получили название иммунные контрольные точки. Они помогают защитить «мирных жителей» от ложной атаки иммунитета, так называемой аутоиммунной реакции [3].
— И где же здесь подвох? — с недоумением спросил Сережа.
А вот где. Мальчику объяснили, что опухолевые клетки — те еще нарушители закона. И почти у всех них есть поддельные пропуска. С их помощью они могут маскироваться под нормальные клетки и успешно проходить проверку. Тут-то и приходит на помощь оружие терапии иммунных контрольных точек. В его «комплект» входят специальные белковые «устройства» — моноклональные антитела, которые связывают белки PD-L1 или PD-1 и препятствуют взаимодействию клеток организма с иммунными агентами [2], [5].
Моноклональные антитела — антитела, которые связываются только с определенным участком (определенной детерминантной группой) макромолекулы (белка, полисахарида и др.) и не отличаются по структуре, степени специфичности к данному участку и прочности его связывания. Такие антитела продуцируют иммунные клетки, произошедшие от одной плазматической клетки-предшественницы, то есть принадлежащие к одному клеточному клону [4].
Помимо PD-L1 и PD-1, существуют и другие белки иммунных контрольных точек, к которым тоже научились подбирать моноклональные антитела. Подробнее об этом можно прочитать здесь.
Солдаты не утаили от Сережи и то, что в последнее время наряду с антителами в «комплект» терапии ИКТ было включено «вооружение» нового типа. Сейчас иммунные контрольные точки научились связывать и блокировать с помощью малых молекул, например, производных антибиотиков. Такие препараты удобно давать пациентам, так как, в отличие от моноклональных антител, эти лекарства можно принимать перорально [6].
Но, так или иначе, Сережа понял, что терапия иммунных контрольных точек создает в организме больного раком режим чрезвычайной ситуации, когда все клетки, включая опухолевые, оказываются под прицелом иммунитета.
Глядя на удивленного мальчика, которого поразило, что во время войны с опухолью иммунной системе приходится так жестоко обходиться со здоровыми клетками, Старший Лимфоцит лишь пожимал плечами:
— Что поделаешь, иногда приходится жертвовать безопасностью организма и рисковать возникновением аутоиммунных реакций ради спасения человека от неминуемой гибели. Не грусти, пойдем лучше посмотрим, что еще интересного есть в нашем арсенале.
Гуманитарная помощь
Продолжая показывать Сереже «склад» иммунотерапии, старший Лимфоцит решил поведать ему о методах, которые могут наделять иммунные клетки дополнительной силой и помогать им на поле боя:
— Помимо того, что мы получаем оружие в виде моноклональных антител или малых молекул, нам приходится усиленно «тренироваться», чтобы успешно сражаться с раком. В этом нам могут помогать специальные вещества — цитокины, в особенности их отдельные представители — интерфероны. Они могут призывать нас в очаг опухоли и усиливать наше действие, в том числе за счет повышения числа антигенов опухоли — уникальных меток на ее поверхности. Ведь для нас, Т-лимфоцитов, антигены служат своеобразными маяками, и мы можем уничтожать чужеродные клетки только после распознавания этих маяков при помощи наших Т-клеточных рецепторов (TCR) [1]. Кроме того, интерфероны потенциально могут принимать участие и в самой атаке на опухоль, убивая чужеродные клетки или лишая их дополнительного питания путем нарушения формирования новых кровеносных сосудов. Цитокины в норме вырабатываются организмом, но врачи часто делают пациентам дополнительные инъекции этих веществ, чтобы помочь внутренним силам в сложной борьбе. Однако одними цитокинами сыт не будешь. Зачастую сами по себе они нам не слишком полезны, поэтому сейчас ученые прибегают к комбинированию цитокиновой терапии с другими методами лечения. Так, например, применение одного из представителей интерферонов I типа — альфа-интерферона (IFNa) — в сочетании с терапией иммунных контрольных точек показало неплохие результаты при лечении опасного рака кожи — меланомы [7].
— А вот это уже интересно! Продолжайте, товарищ Старший Лимфоцит! — воскликнул Сережа.
— Сочетать цитокиновую поддержку можно и с другими видами терапий. Например, с адоптивной Т-клеточной терапией [7]. Она тоже направлена на содействие армии иммунитета в сражении с раком, и о ней, безусловно, стоит поговорить отдельно. Как ты уже, наверное, смекнул, мы, Т-лимфоциты, выступаем в первой линии фронта при борьбе с опухолью. Вполне логично, что чем больше нас в ее очаге и чем эффективнее распознавание антигенов, тем вероятнее становится благоприятный исход битвы. Именно поэтому врачи часто пополняют нашу армию «обыкновенными» Т-лимфоцитами в рамках классической Т-клеточной терапии или специально «экипированными солдатами» в рамках ее разновидности — CAR-Т-клеточной терапии. В первом случае организм получает большое число копий «матерых» Т-лимфоцитов, уже побывавших в эпицентре опухоли и хорошо знакомых с ее антигенами, иными словами, Т-лимфоцитов, инфильтрирующих опухоль. На практике это делается так: врачи извлекают Т-лимфоциты из опухолевой ткани пациента, выращивают их в искусственных условиях и затем в многократно увеличенном количестве вводят обратно в организм больного [8]. Во втором случае иммунные клетки берутся из крови пациента и перед возвращением «домой» приобретают особую «экипировку», которая заключается в снабжении их рецепторами сложной усиленной структуры, или по-научному — химерными рецепторами. Последний метод не только увеличивает число Т-лимфоцитов, но и помогает им лучше распознавать антигены опухоли [9].
Просвещая Сережу, наши «воины» чуть не проплыли мимо своих уважаемых сослуживцев из другого подразделения. Но вовремя заметив их, они не преминули подплыть ближе и отдать честь. Ведь им повстречались не кто иные, как бойцы особого назначения, от «зоркого глаза» которых опухолевым клеткам порой очень сложно скрыться. Этих участников иммунной системы называют NK-клетками, или натуральными киллерами. Позже из рассказов Т-лимфоцитов Сережа узнал, что эти солдаты, без сомнения — ценнейшие помощники в иммунотерапии. Ведь в отличие от Т-лимфоцитов они и правда обладают «специальным зрением». Дело в том, что Т-лимфоциты способны эффективно распознавать антигены опухоли только в случае, если антигены связывает специальный белковый комплекс на поверхности клетки — главный комплекс гистосовместимости — сокращенно MHC [1]. Для натуральных киллеров же участие МНС вовсе не нужно — они узнают «чужаков» по другому механизму. У NK-клеток имеются особые активирующие рецепторы, которые вычисляют аномальные клетки по белкам, отличающимся от классических антигенных комплексов. Это делает опухоль очень уязвимой для атаки иммунной системы. Поэтому можно вполне успешно сражаться с раком, увеличивая количество натуральных киллеров в организме пациента и усиливая их действие с помощью цитокинов или путем блокирования определенных иммунных контрольных точек [10].
Когда волнение, возникшее из-за неожиданной, но весьма полезной для Сережи встречи, понемногу утихло, Старший Лимфоцит решил продолжить рассказ о других возможностях современной иммунотерапии.
— Помощниками армии иммунитета могут быть и своего рода искусственные, особым образом сконструированные агенты. К таковым относят онковакцины — прививки против рака. В отличие от обычных прививок, их делают, когда болезнь уже наступила, чтобы помочь организму справиться с ней. Онковакцины делят на три основных типа: клеточные, пептидные и ДНК/РНК-вакцины. В зависимости от принадлежности к тому или иному виду, они способны по-разному влиять на опухоль, в большинстве случаев заставляя ее производить больше антигенных меток, иными словами, повышая ее иммуногенность. При этом в случае клеточных вакцин в организм доставляются специально модифицированные целые опухолевые клетки или иммунные клетки, выращенные вместе с ними и «натасканные» на их уничтожение. Я обязательно познакомлю тебя с такими солдатами, вполне подходящими на должность агентов онковакцин, а именно с самыми «длиннорукими» участниками иммунной системы — дендритными клетками. Они относятся к так называемым антигенпрезентирующим клеткам, необходимым для активации Т-лимфоцитов [11]. На основе дендритных клеток изготавливаются препараты весьма интересной разновидности клеточных вакцин — дендритно-клеточные вакцины [12]. В случае же двух последних типов вакцин пациенты получают пептиды антигенов опухоли или фрагменты ее ДНК, отвечающие за их производство [13].
— Я буду очень рад знакомству с дендритными клетками! Но подождите... Мне кажется, что сейчас мы упустим злостного преступника. Вот там, смотрите! Вирус!
— Его бояться не стоит, — спокойно ответил Старший Лимфоцит, — ведь это тоже наш помощник — онколитический вирус. Да-да, оказывается, вирусы не только вызывают неприятные симптомы простуды, гриппа и других более опасных болезней, но и преданно служат науке! Сейчас ученые умеют «дрессировать» их специальным образом, в итоге получая первоклассных бойцов с опухолью, которые могут как напрямую убивать чужеродные клетки (лизировать — отсюда и происходит название), так и дополнительно активировать иммунный ответ организма. Они же все-таки вирусы! [14] (рис.1.)
— Как же много всего придумано! — восхитился Сережа, — наука и правда ни секунды не стоит на месте! Но как опухоли все же удается устоять?..
— Ты еще ее плохо знаешь... — с грустью ответил ему старший Лимфоцит.
Глава III Стражи опухоли
Заложники рака
Совсем скоро Сережа стал понимать, что имел в виду Старший Лимфоцит, говоря о каких-то тайных силах опухоли. После познавательной прогулки по «складу» иммунотерапии, армия вновь отправилась патрулировать организм. Дрейфуя по кровеносному руслу, мальчик вдруг заметил группу иммунных клеток, неспешно плывущих ему навстречу. На первый взгляд, они ничем не отличались от хорошо знакомых ему Т-лимфоцитов, с которыми он успел породниться за время своего пребывания в полку.
— Привет защитникам организма! — радостно воскликнул он, но к своему недоумению не получил никакого ответа.
— Странно… вроде бы мои соратники, а такие невежливые… Хотя постойте…
Что-то в этих угрюмых ребятах Сереже показалось подозрительным. Недолго думая, он решил оторваться от своего «войска» и проследить за ними, чтобы разузнать, кто же они такие. Миновав несколько поворотов, подозрительная группа причалила к скоплению необычных клеток, словно пледом, укутанных густой сетью кровеносных сосудов. Тут у Сережи не осталось ни малейших сомнений, что встреченные им клетки не кто иные, как предатели, тайно помогающие опухоли скрываться от законной армии.
— Вот это да… — растерянно произнес он, — вот уж не думал, что опасность кроется прямо под боком… Конечно, я предполагал, что у рака имеются «свои люди», но чтоб в моем же строю...
Совершенно разочарованный Сережа вернулся в строй и рассказал «солдатам», что ему пришлось наблюдать. Бойцы понимающе покачали головами и рассказали мальчику, что те, кого ему довелось повстречать — на самом деле, главные «оппоненты» мирных воинов-Т-лимфоцитов. Ученые называют их регуляторными T-клетками (Treg). Они отличаются от Т-лимфоцитов на молекулярном уровне из-за экспрессии в них транскрипционного фактора FoxP3, активирующего определенные гены. За счет последних Treg способны подавлять активность других Т-лимфоцитов путем выделения особых веществ — ингибиторных интерлейкинов [16].
Транскрипционный фактор — это белок, который способен активировать экспрессию генов, связываясь с так называемым промоторным участком ДНК во время ее «перекодировки» в мРНК (транскрипции).
Интерлейкины — это еще одни представители класса цитокинов, которые могут как стимулировать активность иммунных клеткам, так и подавлять ее [7].
— Выходит, я слишком хорошо думал о свойствах иммунной системы, а теперь мне вдруг открылось ее настоящее лицо — получается, что она настолько глупая и жестокая, что содержит таких чудовищ, намеренно несущих вред всему организму?..
А вот и нет! Сережа узнал, что у этих, на первых взгляд, отрицательных «персонажей», на самом деле, «добрые души». Подобно КПП иммунных контрольных точек, в норме они выполняют защиту здоровых тканей от чрезмерного «запала» иммунных клеток, так же, как и контрольные точки, предотвращая опасные аутоиммунные реакции [17]. Источником зла в данном случае является сама опухоль, которая научилась использовать естественные механизмы иммунитета в собственных интересах. Аномальные клетки могут выделять особые вещества (хемокины), привлекающие Treg к месту своего процветания [16]. Помогать опухоли в этом «грязном деле» может и специальный фермент с загадочным названием IDO (индоламин-2,3-дезоксигеназа). Его роль заключается в осуществлении метаболизма аминокислоты триптофана, в результате которого, в конечном счете, накапливается вещество — кинуренин. Известно, что оно умеет активировать регуляторные Т-клетки и убивать мирных Т-лимфоцитов [18]. Все это, конечно же, очень расстроило нашего героя. Очередным ударом для него оказался тот факт, что похожая участь быть порабощенными опухолью постигает и некоторые другие иммунные клетки, подобные Treg, а именно миелоидные супрессорные клетки (MDSC) [19] и M2 макрофаги, ассоциированные с опухолью (TAM) [20]. Все они входят в так называемое микроокружение опухоли и обеспечивают ей «внешнюю» защиту от воздействия иммунотерапии (рис. 2).
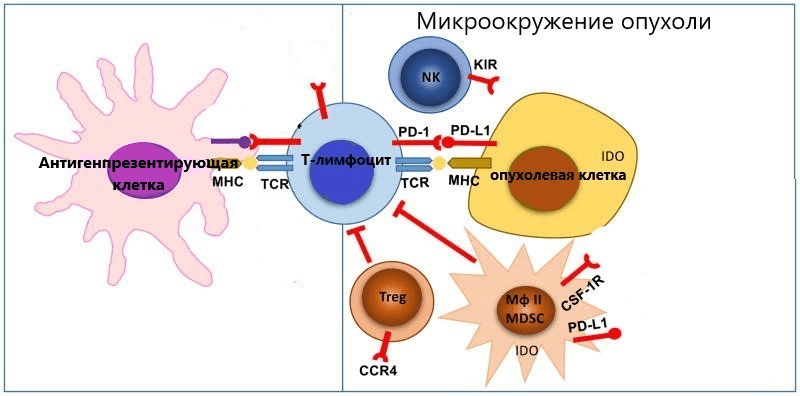
Рисунок 2. Схематическая иллюстрация микроокружения опухоли. Справа показано, как опухолевая клетка способна угнетать действие Т-лимфоцитов и натуральных киллеров (NK) путем связывания с их рецепторами (PD-1 и KIR) или при поддержке участников своего микроокружения (Treg, MDSC и М2 макрофагов). Слева изображено взаимодействие Т-лимфоцита с антигенпрезентирущей клеткой, необходимой для его активации (красными стрелками на рисунке обозначен процесс подавления активности).
[16], рисунок адаптирован
— Не сердись на эти клетки. Им и так приходится не сладко. Мало кому удается устоять перед чарами опухоли, — успокаивал Сережу Старший Лимфоцит, — к сожалению, даже самые сильные солдаты иммунной армии порой оказываются во власти хитроумного рака. Так опухолевые клетки способны угнетать действие NK-клеток, связываясь с особыми белками на их поверхности — ингибирующими рецепторами NKG2A и KIR2D (KIR3D), которые предотвращают атаку натуральных киллеров на здоровые ткани. Взаимодействуя с этими рецепторами, опухолевые клетки притворяются нормальными и усмиряют гнев разъяренных «воинов» [9].
Так, постепенно вторгаясь в секретное царство рака, Сережа понемногу осознавал, с каким изворотливым и непредсказуемым врагом приходится бороться армии иммунитета. Каково же было его потрясение, когда он узнал, что преодоление внешней преграды опухоли вовсе не гарантирует победу над ней, ведь внутри опухолевые клетки собирают еще более изощренную молекулярную «свиту».
Дворцовая свита
Узнать о внутренних силах опухоли Сереже довелось во время отдыха после очередного патруля. Прислонившись к стенке капилляра, он уже собирался ненадолго заснуть, как вдруг над его головой появился Старший Лимфоцит и протянул небольшой конверт.
— Тебе письмо от ученого, который отправил тебя к нам. Прочти. Наверняка, там что-то важное.
И правда. В письме была приведена карта внутреннего устройства опухоли, снабженная подробным описанием того, с чем еще можно столкнуться и чего необходимо остерегаться внутри ее запутанного царства (рис. 3).
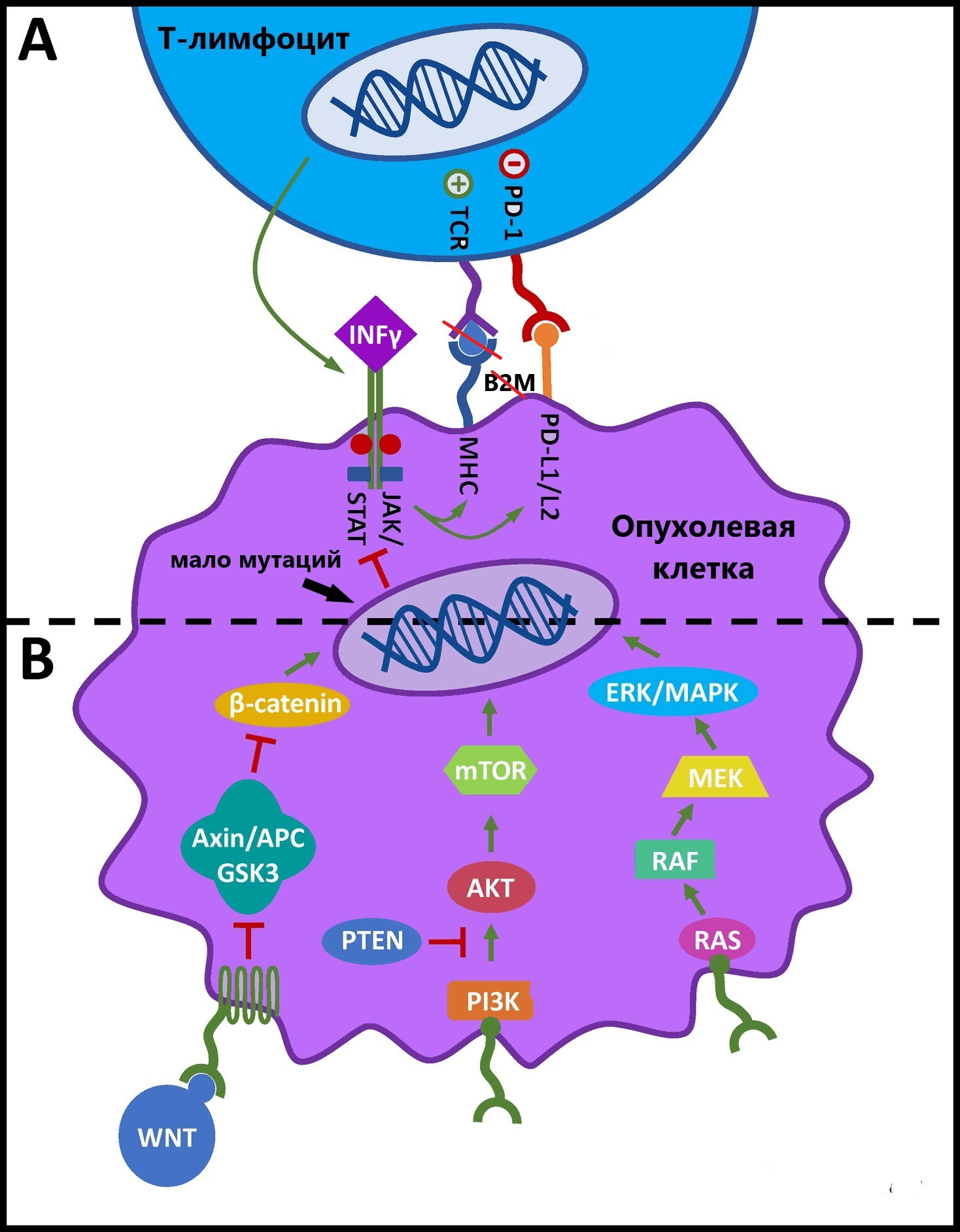
Рисунок 3. Карта внутренних механизмов устойчивости опухоли к иммунотерапии. ДНК опухолевой клетки содержит малое число мутаций, в результате чего она не экспрессирует свои неоантигены и «прячется» от Т-лимфоцитов. Скрываться от них ей помогает и потеря MHC, происходящая из-за нарушения функций белка B2M. Дополнительную поддержку опухолевой клетке оказывает «свита» сигнальных путей MAPK/ERK, PI3K/AKT/mTOR и WNT, которые наглядно проиллюстрированы последовательностью передачи сигналов от белка к белку. И, последний «помощник» опухоли здесь — «лицемерный» гамма-интерферон (IFNy), который может повышать экспрессию как антигенов опухоли, так и ее защитных белков PD-L1/L2 (зелеными стрелками показан процесс стимуляции активности, а красными — подавления).
[29], рисунок адаптирован
— Даже интересно на что еще способны опухолевые клетки! — подумал Сережа и скрепя сердце приступил к чтению.
«Дорогой Сергей!
Отправляя вас на это столь важное и ответственное задание, я так торопился, что совсем забыл рассказать вам о потайных процессах, которые происходят внутри опухолевой клетки и защищают ее от воздействия иммунотерапии. Все они в большинстве случаях касаются изменений на уровне устройства генов и функционирования сигнальных путей — последовательностей сигналов в клетке, которые приводят к запуску в ней определенных процессов.
Служащие армии иммунитета, наверняка, рассказывали вам, что они распознают опухоль по соответствующим меткам — (нео)антигенам. Но вы, скорее всего, уже не раз задавались вопросом, почему вообще у опухолевых клеток есть метки, так невыгодно отличающие их от здоровых. Все дело в том, что антигены, характерные для чужеродных клеток, отличаются от антигенов нормальных из-за присутствия в геноме первых определенных мутаций — изменений в генах. Такая задумка природы наряду с иммунными контрольными точками дополнительно помогает иммунным клеткам отличать “своих” от “чужих” [21]. Однако опухоли и здесь умудряются схитрить. Довольно часто Т-лимфоцитам приходится иметь дело с абсолютно невидимым для них врагом, так как многим опухолевым клеткам, например, клеткам рака предстательной железы, свойственно “прятать” свои неоантигены. Эта способность обусловлена тем, что ДНК таких аномальных клеток содержит малое число мутаций, в том числе, за счет хорошо работающих систем репарации ДНК — ферментов, которые исправляют в ней различные неполадки. Таким образом, чужеродные клетки как бы надевают шапку-невидимку и перестают внешне отличаться от здоровых [22]. Более того, скрываясь от закона, опухоли способны “гримироваться” и по-другому. Даже при наличии неоантигенов они могут оставаться невидимыми для Т-лимфоцитов благодаря потере MHC, которая происходит из-за мутации в гене одного из структурных элементов комплекса — белка B2M (бета-2-микроглобулина) [16]. Так или иначе, Т-лимфоциты попросту не распознают опухолевые клетки, как чужеродные, что, очевидно, снижает эффективность Т-клеточной терапии [22]. Но и это еще не все…
Неоантигены (опухоль-специфичные антигены) — метки-антигены, характерные только для опухолевых клеток [21].
Здесь стоит напомнить, что натуральные киллеры, узнающие чужеродные клетки без MHC, не всегда могут прийти на помощь Т-лимфоцитам, будучи «загипнотизированными» опухолью.
Становясь неуловимыми, опухоли собирают внутри себя “дворцовую свиту”, которая представляет собой совокупность сигнальных процессов, заботящихся об их комфорте и благосостоянии. Первый из них — сигнальный путь MAPK/ERK. Его работу обеспечивают ферменты протеинкиназы. Из их названия понятно, что они отвечают за присоединение фосфатных групп к определенным аминокислотам белков, таким образом, давая им указания по их работе. В результате подачи таких сигналов наряду с другими значимыми для опухоли процессами происходит увеличение количества интерлейкина-8, угнетающего действие Т-лимфоцитов [16]. Следующим на очереди “придворной прислуги” выступает чрезвычайно важный сигнальный путь с длинным названием PI3K/AKT/mTOR. Его участниками так же являются ферменты киназы, а именно протеинкиназы AKT и mTOR и фосфоинозитид-3-киназа PI3K. В этом процессе первым работает фермент PI3K и в отличие от протеинкиназ он присоединяет фосфатные группы не к белкам, а к веществам фосфатидилинозитолам, в результате чего получаются вещества липидной (жировой) природы, фосфатидилинозитол-3,4,5-трифосфаты (PIP3). Они могут передавать сигналы к следующим ферментам AKT и mTOR, которые, в свою очередь, запускают определенные клеточные процессы. Строго говоря, этот сигнальный путь активно функционирует и в здоровых клетках, обеспечивая их нормальный рост и метаболизм. Однако его чрезмерная активность может приводить к: выработке цитокинов, подавляющих иммунитет, увеличению количества молекул PD-L1, а также защищать клетку от своевременной запрограммированной смерти, необходимой, если в ней происходят какие-то нарушения. Эти процессы, конечно же, приходятся на руку опухолям. В нормальных условиях работа этого процесса сдерживается его “наставником” — геном PTEN, который кодирует фермент липидную фосфатазу. Этот фермент отщепляет фосфатные группы от PIP3, блокируя передачу сигналов [23]. Но, к сожалению, некоторые опухолевые клетки, в особенности клетки карциномы эндометрия матки [24] и глиобластомы (разновидности рака головного мозга) [25], держат ген PTEN “взаперти”, инактивируют его, не давая осуществлять необходимую регуляцию своих “подопечных”. Именно поэтому работа PI3K/Akt/mTOR становится чересчур активной и вредной. Что я еще забыл… Ах, да! Сигнальный путь WNT! Для некоторых типов злокачественных опухолей, в частности, для рака прямой кишки, карциномы печени и меланомы, это очень важный “придворный”, о котором необходимо помнить. В большинстве случаев, он начинает работать в присутствии “выпущенного на свободу” белка бета-катенина, который активируется после связывания клеткой так называемых wnt-лигандов. Их сигнал приводит к высвобождению бета-катенина из комплекса связывающих его белков (APC и Axin). Говоря кратко, этот процесс часто становится виновником сокращения участников иммунной армии (Т-лимфоцитов и дендритных клеток) и повышения экспрессии белка PD-L1 [26].
И, наконец, думаю, вы помните про вклад интерферона в лечение онкологических заболеваний. Этот цитокин, как вы уже знаете, может помогать иммунным клеткам. Однако, уже ничему не удивляясь, ученые выяснили, что опухоли снова смогли “проявить изобретательность” и привлечь верного слугу науки в свою свиту. И каким лицемерным он оказался! Во время своего добродетельного повышения числа антигенов чужеродных клеток, один из типов интерферона — интерферон II типа (гамма-интерферон, IFNy) — был уличен в увеличении количества молекул PD-L1, что, конечно, существенно подмочило его репутацию [27]. Более того, опухоли научились преграждать путь его действия. Нарушая работу генов, которые кодируют белки передачи сигналов интерферона в ядро клетки — JAK1/2 (Янус-активируемых киназ), они попросту становятся нечувствительны к его эффектам [28].
Догадываюсь, что сейчас вам, Сергей, не хочется верить всему тому ужасу, который я описываю в своем письме. Но, как ни печально, мои утверждения вовсе не голословны. Научные эксперименты и клинические исследования подтверждают, что все перечисленные мной процессы внутреннего “обслуживания” рака защищают его от многих видов иммунотерапии, в том числе, воздействия онковакцин, терапии иммунных контрольных точек и Т-клеточной терапии. Ведь вся эта льстивая “свита” опухоли либо снижает число неоантигенов на ее поверхности, либо ослабляет действие иммунных клеток, либо изготавливает для нее еще больше поддельных пропусков — PD-L1, с которыми перестают справляться моноклональные антитела. Вот так, мой мальчик, даже самые грандиозные планы науки могут быть в одночасье разрушены или, по крайней мере, осложнены предприимчивостью врага. Но отчаиваться все же рано! Не сомневайтесь, наука не стоит на месте! Внимательно смотрите карту и обращайтесь к моему письму, у вас впереди еще много работы! Успехов!
С наилучшими пожеланиями,
ваш ученый-иммунолог».
Глава IV Военные учения. Как бороться с устойчивостью?
После прочтения письма наш герой серьезно задумался над весьма актуальным вопросом:
— Товарищ Старший Лимфоцит, кажется, я изучил злополучную империю рака вдоль и поперек, когда же меня научат самому главному: как же бороться с его пресловутой устойчивостью к лечению?
— Скоро, рядовой, скоро! — как раз сейчас я хотел рассказать тебе, как солдаты нашей армии учатся преодолевать устойчивость опухоли (рис. 4).
— Ура!! Приступаем к секретной миссии!
Через считанные минуты Сережа и Лимфоцит оказались на одной из многочисленных военных баз иммунитета — в лимфатическом узле, где Лимфоцит и собирался рассказывать мальчику о научных стратегиях борьбы с устойчивостью опухоли.
— Итак, первое, что предлагают делать ученые — несмотря ни на что, усилить действие наших солдат — Т-лимфоцитов: как-никак, мы остаемся одними из главных на поле боя с аномальными клетками. Когда Т-клеточная терапия и терапия ингибирования иммунных контрольных точек не дают ожидаемых результатов, врачи прибегают к сочетанию их между собой или даже комбинированию с абсолютно другими видами лечения — лучевой и химиотерапией [29].
— С лучевой и химиотерапией? Я думал, мы тут про иммунитет говорить будем…
— Верно! Некоторые исследования показывают, что эти способы лечения могут напрямую влиять на состояние и функции иммунной системы, увеличивая число антигенов на поверхности аномальных клеток, повышая количество Т-лимфоцитов и дендритных клеток и одновременно снижая число участников микроокружения опухоли, а также стимулируя выработку цитокинов [30]. Все это естественным образом помогает нам лучше распознавать чужеродные клетки и использовать больший потенциал, чтобы их уничтожить.
— Вот как!
— Помогать, конечно же, стоит не только Т-лимфоцитам. Ведь и другие добрые воины нуждаются в поддержке со стороны науки. Поэтому ученые придумали, как можно помочь и NK-клеткам. Те белки на их поверхности, с которыми умеют связываться белки опухолевых клеток, блокируются моноклональными антителами, подобно рецепторам контрольных иммунных точек. Такая техника может еще больше усилить действие натуральных киллеров [9]. Более того, последние научные исследования пытаются найти все новые способы содействия самым сильным солдатам иммунной армии. Так совсем недавно ученые обнаружили, что усиливать действие NK-клеток способны ингибиторы ферментов GSK-3! Эти ферменты представляют собой киназы синтеза гликогена, необходимого животной клетке запасного углевода. Однако помимо своей основной функции участия в накоплении этого вещества, они были замечены и во многих других клеточных процессах, некоторые из которых могут приводить к угнетению действия натуральных киллеров, Т-лимфоцитов и даже CAR-T-лимфоцитов. Именно поэтому сегодня разрабатываются и активно тестируются специальные препараты для подавления их работы [31].
— Здорово!
— Вторая группа стратегий борьбы с устойчивостью подразумевает прямую борьбу с микроокружением опухоли, с теми самыми Treg, М2 макрофагами и другими «заложниками» аномальных клеток. Известно, например, что М2 макрофаги имеют особые клеточные рецепторы CSF-1R, связывание которых приводит к усиленному росту их вредоносной колонии. Эти рецепторы, как всегда, можно блокировать при помощи малых молекул или моноклональных антител [32]. Что касается регуляторных Т-клеток, то их научились «воспитывать» (репрограммировать) путем изменения их молекулярного и метаболического устройства, в буквальном смысле превращая их в мирные Т-лимфоциты [33].
— Я слышал, что укреплять иммунитет могут даже бактерии, живущие у нас в кишечнике. Имеет ли это какое-то отношение к борьбе с раком?
— Скорее да, чем нет. Хотя до становлении эффективным средством борьбы с устойчивостью бактериям еще далеко, ученые упорно работают в этом направлении. Выяснилось, например, что некоторые бактерии имеют свойство находить очаг опухоли и поселяться в скоплении ее клеток, порой весьма серьезно ей досаждая. Их способность напрямую убивать аномальные клетки, изменять строение необходимой им сети кровеносных сосудов, помогать Т-лимфоцитам и угнетать действие клеток-«глушителей иммунитета» потенциально может сделать их незаменимыми участниками борьбы [34], [35]. Интересно, что эти маленькие существа могут использовать самые неожиданные инструменты для осуществления своих целей, например, их собственные средства передвижения — жгутики! Известно, что жгутики бактерий состоят из особого белка флагеллина, который удивительным образом влияет на количество и действие регуляторных Т-клеток и Т-лимфоцитов, а также стимулирует выработку интерферона NK-клетками [35]!
— Вот это да! Как видно, военные учения армии иммунитета проходят довольно успешно! Теперь я действительно горжусь достижениями современной науки!
— Так держать, рядовой! Ты внес значительный вклад в борьбу во имя иммунотерапии, столько времени помогая нам изучать особенности жизни и хитроумные планы опухоли. Ученые будут тобой довольны. Можешь быть спокоен, наука, непременно, найдет еще более слабые места рака и еще более сильные методы его уничтожения! Хотя сейчас нам все еще не удается полностью искоренить это опасное заболевание, но постоянные исследования и совершенствование подходов лечения, несомненно, делают свое дело. А теперь, думаю, тебе пора возвращаться домой, а то твои родители, наверное, уже волнуются. Не забывай укреплять иммунитет и будь здоров!
— Спасибо вам! Всегда буду помнить ваши уроки и изучать науку!

Рисунок 4. Способы преодоления устойчивости опухоли к иммунотерапии. На рисунке изображены наши главные герои Старший Лимфоцит (слева) и Сережа (справа). Здесь Старший Лимфоцит рассказывает Сереже о различных приемах борьбы с устойчивостью опухолей к иммунотерапии.
коллаж автора
В следующую секунду Сережу ослепила яркая вспышка света, и он в одно мгновение очутился дома в своей уютной комнате. Это ученый в белом халате с гордостью нажал на волшебную кнопку телепортации.
Глава V Эпилог
На следующее утро Сережа проснулся выспавшимся и веселым. На улице светило яркое солнце, разливая приятное сентябрьское тепло. Мальчика не пугала предстоящая контрольная работа. Ведь теперь он знал многое из того, над чем сейчас упорно работают ученые в области иммунотерапии рака. Единственное, что ему очень хотелось — так это рассказать друзьям и одноклассникам о своих небывалых приключениях и ценных знаниях, которые он приобрел. Поэтому он бодро поднялся, надел белую рубашку и новые брюки и вприпрыжку отправился в школу, без опаски посматривая на большие суровые плакаты о болезнях XXI века. Ведь кто-кто, а он-то теперь точно знает, что их всех обязательно победит наука!
Литература
- Иммунитет: борьба с чужими и… своими;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Anthousa Kythreotou, Abdul Siddique, Francesco A Mauri, Mark Bower, David J Pinato. (2018). PD-L1. J Clin Pathol. 71, 189-194;
- Моноклональные антитела;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Katarzyna Guzik, Marcin Tomala, Damian Muszak, Magdalena Konieczny, Aleksandra Hec, et. al.. (2019). Development of the Inhibitors That Target the PD-1/PD-L1 Interaction—A Brief Look at Progress on Small Molecules, Peptides and Macrocycles. Molecules. 24, 2071;
- Kevin C. Conlon, Milos D. Miljkovic, Thomas A. Waldmann. (2019). Cytokines in the Treatment of Cancer. Journal of Interferon & Cytokine Research. 39, 6-21;
- Özcan Met, Kasper Mølgaard Jensen, Christopher Aled Chamberlain, Marco Donia, Inge Marie Svane. (2019). Principles of adoptive T cell therapy in cancer. Semin Immunopathol. 41, 49-58;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Paola Minetto, Fabio Guolo, Silvia Pesce, Marco Greppi, Valentina Obino, et. al.. (2019). Harnessing NK Cells for Cancer Treatment. Front. Immunol.. 10;
- Иммунологическая Нобелевская премия (2011);
- Rachel L Sabado, Sreekumar Balan, Nina Bhardwaj. (2017). Dendritic cell-based immunotherapy. Cell Res. 27, 74-95;
- Alessandra Lopes, Gaëlle Vandermeulen, Véronique Préat. (2019). Cancer DNA vaccines: current preclinical and clinical developments and future perspectives. J Exp Clin Cancer Res. 38;
- Вирусы против рака;
- Hongming Zhang, Jibei Chen. (2018). Current status and future directions of cancer immunotherapy. J. Cancer. 9, 1773-1781;
- Padmanee Sharma, Siwen Hu-Lieskovan, Jennifer A. Wargo, Antoni Ribas. (2017). Primary, Adaptive, and Acquired Resistance to Cancer Immunotherapy. Cell. 168, 707-723;
- Hai Zhao, Xuelian Liao, Yan Kang. (2017). Tregs: Where We Are and What Comes Next?. Front. Immunol.. 8;
- Lijie Zhai, April Bell, Erik Ladomersky, Kristen L. Lauing, Lakshmi Bollu, et. al.. (2020). Immunosuppressive IDO in Cancer: Mechanisms of Action, Animal Models, and Targeting Strategies. Front. Immunol.. 11;
- Christopher Groth, Xiaoying Hu, Rebekka Weber, Viktor Fleming, Peter Altevogt, et. al.. (2019). Immunosuppression mediated by myeloid-derived suppressor cells (MDSCs) during tumour progression. Br J Cancer. 120, 16-25;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Tao Jiang, Tao Shi, Henghui Zhang, Jie Hu, Yuanlin Song, et. al.. (2019). Tumor neoantigens: from basic research to clinical applications. J Hematol Oncol. 12;
- Young Kwang Chae, Michael S. Oh, Francis J. Giles. (2018). Molecular Biomarkers of Primary and Acquired Resistance to T‐Cell‐Mediated Immunotherapy in Cancer: Landscape, Clinical Implications, and Future Directions. The Oncol. 23, 410-421;
- Papa, Pandolfi. (2019). The PTEN–PI3K Axis in Cancer. Biomolecules. 9, 153;
- Ye Tao, Bin Liang. (2020). PTEN mutation: A potential prognostic factor associated with immune infiltration in endometrial carcinoma. Pathology - Research and Practice. 216, 152943;
- Yiming Li, Yuchao Liang, Zhiyan Sun, Kaibin Xu, Xing Fan, et. al.. (2019). Radiogenomic analysis of PTEN mutation in glioblastoma using preoperative multi-parametric magnetic resonance imaging. Neuroradiology. 61, 1229-1237;
- Roel Nusse, Hans Clevers. (2017). Wnt/β-Catenin Signaling, Disease, and Emerging Therapeutic Modalities. Cell. 169, 985-999;
- Angel Garcia-Diaz, Daniel Sanghoon Shin, Blanca Homet Moreno, Justin Saco, Helena Escuin-Ordinas, et. al.. (2017). Interferon Receptor Signaling Pathways Regulating PD-L1 and PD-L2 Expression. Cell Reports. 19, 1189-1201;
- Adam J. Schoenfeld, Matthew D. Hellmann. (2020). Acquired Resistance to Immune Checkpoint Inhibitors. Cancer Cell. 37, 443-455;
- Charlene M. Fares, Eliezer M. Van Allen, Charles G. Drake, James P. Allison, Siwen Hu-Lieskovan. (2019). Mechanisms of Resistance to Immune Checkpoint Blockade: Why Does Checkpoint Inhibitor Immunotherapy Not Work for All Patients?. American Society of Clinical Oncology Educational Book. 147-164;
- K.M. Heinhuis, W. Ros, M. Kok, N. Steeghs, J.H. Beijnen, J.H.M. Schellens. (2019). Enhancing antitumor response by combining immune checkpoint inhibitors with chemotherapy in solid tumors. Annals of Oncology. 30, 219-235;
- Giuseppa Augello, Maria R. Emma, Antonella Cusimano, Antonina Azzolina, Giuseppe Montalto, et. al.. (2020). The Role of GSK-3 in Cancer Immunotherapy: GSK-3 Inhibitors as a New Frontier in Cancer Treatment. Cells. 9, 1427;
- Brooke Benner, Logan Good, Dionisia Quiroga, Thomas E Schultz, Mahmoud Kassem, et. al.. (2020). Pexidartinib, a Novel Small Molecule CSF-1R Inhibitor in Use for Tenosynovial Giant Cell Tumor: A Systematic Review of Pre-Clinical and Clinical Development. DDDT. Volume 14, 1693-1704;
- Mariela A. Moreno Ayala, Zehui Li, Michel DuPage. (2019). Treg programming and therapeutic reprogramming in cancer. Immunology. 157, 198-209;
- Микробиота и опухоли: новый шаг к пониманию причин канцерогенеза;
- Mai Thi-Quynh Duong, Yeshan Qin, Sung-Hwan You, Jung-Joon Min. (2019). Bacteria-cancer interactions: bacteria-based cancer therapy. Exp Mol Med. 51, 1-15.