Рассказ о том, как ученые бактериальные и синтетические клетки подружили
12 марта 2024
Рассказ о том, как ученые бактериальные и синтетические клетки подружили
- 646
- 0
- 4
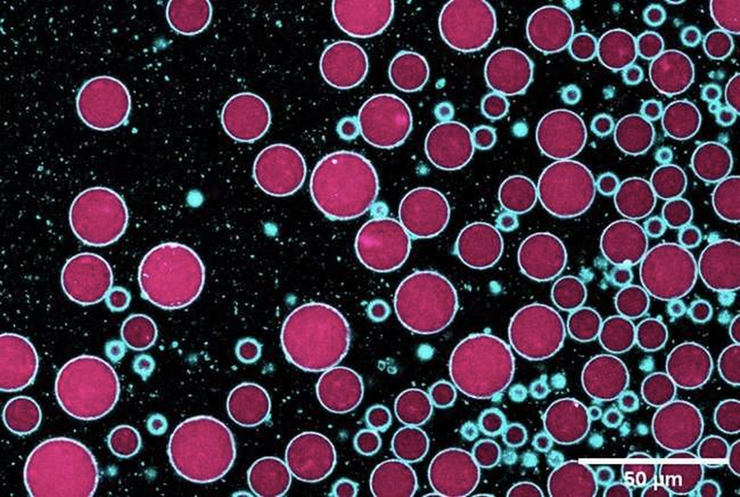
Синтетические клетки, созданные в результате эмульсионно-капельного переноса. Синим обозначены мембраны клеток, розовым — их внутреннее содержимое.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: «Сенсация! Сенсация! Ученые создали биологические клетки и научили их общаться!». Так мог бы звучать заголовок в желтой прессе, если бы они решили опубликовать данные исследования, которое провели ученые из Оксфорда и университетского колледжа Лондона.
Да, звучит действительно потрясающе! Неудивительно, что эта работа опубликована в журнале Nature Chemical Biology и очень активно цитируется. Разберемся же в том, что такого необычного придумали ученые и в чем польза их изобретения.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Синтетическая биология» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Синтезировать, да не высинтезировать
Синтетическая биология существует уже далеко не первый день, поэтому само по себе словосочетание «синтетическая клетка» уже не вызывает никакого удивления. Ученые научились и синтезировать геном с нуля, и внедрять его в уже живые клетки [1], [2].
Более подробно ознакомиться с областью вы можете в статьях «Синтетическая биология: от программирования компьютеров к программированию клеток» [3] и «Синтетическая биология: от наблюдения к вмешательству» [4] на портале «Биомолекула».
Даже создание синтетических клеток — уже известная науке технология. Чаще всего для этого используется метод эмульсионно-капельного переноса (рис. 1) [5]. В результате получаются везикулы с двойной липидной мембраной — вполне себе модель живой клетки.
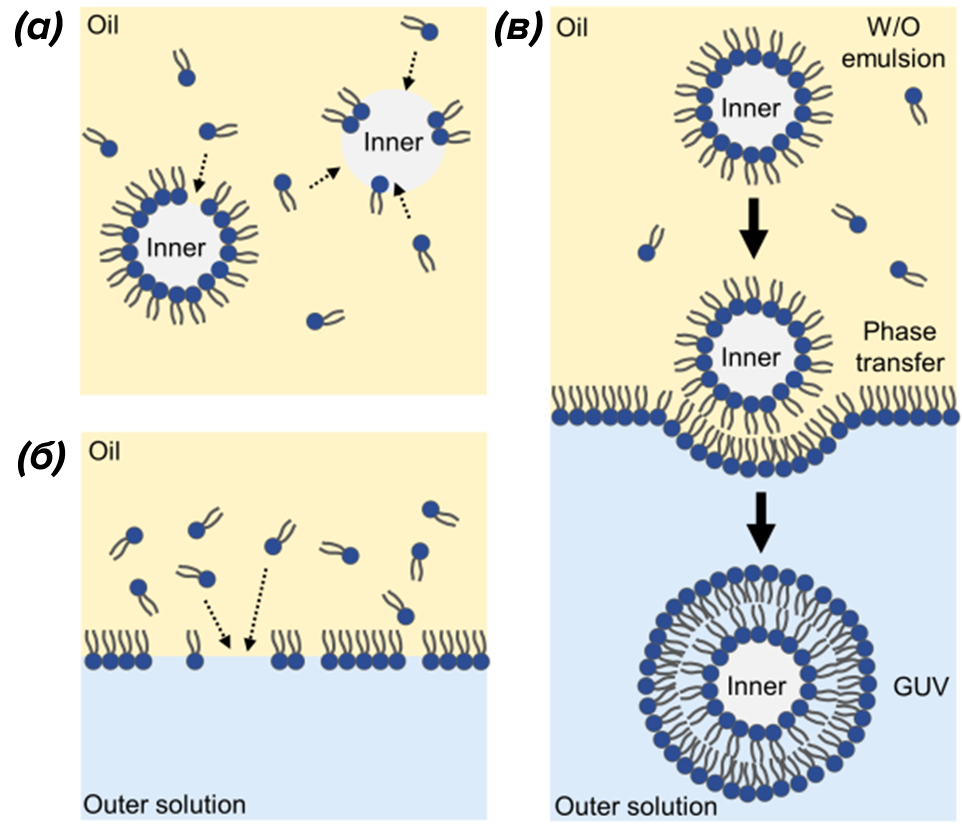
Рисунок 1. Образование везикул с помощью эмульсионно-капельного фазового переноса.
(а) — эмульгирование водного раствора сахарозы в масляном растворе с образованием стабильных капель, покрытых липидным монослоем; (б) — нанесение масляного раствора на водный раствор глюкозы для формирования вторичного липидного слоя; (в) — соединение эмульсионных капель с монослоем с помощью центрифугирования. В результате получаются везикулы с двойной липидной мембраной, которые могут выступать как модель живой клетки.
Если вставить в такую систему мембран генетический аппарат, то получится неживая клетка, способная вести себя, как живая [6]. Отличие такой структуры от живой клетки — их способность обладать любыми свойствами, которые им присвоит человек [7].
Транскрипция у синтетических клеток в разы проще, чем у живых. В живых клетках синтез РНК на матрице ДНК — сложный процесс, в котором участвуют ферменты и некоторые другие белки, и который состоит из разных стадий. Транскрипиция контролируется набором белков, которые должны объединиться с кофакторами (другими белками), чтобы образовать комплексы, стимулирующими или подавляющими синтез РНК. Этих факторов большое множество, они отличаются у эукариот и у прокариот.
В синтетических клетках для регуляции транскрипции ученые используют только несколько четко определенных факторов транскрипции, чувствительных к малым молекулам или трансляционным рибопереключателям (рис. 2) [8].
Рибопереключатель — элемент 5’-некодирующей области РНК, который участвует в регуляции мРНК. Он состоит из двух участков: аптамера, чувствительного к связыванию с малыми молекулами, и платформы экспрессии, взаимодействующей с белками трансляции. При связывании аптамера с малыми молекулами конформация участка между аптамером и платформой экспрессии изменяется, изменяя вторичную структуру РНК, за счет чего и происходит регуляция.
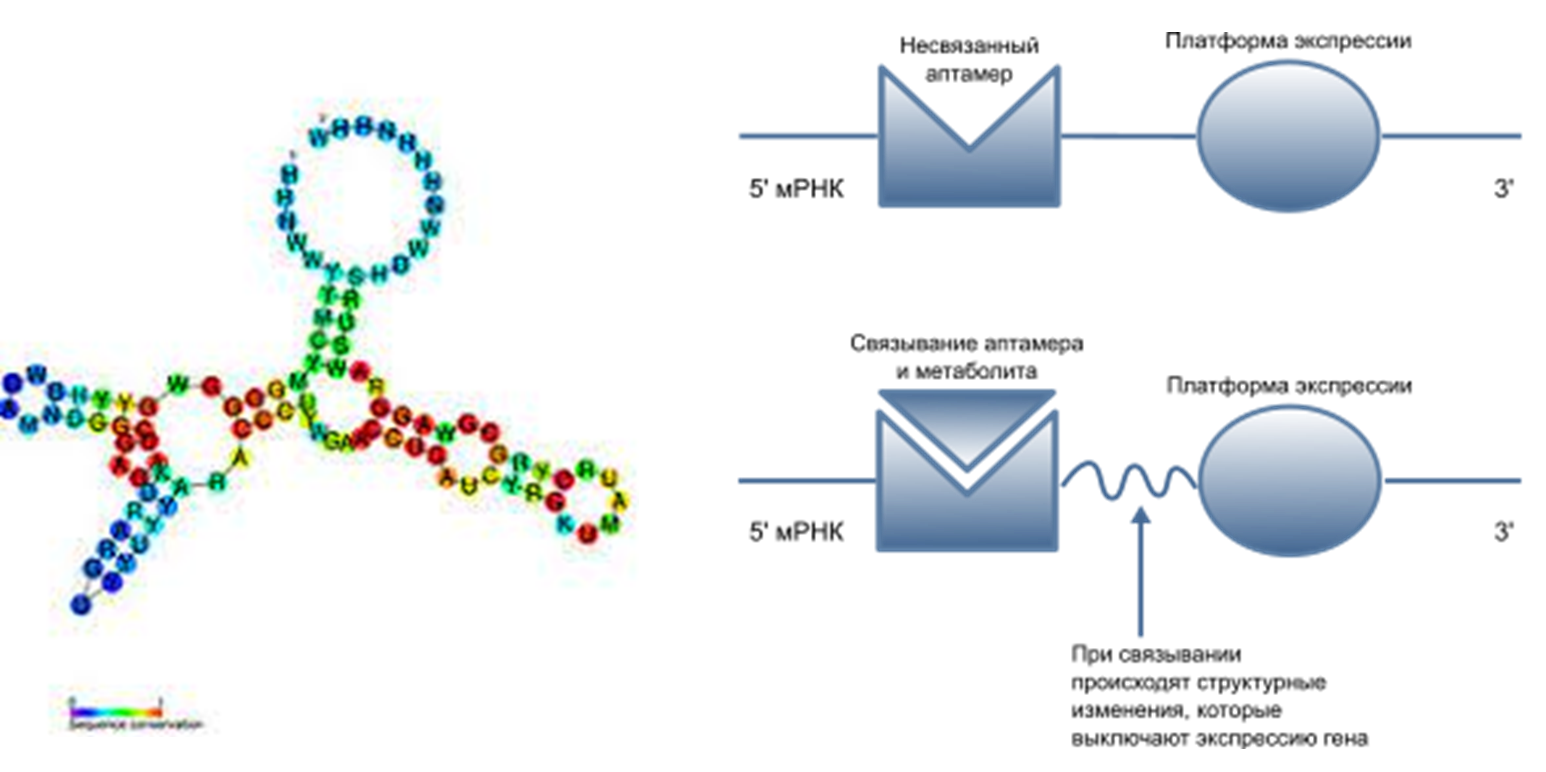
Рисунок 2. Пример вторичной структуры тетрагидрофолатного рибопереключателя (слева) и принцип работы рибопереключателя (справа).
Коммуникация синтетических клеток происходит двумя способами: за счет высвобождения сигнальных молекул, не проникающих через мембраны (с использованием α-гемолизина), или же за счет способных проникать через мембраны ацилгомосеринлактонов (АГСЛ, основные молекулы для коммуникации у живых бактерий) [7].
У этих методов есть и свои ограничения, например, несовместимость работы некоторых АГСЛ друг с другом [7]. Ученые постоянно совершенствуют системы синтетических клеток и придумывают новые методы для организации их коммуникации и трансляции. В статье, о которой мы поговорим, как раз приведен один из таких усовершенствованных механизмов: как клетки и бактерии научились общаться с помощью света.
В начале была мембрана
План у ученых, на первый взгляд, был простой: создать синтетические клетки, испускающие сигнал, модифицировать живые бактерий так, чтобы они этот сигнал понимали — и вуа-ля! Но обо всем по порядку.
Сначала было решено сконструировать такие искусственные клетки, которые бы отдавали в окружающую среду понятный для живых бактерий сигнал.
С помощью эмульсионно-капельного фазового переноса исследователи создали из фосфатидилхолина довольно большие, 3–20 нм в диаметре, синтетические везикулы. Далее предстояло сконструировать и ввести генетический конструкт [7].
Новаторство этого исследования — использование света для регуляции трансляции. Ученые подумали, что это может оказаться очень удобно — «включать» и «выключать» клетки световым сигналом — такое может пригодиться и в онкологии, и в других областях медицины! В связи с этим генетический конструкт они сделали светочувствительным. Он состоял из светочувствительного промотора фага Т7, сильного сайта связывания рибосомы (ССР), гена интереса (ГИ) и терминатора фага Т7. Геном интереса был выбран флуоресцентный белок mNeonGreen (рис. 3).
Необходимо было убедиться, что ДНК в синтетической клетке действительно светочувствительная. Для этого ученые доставили генетический конструкт внутрь клетки. Оказалось, что внутри синтетической клетки экспрессия генов зависит от наличия УФ-света — система работала (рис. 3)!
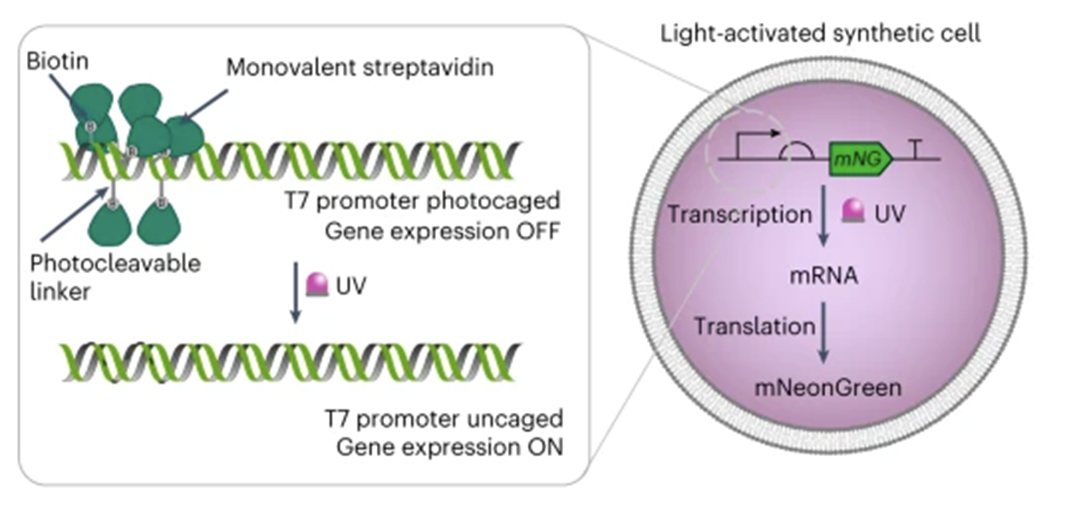
Рисунок 3. Фоточувствительная генетическая конструкция внутри синтетической клетки. К модифицированным тиминовым основаниям на 5’-конце праймеров (специальных фрагментов ДНК) ученые присоединили фоторасщепляемые биотинилированные линкеры — таким образом получились специальные модифицированные праймеры. Далее эти праймеры с помощью ПЦР присоединили к промотору Т7 — так получился фоточувствительный промотор. Затем исследователи присоединили к промотору молекулы стрептавидина, связывание которого с биотином создавало стерическую блокаду, препятствующую присоединению РНК-полимеразы Т7 к промотору Т7, под которым находился ген флуоресцентного белка mNeonGreen. Оказалось, что в отсутствие света из-за присоединенного через биотин стрептавидина РНК-полимераза Т7 не связывается с промотором Т7 и ген не транскрибируется. После облучения УФ РНК-полимераза Т7 связывается с промотором Т7, инициирует транскрипцию и последующую трансляцию интересующего белка mNeonGreen.
Стрептавидин-биотиновое связывание часто используют в молекулярной биологии и биохимии из-за того, что каждая субъединица гомотетрамера стрептавидина имеет очень высокое сродство к молекуле биотина, и при их связывании образуется комплекс исключительно высокой стабильности; это соединение широко используют в аналитических системах, при очистке белков или для адресной доставки.
По команде стройся
Итак, искусственные клетки были готовы к тому, чтобы «включаться» и «выключаться» по ультрафиолетовой команде. Объясним здесь, почему исследователи выбрали именно свет в качестве переключателя.
Преимущество света перед малыми молекулами для активации транскрипции заключается в том, что такую систему проще контролировать в пространстве. Это ученые подтвердили на первом этапе эксперимента. Они поместили синтетические везикулы в агарозу, чтобы те не двигались, и облучили их УФ-светом. В результате получились говорящие сами за себя снимки — клетки можно включать и выключать очень избирательно (рис. 4).
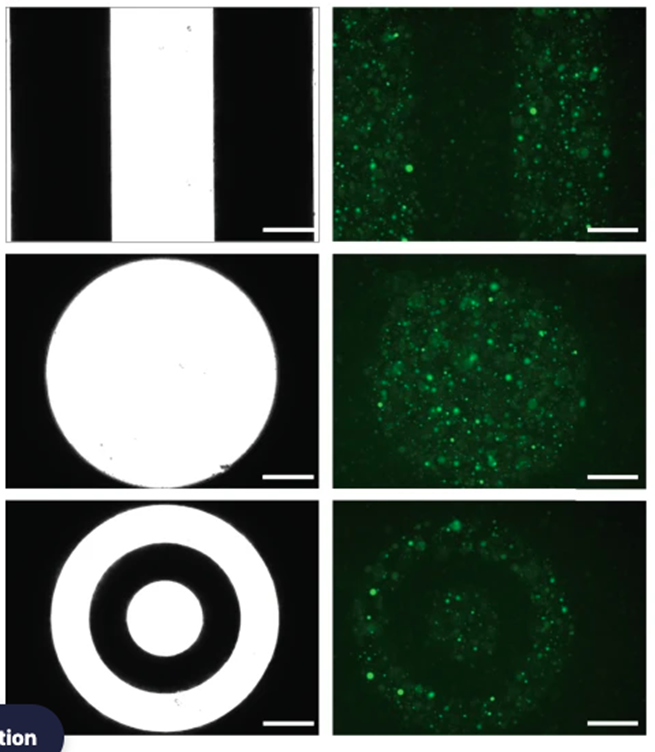
Рисунок 4. Синтетические клетки со вставленным генетическим конструктом поместили в агарозу и активировали в них экспрессию флуоресцентного белка с помощью УФ-света через фотомаску. Слева — используемые фотомаски. Справа — синтетические клетки экспрессируют флуоресцентный белок только при освещении через светлые участки фотомаски.
Теперь предстояло запрограммировать клетки так, чтобы они по команде производили молекулы, сигнал от которых был бы «понятен» бактериям.
Для этого ученые внесли в синтетические клетки генетический конструкт, кодирующий фермент BjaI (АГСЛ-синтазу). Его функция заключается в том, что он превращает субстраты изовалерил-кофермент А (ИВ-коА) и S-аденозилметионин (SAM) в N-изовалерил-L-гомосерин лактон (ИВ-ГСЛ) (рис. 5).
Молекулы субстрата крупные, заряженные и не проходят через мембрану, а молекулы ИВ-ГСЛ — существенно меньше и через мембраны проходят. Таким образом, в синтетических клетках, содержащих субстрат и генетических конструкт, экспрессирующий BjaI, происходит синтез ИВ-ГСЛ. Он же, в свою очередь, проходит через клеточную мембрану и воспринимается бактериальными клетками (рис. 5).
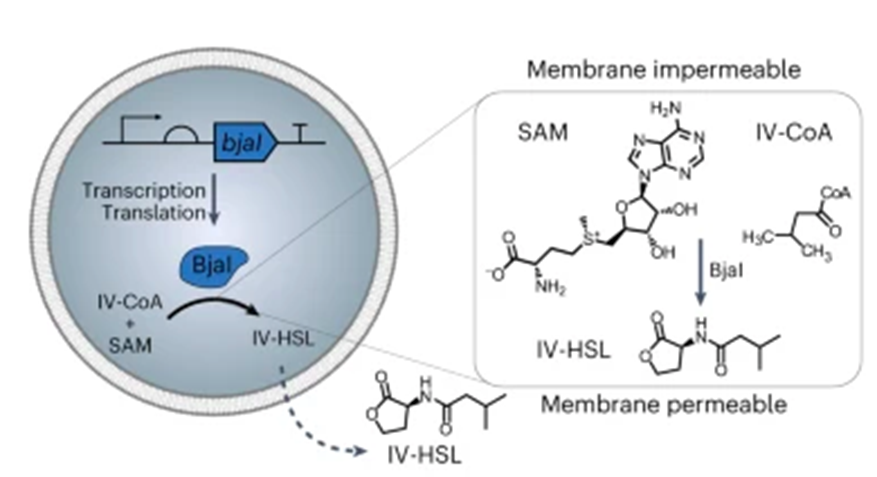
Рисунок 5. Справа — синтез проходящего через мембраны ИВ-ГСЛ из непроходящих через мембраны субстратов ИВ-коА и S-аденозилметионина внутри синтетической клетки с помощью АГСЛ-синтазы BjaI. Слева — превращение изовалерил-кофермента А (ИВ-коА, IV-CoA) и S-аденозилметионина (SAM) в N-изовалерил-L-гомосерин лактон (ИВ-ГСЛ, IV-HSL) с помощью фермента BjaI (АГСЛ-синтазы).
Ученым необходимо было удостовериться, не мешают ли молекулы субстрата синтезу фермента BjaI, ведь всякое может случиться. Чтобы убедиться, что все в порядке, они проинкубировали вместе субстрат, внеклеточную систему синтеза BjaI и бактериальные клетки-реципиенты. Все оказалось в полном порядке! Можно было продолжать работу.
Тщательная подготовка
Оставалось трансформировать принимающую сторону, то есть бактериальные клетки-реципиенты, таким образом, чтобы было видно, реагируют они на сигнал от синтетических клеток (доноров) или нет. Для этого ученые взяли линию E. coli и трансформировали ее с помощью плазмиды [11].
Генетический конструкт исследователи организовали следующим образом. Транскрипционный фактор BjaR экспрессировался в любом случае, так как он находился под контролем постоянно активного промотора. Белок же GFP производился только тогда, когда BjaR, связавшись с ИВ-ГСЛ, взаимодействовал с промотором и привлекал к нему РНК-полимеразу. Если связывания BjaR с ИВ-ГСЛ не происходило, то белок GFP не экспрессировался. Конечно, ученые проверили, хорошо ли светятся клетки в ответ на ИВ-ГСЛ — система оказалась довольно чувствительной (рис. 6).
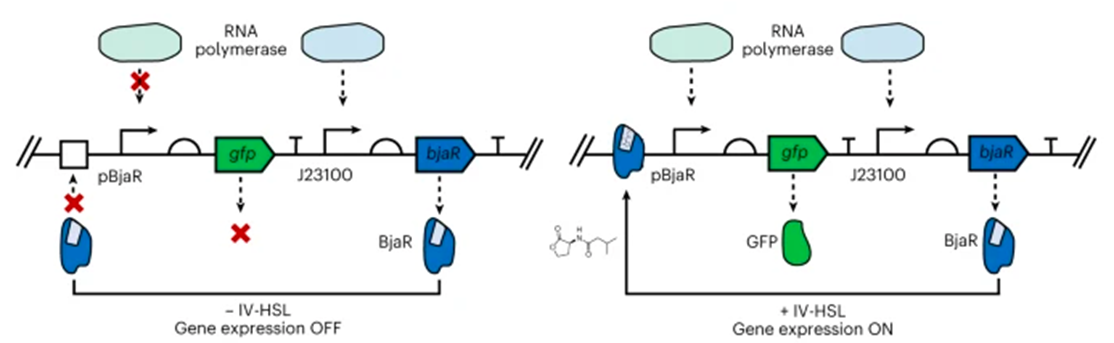
Рисунок 6. В отсутствие ИВ-ГСЛ BjaR не распознает консенсусную связывающую последовательность перед промотором GFP, и экспрессия GFP отключается. При связывании с ИВ-ГСЛ BjaR связывается со операторным сайтом выше промотора pBjaR, привлекая РНК-полимеразу к промотору и активируя экспрессию GFP.
Однако свечение клеток без ИВ-ГСЛ все же, увы, наблюдалось. Чтобы понять, почему так происходит, ученые сделали линию клеток без гена BjaR и ввели туда ту же плазмиду. Ура! Свечения без ИВ-ГСЛ больше не было.
Ученые всегда перфекционисты. И авторы работы хотели, чтобы система была идеальной и никакого свечения в отсутствие субстрата не было вообще. Чтобы этого достигнуть, они решили использовать направленную эволюцию BjaR. Да-да, оказывается, можно заставить белок эволюционировать в нужном для нас направлении.
Итак, исследователи устроили отбор нужных клеток-мутантов. С помощью ПЦР они создали библиотеку мутантных генов BjaR [12] — всего 45 штук — и провели отбор функциональных вариантов BjaR. Затем они обогатили библиотеку: промыли клетки, вырастили их в среде без ИВ-ГСЛ и отобрали наиболее быстро растущие клоны. Плазмиды из всех клеток, оставшихся после фазы роста, затем использовали в качестве матрицы ДНК для трансформации в следующем раунде эволюции. Всего ученые провели четыре таких раунда.
В итоге исследователи отобрали трех победителей и отсеквенировали их геном. Оказалось, что мутации находились в кодоне инициации трансляции. Чтобы убедиться, действительно ли мутанты лучше подходят для эксперимента, ученые вставили мутантный ген в плазмиду и проверили уровень свечения — все было в порядке. Наилучшие результаты показал кодон ACG.
Чтобы еще усовершенствовать систему, исследователи попробовали модифицировать расположенный перед BjaR сайт, связывающийся с рибосомой. Это привело к дозозависимому усилению флуоресценции, благодаря чему и был отобран лучший вариант BjaR. Итак, была проделана огромная работа: что же дальше?
Взаимодействие клеток
Итак, все было готово. Оставалось проверить, работает ли система, общаются ли клетки между собой? Исследователи зафиксировали синтетические клетки в агарозе, чтобы воздействие света было направленным. Поверх них нанесли клетки-реципиенты. Включили ультрафиолет и... Вуаля! Клетки E.coli светились красивым зеленым цветом (рис. 7).

Рисунок 7. Активированные светом синтетические клетки иммобилизовали внутри агарозных подушек, содержащих минимальную среду М9. Клетки-реципиенты впоследствии наносили поверх наполненных синтетическими клетками агарозных подушечек (слева). При облучении УФ-светом синтетических клеток фермент BjaI, и, как следствие, ИВ-ГСЛ продуцировались внутри них. ИВ-ГСЛ диффундировал через липидную мембрану в агарозу и активировал экспрессию GFP в клетках-реципиентах, удерживаемых выше. Флуоресценция GFP не наблюдалась в реципиентах, которые не подвергались воздействию УФ, или на агарозных планшетах, содержащих синтетические клетки без матриц ДНК, кодирующих BjaI.
Масштабная линейка слева 200 мкм. Масштабная линейка справа 20 мкм. Изображения получены в двух независимых экспериментах.
Давайте еще раз проговорим механизм взаимодействия, который включался между синтетическими клетками и бактериями при включении УФ-света.
Итак, когда включается свет, в синтетических клетках продуцируется фермент BjaI, который в присутствии молекул субстрата синтезирует из них N-изовалерил-L-гомосеринлактон. В бактериальных клетках стабильно продуцируется транскрипционный фактор BjaR, который, связавшись с ИВ-ГСЛ от синтетических клеток, активирует экспрессию гена светящегося белка GFP [13].
В чем же фишка?
В этой работе ученые отказались от управления транскрипцией ДНК с помощью веществ природного происхождения. Вместо этого они использовали УФ-свет для точного контроля активации синтетических клеток с химически модифицированными матрицами ДНК.
В данной конкретной модели УФ-свет стимулировал фоторасщепления 2-нитробензильных групп, содержащихся в промоторах T7 ДНК. Однако модульная природа таких промоторов делает их полностью настраиваемыми. Изменив конфигурацию промотора, можно отрегулировать экспрессию генов и заставить клетки реагировать на более биосовместимый и лучше проникающий в ткани видимый или ближний инфракрасный свет.
Помимо того, что это все очень интересно, в чем же фишка таких исследований? Как они могут помочь непосредственно людям? Во-первых, синтетические клетки можно использовать для изучения механизмов клеточной коммуникации в целом, например, в биопленках. Во-вторых, синтетические клетки, активируемые ближним инфракрасным светом, теоретически можно использовать в качестве устройств доставки лекарств, которые выделяли бы лекарственные малые молекулы или белки в нужном месте.
Только представьте себе — по сигналу можно будет заставить клетки выделять лекарства в каком-то конкретном месте организма именно в то время, когда решит врач! Кажется, за такое будущее фармакотерапии ученым точно стоит побороться!
Литература
- Синтезировать-невысинтезировать!;
- Синтетическая жизнь;
- Синтетическая биология: от программирования компьютеров к программированию клеток;
- Синтетическая биология: от наблюдения к вмешательству;
- Sophie Pautot, Barbara J. Frisken, D. A. Weitz. (2003). Production of Unilamellar Vesicles Using an Inverted Emulsion. Langmuir. 19, 2870-2879;
- Vincent Noireaux, Albert Libchaber. (2004). A vesicle bioreactor as a step toward an artificial cell assembly. Proc. Natl. Acad. Sci. U.S.A.. 101, 17669-17674;
- Jefferson M. Smith, Denis Hartmann, Michael J. Booth. (2023). Engineering cellular communication between light-activated synthetic cells and bacteria. Nat Chem Biol. 19, 1138-1146;
- Katarzyna P. Adamala, Daniel A. Martin-Alarcon, Katriona R. Guthrie-Honea, Edward S. Boyden. (2017). Engineering genetic circuit interactions within and between synthetic minimal cells. Nature Chem. 9, 431-439;
- Jefferson M. Smith, Razia Chowdhry, Michael J. Booth. (2022). Controlling Synthetic Cell-Cell Communication. Front. Mol. Biosci.. 8;
- Roberta Lentini, Noël Yeh Martín, Michele Forlin, Luca Belmonte, Jason Fontana, et. al.. (2017). Two-Way Chemical Communication between Artificial and Natural Cells. ACS Cent. Sci.. 3, 117-123;
- Stefan J. Tekel, Christina L. Smith, Brianna Lopez, Amber Mani, Christopher Connot, et. al.. (2019). Engineered Orthogonal Quorum Sensing Systems for Synthetic Gene Regulation in Escherichia coli. Front. Bioeng. Biotechnol.. 7;
- Yuki Kimura, Shigeko Kawai-Noma, Kyoichi Saito, Daisuke Umeno. (2020). Directed Evolution of the Stringency of the LuxR Vibrio fischeri Quorum Sensor without OFF-State Selection. ACS Synth. Biol.. 9, 567-575;
- Andrea Lindemann, Gabriella Pessi, Amy L. Schaefer, Margrith E. Mattmann, Quin H. Christensen, et. al.. (2011). Isovaleryl-homoserine lactone, an unusual branched-chain quorum-sensing signal from the soybean symbiont Bradyrhizobium japonicum. Proc. Natl. Acad. Sci. U.S.A.. 108, 16765-16770.