Синтетическая жизнь
08 октября 2015
Синтетическая жизнь
- 4183
- 3
- 8
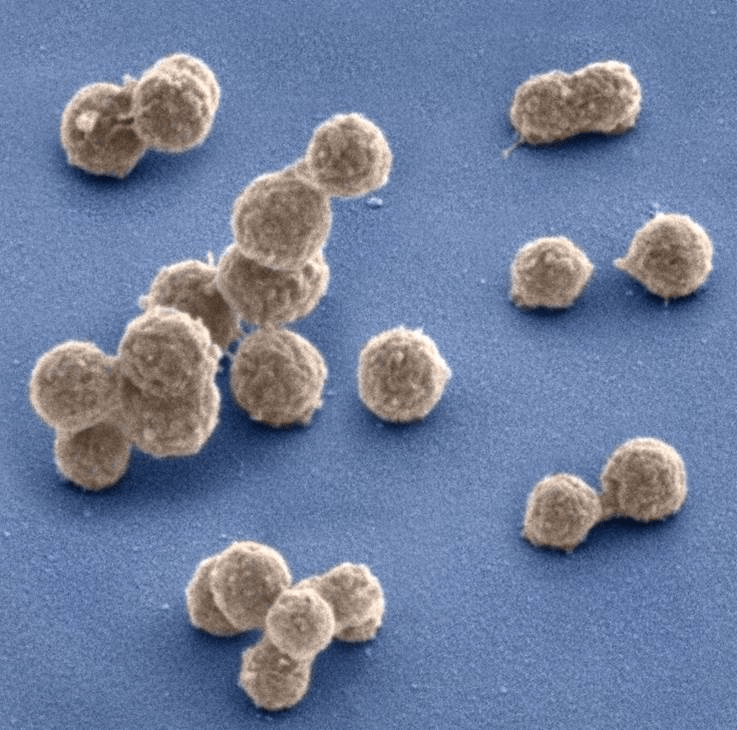
Электронная микрофотография синтетической клетки Mycoplasma mycoides JCVI-syn1.0.
рисунок с сайта J. Craig Venter Institute
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Пока одни ученые изучают геномы, другие пытаются их создавать, пользуясь искусственно синтезируемыми «деталями». Этим они напоминают инженеров, а их работа — результат многих миллионов лет эволюции. Синтетическая биология — область, где наука, изучающая живое, становится наукой, его создающей, пытаясь не только понять фундаментальные принципы организации и работы живых систем, но и решить прикладные задачи — от лечения заболеваний до биотехнологий будущего.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Инструкция для живого
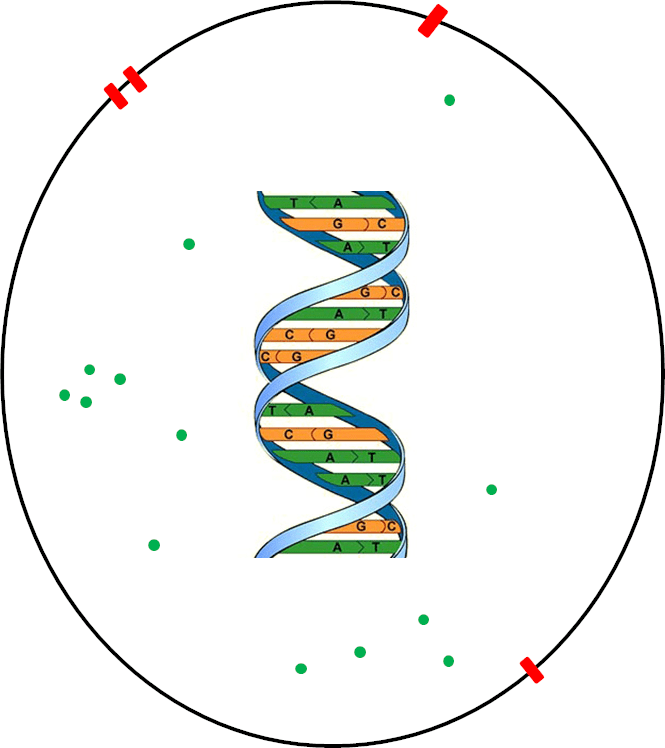
Рисунок 1. Схематическое изображение клетки. ДНК клетки — «программный код», в котором заключена вся необходимая для жизни информация, а цитоплазма (внутреннее содержимое клетки) — «способ реализации» кода (среда, которая интерпретирует зашифрованную в ДНК информацию). Зеленые точки — рибосомы; красным обозначены каналы, через которые происходит обмен с окружающей средой. Масштаб не соблюден.
рисунок автора статьи
Поведение клетки — раздражение, деление, рост, дифференцировка — подчинено химическим реакциям, компоненты которых — белки — закодированы в ее геноме. Геном представляет собой совокупность всей ДНК клетки, напоминая при этом «инструкцию» или «программу», в которой содержится вся наследственная информация в виде последовательности четырех символов (оснований) — A, T, G и C, — необходимая для построения и поддержания жизни. Для выполнения команд этот код должен быть интерпретирован (прочтен), а информация из последовательности оснований реализована (через РНК и белки) в наборе химических реакций в цитоплазме (рис. 1). Последние в конечном счете детерминируют все свойства живого, и это справедливо для всех организмов — от бактерий и архей до высших эукариот, что подчеркивает фундаментальность такого механизма. За многие миллионы лет эволюции организмы приобретали (и до сих пор это делают) различные гены, которые помогали им лучше приспосабливаться к условиям в своей нише. Поэтому разные живые существа имеют отличающиеся геномы, которые адаптированы к соответствующим условиям жизни, хотя некоторые элементы схожи (консервативны) у самых филогенетически удаленных организмов.
О масштабном проекте «Геном человека», его результатах и перспективах постгеномной эры читайте: «Геном человека: как это было и как это будет» [1]. — Ред.
Для «чтения» информации, закодированной в ДНК, ученые прибегают к различным методам секвенирования , прочитывая каждый символ (основание) и получая в конечном итоге последовательность (на компьютере), аналогичную геному клетки (рис. 2).
О новых методах чтения ДНК рассказано в статьях «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)» [2], «Секвенирование единичных клеток (версия — Metazoa)» [3] и «Разработан метод анализа экспрессии генов на уровне индивидуальных клеток» [4], а о проблемах, связанных с нарастающими темпами секвенирования полных человеческих геномов (в том числе и в России), — в обзоре «Код жизни: прочесть не значит понять» [5]. — Ред.
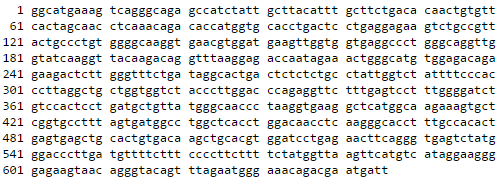
Рисунок 2. Пример отображения «прочтенной» последовательности ДНК. Буквы означают азотистые основания (а — аденин, t — тимин, g — гуанин, c — цитозин).
фрагмент последовательности гена гемоглобина человека взят из GenBank (номер DQ659148.1)
Концепция синтетической биологии
Синтетическая биология как наука появилась в начале этого века [6], когда были получены искусственные простые генно-регуляторные системы. Так, в 2000 году был сконструирован генетический триггер, который переключается между двумя стабильными состояниями в бактерии E. coli под действием термического или химического стимулов (рис. 3) [7]. Это напоминает электрическую цепь с несколькими переключателями (гены и белки) и выходным сигналом («лампочкой»), которым может быть изменение состояния клетки — например, синтез флуоресцентного белка . Удавшийся эксперимент ознаменовал новые возможности в молекулярной и клеточной биологии и стал одним из первых шагов в создании «искусственной» жизни.
О многообразии флуоресцентных белков и их применении в биологических исследованиях рассказывают статьи: «Флуоресцирующая Нобелевская премия по химии» [8], «Флуоресцентные белки: разнообразнее, чем вы думали!» [9], «“Нарисуем” живую клетку» [10]. — Ред.
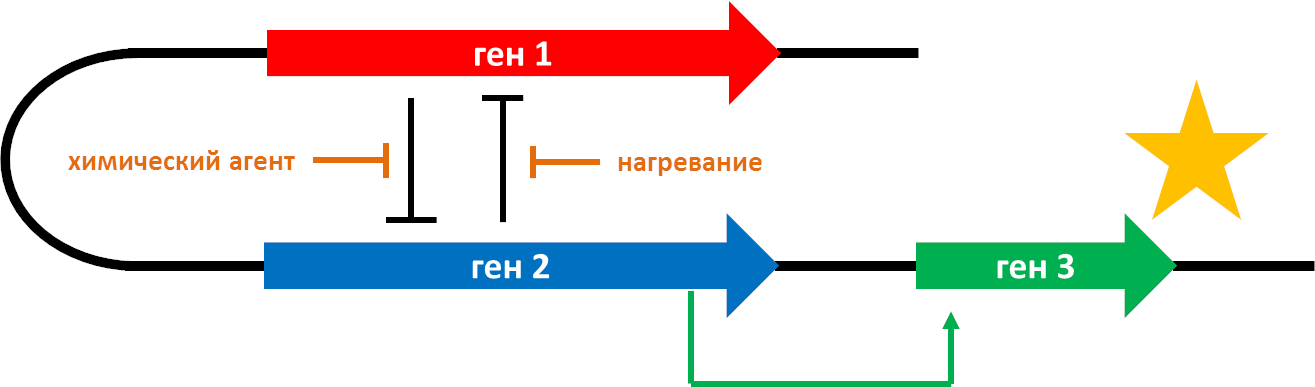
Рисунок 3. Переключатель из двух генов и гена-репортера. Оба гена (красный и синий) взаимно репрессируют друг друга (тупая стрелка), и когда экспрессия одного подавлена, второй ген активируется. В качестве инактиваторов экспрессии в этой модели используются химический агент и тепловой шок (нагревание). Второй ген активирует третий (зеленый), экспрессирующий флуоресцентный белок, свечение которого можно зарегистрировать.
рисунок автора статьи
В настоящее время под синтетической биологией понимают создание новых биологических конструктов и систем, а также изменение природных живых систем с целью получения организма с желаемыми качествами [11]; опорой для этого служат математические модели (пример — триггер Жакоба-Моно). Первое подразумевает синтез генома de novo, второе — целенаправленное изменение уже существующего (внесение или удаление его элементов).
Минимальный геном
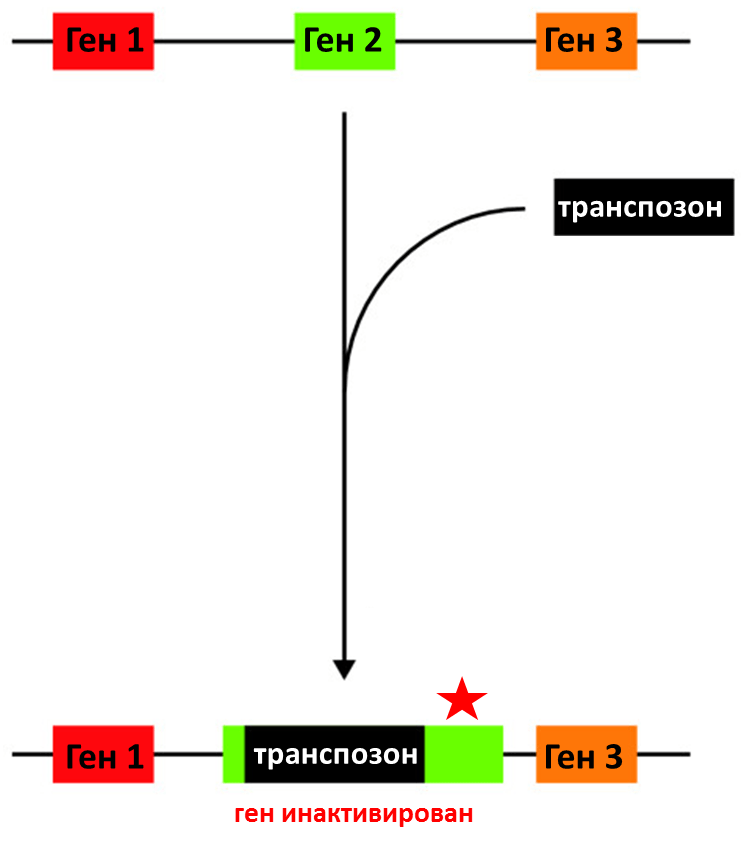
Рисунок 4. Схематичное изображение транспозонного мутагенеза.
рисунок автора статьи
Минимальный геном — важная концепция в контексте синтетической биологии. Он представляет собой наименьшее число генетических элементов, которые необходимы для существования свободноживущего клеточного организма [12]. Это понятие тесно связано с видовой специфичностью и внешними факторами (должны быть обеспечены неограниченность ресурсов, оптимальные физические условия, отсутствие конкуренции) и зависит от конечной цели [13]; без учета этого такая концепция теряет свою ценность из-за неспособности поддерживать жизнь (по крайней мере, современного типа). Предпосылкой к этому стал поиск минимально необходимого числа генов [14], которое достаточно для клетки (при вышеперечисленных условиях). Для этого было проведено сравнение самого короткого генома среди свободноживущих организмов — Mycoplasma genitalium (0,58 млн п.н. (миллиона пар нуклеотидов), около 524 генов) — с геномом Haemophilus influenza (1,83 млн п.н., около 1788 генов), после чего были найдены 256 генов-кандидатов, достаточных для поддержания жизни современного типа. Помимо предсказательной модели, для поиска необходимых генов (при идеальных условиях) использовали экспериментальные подходы: транспозонный мутагенез, последовательное выключение генов и подавление генной экспрессии антисмысловыми РНК.
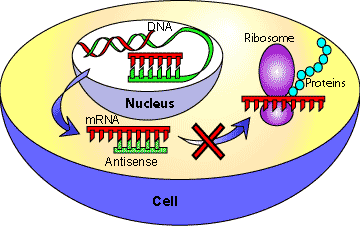
Рисунок 5. Механизм блокирования трансляции антисмысловой РНК. Образуя двухцепочечный комплекс (по принципу комплементарности) с матричной РНК, антисмысловая (antisense) РНК препятствует трансляции (синтезу белкового продукта гена).
Первый подход основан на трансформации (трансфекции) клеток вектором, содержащим транспозон (мобильный, то есть способный перемещаться в геноме, элемент) и селективный маркер (например, маркер резистентности к антибиотикам), по которому можно будет отобрать бактериальные колонии, в которые попал вектор. Транспозон встраивается в гены клетки-хозяина, «разрывая» и инактивируя их (рис. 4). Если вставка произошла в жизненно необходимом гене (генах), то клетка погибает, не оставляя потомков, и колония не формируется; при этом клетка толерантна к вставкам в не жизненно важных генах (главный принцип: если ген может быть «разорван», то без него клетка может обойтись в данных условиях). Дальнейший отбор на селективной среде и изучение гено-/фенотипа позволяют установить инактивированные гены. Однако некоторые необходимые гены могут оказаться толерантными к транспозиции, а уменьшение скорости роста, которое вызывают некоторые мутировавшие «второстепенные» гены, может сформировать ложное представление об их значимости — экспериментатор рискует ошибочно принять одни за другие [15].
Направленный синтез антисмысловых РНК (РНК, которые комплементарно связываются с мРНК целевого гена, формируя двухцепочечный нетранслируемый комплекс) в клетках подавляет экспрессию гена на посттранскрипционном уровне, что используется для его целевой инактивации (рис. 5) [16]. Проблема заключается в том, что не всегда удается достичь адекватной экспрессии антисмысловой РНК, и это накладывает свои ограничения на применение такого метода. На основе вышесказанного (и с использованием некоторых других методов) в более позднем исследовании [17] было охарактеризовано 206 генов, необходимых для поддержания жизни клетки с минимальным размером генома. Генетический аппарат такой клетки кодирует почти полный набор белков, отвечающих за репликацию (белки реплисомы, вспомогательные белки), транскрипцию (полимеразы и т.д.) и менее полный комплекс белков трансляции (субъединицы рибосом, факторы трансляции), а также сильно редуцированные системы репарации ДНК и регуляции транскрипции. В этой клетке нет путей биосинтеза аминокислот, редуцирован биосинтез липидов и углеводов, а в качестве источника энергии выступает субстратное фосфорилирование — примитивный способ синтеза богатых энергией соединений (рис. 6, более детально — см. [17]).
Важность модели минимального генома заключается в возможностях лучше понять фундаментальные принципы жизни, руководствуясь более простой системой; исходная простота также помогает лучше контролировать такую систему при добавлении новых, усложняющих ее, функциональных конструктов. Имея наборы жизненно необходимых генов, можно построить более сложные модули для последующих систем (синтетических геномов), а также предсказать «уязвимые места» клеток, на которые можно воздействовать в своих целях (например, таргетное производство новых антибиотиков против патогенных организмов).
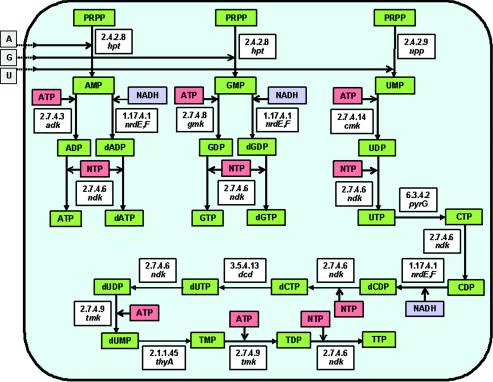
Рисунок 6. Метаболизм клетки с минимальным геномом. В белых боксах приведены классификационные номера ферментов и названия кодирующих их генов. В зеленых —промежуточные и конечные продукты метаболизма, а в розовых — источники химической энергии.
Синтезированная жизнь
Одним из триумфов в синтетической биологии стал синтез de novo генома Mycoplasma genitalium [18], [19] (рис. 7). Бактерия с синтезированным геномом длиной более 580 т.п.н. (точнее — 582970 п.н.) получила название Mycoplasma genitalium JCVI-syn1.0 в честь института, в котором проводились работы (J. Craig Venter Institute). Использование бактерий в качестве модельной системы удобно из-за небольших размеров генома, быстрого роста бактериальных колоний и простоты трансплантации синтезированной хромосомы в клетку-реципиент. Первоначально весь геном был смоделирован на компьютере, где в межгенных областях (последовательностях ДНК между генами), толерантных к транспозиции, фрагменты ДНК иерархично собирались во все более крупные части. На первом этапе собирались участки ДНК («кассеты», 101 штука) длиной 5–7 т.п.н. с перекрывающимися последовательностями для соединения друг с другом (последняя кассета полностью перекрывается с первой для замыкания в кольцо — типичную форму существования ДНК в бактериальных клетках) (рис. 8). Затем методами in vitro-рекомбинации (комплекс генно-инженерных методов, в основе которого — манипуляции in vitro, приводящие к образованию новых гибридных молекул ДНК) такие кассеты были собраны по четыре и в составе BAC-вектора (bacterial artificial chromosome, одна из форм передачи в клетку крупных фрагментов ДНК, в нашем случае — 10–20 т.п.н.) перенесены в E. coli для дальнейшей их наработки. (Дело в том, что без этапа многократного «размножения» в бактериях получить нормальные копии фрагментов «в пробирке» невозможно по ряду причин.)
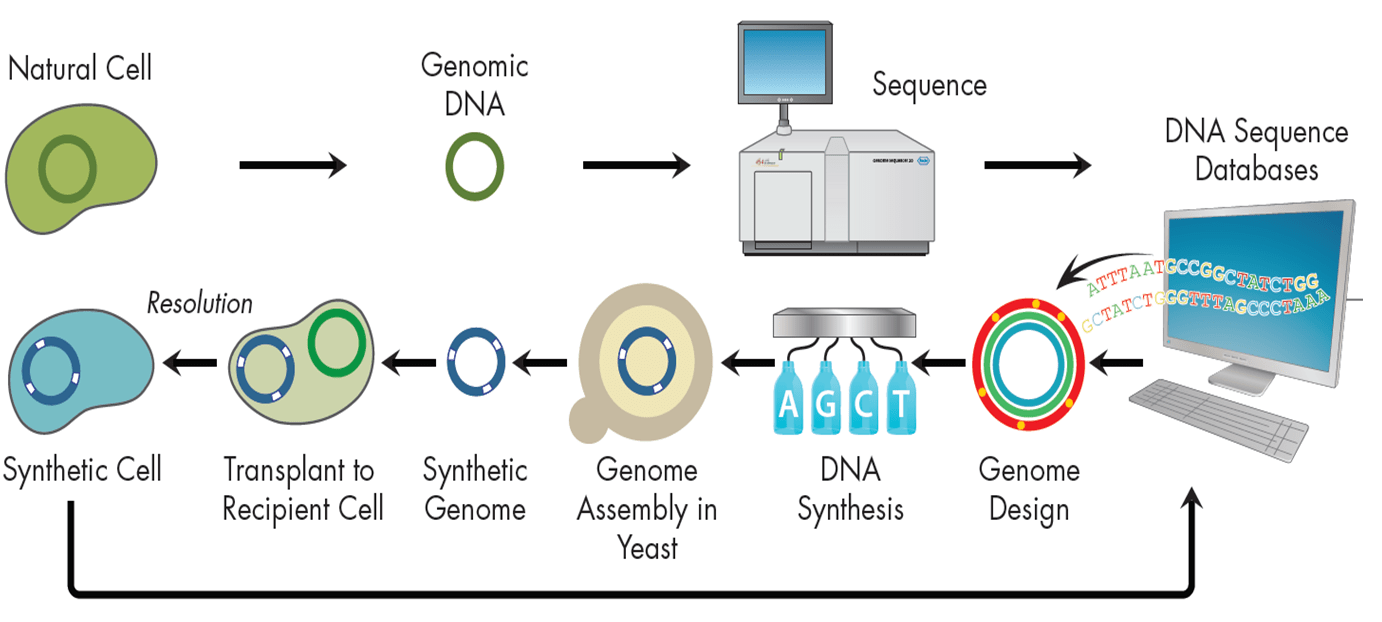
Рисунок 7. Общая схема синтеза организмов de novo.
В несколько этапов из таких модулей были собраны последовательности вплоть до вставок размером ¼ генома M. genitalium, после чего возникли трудности со сборкой бόльших по размеру фрагментов ДНК. Эта проблема была решена использованием TAR-вектора (специальный вектор для клонирования в дрожжевые клетки, «искусственная хромосома») и копированием конструкций в дрожжах S. cerevisiae. Выделение вектора со вставкой синтезированного генома и последующая аннотация последнего показали идентичность смоделированной на компьютере и полученной последовательностей.
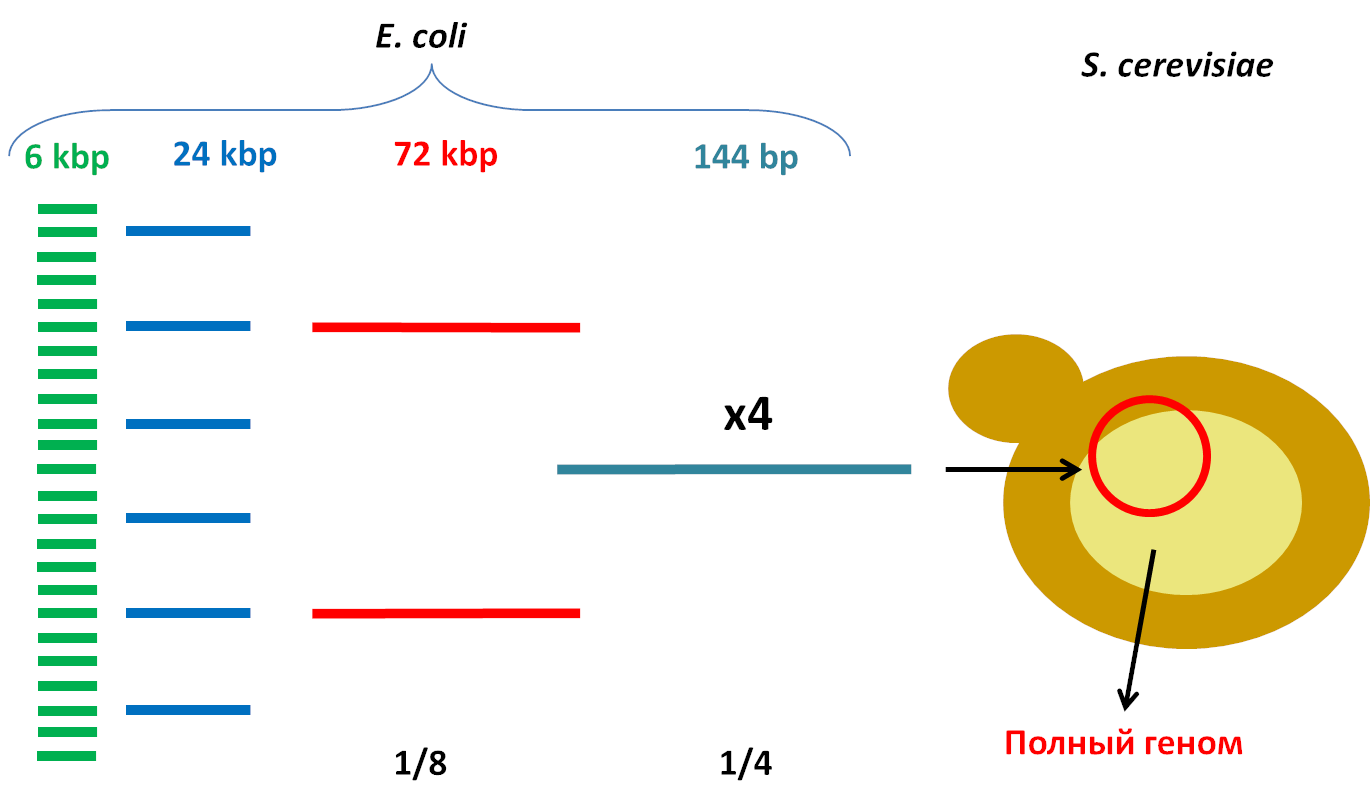
Рисунок 8. Схема сборки генома M. genitalium JCVI-syn1.0.
рисунок автора статьи
После этого похожим способом был синтезирован геном Mycoplasma mycoides (M. mycoides JCVI- syn1.0, рис. 9) [20], но, в отличие от предыдущего эксперимента, он был успешно трансплантирован в клетку-реципиент M. capricolum с получением жизнеспособной бактерии. Несмотря на природное происхождение плазматической мембраны и цитоплазмы, такие бактерии проявляли фенотипические признаки клеток M. mycoides. Данный эксперимент показывает функциональную релевантность искусственной хромосомы и процесс перехода от «программы» к ее «реализации».
Об этом подробно рассказано в статьях «Создано первое живое существо с синтетическим геномом» [21] и «Жизнь в эпоху синтетической жизни» [22]. — Ред.
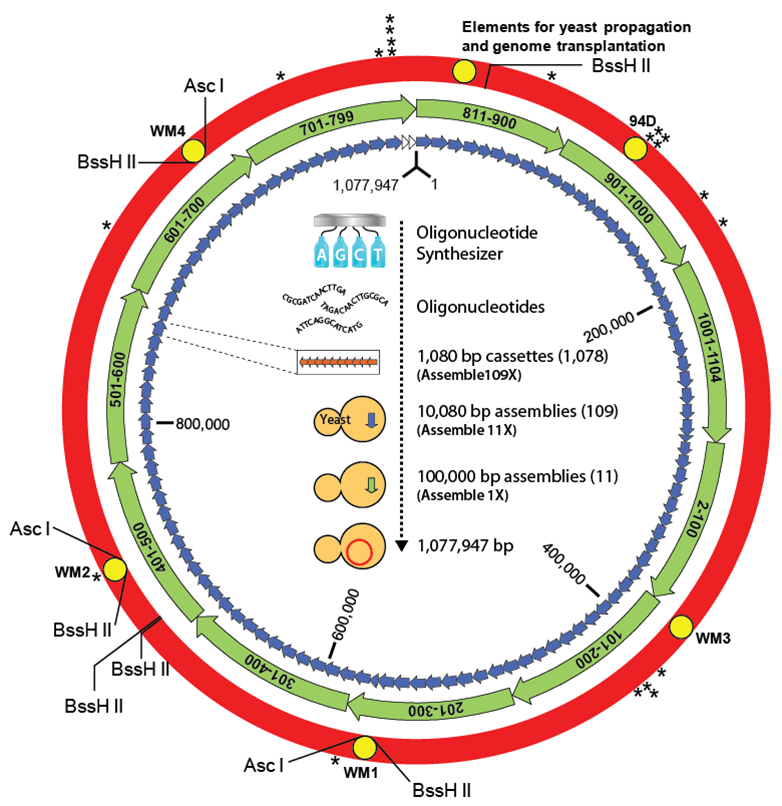
Рисунок 9. Схема сборки генома M. mycoides JCVI-syn1.0.
В настоящий момент экспериментаторы-«синтетики» ведут работы по минимизации размера генома M. mycoides JCVI-syn1.0, руководствуясь подходами, описанными ранее («выключение» генов в целом геноме или предсказание жизненно важных элементов и затем синтез de novo). Возможно, в скором времени число «синтетических» бактерий увеличится еще на одну, но на этот раз это будет не встречающийся в природе организм — упрощенный вариант своего природного аналога.
«Язык программирования» жизни
Создание контролируемой и отлаженной системы требует строгой типизации действий и четкого набора правил и инструкций; более того, наличие формализованного языка существенно повышает воспроизводимость результатов. Так, в 2011 году появляется «язык», на котором возможно «общаться» в контексте синтетической биологии — SBOL (Synthetic Biology Open Language) [23], чем-то напоминающий язык программирования. Он представляет собой набор стандартных компонентов (building blocks, строительных блоков), которые отражают различные генетические элементы (рис. 10). Их комбинация составляет генетические конструкты с определенными функциями, хранящиеся в виде библиотеки, благодаря чему можно пользоваться уже готовыми шаблонами (или конструктами) или уточнять их для своих нужд благодаря иерархичности языка. Таким образом, от задания последовательности нуклеотидов в геноме мы переходим к более высокому уровню сборки из комплекса последовательностей, связанных функциональной значимостью.
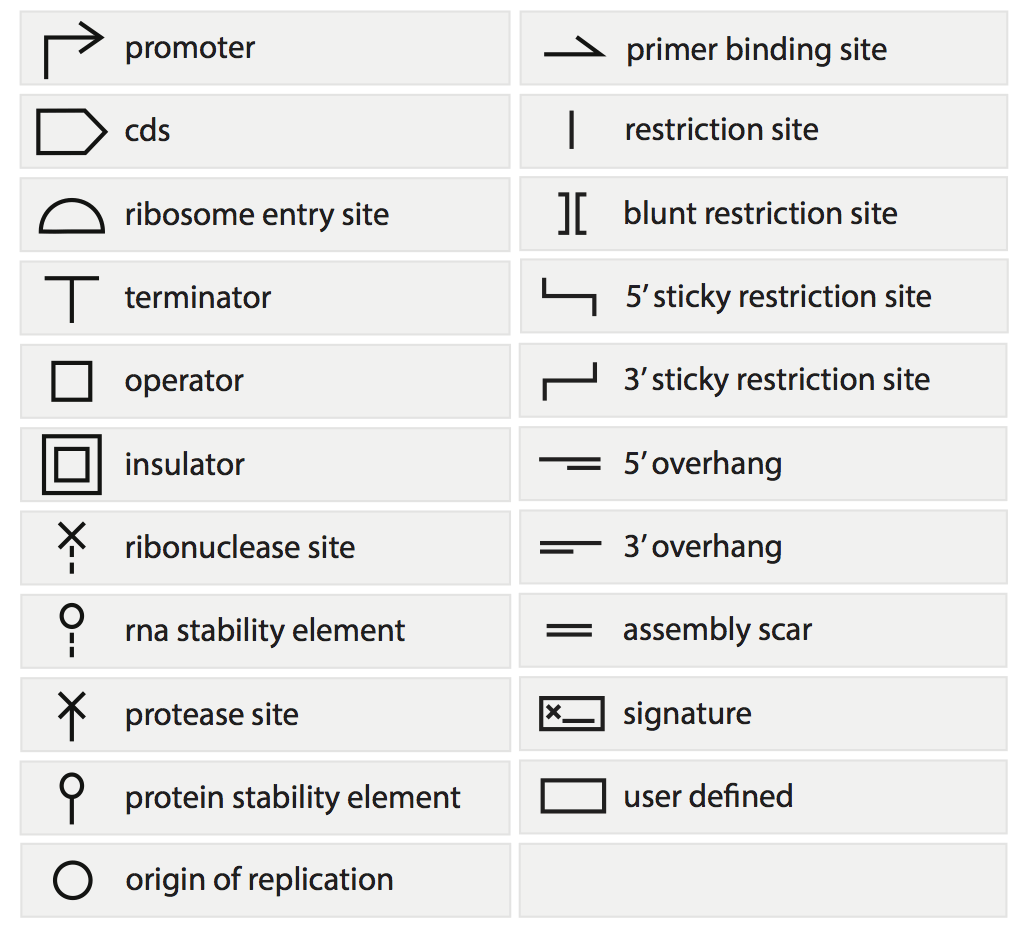
Рисунок 10. Графические элементы SBOL.
Камни преткновения
В связи со своей упрощенностью синтетические организмы очень требовательны к условиям роста, проигрывая в гибкости своим природным аналогам. Кроме того, значительно более медленный рост причиняет неудобства во время их изучения и практического использования (есть и обратный эффект [24]). Необходимость больших ресурсов для получения и исследования синтетических организмов также провоцирует определенные затруднения. Однако такие системы дают детальное представление о взаимодействии генов и гораздо больший контроль при добавлении различных биохимических путей. К сожалению, пока все исследования проведены на бактериях (в связи со сложностью эукариотических организмов: замысловатой эпигенетической регуляцией , большой длиной генома и особенностями его организации), хотя сейчас совместными усилиями многих ученых реализуется проект по синтезу генома дрожжей Saccharomyces cerevisiae (Synthetic Yeast 2.0) [25]. Если цель будет достигнута, то это однозначно станет новым прорывом в искусстве создания синтетической жизни — состоится переход от прокариотических организмов к эукариотическим, а в дальнейшем, возможно, и к многоклеточным существам.
Под этим термином понимают влияния на экспрессию генов, не затрагивающие последовательность нуклеотидов ДНК. Эпигенетические модификации хроматина просто определяют, как наследственную информацию нужно «считывать» — каким генам молчать, а каким — работать: «Развитие и эпигенетика, или история о минотавре» [26], «Катится, катится к ДНК гистон» [27]. Эти модификации порой не менее значимы для здоровья человека, чем нарушающие первичную структуру ДНК мутации: «Эпигенетические часы: сколько лет вашему метилому?» [28], «Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?» [29], «Пилюли для эпигенома» [30]. — Ред.
Прикладное значение
Получив модельную систему с заранее известными свойствами, ее можно усовершенствовать в зависимости от целей, которые стоят перед исследователем. Например, добавлять наборы генов, отвечающих за желаемые биохимические пути, в том числе комбинируя их так, чтобы получать новые, не встречающиеся в природе вещества [31]. Такие организмы могут стать потенциальными источниками энергии и продуцентами топлива, а также средством биоремедиации (очистки окружающей среды с помощью биологических объектов) [32], [33]. Они могут найти свое применение в генотерапии, а знание о жизненно необходимых для клетки генах может лечь в основу производства принципиально новых антибиотиков.
Заключение
Еще с давних времен люди пытались получить живое из неживого (см. Самозарождение), и если такие методы выглядят скорее как плод фантазии, то с развитием наук о живом и появлением молекулярной биологии стало накапливаться все больше истинных данных о функционировании живого организма и роли генома в нем. Вступив в эру геномных технологий и расшифровки ДНК, ученые получили ключевой инструмент для искусственного создания геномов, что стало предпосылкой к зарождению синтетической биологии. Но... для окончательной сборки генома и получения работающей системы все еще нужен другой живой организм, то есть по-прежнему справедливо «omnis cellula e cellula» («клетка происходит только от другой клетки», Рудольф Вирхов). Однако быстрое развитие ДНК-технологий и изучение систем искусственных клеток (artificial cells) [34], способных имитировать клеточное деление [35], дают надежду на то, что этому постулату в будущем будет предложена достойная альтернатива.
Теперь генетические инженеры могут орудовать не только «по-старинке» — in vitro, — но и прямо в живых объектах. Особую популярность приобрели системы редактирования ZFN, TALEN и CRISPR/Cas9, основанные на сайт-специфическом действии нуклеаз in vivo: «А не замахнуться ли нам на... изменение генома?» [36], «CRISPR-системы: иммунизация прокариот» [37], «Мутагенная цепная реакция: редактирование геномов на грани фантастики» [38]. Однако это не означает, что апокалипсис не за горами — контроль, контроль и еще много раз контроль (причем на законодательном уровне) никто не отменял. Зато победу над множеством тяжелейших недугов (и старостью?) это сулить может. — Ред.
Литература
- Геном человека: как это было и как это будет;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Секвенирование единичных клеток (версия — Metazoa);
- Разработан метод анализа экспрессии генов на уровне индивидуальных клеток;
- Код жизни: прочесть не значит понять;
- Смыслы «жизни»;
- Gardner T.S., Cantor C.R., Collins J.J. (2000). Construction of a genetic toggle switch in Escherichia coli. Nature. 403, 339–342;
- Флуоресцирующая Нобелевская премия по химии;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- «Нарисуем» живую клетку;
- Сайт сообщества исследователей и лабораторий Synthetic Biology;
- Mushegian A. (1999). The minimal genome concept. Curr. Opin. Genet. Dev. 9, 709–714;
- Zhang L.Y., Chang S.H., Wang J. (2010). How to make a minimal genome for synthetic minimal cell. Protein Cell. 1, 427–434;
- Mushegian A.R., Koonin E.V. (1996). A minimal gene set for cellular life derived by comparison of complete bacterial genomes. Proc. Natl. Acad. Sci. USA. 93, 10268–10273;
- Langridge G.C., Phan M.D., Turner D.J., Perkins T.T., Parts L., Haase J. et al. (2009). Simultaneous assay of every Salmonella Typhi gene using one million transposon mutants. Genome Res. 19, 2308–2316;
- Ji Y., Zhang B., Van S.F., Horn, Warren P., Woodnutt G. et al. (2001). Identification of critical staphylococcal genes using conditional phenotypes generated by antisense RNA. Science. 293, 2266–2269;
- Gil R., Silva F.J., Peretό J., Moya A. (2004). Determination of the core of a minimal bacterial gene set. Microbiol. Mol. Biol. Rev. 68, 518–537;
- Gibson D.G., Benders G.A., Andrews-Pfannkoch C., Denisova E.A., Baden-Tillson H., Zaveri J. et al. (2008). Complete chemical synthesis, assembly, and cloning of a Mycoplasma genitalium genome. Science. 319, 1215–1220;
- Геном, собранный вручную;
- Gibson D.G., Glass J.I., Lartigue C., Noskov V.N., Chuang R.Y., Algire M.A. et al. (2010). Creation of a bacterial cell controlled by a chemically synthesized genome. Science. 329, 52–56;
- Элементы: «Создано первое живое существо с синтетическим геномом»;
- Жизнь в эпоху синтетической жизни;
- Galdzicki M., Clancy K.P., Oberortner E., Pocock M., Quinn J.Y., Rodriguez C.A. et al. (2014). The Synthetic Biology Open Language (SBOL) provides a community standard for communicating designs in synthetic biology. Nat. Biotechnol. 32, 545–550;
- Juhas M. (2015). On the road to synthetic life: the minimal cell and genome-scale engineering. Crit. Rev. Biotechnol. 7, 1–8;
- Синтетическая хромосома;
- Развитие и эпигенетика, или История о Минотавре;
- Катится, катится к ДНК гистон;
- Эпигенетические часы: сколько лет вашему метилому?;
- Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?;
- Пилюли для эпигенома;
- Klein J., Heal J.R., Hamilton W.D., Boussemghoune T., Tange T.Ø., Delegrange F. et al. (2014). Yeast synthetic biology platform generates novel chemical structures as scaffolds for drug discovery. ACS 3, 314–323;
- Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области;
- Пределы биодоступности углеводородов в грунтах;
- Hammer D.A., Kamat N.P. (2012). Towards an artificial cell. FEBS Lett. 586, 2882–2890;
- Zhu T.F., Szostak J.W. (2009). Coupled growth and division of model protocell membranes. J. Am. Chem. Soc. 131, 5705–5713;
- А не замахнуться ли нам на... изменение генома?;
- CRISPR-системы: иммунизация прокариот;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики.