
Растения разумные: тайная жизнь зеленых существ
21 февраля 2024
Растения разумные: тайная жизнь зеленых существ
- 690
- 0
- 3
Иллюстрация, демонстрирующая разнообразие представителей растительного мира. Об этих и других удивительных растениях вы узнаете в статье. Слева: Nepenthes albomarginata (Непентес кувшинчиковый), справа: Utricularia vulgaris (Пузырчатка обыкновенная), снизу: Ophrys apifera (Офрис пчелоносная), сверху: Cuscuta pentagona (Повилика или Кускута), обвивающая томат.
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Мир растений удивителен и разнообразен. Какие тайны хранят загадочные зеленые существа? Они достаточно разумны, чтобы подобрать наилучший способ питания и получения необходимых веществ, даже если ради этой цели придется изобрести хитрые ловушки для насекомых и стать хищниками или же паразитами, нагло воруя ресурсы у других. Кроме того, растения научились сотрудничать с другими организмами на взаимовыгодных условиях и придумывать защитные механизмы для получения преимущества в коэволюционной гонке вооружений. Из этой статьи вы узнаете о некоторых интересных представителях флоры, которые успешно справились с такими непростыми задачами.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Наша планета является домом для всех живых организмов, среди которых преобладают растения, составляющие большую часть эукариотических существ на Земле. Тем не менее, изучение поведения и интеллекта на протяжении долгого времени было направлено на животных. Может показаться, что, по сравнению с животными, растения не столь интересны в подобных исследованиях. Ведь на первый взгляд они ничего не делают: не способны к восприятию окружающего мира и ответной реакции на него, да и вообще находятся только на одном месте. В момент опасности растение не сможет напасть или хотя бы убежать, как это делают представители фауны (в противном случае это было бы что-то из области фантастики!). И вообще, животные будто бы ближе для понимания и изучения, поскольку, как и мы, они имеют мозг, нервную систему, обладают органами чувств — носом, глазами и ушами... А растения кажутся нам такими далекими, их жизнь — настоящая загадка.
Однако зеленые существа намного сложнее и интереснее, если познакомиться с ними поближе и приоткрыть завесу этой тайны. Тогда можно узнать, что растения тоже обладают своего рода разумом. Они собирают информацию об окружающей среде, исследуют и распределяют разные ресурсы, производят оценку опасностей, формируют методы защиты против них и находят себе партнеров для продолжения рода. Причем некоторые растения научились все это делать с применением хитростей и необычных уловок, которые пригодились во всех аспектах жизни: от питания до собственной защиты.
Питание: «мясная» диета на земле и в воде
Как нам известно, в питании большей части растений нет ничего специфического. Листья могут поглощать углекислый газ и солнечный свет, а подземные органы — корни — способны всасывать влагу и питательные вещества. Так растения добывают минеральные соли, получая свою порцию азота и фосфора, что, в общем-то, необходимо и всем существам для жизни [1].
Наиболее удивительными являются случаи, когда обычного питания становится крайне мало. Именно тогда растения готовятся к охоте на насекомых, чтобы за счет белковой пищи восполнять потребность необходимыми элементами. Плотоядные растения завлекают свою добычу, ловят и убивают ее, вбирая недостающие вещества из переваренных тел. Весьма необычный способ поглощения пищи для автотрофов, не так ли? Этот тип питания эволюционно развивался в результате преобразования фотосинтетически активных листьев растений в специализированные органы, называемые ловушками.
Еще кое-что о плотоядных растениях можно узнать из статьи «Биомолекулы»: «Растения, которые делают „кусь!“» [2].
Где-то там, среди просветов вересковых лесов, живет искусный охотник — поразительный Непентес альбомаргината. (рис. 1) Эти кувшинчиковые растения произрастают в субстратах с дефицитом азота, так что им пришлось «обучиться» привлекать и отлавливать насекомых — термитов, неподалеку поедающих лишайники [3].

Рисунок 1. Все растения рода непентес Nepenthes отличаются широким межвидовым разнообразием, если брать в расчет форму, размер кувшинчика, окрас и индивидуальное пристрастие к пище — «белковую диету». Растение непентес альбомаргината N. albomarginata (а) довольствуется попавшими в свою ловушку термитами. А его более грозные собраты непентес Аттенборо N. attenboroughii (б) и непентес Палаваненсис N. palawanensis (в) настроены серьезнее: их сегодняшним обедом вполне может стать какой-либо неосторожный грызун, ящерица или птица [4].
фотографии с сайтов inaturalist.org и Wikimedia
Непентес имеет ловушки-чашечки — «внешние желудки», примерно наполовину наполненные мутной вязкой пищеварительной жидкостью, состоящей из белков и коктейля гидролитических ферментов для разложения добычи. Эти «резервуары» и есть хитрое приспособление для ловли насекомых [5].
По сравнению с другими плотоядными растениями, которые привлекают к себе внимание за счет причудливого яркого окраса, этот охотник решил не делать акцент на цвете. Интересно, что некоторые другие виды непентесов, обладающие красным или желтым окрасом, выделяют нектар и имеют сладкий аромат. У непентес альбомаргината — светло-зеленые кувшинчики, которые не сопровождаются видимым выделением нектара и не имеют запаха [3].
По размеру кувшинчик сравнительно небольшой, он может легко уместиться на ладони. А верхнюю часть зеленой чашечки аккуратно украшает бело-молочная каемка — полоса трихом (небольших «волосков»), из-за которой растение и получило свое название (на латинском albomarginata означает «белоокаймленный»). Может быть, с такими не слишком примечательными данными не выиграть конкурс красоты среди прочих плотоядных растений, но вполне возможно занять первое место по поеданию добычи! Действительно, что касается пищи, хищник из мира растений не довольствуется малым и отличается хорошим аппетитом: в его кувшинчике может содержаться от 1000 до 6000 особей термитов [1]!
Ободок из светлых трихом не просто так украшает чашечку непентеса. Такая ворсистая полоса уникальна: ее нет ни у одного другого вида! Съедобные трихомы имитируют лишайник, а прожорливые термиты толпами спешат отведать лакомство, суетливо пытаясь отхватить кусочек с этой каемки. (рис. 2) [6]. Среди большого скопления «народа» оголодавшие насекомые легко теряют равновесие, поскальзываются и скатываются в смертоносную чашу, содержащую смесь из пищеварительного сока и дождевой воды. Внутренняя поверхность кувшинчика очень скользкая, имеет восковой слой, вскарабкаться по ней невозможно и выхода уже не найти [1], [3].

Рисунок 2. Термиты, поедающие трихомы на непентесе. Что касается внешнего вида, то хищник непентес N. albomarginata решил не привлекать к себе особого внимания и выбрал сдержанный образ. Единственное украшение — бело-молочная каемка из трихом, которая выглядит простой только на первый взгляд. Она служит эффективной приманкой для многочисленных термитов, служащих ценной добычей для хитроумного растения. Термиты — одни из самых распространенных наземных беспозвоночных, а еще они являются наиболее богатым источником азота по сравнению с другой местной пищей (а). На некоторых непентесах светлая полоса поменяла цвет на коричневатый: здесь трапезничали насекомые. В последний раз (б) [6].
фотографии с сайтов nature.com и Wikimedia
Выдался отличный улов, и теперь растение может заняться перевариванием угодившей в ловушку добычи с помощью ферментов, содержащихся в жидкости кувшинчика. В течение нескольких недель стенки растения получат питательные вещества, а добытый азот поможет образоваться новым листьям. Кроме этого, непентесу нужно «подумать» над решением и другого вопроса: некоторую часть азота необходимо направить на производство и восстановление каемок, чтобы вновь заманивать жертв c помощью своего главного оружия... [1].
Коварный непентес альбомаргината ловко использует добытые ресурсы: откладывает их как на сегодняшний день, так и успешно инвестирует в будущее, умело просчитывая все доходы и расходы, оставаясь при этом в явном плюсе.
Все это — крайне вынужденная мера для выживания. Если почва не дает то, в чем нуждаются растения, они становятся хищниками и всеми возможными путями берут свое, используя различные изобретательные уловки для охоты на суше. Помимо этого, хищные растения обучились добывать себе животную пищу и под водой.
Пузырчатка (Utricularia) — род плотоядных растений, охотящийся на зоопланктон в прибрежных зонах озер. Пузырчатка засасывает добычу чрезвычайно быстро: не успеет пройти и нескольких миллисекунд, а жертва уже поймана! Высокоскоростной способ захвата стал удачным настолько, что в ходе эволюции возникли самые разнообразные виды пузырчатки. Один из этих видов —пузырчатка обыкновенная Utricularia vulgaris [1].
На поверхности озера, по соседству с плавающими листьями кувшинок, расположилась хищная пузырчатка. (рис. 3) Не имея корней, она плавает свободно и добавляет красок этой местности: вытянувшись из воды на голом стебле, пузырчатка обыкновенная демонстрирует ярко-желтые соцветия. (рис. 3а) Как и другие цветы, она мирно угощает своим нектаром насекомых. Интересующее нас отличие от других представителей цветов таится под водой [1].

Рисунок 3. (а) — пузырчатка среди кувшинок; (б) — ярко-желтые цветы пузырчатки; (в) — побеги пузырчатки с ловушками; (г) — хищное растение пузырчатка обыкновенная Utricularia vulgaris.
фотографии с сайтов inaturalist.org и Wikimedia
Именно там находятся густые заросли из достаточно длинных побегов, покрытых рассеченными листьями, на которых усеяны крохотные полупрозрачные пузырьки-ловушки вытянутой формы (рис. 3в и 3г). Изнутри пузырьки имеют железы, выделяющие ферменты для расщепления белков и фосфатов, что обеспечивает скорейшее переваривание зоопланктона. На ловчем пузырьке есть отверстие и специальный клапан, который регулирует открытие и закрытие этого отверстия. Его область покрывают чувствительные волоски. Если, к примеру, любопытная дафния слегка дотронется до них, это малейшее касание приведет к открытию клапана и, как следствие, мгновенному засасыванию водяной блохи в капкан [1], [7].
У дафнии не хватило бы сил сопротивляться стремительному потоку воды, который вталкивает ее в ловушку. К тому же, блоха не сможет выбраться оттуда наружу, ведь клапан закрывается очень надежно. Ловушка работает благодаря осмотическому давлению, которое создается пузырьками по окончании переваривания предыдущей жертвы. Пузырьки выкачивают жидкость, и их стенки переходят в сжатое состояние, таким образом подготавливая капкан к очередной охоте. Принесенная потоками воды пища обеспечивает пузырчатку всеми необходимыми веществами в таком количестве, что растение может позволить себе не иметь корней и беспечно перемещаться по озеру в поиске новых заключенных для своей ловушки [1], [7].
Исследуя разнообразные, хитрые, затейливые ловушки и способы отлова добычи, можно сделать вывод, что в процессе эволюции растения превратились в умных высококлассных охотников. Бесспорно, каждое хищное растение — сложный и поразительный организм, тихо выжидающий, когда добыча добровольно угодит в капкан.
Однако растению не в силах изменить охотничью тактику, выбрав на сегодня новый вариант ловли жертв. Было бы странно ожидать этого от представителей флоры, ведь растения не мыслят в привычном для нас понимании. Способность к какому-либо выбору является сложным когнитивным механизмом, что присуще лишь высшим животным. Тем не менее, среди зеленых существ нашлись и такие, которые, на удивление, демонстрируют принятие решения по поводу своего существования и каким-то невероятным образом делают выбор в питании и дальнейшей жизни.
Паразитизм: за все ресурсы «платит» другой!
Известно, что есть организмы, которые идут по нечестному пути, существуя и питаясь за счет других, не предлагая взамен ничего. Среди растений тоже найдутся любители красть чужие ресурсы. Растения-паразиты получают питание из растений-хозяев, поддерживая в них жизнь лишь для того, чтобы выжить самому.
Растения рода Cuscuta — стеблевые голопаразиты, не имеющие корней и полностью сформировавшихся листьев, а их вегетативная часть представляет собой только стебель. Каждый молодой побег кускуты ставит перед собой жизненно важную цель — как можно быстрее выбрать растение-хозяина, ведь он не может выживать в одиночку длительный период времени [8].

Рисунок 4. Томат и растение Cuscuta pentagona. Побег повилики находит молодой куст томата и обвивается вокруг него (снизу); томат, зараженный растением Cuscuta pentagona (сверху). Томат производит следующие летучие терпеноиды: α-пинен, β-мирцен и β-фелландрен. Они являются хемоаттрактантами для кускуты. По притягательному пахучему следу повилика определяет, в какой стороне находится томат, чтобы виться и расти в его направлении.
Для кускуты пятиугольной Cuscuta pentagona лучшим хозяином окажется томат. Чтобы избежать гибели, в кратчайшие сроки, побег должен встретиться с намеченной целью (рис. 4). Почему же у повилики настолько сжатые сроки? Нетерпеливому растению некогда ждать, когда пища прибудет сама, как это делают, к примеру, непентесы и пузырчатки, поэтому на поиски нужно отправляться самому. Свои запасы питательных веществ и энергии паразит расходует примерно за три дня, по причине того, что их содержание в семенах ограничено, а способность к фотосинтезу крайне слаба. Все силы направлены исключительно на интенсивный рост в длину, чтобы добраться до хозяина [8], [9].
Когда ползучий стебель все же наткнется на куст томата, можно считать, жизненная цель подрастающего паразита выполнена, выбор хозяина сделан. Теперь можно спокойно существовать и, как вампир, вытягивать соки из растения-хозяина.

Рисунок 5. Ближайший родственник паразита C. pentagona — растение C. australis.
1, 2 — пророщенный побег C. australis, который нашел хозяина — дикий томат Solanum pennellii (3, 4) и образовал частичную гаусторию (3).
5, 6 — цветки и семенные коробочки, соответственно.
Найдя томат, паразит обвивается вокруг него и проникает в его стебли через особые присоски — гаустории, развивающиеся из специальных нитевидных клеток, называемые поисковыми гифами. Они контактируют с сосудистой тканью томата для выведения воды, углеводов и прочих растворенных веществ, которые пойдут на собственные нужды (рис. 5). Кускута ищет именно томат, разборчиво «принюхиваясь» среди всех витающих в воздухе ароматов, чтобы уловить нужный. У растений нет обоняния, но своего зеленого хозяина повилика находит по запаху! Паразит улавливает сигналы — летучие соединения для распознавания местоположения томата [8], [10].
С помощью несложного аромаэксперимента можно это подтвердить. Для начала летучие вещества томата-хозяина извлекают из отфильтрованного воздуха в системе сбора летучих веществ. Затем ползучий молодой побег располагают между двумя резиновыми флаконами, один из которых содержит выделенные из томата концентрированные «духи», а другой флакон остается ничем не заполненный. Паразит проявляет активный интерес к сосуду, который оставляет ароматический след, ожидаемо игнорируя пустой. Не подозревая, что ее обманули, повилика движется по направлению к флакону, издающему запах. Цепкое растение тянется к нему точно так же, как если бы вместо резиновой чаши был настоящий куст томата (рис. 6) [1], [9].
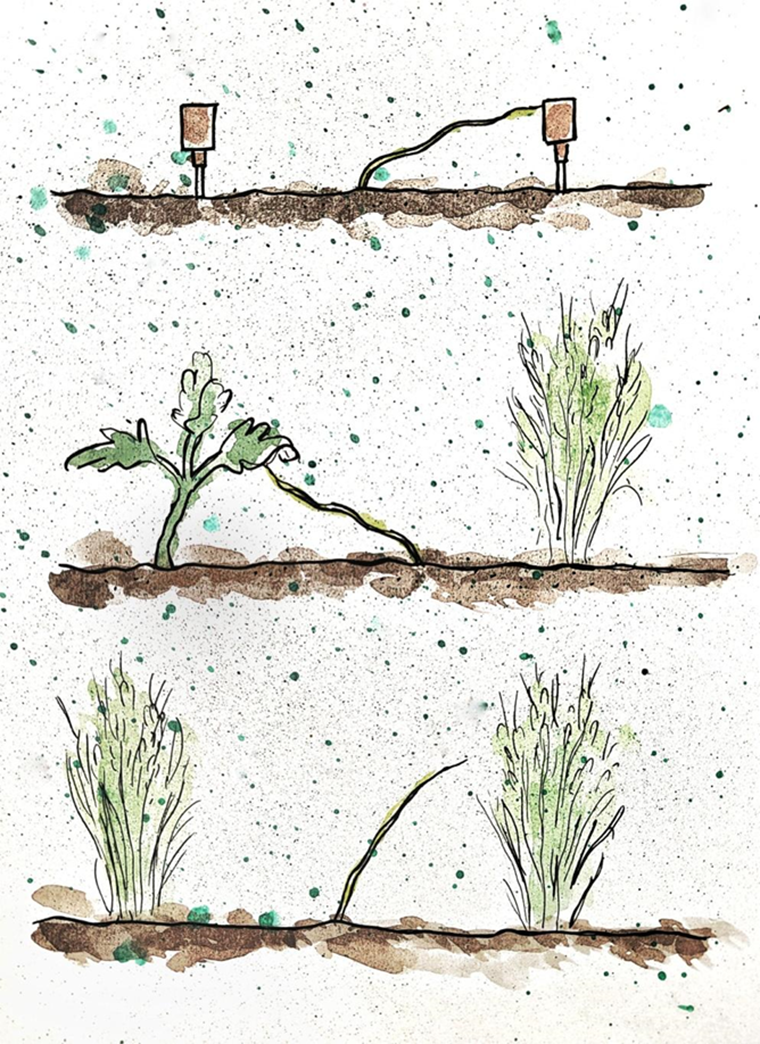
Рисунок 6. Серия экспериментов, демонстрирующая тот факт, что повилика находит растение-хозяина по запаху.
Изображение сверху — повилика тянется к флакону, издающий запах томата.
В центре — между пророщенной пшеницей и молодым кустом томата повилика выбирает томат.
Снизу — повилике приходится выбирать из того, что имеется: она тянется к пшенице.
Интересно, что повилика распознает аромасигналы от растений-хозяев и растений, не являющихся таковыми. Если прорастить кускуту на одинаковом расстоянии от томата и пшеницы, то растение делает выбор в отношении любимого блюда, демонстрируя направленный рост к своему хозяину. Поставив еще один эксперимент, можно понаблюдать за поведением ползучего стебля, если вокруг него оставить только пшеницу. В этом случае паразит решит, что пшеница лучше, чем совсем ничего и прикрепится к злаку. Без хозяина кускута погибнет, поэтому приходится довольствоваться тем, что есть, и поскорее добирается до ближайшей пшеницы (рис. 6) [1], [9].
Подводя итог вышесказанному, можно сделать вывод о том, что повилика способна различать летучие вещества томата среди окружающих растений, выбирая лучшее питание для себя.
Личная защита: стражи из животного мира
В погоне за лучшим питанием важно самим не стать чьим-то обедом. Поэтому, как все живые организмы, зеленые существа тоже используют защитные стратегии от нападений. Чтобы не быть съеденными, растения «придумали» разного рода методы борьбы с врагами.
Некоторые виды акаций могут похвастаться наличием механической защиты от травоядных млекопитающих — острыми шипами длиной в несколько сантиметров, которые не дают животным добраться до сочных листьев. При этом острые, словно иглы, колючки не спасут растение от наступлений насекомых. Однако шипы — это только первая линия обороны. Усиленная мера защиты кроется внутри этих колючек. В них обустроили себе жилище муравьи, оберегающие акацию от повреждений, которые могут нанести позвоночные и беспозвоночные животные (рис. 7) [11], [12].
Муравьи отпугивают вредителей, а растение любезно предоставляет своим помощникам пищу, место для проживания и выращивания потомства. Как только вторжение на муравьиную территорию было замечено, стражи оперативно реагируют на чужака. Они агрессивно набрасываются и впиваются жалом в нарушителя, защищая акацию (рис. 8) [11], [12].

Рисунок 8. Муравьи-защитники акации и козел.
(а) — муравьи Crematogaster mimosae, поглощающие внефлоральный нектар растения Acacia zanzibarica;
(б) — муравьи C. mimosa, исследующие ветви в поисках возможного чужака на их территории;
(в) — козел, потревоживший акацию. Муравьи уловили механические вибрации, созданные животным, и напали на козла, чтобы отпугнуть его. Кроме механических вибраций, муравьи способны улавливать и химические сигналы. Когда травоядное животное повреждает ветви или листья акации, происходит выделение летучих веществ растения. В этом случае нарушителя можно обнаружить по запаху. Другие химические сигналы — феромоны тревоги, которые используются муравьями для передачи информации о нападении. Однако химические сигналы не всегда являются настолько действенными, как механические. Скорость распространения всех летучих веществ напрямую зависит от воздушных потоков и диффузии. Распространение химических сигналов бывает медленным, к тому же порой неэффективным, поскольку они могут просто не дойти до муравьев, находящихся на наветренной стороне акации.
Муравьи узнают о вторжении благодаря передаче вибрации от растений, поступающей со стороны травоядных животных. Удивительно, что охранники различают вибрации, вызванные непрошеными гостями от вибраций, созданных ветром. Такой сигнал распространяется по всем веткам акации, активируя защитное поведение живущих на растении муравьев. Они способны определить, в каком направлении двигаться и атаковать [11], [12].
Растение добросовестно выполняет свою часть «сделки» и за эффективную работу «вручает» богатую углеводами награду — экстрафлоральный нектар (вырабатываемый растением вне цветка). Лучших условий для сотрудничества муравьям не найти: и еда, и дом, причем все это находится в одном месте! Муравьи очень внимательные охранники, которые стараются никого не подпускать к своему жилищу (рис. 9).

Рисунок 9. Мультяшная иллюстрация, демонстрирующая категоричность муравьев ко всему, что вторгается на их пространство: даже посыпанные на растение сахаринки будут сразу же удалены. Отличная охрана, не пролезет даже изворотливая кускута!
рисунок автора статьи по материалам [1]
Тем не менее, растение иногда нуждается и в других насекомых. Например, во время цветения акация была бы рада пригласить гостей для перекрестного опыления [13].
Посетители цветов действуют по определенному суточному графику. У акаций значительная часть пыльцы собирается одиночными пчелами. Они начинают проявлять активность утром, во время первого распускания цветов (8:00–9:00 ч), а пик сбора пыльцы приходится на позднее утро и дневное время (11:00–14:00 ч). За несколько часов пчелы успевают собрать большое количество пыльцы [13]!
Муравьи-стражи также проявляют активность по графику, патрулируя ветви акации в конкретное время. Количество муравьев, исследующих растение, обычно снижается утром (с 9:00 до 10:00 ч), а увеличивается чаще во второй половине дня (лишь изредка несколько особей могут пробегать по ветвям и до 14:00 ч) [13].
Так, графики работы стражей и собирателей пыльцы зачастую приходятся на разное время, что позволяет пчелам посещать цветы, снижая вероятность встречи насекомых.
Активность муравьев еще зависит от возраста цветов. В период раннего утра муравьи патрулируют старые или еще нераскрывшиеся бутоны, избегая молодых цветов. Но в некоторых случаях стражи задерживаются около них на несколько секунд, если распустившийся цветок встретится на пути. Конечно, муравьи бы отреагировали на гостей акации, но в такое время (7:00–10:00 ч) опыляемые пчелами цветы встречаются реже [13].
При возрастании активности патруля во второй половине дня молодые цветы посещаются дольше, чем утром (рис. 10). Такая модель поведения обусловлена тем, что только молодые цветы способны отпугнуть муравьев при своем первом утреннем распускании с помощью кратковременного химического сигнала [13].
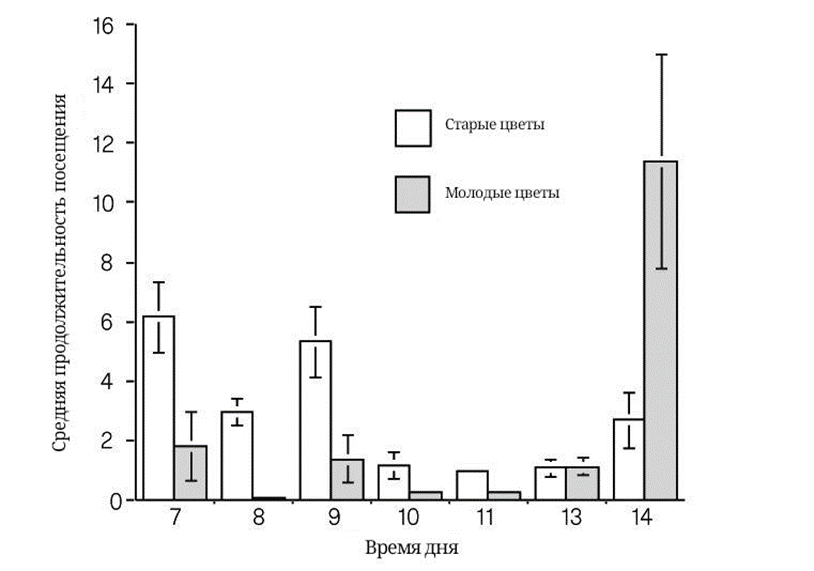
Рисунок 10. Продолжительность посещений молодых и старых цветков в течение суток на протяжении четырех дней (взяты средние значения с учетом погрешностей).
Некоторые виды акаций содержат отпугивающий муравьев нектар, но у растения акации Acacia zanzibarica количество нектара невелико. В этом случае «цветочный репеллент» находится на поверхности венчика или даже в пыльце.
Таким образом, муравьи способствуют опылению акации тем, что не «трогают» молодые цветы, а своим временным отсутствием позволяют опылителям добраться до цветов. Дальше, по муравьиному графику, стражи возвращаются к патрульной должности, отпугивая насекомых, питающихся цветами или семенами [13].
Количество муравьев на ветвях одной акации в период ее цветения и плодоношения имеет прямую связь с зарождением семян. Численность страж на одной отдельно взятой ветке является достаточно фиксированной, учитывая распределение количества модифицированных муравьиных домиков-колючек и их приблизительные размеры. В проведенном исследовании установлена взаимосвязь численности муравьев и количества завязей плодов на соцветиях акации (рис. 11). Как оказалось, ни один из разных факторов, не имеющих отношения к муравьям, не является существенным для завязывания плодов [13]!
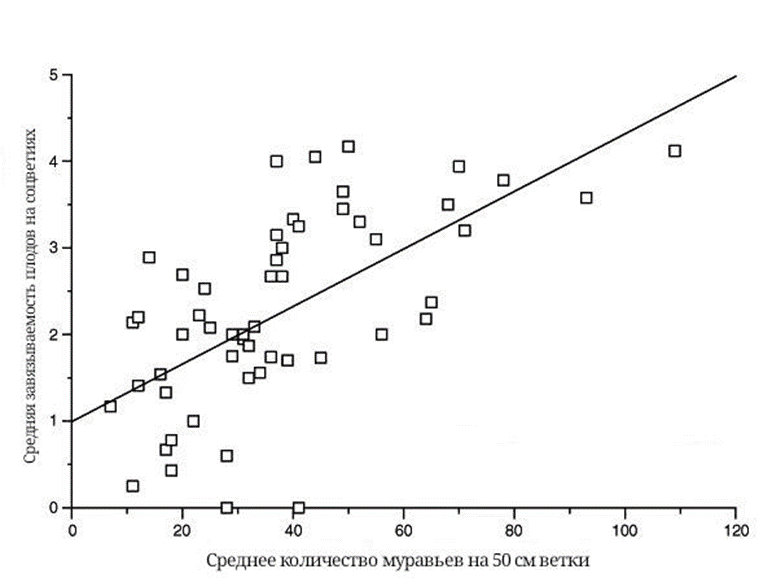
Рисунок 11. Количество муравьев на ветку по пять ветвей на каждом из одиннадцати взятых деревьев. Завязывание семян оценивалось на ветках одинаковой длины.
Установленный мутуализм между муравьями и акацией играет важную роль в жизни этих существ. Без нее муравьи не смогли бы выжить, а растение подвергалось бы систематическим нападениям травоядных животных, что увеличило бы повреждения листьев и цветков, снизив количество плодов [11], [13].
Помимо союзников из животного мира, зеленые существа могут использовать химическое оружие для собственной защиты от насекомых-вредителей.
Растения и насекомые живут вместе более 350 млн лет. В процессе коэволюции они усердно вырабатывали непростые стратегии для избегания защитных систем друг друга. Такая эволюционная гонка вооружений между растениями и насекомыми привела к развитию у зеленых существ разных механизмов защиты, которые могут считывать сигналы от повреждений и наносить «ответный удар», чтобы противостоять им [14].
Среди пустыни трудно не заметить молодую зелень дикого табака, привлекающую к себе внимание травоядных насекомых. В предвкушении сочного угощения они набрасываются на растение, обгладывая табачные листья один за другим. Однако табак не терпит нападения и дает отпор голодным насекомым [1].
У растения ответной реакцией является выработка и активация защитных механизмов — ядовитых для многих животных веществ, которые снижают пригодность растительных тканей в качестве пищи. Табак содержит пиридиновый алкалоид никотин. Он может взаимодействовать с ацетилхолиновыми рецепторами в нервной системе животных, поэтому является чрезмерно токсичным для большей части травоядных организмов [15].
Прежде чем начнется производство никотина, в ответ на укусы насекомых высвобождается растительный гормон — жасмоновая кислота , служащая сигналом о повреждении.
Про жасмонаты и жасмоновую кислоту можно почитать в статье «Биомолекулы»: «Жасмонаты: „слезы феникса“ из растений» [16].
Жасмоновая кислота вырабатывается из линоленовой кислоты. Помимо того, что жасмоновая кислота является важным сигналом, регулирующим защиту растения от травоядных животных, она выполняет разные функции в его жизни и развитии: образование цветков и пыльцы, рост корней и образование придаточных корней, старение, защита от патогенов и пр. [17], [18].
Жасмоновая кислота быстро накапливается в механически поврежденных тканях табака, что служит сигналом для производства защитного метаболита против атакующих насекомых. Никотин эффективно помогает растению отбиться от нашествия насекомых, однако некоторые из них все же имеют иммунитет к этому токсину. Гусеница бражника Manduca sexta переносит смертельные для других неадаптированных травоядных дозы никотина, питаясь табаком. Поедая растение, слюна насекомого смешивается с пережеванными листьями. По слюне табак «узнает» своего врага и выбирает новую тактику для борьбы с вредителем. Растение ограничивает производство никотина, экономя ресурсы, ведь против гусеницы токсин все равно не подействует. Поэтому после сигнала о повреждении происходит накопление ингибитора протеазы — вещества, направленного на разрушение пищеварительных ферментов гусеницы, замедления ее роста и развития. Помимо этого, табак выделяет летучие соединения в виде шестиуглеродных альдегидов, спиртов и их сложных эфиров, что привлекает естественных врагов насекомого. На такие химические крики о помощи откликается большеглазый жук Geocoris pallens, который охотится на гусениц M. Sexta (рис. 12) [17], [19], [20].

Рисунок 12. Дикий табак использует целый набор инструментов против нападений травоядных насекомых — прямых и косвенных механизмов защиты. Косвенная (непрямая) защита подразумевает выделение летучих химических веществ, которые привлекли жука Geocoris pallens. Жук (внизу слева) готовится к нападению на личинок гусеницы.
Высвобождение летучих соединений является механизмом непрямой защиты, который привлекает хищников и паразитов для устранения вредителя. Такого типа сигнализация увеличивает поедание травоядных насекомых хищниками, тем самым увеличивая возможность растений к размножению и приспособлению. А прямая защита — выделение белков-ингибиторов протеаз — недостаточно эффективна, чтобы растение применяло ее отдельно [19].
Без насекомых-союзников растениям пришлось бы гораздо сложнее. Муравьи защищают свою акацию — источник пищи и дом, а большеглазый жук спешит на зов о помощи и получает питательную награду. Все это благодаря придуманным растениями стратегиям защиты и системе поощрения: они знают, что дать своим помощникам взамен. Охрана растений и уничтожение их вредителей позволяет зеленым существам спокойно расти, развиваться и размножаться.
Дела любовные: размножение с помощью обмана
Растения разработали гениальные планы по отлову добычи, создав необычные ловушки, умело приспособились к сотрудничеству с животными миром, чтобы иметь отличную защиту, выискивали наилучшее питание для получения необходимых веществ. Помимо этого, все зеленые существа должны позаботиться и о продолжении своего рода. Некоторые представители флоры даже в этом деле проявили изобретательность и хитрость.
При цветении орхидеи поступают крайне нечестно: растения имитируют половые феромоны и внешний вид самки пчелы, привлекая самцов для опыления (рис. 13). Феромоны являются видоспецифичными: каждый вид насекомых-опылителей привлекает разный набор ароматических соединений. Благодаря такой специфичности — уникальному запаху — коварные орхидеи, маскирующиеся под самку, стараются поддерживать собственную репродуктивную изоляцию от близких видов орхидей [21–23].
При попытке спариться с «самкой» самец собирает головой поллинарии орхидеи, которые после передадутся другому растению (рис. 14). Для орхидеи такой вид отношений идет только на пользу, в отличие от пчелы, которая осталась ни с чем [24].

Рисунок 13. Разные виды орхидей-офрисов, которые внешне имитируют самку пчел. Их лабеллумы покрыты волосками, которые очень похожи на ворсинки настоящих насекомых. На фото — Ophrys apifera.
Цветочные визуальные сигналы — цвет и форма околоцветника — являются одними из самых приметных опознавательных признаков для опылителей. Но визуальные сигналы продуктивнее работают вместе с обонятельными, ведь такое совместное действие разных сигналов повышает уровень привлечения опылителей к растениям [21].
Если помимо привлекательного внешнего вида и запаха растения предложат щедрое вознаграждение, насекомые с большей эффективностью осуществят перенос пыльцы и опыление. Однако цветы, ничего не предлагающие в награду насекомым, опыляются реже, чем те, которые любезно угощают сладким нектаром. Может показаться, что обман — не самая лучшая тактика для орхидей [23].
Тем не менее, репродуктивный успех орхидей не измеряется одним лишь производством семян. В противном случае такой подход к опылению не был бы настолько распространенным, а орхидей ждала бы неудача в эволюционной гонке.
Эти цветы выбрали другой подход к вопросу о семенах, ведь за счет избегания инбридинга повышается качество семян, а не их количество. Не получив желаемого, обманутые и разочарованные пчелы улетят с пыльцой в поисках настоящей самки подальше от коварного цветка, снизив вероятность близкородственного опыления предыдущей орхидеи. Отлетев на другой участок с цветами, ищущая пару пчела может вновь «очароваться» другой орхидеей, пахнущей точно как самка (но при этом ее аромат сильнее и привлекательнее!) [23].
Обонятельные сигналы, вырабатываемые орхидным лабеллумом, способны действовать как аттрактанты на дальние расстояния, заманивая самцов пчел. Химические анализы показали, что цветки орхидей образуют сложные многосоставные смеси из соединений, среди которых есть компоненты метаболизма жирных кислот (алканы и алкены) [21], [25], [26].
Приблизившись к цветку, обонятельные сигналы стимулируют самцов к пседокопуляции с лабеллумом. При попытке спаривания пыльца, полученная от первой орхидеи, попадает на рыльце пестика второй орхидеи, что обеспечит опыление.

Рисунок 14. Самец пчелы Andrena nigroaenea с желтым орхидным поллинарием на голове, который пытался совокупиться с орхидеей Ophrys lupercalis. Орхидеи отличаются от других однодольных растений тем, что имеют поллинарии, представляющие собой образования, состоящие из пыльцевых зерен. Они компактно упакованы в поллинии и висцидиум вместе со стеблем поллиния. Висцидиум играет важную роль в передаче поллинария опылителю: он выделяет липкое вещество, которое приклеивает поллинарий к пчеле для переноса следующему цветку орхидеи.
Такой обман эволюционно мог развиться у этого вида растений путем модификации систем, которые растения использовали для выработки своих собственных соединений. При каждом изменении соотношения и комбинаций соединений в своем запахе, и, как следствие, увеличении посещаемости опылителей, орхидеи получали большее репродуктивное преимущество [21].
На протяжении миллионов лет зеленые существа создавали вокруг себя среду обитания, в которой могли развиваться и животные. Среди всех многоклеточных организмов только растения имеют способность к преобразованию солнечного света в органические вещества посредством фотосинтеза. За счет этого они могли быть более свободны по сравнению с другими организмами, которые полностью зависели от растений, производящих пищу и кислород. Но задачи растений не так просты. Для сохранения и своей жизни им приходилось подстраиваться под различные факторы окружающей среды и разрабатывать сложные стратегии под руководством эволюции и естественного отбора. Они «поведали» зеленым существам секреты о различных способах размножения и питания, научились создавать замысловатые ловушки, манипулировать, обманывать, красть, сотрудничать с животными и звать на помощь.
Литература
- Арцт Ф. Умные растения. М.: «Ломоносовъ», 2013. — 240 с.;
- Растения, которые делают «кусь!»;
- Laurence Gaume, Vincent Bazile, Maïlis Huguin, Vincent Bonhomme. (2016). Different pitcher shapes and trapping syndromes explain resource partitioning in Nepenthes species. Ecology and Evolution. 6, 1378-1392;
- Sabulal Baby, Anil John Johnson, Elavinamannil Jacob Zachariah, Abdul Azeez Hussain. (2017). Nepenthes pitchers are CO2-enriched cavities, emit CO2 to attract preys. Sci Rep. 7;
- Sandy Rottloff, Sissi Miguel, Flore Biteau, Estelle Nisse, Philippe Hammann, et. al.. (2016). Proteome analysis of digestive fluids inNepenthespitchers. Ann Bot. 117, 479-495;
- Ulrike Bauer, Walter Federle, Hannes Seidel, T. Ulmar Grafe, Christos C. Ioannou. (2015). How to catch more prey with less effective traps: explaining the evolution of temporarily inactive traps in carnivorous pitcher plants. Proc. R. Soc. B.. 282, 20142675;
- Olivier Vincent, Philippe Marmottant. (2011). Carnivorous Utricularia: The buckling scenario. Plant Signaling & Behavior. 6, 1752-1754;
- Bettina Kaiser, Gerd Vogg, Ursula B. Fürst, Markus Albert. (2015). Parasitic plants of the genus Cuscuta and their interaction with susceptible and resistant host plants. Front. Plant Sci.. 6;
- Mark C. Mescher, Justin Runyon, Consuelo M. De Moraes. (2006). Plant Host Finding by Parasitic Plants. Plant Signaling & Behavior. 1, 284-286;
- Megan LeBlanc, Gunjune Kim, Beneeta Patel, Verlyn Stromberg, James Westwood. (2013). Quantification of tomato and Arabidopsis mobile
RNA s trafficking into the parasitic plant Cuscuta pentagona. New Phytologist. 200, 1225-1233; - Felix A. Hager, Kathrin Krausa. (2019). Acacia Ants Respond to Plant-Borne Vibrations Caused by Mammalian Browsers. Current Biology. 29, 717-725.e3;
- Peggy S.M. Hill. (2019). Biotremology: We Fight for Food. Current Biology. 29, R209-R212;
- P. G. Willmer, G. N. Stone. (1997). How aggressive ant-guards assist seed-set in Acacia flowers. Nature. 388, 165-167;
- Abdul Rashid War, Michael Gabriel Paulraj, Tariq Ahmad, Abdul Ahad Buhroo, Barkat Hussain, et. al.. (2012). Mechanisms of plant defense against insect herbivores. Plant Signaling & Behavior. 7, 1306-1320;
- Anke Steppuhn, Klaus Gase, Bernd Krock, Rayko Halitschke, Ian T Baldwin. (2004). Nicotine's Defensive Function in Nature. PLoS Biol. 2, e217;
- Жасмонаты: «слёзы феникса» из растений;
- Variluska Fragoso, Eva Rothe, Ian T. Baldwin, Sang‐Gyu Kim. (2014). Root jasmonic acid synthesis and perception regulate folivore‐induced shoot metabolites and increase Nicotiana attenuata resistance. New Phytologist. 202, 1335-1345;
- Youngjoo Oh, Ian T. Baldwin, Ivan Galis. (2013). A Jasmonate ZIM-Domain Protein NaJAZd Regulates Floral Jasmonic Acid Levels and Counteracts Flower Abscission in Nicotiana attenuata Plants. PLoS ONE. 8, e57868;
- John Pickett. (2012). Indirect routes to reproductive success. eLife. 1;
- Nan Qu, Ursula Schittko, Ian T. Baldwin. (2004). Consistency of Nicotiana attenuata's Herbivore- and Jasmonate-Induced Transcriptional Responses in the Allotetraploid Species Nicotiana quadrivalvis and Nicotiana clevelandii. Plant Physiology. 135, 539-548;
- Demetra Rakosy, Martin Streinzer, Hannes F. Paulus, Johannes Spaethe. (2012). Floral visual signal increases reproductive success in a sexually deceptive orchid. Arthropod-Plant Interactions. 6, 671-681;
- Florian P. Schiestl, Manfred Ayasse, Hannes F. Paulus, Christer Löfstedt, Bill S. Hansson, et. al.. (1999). Orchid pollination by sexual swindle. Nature. 399, 421-421;
- Heidi Ledford. (2007). The flower of seduction. Nature. 445, 816-817;
- Nicolas J Vereecken, Salvatore Cozzolino, Florian P Schiestl. (2010). Hybrid floral scent novelty drives pollinator shift in sexually deceptive orchids. BMC Evol Biol. 10, 103;
- Manfred Ayasse, Stefan Dötterl. (2014). The role of preadaptations or evolutionary novelties for the evolution of sexually deceptive orchids. New Phytologist. 203, 710-712;
- Marc Thielen, Dagmar Voigt, Friederike Gallenmüller, Thomas Speck, Stanislav Gorb. (2021). “Push and Pull”: Biomechanics of the Pollination Apparatus of Oncidium spp.. Front. Mech. Eng.. 6.








