Жасмонаты: «слёзы феникса» из растений
23 ноября 2018
Жасмонаты: «слёзы феникса» из растений
- 3296
- 0
- 11
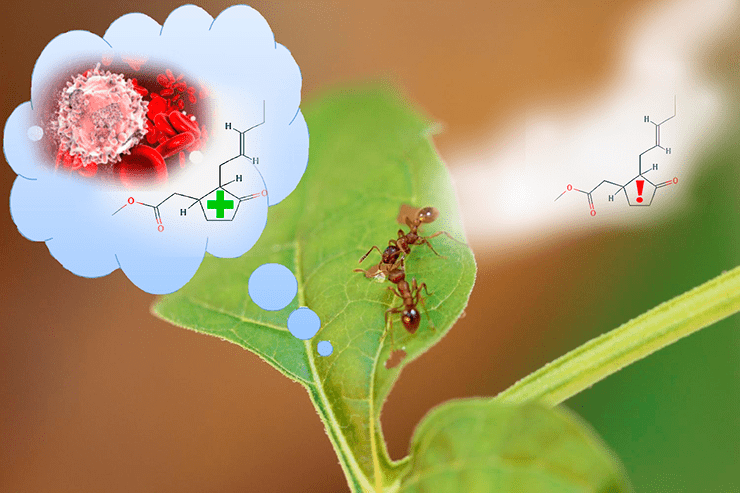
Когда насекомое или какая-то другая живность поедает растение, растение выделяет гормон метилжасмонат. Метилжасмонат оказался способен влиять на человеческие клетки, в частности подавляя воспаление (на рисунке рядом с метилжасмонатом лейкоцит — ведущая клетка воспаления), что делает его перспективным как «шаблон» для создания новых лекарств. Помимо этого, метилжасмонат летуч и передается по воздуху другим растениям как «сигнал тревоги».
коллаж автора статьи
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: В первой статье этого небольшого цикла я начал рассказывать о гормонах растений, сосредоточившись, главным образом, на абсцизовой кислоте и на фармацевтических исследованиях, на которые она вдохновила ученых. В этой статье обсуждаются жасмонаты. Эти гормоны растений очень похожи на простагландины, которые в нашем организме регулируют воспаление. И при этом на организм животных жасмонаты оказывают противовоспалительное действие, что делает их интересными с точки зрения создания новых лекарств. Является ли противовоспалительный эффект жасмонатов следствием их химического сходства с простагландинами? Я попытаюсь рассмотреть этот вопрос на основе собственных исследований и провести небольшой экскурс в вопрос противоракового действия жасмонатов.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Нет ничего более изобретательного, чем природа.
Цицерон
У растений, как и у человека и животных, тоже есть свои гормоны. И так же, как в нашем организме, они регулируют почти все стороны жизнедеятельности представителей флоры — рост, развитие, размножение, адаптацию к неблагоприятным условиям окружающей среды. Нет, пожалуй, только «борьбы и бегства» (которые человеку обеспечивает гормон адреналин) — но лишь потому, что деревья и кусты бегать не способны.
Как оказалось при пристальном изучении, значимость гормонов растений выходит за рамки ботаники: они могут и на животный организм действие оказать, и новыми лекарствами послужить. В первой статье этой серии я уже рассказывал о гормоне растений, который вдобавок оказался важным сигнальным веществом в организме животных и человека, — об абсцизовой кислоте [1]. Начав с информации о ее роли в жизнедеятельности растений, я плавно перешел к ее функции в животном организме. Здесь же для удобства понимания мне придется сделать наоборот и начать повествование с рассказа о веществах, синтезируемых в нашем организме.
Простагландины и лейкотриены
Вещества, о которых пойдет речь, не относятся к гормонам, скорее их можно назвать медиаторами воспаления. Синтезируются они из общего предшественника — арахидоновой кислоты, и называются простагландинами и лейкотриенами (рис. 1).
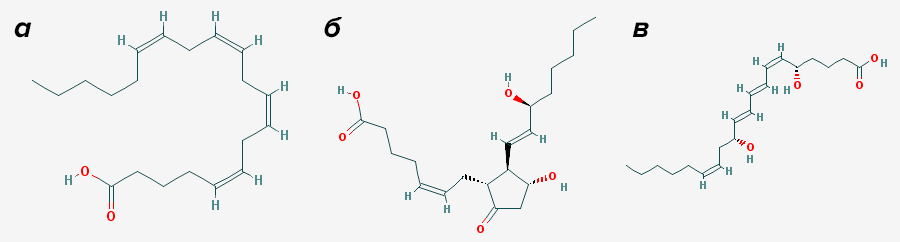
Рисунок 1. Арахидоновая кислота и ее биологически активные производные. а — Арахидоновая кислота, один из представителей жирных кислот. б — Пример простагландина: простагландин E2. Это окисленное производное жирной кислоты, середина которого в ходе окисления ферментом циклооксигеназой (см. далее в тексте) замкнута в цикл. в — Лейкотриен B4. Фермент липоксигеназа «издевался» над ним чуть меньше, чем циклооксигеназа над простагландином — просто окислил («врезал» в него две гидроксильные группы), не замыкая в цикл.
Путь синтеза простагландинов и лейкотриенов начинают два фермента-«коллеги»: соответственно циклооксигеназа и липоксигеназа. Если присмотреться к названию первого фермента, можно сразу понять, за что его так «окрестили» биохимики: помимо окисления («-оксигеназа») он еще и замыкает в середине цепочки арахидоновой кислоты маленькое пятичленное кольцо, или цикл («цикло-»). Получается нестойкое вещество, на которое в дальнейшем «наводит лоск» один из ферментов групп простагландинсинтетаз и тромбоксансинтаз, немного меняя структуру кольца. И получаются биологически активные простагландин и тромбоксан (рис. 2) [2], [3].
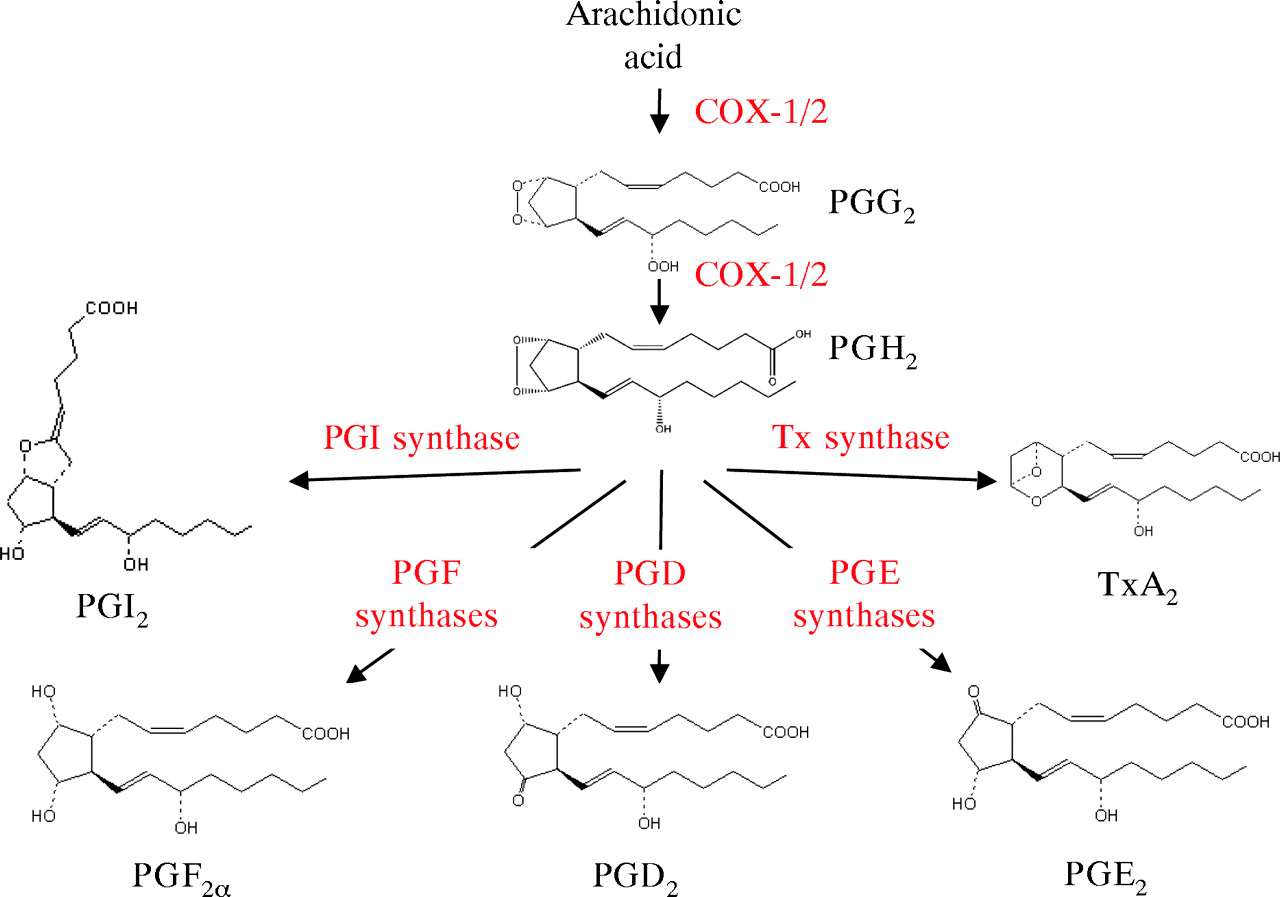
Рисунок 2. Биосинтез простагландинов. COX-1/2 — это циклооксигеназа (цифры «1/2» обозначают, что существуют две формы этого фермента: COX-1 и COX-2). «Свою» реакцию она проводит в две стадии, продуктами которых являются нестойкие короткоживующие простагландины: PGG2 и PGH2. Сформировав их «каркас», COX-1/2 отпускает их в свободное плавание, но их тут же перехватывают другие ферменты — многочисленные простагландинсинтазы и тромбоксансинтаза (показаны на рисунке внизу) — и придают им окончательную форму. В таком виде они относительно стабильны и биологически активны. Они будут действовать на клетки мишени через GPCR и, как выяснится дальше, через PPARγ, о котором мы говорили раньше.
Упомянутая выше циклооксигеназа интересна тем, что именно ее блокируют привычные нам жаропонижающие и обезболивающие лекарства: аспирин, диклофенак, ибупрофен и подобные им. Все они объединены в группу нестероидных противовоспалительных средств (НПВС). Их эффект связан с тем, что простагландины обеспечивают не только воспаление как таковое, но и сопутствующие ему боль и лихорадку. В общем, почти универсальный химический сигнал о повреждении организма.
Похожий спектр функций выполняют лейкотриены, синтезируемые при участии липоксигеназы. Если опустить химические подробности реакции, то в целом она проще: в молекулу кислоты просто «врезается» одна–две гидроксильные (–OH) группы. К некоторым лейкотриенам еще «привешивается» короткий пептид — от одного до трех аминокислотных остатков (рис. 3) [2–4].
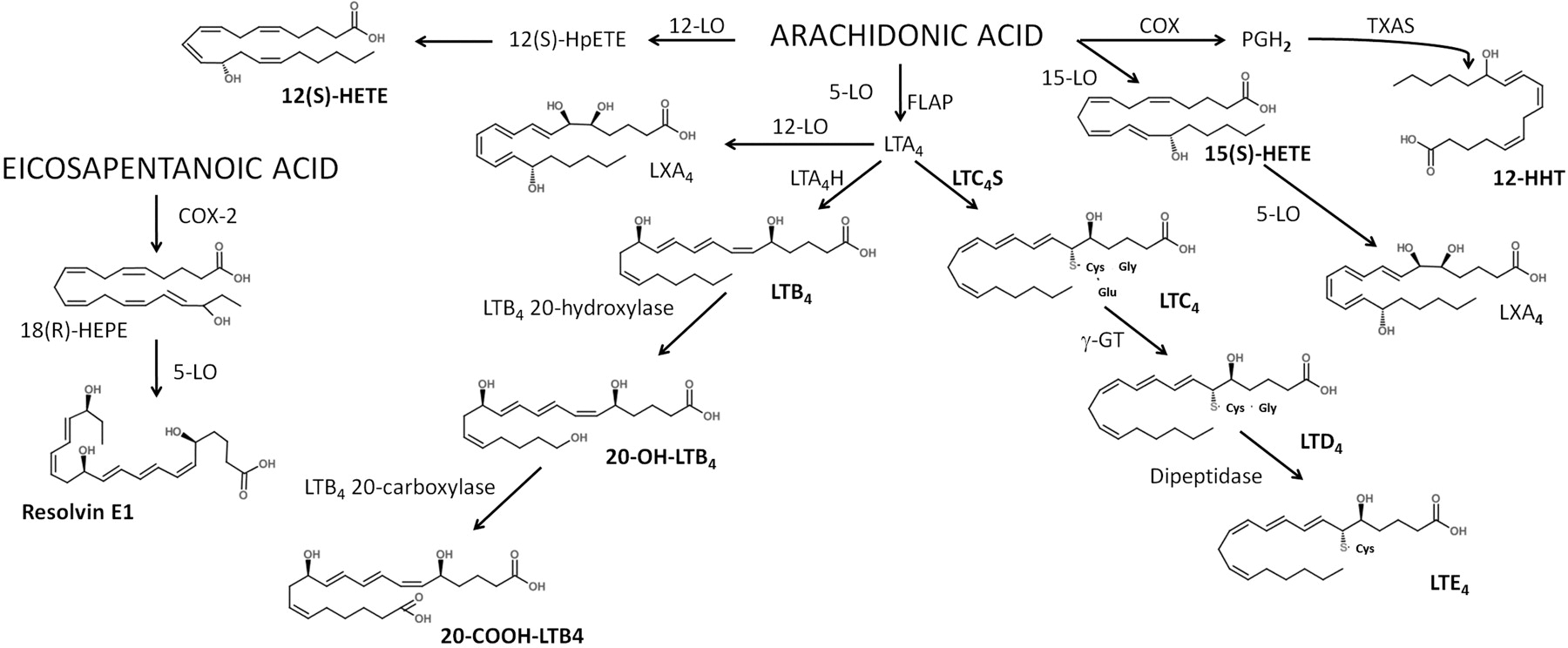
Рисунок 3. Биосинтез лейкотриенов
Жасмонаты: кто они такие?
Любопытно, но уже хорошо известно, что растения синтезируют вещества, химически похожие на наши простагландины и лейкотриены и выполняющие в растительном организме почти такие же функции. Больше того — такие вещества присутствуют у большинства живых организмов! И все они, как правило, передают сигнал от клетки к клетке, то есть это эволюционно очень древние гормоноподобные вещества [5]. Подобная ситуация описывалась в первой статье цикла применительно к абсцизовой кислоте [1].
К таким соединениям относятся в том числе жасмонаты — производные жасмоновой кислоты (рис. 4а). В свою очередь, кислота так названа «в честь» жасмина, из которого была впервые выделена.
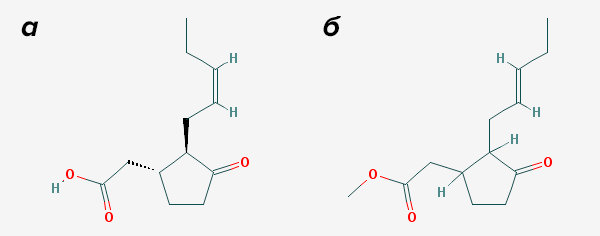
Рисунок 4. Жасмонаты. а — Жасмоновая кислота, химическая предшественница всех жасмонатов, «неклассических» гормонов растений. б — Метилжасмонат, метиловый эфир жасмоновой кислоты, мощный гормон ответа на повреждение, а «по совместительству» летучий растительный сигнал тревоги.
Жасмоновая кислота, как и вообще все жасмонаты, очень похожа на наши простагландины. Только, в отличие от них, молекула у нее в целом меньше, углеродные цепочки короче. Это происходит из-за интересного биосинтеза кислоты. У растений нет циклооксигеназы и разом окислить кислоту и замкнуть ее в цикл они не могут. Поэтому биосинтез жасмоновой кислоты, хоть она похожа на наши простагландины, начинается как биосинтез наших лейкотриенов! Далее два фермента, которых, в свою очередь, нет у нас, завершают окисление и замыкают кольцо. А затем происходит нечто совсем для нашего организма невообразимое — кислота частично окисляется, из-за чего «головная» цепочка укорачивается. А «хвостовая» цепь у нее короткая изначально — из-за того, что растения используют в синтезе жасмонатов не арахидоновую кислоту, как человек и другие животные, а близкую к ней линоленовую.
Жасмонаты традиционно не относятся к классическим гормонам растений. Это роднит их с нашими простагландинами — специалисты по физиологии и биохимии человека простагландин гормоном не назовут вообще. Но самое удивительное — в уже упоминавшемся сходстве функций жасмонатов в растениях с функциями простагландинов в нашем организме.
Они также участвуют в реакции растения на повреждение, внедрение болезнетворной бактерии или гриба или поедание насекомым или млекопитающим [5], [6] — все то, что вызывает у нас воспаление! У растений из-за совершенно другой структуры тканей воспаление (по крайней мере, в привычном нам смысле) развиться не может. Но жасмонаты запускают синтез антимикробных и инсектицидных соединений, а также белков, блокирующих пищеварительные ферменты незадачливого травоядного. Такая реакция «химического иммунитета» — в чем-то даже интересней нашего воспаления [7].
В плане функции жасмонатов растения пошли на трюк, неведомый человеку, несмотря на наличие подобных соединений! Наши простагландины действуют обычно вблизи места возникновения, чаще всего в месте повреждения тканей. Растительные жасмонаты, мало того, что распространяются по всему растению, подобно настоящим гормонам (почему они все-таки гормоны, хоть и неклассические), так еще способны действовать на соседние растения!
Жасмоновая кислота сама по себе хорошо растворяется в воде — это связано с наличием карбоксильной группы (–COOH), которая в воде хорошо отщепляет ион водорода — вспоминаем школьный курс химии и электролитическую диссоциацию. Но растения к этой кислоте умеют присоединять метильную группу эфирной связью. Получается уже эфир: метиловый эфир жасмоновой кислоты, а биохимики зовут его просто метилжасмонат (рис. 4б).
Присоединение метильной группы делает это соединение менее растворимым в воде и летучим, способным распространяться от растения к растению по воздуху [8]. Как вам идея передавать гормоны на расстоянии, чтобы они действовали на других людей? Растения могут это проделать! Если кто-то начинает поедать растение, оно выделяет метилжасмонат — и в соседних растениях индуцируется синтез токсичных и балластных веществ, делающих их поедание малоприятным и даже опасным.
Почему же у нас нет такой возможности? А за ненадобностью. Человек может предупредить о том, что его кто-то ест (или как-то по-другому повреждает) другим способом. Я уже выношу за скобки речь, которой только мы и обладаем, а животные нет. Но человек, как и любое животное, может закричать, может, на худой конец, заплакать. Я считаю, такая коммуникация «круче»! Растения так не могут — голоса у них нет (мифический плач мандрагоры не в счет). Так что можно сказать, что растения плачут метилжасмонатом!
Зачем жасмонаты медикам?
Самое интересное, что в экспериментах на животных жасмонаты оказывают противовоспалительное действие [9–11]. В этом «замечены» прежде всего уже упомянутый метилжасмонат [10], а также синтетические производные жасмонатов, в состав которых введен атом хлора [11]. В силу этого они перспективны в плане создания на их основе новых противовоспалительных средств.
Вот тебе и раз! Растительные сигналы тревоги,
- запускающие ответ на повреждение,
- по строению похожие на вещества, запускающие в нашем организме воспаление,
- обладающие способностью это самое воспаление в животном организме выключать!
Кажется, снова через миллиарды лет эволюции протянулась какая-то связь, какой-то сохранившийся общий путь... Или нет?
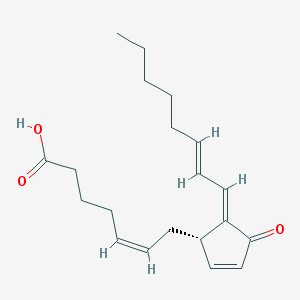
Рисунок 5. 15-деокси-Δ12,14-простагландин J2
Такая гипотеза есть. Если посмотреть на формулу жасмоновой кислоты, то можно заметить, что она очень похожа на один из наших простагландинов — 15-деокси-Δ12,14-простагландин J2 (рис. 5), который отличается тем, что не стимулирует воспаление, а останавливает его. Для краткости этот простагландин чаще всего называют 15d-PGJ2. Он оказывает противовоспалительное действие, действуя через... активируемый пролифератором пероксисом рецептор-гамма (PPARγ) [12], [13], уже знакомый нам из предыдущей статьи серии [1].
Интуитивно мысль тянется к тому, чтобы связать действие жасмонатов с этим структурным сходством. И на самом деле в научных работах сейчас доминирует именно эта гипотеза [9], [11], [14]: жасмонаты оказывают на организм человека противовоспалительное действие, потому что похожи на наш противовоспалительный простагландин.
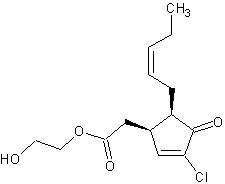
Рисунок 6. Синтетический жасмонат J11-Cl — «главный герой» исследования ученых из Кореи, Китая и США
Группа исследователей из Кореи, Китая и США попыталась подтвердить это предположение методом компьютерного моделирования [9]. Они исследовали новый синтетический жасмонат 2-гидроксиэтил-5-хлоро-4,5-дидегидрожасмонат (чтобы не выговаривать и не писать такое название каждый раз, они кратко назвали соединение J11-Cl) (рис. 6). Это соединение оказалось способно облегчать симптомы воспаления толстого кишечника в эксперименте in vivo (на мышах), а в эксперименте in vitro стимулировало активность PPARγ.
Самое интересное началось при рассмотрении результатов молекулярного моделирования связывания J11-Cl с рецептором PPARγ: соединение, по утверждению исследователей, «легло» в рецептор так же, как 15d-PGJ2 и глитазоны (про глитазоны мы писали в первой статье серии [1]).
Теория очень красивая. Еще красивее, чем в случае с абсцизовой кислотой. Но если насчет того, что жасмонаты (в том числе J11-Cl) активируют этот рецептор, сомнений нет, то насчет связывания есть один червячок сомнений.
Жасмонаты под компьютерным «микроскопом»: все ли то золото, что блестит?
Группа исследователей из Тверского государственного медицинского университета, в числе которых и автор этой статьи (далее именуем себя «мы»), провела другое исследование жасмонатов методами молекулярного моделирования [15–17]. Только на этот раз взяла побольше жасмонатов: и саму жасмоновую кислоту (ведь она больше всего похожа на наши простагландины!), и метилжасмонат, и синтетические жасмонаты.
Чтобы лучше понять используемые нами методы, читатель может обратиться к хорошим обзорам по ним, размещенным на «Биомолекуле»: «Драг-дизайн: как в современном мире создаются новые лекарства» [18] и «12 методов в картинках: «сухая» биология» [19].
Сначала мы попытались в специальной программе наложить различные конформации жасмонатов и производных простагландина J2 (в том числе 15d-PGJ2) друг на друга, причем так, чтобы совпали самые «примечательные» фрагменты — карбоксильная группа (–COOH) на одном из концов молекулы и кольцо . Иначе все структурное сходство между жасмонатами и простагландинами окажется не более чем красивой случайностью.
Большинство молекул в трехмерном виде, в коем на самом деле и существуют, являются гибкими. И могут принимать в пространстве разные формы. Каждая из них называется конформацией.
Используемая нами программа Pharmit доступна онлайн. Наложение производится на основе вычисления фрагментов молекулы, важных для лекарственной активности. Совокупность таких фрагментов называется фармакофором, а само наложение — соответственно, фармакофорным. Фрагменты фармакофора на рисунках изображаются в виде сетчатых шариков.
И оказалось, что жасмонаты таким образом на простагландин не накладываются. Как уже отмечено выше, молекула жасмоната меньше, и со стороны «головы» (карбоксильной группы) она особенно короткая. Не то что длинный простагландин. Поэтому, в принципе, ни в один рецептор они лечь одинаково не могут (рис. 7).
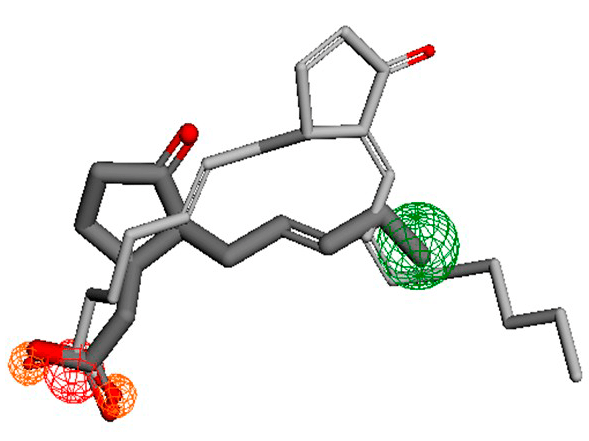
Рисунок 7. Наложение жасмоновой кислоты (темная) на 15d-PGJ2 (светлый). Видно, что жасмоновая кислота слишком короткая, чтобы совместиться с нашим простагландином. В трехмерном формате сходство весьма условное.
изображение автора статьи, черно-белая версия приведена в [15]
Следующим этапом мы загрузили из банка данных PDB структуры PPARγ в комплексе с различными натуральными и синтетическими веществами, которые его активируют (в фармакологии они называются агонистами) .
В банке PDB содержатся структуры, расшифрованные экспериментально методом рентгеновской кристаллографии — когда из белка, к тому же соединенного с каким-нибудь гормоном, нейромедиатором или лекарством, пытаются получить кристалл (это трудно!). А когда кристалл вырастает, изучают, как он рассеивает рентгеновские лучи. А далее компьютер по сложному алгоритму рассчитывает структуру молекулы, исходя из картины рассеяния. Метод надежный, так что можно ему доверять. Если в рецепторе была маленькая молекула (в биохимии она называется лигандом), в кристалле она как бы «вморожена» в белок точно в том положении, в котором связывается с ним. Это позволяет изучать и сравнивать, как разные молекулы связываются с рецепторами. Подробнее об этих подходах рассказывается в статьях спецпроекта «12 биологических методов в картинках»: «Структурная биология» [20] и «Сухая биология» [19].
Белок сам по себе гибкий, поэтому структуры немного отличаются друг от друга — в каждой из них белок идеально «подогнан» к лиганду. Загруженные структуры использовались для компьютерного моделирования связывания жасмонатов с PPARγ. Специальная программа рассчитывала, как жасмонаты должны связаться с рецептором, чтобы энергетически это было наиболее выгодно . В итоге получился набор поз, в которые жасмонат может «лечь» в рецепторе.
Такой подход называется докингом. Название это происходит от английского слова docking («стыковка») и очень точно отражает суть процесса. Этот метод чаще всего используют для предсказания и моделирования связывания белка с лигандом, если для обеих молекул известны пространственные структуры . Мы использовали доступную бесплатно программу AutoDockVina, выпущенную Институтом Скриппса в США. Интересно, что сама программка запускается из командной строки (впрочем, бесплатные программы для молекулярного моделирования часто так и работают). Графическая оболочка с ней разобщена, поставляется отдельно (но тоже бесплатно) и называется AutoDockTools. Несмотря на эти небольшие неудобства, визуализация в ней отличная — некоторые картинки вы можете увидеть ниже. Подробнее о докинге можно почитать в статьях «12 методов в картинках: «сухая» биология» [19] и «Виртуальные тропы реальных лекарств» [21].
Редакция «Биомолекулы» предупреждает: докинг — довольно незрелый метод компьютерного моделирования, и от него не стоит ждать, что он с абсолютной достоверностью даст ответ на вопрос «как связывается лиганд с рецептором?». Вместо этого любая программа докинга выдаст около 100 500 вариантов связывания, среди которых будут примерно все возможные (и вся надежда на то, что среди них будет также и близкий к правильному). Как правило, выбрать среди них реалистичные — и есть научная задача, с которой приходится сталкиваться молекулярным «модельерам». См. также «Я б в биоинформатики пошел, пусть меня научат!» [22]. — Ред.
После докинга в другой программе (собственно, в уже упомянутой графической оболочке AutoDockTools) мы наложили полученные позы жасмонатов на те молекулы, которые были «вморожены» в рецептор при кристаллизации.
А затем мы вернулись к серверу Pharmit, только на этот раз использовали его в другом режиме. Мы загрузили в него структуру простагландина вместе с рецептором PPARγ (так тоже можно сделать!). Сервер при этом автоматически подсвечивает те фрагменты, которые важны для лекарственной активности. И на них уже попытались наложить жасмонаты.
Как и в модели без рецептора, получилось, что на 15d-PGJ2 жасмонаты накладываются весьма условно, чаще всего каким-то одним фрагментом. И этого недостаточно, чтобы полностью воспроизвести все контакты с рецептором. Таким образом, мы еще раз подтвердили свой неутешительный вывод: сходство между жасмонатом и простагландином оказалось весьма поверхностным.
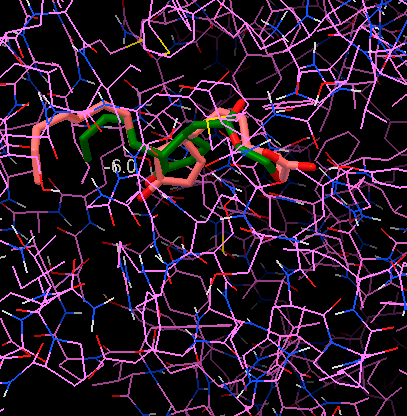
Дело в том, что самые важные контакты 15d-PGJ2 с PPARγ находятся с области кольца и карбоксильной группы. А в трехмерной модели 15d-PGJ2, связанного с рецептором (как и выше в его же модели без рецептора), жасмоновая кислота не может наложиться так же, чтобы совпали и кольцо, и «голова» (рис. 8).
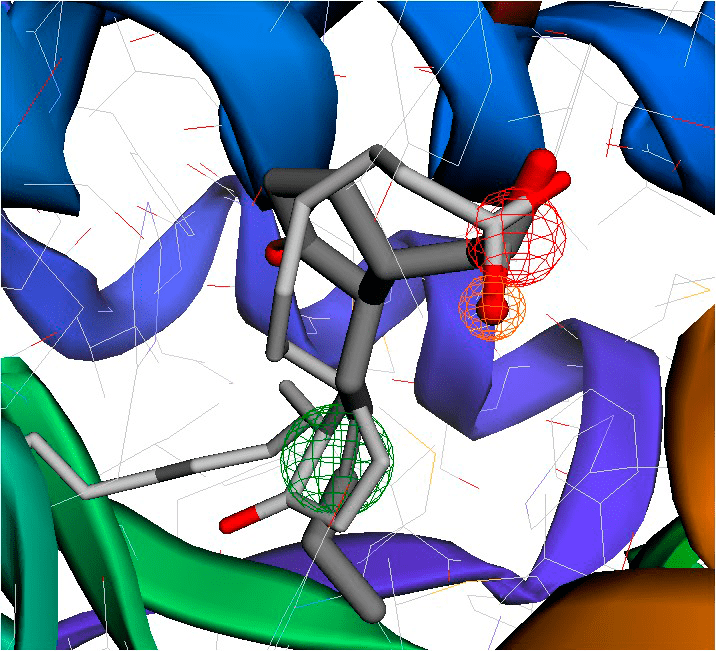
Рисунок 8. Фармакофорное наложение жасмоновой кислоты (темная) на 15d-PGJ2 (светлый), выполненное на сервере Pharmit. Спирали рецептора PPARγ обозначены радужными цветами. Видно, что структурное сходство между жасмонатом и простагландином при наложении теряется: где у простагландина кольцо, у жасмоната хвост. И по длине он покрывает приблизительно только половину простагландина.
изображение автора статьи, черно-белая версия приведена в [15]
Однако PPARγ имеет достаточно широкий круг агонистов — то есть активировать его могут достаточно разные и по строению «разношерстные» молекулы. И с ним способны связываться не только жирные кислоты и их производные, но и... нестероидные противовоспалительные средства (НПВС), о которых писалось выше. Те самые диклофенак, индометацин и прочие подобные им обезболивающе-жаропонижающие (рис. 9а и 9б).
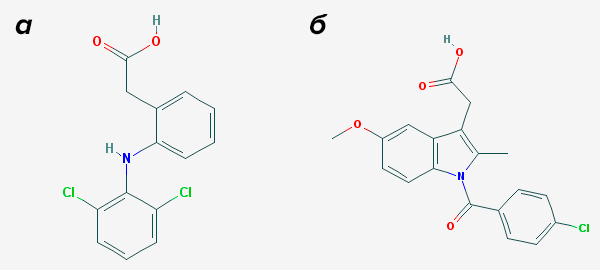
Рисунок 9. Нестероидные противовоспалительные средства: а — диклофенак, б — индометацин
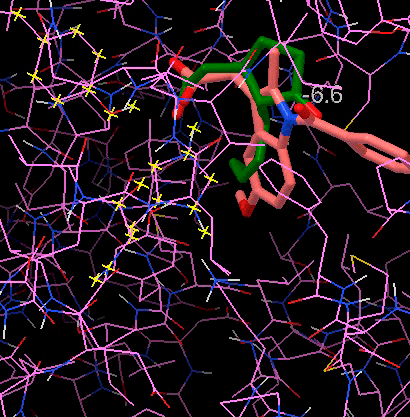
Рисунок 10. Наложение жасмоновой кислоты на жаропонижающее и обезболивающее средство индометацин при докинге. Видно, что с индометацином кислота совмещается неплохо.
изображение автора статьи, черно-белая версия приведена в [15]
И при повторении того же самого «эксперимента» с моделями PPARγ, в который «вморожены» связавшиеся с ним НПВС, оказалось, что на НПВС жасмонаты накладываются очень даже неплохо (рис. 10).
Вот уж где внешность обманчива, так это в молекулярном моделировании взаимодействия потенциальных лекарств с рецепторами. В трехмерной модели PPARγ жасмонату гораздо проще связаться с PPARγ так же, как жаропонижающему средству, нежели расположиться в его связывающем участке подобно простагландину. К тому же, связавшись подобно обезболивающе-жаропонижающему, жасмонат воспроизводит все необходимые контакты и связи с рецептором. А ведь на НПВС, на первый взгляд, жасмонат похож мало.
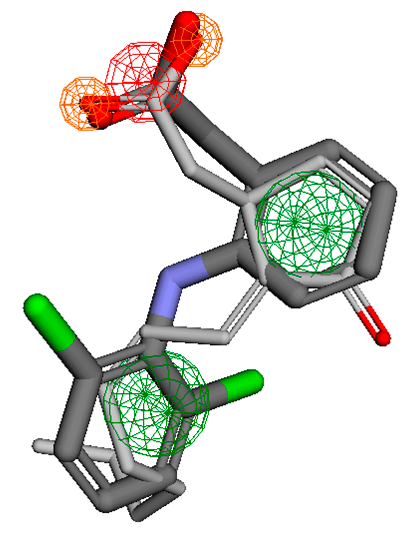
Рисунок 11. Наложение обезболивающего средства диклофенака (темный) на жасмоновую кислоту (светлый). Не правда ли, похожи?
иллюстрация автора статьи из [17]
Однако на трехмерной модели при наложении одной молекулы на другую (что нами и было сделано) сходство становится почти очевидным. На рисунке жасмоновая кислота наложена на диклофенак в модели без рецептора. Совместилась так хорошо, что почти с ним сливается (рис. 11).
Чтобы эти аргументы имели бóльшую силу, мы воспользовались еще одной компьютерной методикой, которая называется предсказанием мишени [23–27]. Мишенью в данном случае именуется тот белок или другая молекула, с которой непосредственно связывается лекарство, вызывая свой эффект. Направленное воздействие на мишень есть основа таргетной терапии, лежащей в основе современных взглядов на медицину [28].
Предсказание мишени проводится с помощью специальных серверов. Такие серверы имеют выход в базы данных веществ и их биологических активностей, либо даже имеют эти базы в своем составе. В каждой базе вещества «разложены по полочкам», где каждая полочка соответствует определенному рецептору, с которым это вещество, согласно экспериментальным данным, связывается. Сервер использует особые математические методы вычисления меры «похожести» веществ, чтобы предположить, с чем исследуемое соединение будет взаимодействовать. Только вот «похожесть» можно посчитать двумя способами — можно прямо по двухмерной формуле, а можно сделать из нее 3D-структуру вроде тех, что мы визуализировали выше, и посчитать уже по ней.
Обычно эти серверы используют, чтобы просто прикинуть, с чем может взаимодействовать вещество. Отчасти этой целью задались и мы — дело в том, что помимо J11-Сl, другие жасмонаты на взаимодействие с рецептором PPARγ, строго говоря, никто не проверял. Мы предположили, что они тоже с ним связываются, лишь основываясь на сходном противовоспалительном действии и сходной химической структуре.
При использовании любого из этих подходов серверы выдавали результат, что с PPARγ жасмонаты связываться должны. Это был дополнительный небольшой объективный плюсик к нашим рассуждениям — хотя бы теоретически существует возможность, что другие жасмонаты связываются с PPARγ.
Но мы еще открывали подробную выкладку каждого вычисления и смотрели, с какими активаторами PPARγ сервер нашел сходство. И оказалось, что при использовании «плоских» формул не только люди, но и сервер считал жасмонаты похожими на простагландины. Но сходство это пропадало, стоило переключиться на расчет с трехмерными моделями. А появлялось сходство с более короткими и объемистыми молекулами, похожими на наши обезболивающие и жаропонижающие (они же НПВС).
У нас получилось, что жасмонаты связываются с PPARγ, как диклофенак с индометацином. А у зарубежных авторов — что связываются как простагландин. Противоречие?
Не совсем. Дело в том, что зарубежные авторы испытывали простагландин с гидроксиэтильной (–CH2–CH2–OH) группировкой, присоединенной к карбоксильной группе. И поэтому «головная» цепочка у этого простагландина оказалась немного удлинена. И в нашем эксперименте гидроксиэтилированные жасмонаты тоже смогли лечь в связывающий участок PPARγ как простагландин (рис. 12) [16], [17]. Это было такое своеобразное исключение.
Но при этом, фактически, вместо карбоксильной группы с рецептором связывалась группа –OH на самом конце молекулы. Так что все же сходство с простагландинами несколько сомнительное.
Таким образом, жасмонаты трехмерно более похожи на хорошо известные нам противовоспалительные лекарства, чем на простагландины. И, скорее всего, могут «подменять» их в рецепторе PPARγ. Что тоже неплохое объяснение противовоспалительному эффекту.
Кстати, а почему НПВС вдруг связываются с PPARγ? При знании фармакологии это должно вызвать удивление. Дело в том, что если лекарство связывается с каким-то рецептором, то, как правило, оно по своей структуре имитирует ту молекулу, которая активирует или отключает его в естественных условиях. Что там имитируют короткие толстенькие НПВС, если PPARγ — рецептор для длинных змееподобных молекул жирных кислот и их производных, с которыми у него общая только карбоксильная группа?
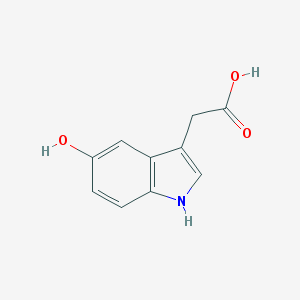
Рисунок 13. Гидроксииндолуксусная кислота — один из недавно открытых естественных активаторов PPARγ
Оказывается, у PPARγ есть еще одна группа естественных лигандов — индолуксусные кислоты [29], образующиеся в нашем организме при распаде серотонина (рис. 13).
Их-то сайт связывания НПВС и занимают, тут сходное строение действительно налицо. И связывание жасмонатов при докинге и фармакофорном наложении оказалось очень похоже на связывание индолуксусных кислот.
Это неожиданно не только тем, что в попытках изучить механизм действия жасмонатов мы все дальше уходим от простагландинов, но и тем, что, по сути, мы вернулись к фитогормонам. Индолуксусные кислоты у растений тоже выполняют роль гормонов — в физиологии растений они называются ауксинами. Правда, в литературе до сих пор не было никаких сведений о «перекресте» между функциями ауксинов в растении и их действием на человека. Так что пока это только информация к размышлению...
Проведя моделирование на PPARγ, мы не остановились на достигнутом и пошли несколько дальше. Напомню, что НПВС, вообще-то, рассчитаны не на связывание с PPARγ (в этом они «уличены» сравнительно недавно), а на блокирование циклоооксигеназы, делающей для нас простагландины, — это их основная мишень. Мы проверили, а могут ли с ней жасмонаты связаться и тоже ее заблокировать? Оказалось — теоретически могут (рис. 14)! Но по этому вопросу экспериментальных данных нет вообще, так что пока это не более чем предположение.
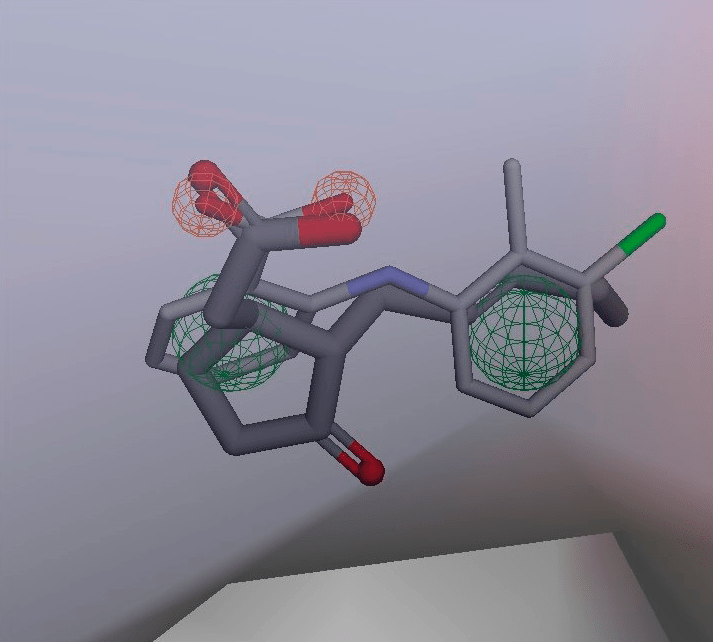
Рисунок 14. Наложение жасмоновой кислоты (темная) на толфенамовую кислоту (светлая, является жаропонижающим средством) в активном центре циклооксигеназы. Ложатся почти идентично! Может, жасмонат и циклооксигеназу блокирует? Точно мы пока не знаем, но такое вполне возможно.
изображение автора статьи, черно-белая версия приведена в [15]
Но это и подстраховка на тот случай, если мы просчитались с предсказанием мишени, и не все жасмонаты, а только, допустим, J11-Cl связывается с PPARγ. Тогда все равно придется как-то объяснять противовоспалительный эффект остальных жасмонатов: и метилжасмоната, и его хлорированного производного! И снова всплывет способность в компьютерной модели связаться с циклооксигеназой так же, как НПВС.
Таким образом, пока мы почти в любом случае выходим на «трехмерную» аналогию между жасмонатами и известными противовоспалительными препаратами, которая может иметь далеко идущие биологические последствия. Так что, может, и не в простагландинах дело, а жасмонаты — всего-навсего новые аналоги индометацина и диклофенака?
Конечно, точку пока ставить в этом вопросе рано. Прежде чем сказать что-то наверняка, нужно результаты перепроверить более точными методами, так что исследование продолжается. Ученому присуще сомнение, и оно тем сильнее, чем смелее его утверждение. Тем более если вопросов пока больше, чем ответов. Небольшой добавочный аргумент в пользу нашей объективности в вопросе «На что похожи жасмонаты с точки зрения наших клеток?» состоит в том, что первоначально мы хотели не опровергнуть, а подтвердить гипотезу, что противовоспалительное действие жасмонатов связано со сходством между ними и простагландинами. Уж больно красивая! Но она неожиданно не захотела подтверждаться.
Пока же мы сделали такой промежуточный вывод: при разработке новых лекарств на основе жасмонатов интересно будет поискать общие элементы между ними и НПВС. А затем на базе такого сравнения создать что-то новое с сильными противовоспалительными свойствами. Этот подход может оказаться более продуктивным, чем поиск сходств между жасмонатами и простагландинами.
Напоследок заинтересовавшимся напомним, в каких статьях можно прочитать про наши исследования подробнее: [15–17].
Жасмонаты лечат не только воспаление, но и рак
Медицинский интерес к жасмонатам определяется не только их противовоспалительным эффектом, хотя он больше всего интересен с точки зрения поиска аналогий и эволюционно общих путей. Гораздо больше научных статей о возможном применении жасмонатов в медицине посвящено их противораковому эффекту.
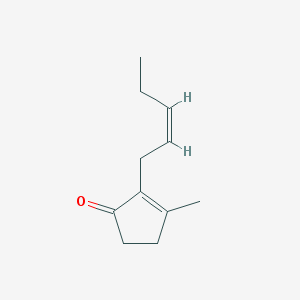
Рисунок 15. Жасмон — «обезглавленное» производное жасмоновой кислоты, которое, тем не менее, сохраняет способность лечить рак
В основном в фокусе внимания оказался уже упомянутый метилжасмонат: он способен тормозить рост рака простаты и индуцировать гибель (апоптоз) в клетках рака легких. Помимо метилжасмоната, на это оказался способен также жасмон — летучее вещество, которое получается при отщеплении карбоксильной группы от жасмоновой кислоты (рис. 15) [30], [31]. Также сообщается об увеличении эффективности традиционных высокотоксичных химиотерапевтических препаратов при комбинировании их с жасмонатами [30].
Самая значимая и самая морально тяжелая проблема современной онкологии — неизбирательность действия традиционных противораковых лекарственных препаратов. Они, как правило, действуют на все клетки без исключения, просто-напросто смертельно повреждая их ДНК, аппараты деления или синтеза белка (что есть во всех клетках). Узкий зазор между эффективностью и токсичностью у традиционных препаратов определяется только скоростью деления клеток — именно поэтому опухолевые клетки сильнее «попадают под удар». В настоящее время идет постоянный поиск препаратов, которые действовали бы на опухолевые клетки селективно . Сейчас основной подход к этой проблеме — разработка препаратов, действующих на конкретные молекулы, задействованные в регуляции деления клетки. Такие препараты называют таргетными (от англ. target — «цель», «мишень»).
Про таргетную терапию «Биомолекула» уже писала неоднократно, в основном в контексте использования для этой цели антител. Антитела удобны тем, что очень специфичны, но их потенциальное разнообразие очень велико, и при должном умении их можно нацелить почти на любую «кнопочку» (рецептор) на поверхности клетки, чтобы ее «включить» или «выключить». В 2018 году Нобелевскую премию вручили ученым, разработавшим препарат для лечения рака на основе антител к белку CTLA-4 на поверхности T-лимфоцитов. Если говорить вкратце, то при применении препарата на лимфоците как бы отключаются тормоза, и он атакует опухоль [32]. Также есть сообщения о возможности применения для терапии рака антител... верблюда [33]! Достойное место в будущей таргетной терапии, возможно, займут лектины — белки, специфически распознающие углеводные остатки, «прицепленные» к другим белкам на поверхности клетки [34].
Но, наряду с этими разработками, параллельно идут исследования в области использования для терапии рака маленьких молекул, похожих на привычные нам лекарства: их производство можно сделать дешевле, их удобнее хранить и применять. Жасмонаты, о которых идет речь, — как раз один из возможных вариантов такой терапии.
Говоря об этом, я описываю маленькие, но важные шаги, которые делают ученые на пути борьбы с раком. От них зачастую ждут, чтобы они свернули горы: «победили рак», «нашли лекарство от болезни Альцгеймера» или сделали что-то более грандиозное. Почему не все так просто — можно прочитать на «Биомолекуле» [35], [36].
Жасмонаты без всяких молекулярных ухищрений со стороны человека оказались способны убивать и подавлять раковые клетки, но «не трогать» нормальные [37], [38]. Только вот как они это делают — исследователям пока до конца не понятно. Предложено несколько механизмов. Первый из них — действие на митохондрии («энергетические станции» клетки), в результате чего они «обесточиваются». Второй — запуск внутри клетки химических реакций с генерацией химически активных соединений кислорода (прежде всего, перекиси водорода — той самой, которой обрабатывают раны), в результате чего клетка буквально сгорает в окислительном пожаре [39]. Третий механизм, как и в случае с ретиноевой и абсцизовой кислотами [1], заключается в том, что процесс злокачественного перерождения как бы обращается вспять: недифференцированная клетка встает на путь специализации снова.
И эти функции тоже находят параллели в растительном организме. В растительной клетке активация выработки перекиси водорода жасмонатами необходима для запуска ответа на болезнетворные микроорганизмы и поедание растения травоядными животными. Кроме того, перекись водорода в растительной клетке регулирует апоптоз и старение (которые также контролируются жасмонатами).
В человеческих и животных опухолевых клетках происходит примерно то же самое — в клетке в результате резкого увеличения концентрации перекиси водорода срабатывает «аварийная защита» и включается программа самоуничтожения путем апоптоза [37].
Помимо такого грубого действия, жасмонаты активируют в раковой клетке белки, называемые MAPK (mitogen-activated protein kinases, протеинкиназы, активируемые митогенами). Эти белки внутри клетки служат одним из ключевых звеньев передачи сигналов, контролирующих деление и дифференцировку, от рецепторов на поверхности клетки к «исполнительным механизмам» в ядре. Активация MAPK метилжасмонатом приводит либо к тому, что клетка возвращает себе более-менее привычный облик и «дифференцируется», либо к тому же апоптозу [37]. Фокус в том, что и в клетках растений жасмонаты тоже активируют MAPK [39]. Похоже, мы снова столкнулись с эволюционной аналогией...
Завершая эту заметку, хочу напомнить, что в начале я сравнивал жасмонаты со «слезами» растения. Но по своему потенциальному целительному эффекту напоминают они скорее всего хорошо известные из мифологии слезы феникса. Только прежде чем мы сможем ими воспользоваться, необходимы еще годы исследований...
Литература
- Абсцизовая кислота: гормон покоя и стресса, лекарство от сахарного диабета;
- Катцунг Б.Г. Базисная и клиническая фармакология (в 2 т., том 1). М.–СПб.: «Бином»–«Диалект», 2007. — 648 с.;
- Christie W.W. (2018). Leukotrienes, lipoxins and related eicosanoids. The LipidWeb;
- M. Back, S.-E. Dahlen, J. M. Drazen, J. F. Evans, C. N. Serhan, et. al.. (2011). International Union of Basic and Clinical Pharmacology. LXXXIV: Leukotriene Receptor Nomenclature, Distribution, and Pathophysiological Functions. Pharmacological Reviews. 63, 539-584;
- K. Kazan, J. M. Manners. (2008). Jasmonate Signaling: Toward an Integrated View. PLANT PHYSIOLOGY. 146, 1459-1468;
- Хелдт Г.-В. Биохимия растений. М.: «Бином», 2014. — 471 с.;
- C. Wasternack. (2007). Jasmonates: An Update on Biosynthesis, Signal Transduction and Action in Plant Stress Response, Growth and Development. Annals of Botany. 100, 681-697;
- Guepil Jang, Jae Sung Shim, Choonkyun Jung, Jong Tae Song, Han Yong Lee, et. al.. (2014). Volatile methyl jasmonate is a transmissible form of jasmonate and its biosynthesis is involved in systemic jasmonate response in wounding. Plant Biotechnol Rep. 8, 409-419;
- Jieun Choo, Yunna Lee, Xin-jia Yan, Tae Hwan Noh, Seong Jin Kim, et. al.. (2015). A Novel Peroxisome Proliferator-activated Receptor (PPAR)γ Agonist 2-Hydroxyethyl 5-chloro-4,5-didehydrojasmonate Exerts Anti-Inflammatory Effects in Colitis. J. Biol. Chem.. 290, 25609-25619;
- Solomon UMUKORO, Akinyinka Oladipo ALABI, Anthony Taghogho EDUVIERE, Abayomi Mayowa AJAYI, Oluwafemi Gabriel OLUWOLE. (2017). Anti-inflammatory and membrane stabilizing properties of methyl jasmonate in rats. Chinese Journal of Natural Medicines. 15, 202-209;
- Hung The Dang, Hye Ja Lee, Eun Sook Yoo, Jongki Hong, Baoquan Bao, et. al.. (2008). New jasmonate analogues as potential anti-inflammatory agents. Bioorganic & Medicinal Chemistry. 16, 10228-10235;
- A. Jawerbaum. (2004). Influence of peroxisome proliferator-activated receptor activation by its endogenous ligand 15-deoxy 12,14 prostaglandin J2 on nitric oxide production in term placental tissues from diabetic women. Molecular Human Reproduction. 10, 671-676;
- A.F. Soares, O. Nosjean, D. Cozzone, D. D’Orazio, M. Becchi, et. al.. (2005). Covalent binding of 15-deoxy-delta12,14-prostaglandin J2 to PPARγ. Biochemical and Biophysical Research Communications. 337, 521-525;
- Zhiran Ju, Mingzhi Su, Jongki Hong, Sultan Ullah, Eun La Kim, et. al.. (2018). Design of PPAR-γ agonist based on algal metabolites and the endogenous ligand 15-deoxy-Δ12, 14-prostaglandin J2. European Journal of Medicinal Chemistry. 157, 1192-1201;
- G.F. Kurakin, N.P. Lopina, G.E. Bordina. (2018). ANALYSIS OF THE MECHANISM ACTION OF JASMONATES USING COMPUTATIONAL CHEMISTRY APPROACHES. PBMPC. 21;
- Куракин Г.Ф., Лопина Н.П., Бордина Г.Е. (2018). Фармакофорный анализ механизма противовоспалительного действия жасмонатов. Сборник тезисов XIII Международной (XII Всероссийской) Пироговской научной медицинской конференции студентов и молодых ученых. 116;
- Куракин Г.Ф. (2017). Фармакофорная основа противовоспалительного действия жасмонатов. Клинические и теоретические аспекты современной медицины — 2017: материалы Всероссийской научной конференции с международным участием. 4;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- 12 методов в картинках: «сухая» биология;
- 12 методов в картинках: структурная биология;
- Виртуальные тропы реальных лекарств;
- Я б в биоинформатики пошёл, пусть меня научат!;
- David Gfeller, Aurélien Grosdidier, Matthias Wirth, Antoine Daina, Olivier Michielin, Vincent Zoete. (2014). SwissTargetPrediction: a web server for target prediction of bioactive small molecules. Nucleic Acids Research. 42, W32-W38;
- Mahendra Awale, Jean-Louis Reymond. (2017). The polypharmacology browser: a web-based multi-fingerprint target prediction tool using ChEMBL bioactivity data. J Cheminform. 9;
- Michael J Keiser, Bryan L Roth, Blaine N Armbruster, Paul Ernsberger, John J Irwin, Brian K Shoichet. (2007). Relating protein pharmacology by ligand chemistry. Nat Biotechnol. 25, 197-206;
- Jiayu Gong, Chaoqian Cai, Xiaofeng Liu, Xin Ku, Hualiang Jiang, et. al.. (2013). ChemMapper: a versatile web server for exploring pharmacology and chemical structure association based on molecular 3D similarity method. Bioinformatics. 29, 1827-1829;
- Xia Wang, Yihang Shen, Shiwei Wang, Shiliang Li, Weilin Zhang, et. al.. (2017). PharmMapper 2017 update: a web server for potential drug target identification with a comprehensive target pharmacophore database. Nucleic Acids Research. 45, W356-W360;
- Таргетная терапия — прицельный удар по болезни;
- Tsuyoshi Waku, Takuma Shiraki, Takuji Oyama, Kanako Maebara, Rinna Nakamori, Kosuke Morikawa. (2010). The nuclear receptor PPARγ individually responds to serotonin- and fatty acid-metabolites. EMBO J. 29, 3395-3407;
- Ammad Ahmad Farooqi, Ghazala Butt, Zubia Razzaq. (2012). Algae extracts and methyl jasmonate anti-cancer activities in prostate cancer: choreographers of ‘the dance macabre’. Cancer Cell International. 12, 50;
- Paulina Dąbrowska, Wilhelm Boland. (2007). iso-OPDA: An Early Precursor ofcis-Jasmone in Plants?. ChemBioChem. 8, 2281-2285;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- От рака вылечит... верблюд!;
- Лектины — новые инструменты в диагностике и терапии злокачественных опухолей;
- Соревнуясь с раком;
- Нерешаемые проблемы биологии: нельзя создать два одинаковых организма, нельзя победить рак, нельзя картировать организм на геном;
- Italo Mario Cesari, Erika Carvalho, Mariana Figueiredo Rodrigues, Bruna dos Santos Mendonça, Nivea Dias Amôedo, Franklin David Rumjanek. (2014). Methyl Jasmonate: Putative Mechanisms of Action on Cancer Cells Cycle, Metabolism, and Apoptosis. International Journal of Cell Biology. 2014, 1-25;
- Meng Zhang, Michael W Zhang, Lili Zhang, Lingrui Zhang. (2015). Methyl jasmonate and its potential in cancer therapy. Plant Signaling & Behavior. 10, e1062199;
- Eliezer Flescher. (2007). Jasmonates in cancer therapy. Cancer Letters. 245, 1-10;
- Tsuyoshi Waku, Takuma Shiraki, Takuji Oyama, Kosuke Morikawa. (2009). Atomic structure of mutant PPARγ LBD complexed with 15d-PGJ2: Novel modulation mechanism of PPARγ/RXRα function by covalently bound ligands. FEBS Letters. 583, 320-324.