Размер имеет значение
23 октября 2013
Размер имеет значение
- 3372
- 0
- 3
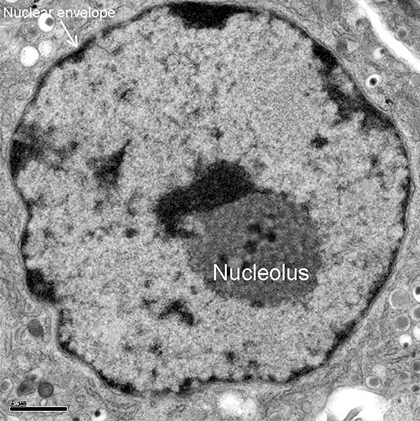
Ядрышко (Nucleolus) под электронным микроскопом
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Функционирование любого компонента живой клетки контролируется обширной и сложной регуляторной сетью. Не является исключением и ядрышко. Однако механизмы, приводящие к его гипертрофии, были плохо изучены до недавнего времени. Исследование на данную тему представила группа учёных из США и Канады: им удалось выяснить, какие гены влияют на изменение размеров ядрышка.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Что такое ядрышко
Ядрышко — это небольшой субкомпартмент, расположенный в ядре клетки, который осуществляет транскрипцию и процессинг рРНК, а также сборку рибосом. Важность роли, исполняемой ядрышком, можно осознать, обратившись к следующему примеру: активно растущие клетки млекопитающих содержат от 5 до 10 миллионов рибосом каждая, и они должны быть синтезированы всякий раз, как клетка делится [1].
Ядрышки расположены вокруг особых регионов хромосом, гены которых кодируют различные по длине и массе рРНК (5,8S, 18S и 28S рРНК). Эти участки хромосом, пространственно ассоциированные с ядрышком, называют ядрышковыми организаторами. Каждый ядрышковый организатор представляет собой кластер тандемно повторяющихся генов рРНК. Сосредоточенность таких генов в определённом месте ядра, а также интенсивность их транскрипции, обусловливает характерную морфологию ядрышка [2]. ДНК, кодирующую различные варианты рибосомальной РНК, принято называть рДНК. Стоить отметить, что 5,8S, 18S и 28S рРНК транскрибируются в виде единого длинного предшественника, который затем подвергается «разрезанию» на более мелкие (уже функциональные) молекулы, из которых в дальнейшем и собираются сами рибосомы. Реакция эта катализируется ферментом РНК-полимеразой I. 5S же рРНК транскрибируется за пределами ядрышка, а реакция катализируется другим ферментом — РНК-полимеразой III [1].
Однако ядрышко — это не просто транскрибирующаяся рРНК; это рибонуклеопротеиновая частица. Проще говоря, в его состав входят как РНК, так и белок. В структуре ядрышка можно выделить три основные части: гранулярный компонент — это созревающие субъединицы рибосом; фибриллярный компонент — здесь происходит инициация процессинга рРНК; и плотный фибриллярный компонент, где и происходит транскрипция рРНК.
То, что ядрышко способно варьировать в размерах, было известно достаточно давно. К примеру, оно увеличивается в быстрорастущих клетках дрожжей. Что более интересно, гипертрофия ядрышка наблюдается и в раковых клетках человека — это стало одним из основных признаков, характеризующих злокачественную опухоль [3].
Но наблюдаемый размер ядрышка — это лишь вершина айсберга; на деле он прямо зависит от концентрации пре-рРНК в клетке, которая, в свою очередь, положительно коррелирует с активностью РНК-полимеразы I. Синтез рРНК требует больших затрат энергии, и когда клетка испытывает недостаток питания, транскрипция генов рДНК тормозится, и ядрышко уменьшается в размерах. Напротив, в благоприятных условиях клетка начинает активный синтез белка, готовясь к последующему делению, и ей требуется большее число рибосом [4]. Из-за этого она усиливает продукцию рРНК, и ядрышко увеличивает размер. Если мы хотим ответить на вопрос «что влияет на размер ядрышка?», нам стоит понять, что же контролирует активность полимеразы I.
Механизмы регуляции размеров ядрышка
Этим же вопросом задались и биологи из США и Канады, и, чтобы ответить на него, они провели ряд экспериментов. В качестве модельных организмов учёные использовали дрожжи и дрозофилу. Методики исследования для каждого объекта были индивидуальны. Так, для дрожжей была создана генно-инженерная линия, отличная от дикого типа по множеству генов. Гены, не являющиеся жизненно важными, содержали делеции — т.е. они были нерабочими. Жизненно важные же гены состояли из температурно-чувствительных аллелей, и при повышении температуры функционирование их белковых продуктов нарушалось. Для дрозофилы была использована другая методика — здесь гены «глушились» путём РНК-интерференции [5], [6]. Регистрация изменений размера ядрышек производилась схожим образом: в оба организма вводились флуоресцентные белки (посредством репортерных генов), каждый из которых окрашивал цитоплазму, ядро и ядрышко в определённый цвет. Получение и обработка данных осуществлялись посредством автоматизированной конфокальной микроскопии [4].
В ходе эксперимента у дрожжей было выявлено 113 генов, мутации в которых вызывали значимые изменения фенотипа ядрышка. И целых 78 из них оказались жизненно важными! Это свидетельствует о том, что корректная регуляция активности полимеразы I крайне важна для жизнеспособности клетки. Если говорить о мухе, то у неё ответственными за изменение размеров ядрышка оказались целых 757 генов. С функциональной точки зрения, белки, кодируемые этими генами, оказались схожими у обоих видов. Более того, белки со схожими функциями, будучи «выключенными», оказывали схожее воздействие на фенотип ядрышка как у дрозофилы, так и у дрожжей (рис. 1).
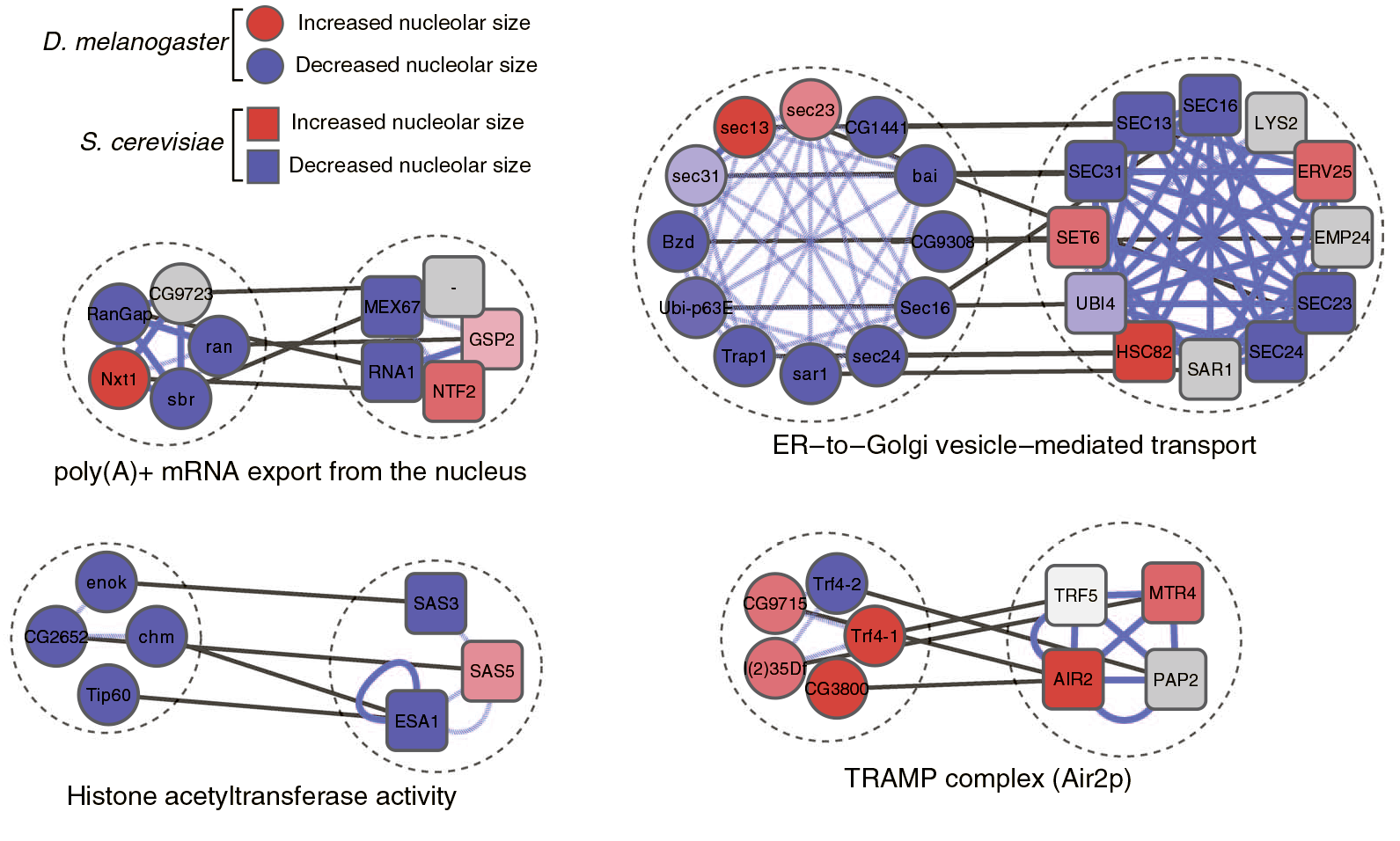
Рисунок 1. Сравнение мутаций в белках дрожжей (квадраты) и дрозофилы (круги) и их воздействие на фенотип ядрышка. poly(A)+ mRNA export from the nucleus — полиаденилирование и экспорт мРНК из ядра; Histone acetyltransferase activity — ацетилирование гистонов; ER—to—Golgi vesicle—mediated transport — везикулярный транспорт из ЭПР в аппарат Гольджи; TRAMP complex — белковый комплекс, участвующий в процессинге 3′-конца рРНК.
Синим цветом обозначены белки, «выключение» которых уменьшало ядрышко; красным — увеличивало. Интенсивность цвета соответствует степени изменения размеров.
Хорошо заметно, что белки, ответственные за полиаденилирование, экспорт мРНК, ацетилирование гистонов и транспорт, в большинстве случаев вызывают уменьшение размеров ядрышка, в то время как TRAMP увеличивает его. Из этого можно сделать вывод, что TRAMP играет роль супрессора транскрипции рРНК.
К примеру, к увеличению размеров ядрышка приводили мутации в генах, ответственных за регуляцию клеточного цикла, процессинг рибосомальной и матричной РНК и репликацию ДНК. Утрата же функций белками, участвующими в таких фундаментальных процессах, как везикулярный транспорт из ЭР в Гольджи, синтез рРНК, сборка нуклеосом, регуляция транскрипции и ацетилирование гистонов, приводила к фенотипу с уменьшенным ядрышком. Основываясь на этих фактах, можно сделать вывод о том, что регуляция активности полимеразы I — высоко консервативный процесс, который регулируется функционально идентичными белками даже у эволюционно удаленных организмов.
Однако исследователей не удовлетворил этот ответ, и они решили выяснить, имеются ли видоспецифичные регуляторы ядрышкового размера. Таким кандидатом стал белковый комплекс HIR, чьи ортологи содержатся в большинстве эукариотических организмов: от дрожжей до человека. Данный комплекс участвует в целом ряде процессов: сборке нуклеосом, регуляции транскрипции, элонгации, сайленсинге генов и даже старении. Но участие этого белка в транскрипции именно рДНК ранее не было доказано, и исследователи предположили, что HIR в дрожжах обладает такой функцией, и она является видоспецифичной. Учёным удалось найти доказательства своим предположениям: мутации в генах, кодирующих субъединицы комплекса, приводили к повышению концентрации пре-РНК и увеличению ядрышка. Подобный опыт был проведён и для дрозофилы, где мишенью стал HIRA — аналог HIR. Однако в этом случае никакого влияния на размер ядрышка обнаружено не было [4]. Несмотря на высокую консервативность механизмов регуляции активности РНК-полимеразы I, за этот процесс могут быть ответственны и белковые комплексы, часть функций которых специфична для конкретного вида.
Помимо выяснения функций белков, связанных с активностью полимеразы I, учёные попытались выяснить и их внутриклеточную локализацию. Как оказалось, бóльшая часть из тех, что связана с размером ядрышка, локализована в ядре, ядрышке, эндоплазматическом ретикулуме и аппарате Гольджи (рис. 2), — значит, деятельность этих органелл связана с корректной работой РНК-полимеразы I.
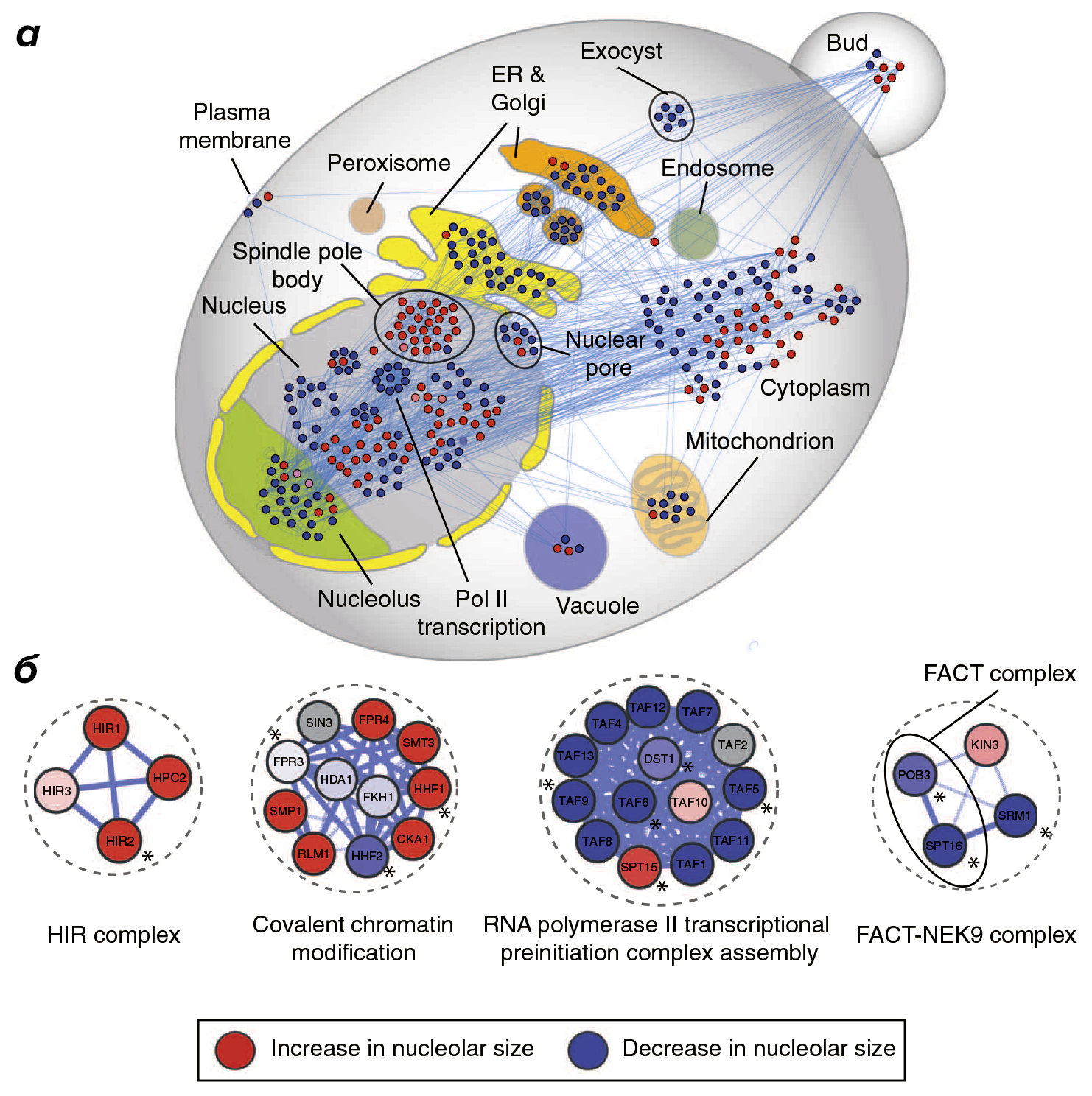
Рисунок 2. Регуляторы транскрипции рДНК у S. cerevisiae. а — Внутриклеточное распределение белков, влияющих на размер ядрышка (на примере дрожжей). Такие белки располагаются во многих органеллах, но больше всего их в ядре и ядрышке. Это согласуется с идеей о том, что варьирование размеров ядрышка вызвано изменением активности РНК-полимеразы I. б — Некоторые белки дрожжей, мутации в которых влияют на фенотип ядрышка. HIR complex — мультифункциональный белковый комплекс, регулирующий транскрипцию, опосредованную полимеразой I. Covalent chromatin modification — белки, ответственные за модификацию хроматина. RNA polymerase II transcriptional preinitiation complex assembly — белки, участвующие в сборке комплекса, необходимого для инициации транскрипции РНК-полимеразой II. FACT—NEK9 complex — белковый комплекс, взаимодействующий с гистонами и влияющий на транскрипцию, осуществляемую РНК-полимеразой II [7].
Легко заметить, что к увеличению ядрышка приводят мутации в тех белках, чьи функции связаны с регуляцией состояния хроматина. В то же время «выключение» белков, влияющих на активность РНК-полимеразы II и, как следствие, на уровень биосинтеза белка, вызывают уменьшение размеров ядрышка.
Как уже отмечалось, для быстрорастущих и делящихся клеток характерно гипертрофированное ядрышко. Здесь учёные и решили выяснить: а всегда ли увеличение размеров ядрышка означает заодно и возрастание скорости роста и деления клеток до аномальных значений? Чтобы ответить на этот вопрос, учёные взяли 50 линий дрожжей с мутациями по не жизненно важным генам, и одну контрольную линию дикого типа. Во время наблюдения не удалось установить никаких значимых различий в скоростях роста и деления между мутантами и диким типом. Из этого можно сделать следующий вывод: увеличенное ядрышко и повышенная активность полимеразы I не являются достаточными факторами для перерождения клетки в раковую.
Фундаментальные исследования — это хорошо, но большинству людей интересно прикладное применение знаний. Так каким же образом данная замечательная работа поможет на практике? Прежде всего, стоит помнить, что не всякое повышение активности РНК-полимеразы I приводит к злокачественному фенотипу, но каждый злокачественный фенотип содержит гиперактивный фермент. Значит, мишенью может служить как сама полимераза, так и гены, контролирующие её работу. К примеру, посредством всё той же РНК-интерференции можно заглушить гены, которые после утраты функций приводят к уменьшению размеров ядрышка, а значит, и к ослаблению синтеза рРНК. Другой путь — непосредственное ингибирование работы РНК-полимеразы I. И такой ингибитор был найден: это препарат CX-3543, обладающий противоопухолевой активностью и проходящий в настоящее время клинические испытания. Действительно, описанная нами работа американских и канадских учёных имеет ценность не только в области фундаментальных исследований, но и помогает найти новые способы терапии рака.
Литература
- Cooper G.M. The Cell. 2nd edition: A Molecular Approach. Boston: Boston University, 2000;
- Льюин Б. Гены. М.: «Бином», 2012. — 896 с.;
- Denis Drygin, William G. Rice, Ingrid Grummt. (2010). The RNA Polymerase I Transcription Machinery: An Emerging Target for the Treatment of Cancer. Annu. Rev. Pharmacol. Toxicol.. 50, 131-156;
- R. A. Neumuller, T. Gross, A. A. Samsonova, A. Vinayagam, M. Buckner, et. al.. (2013). Conserved Regulators of Nucleolar Size Revealed by Global Phenotypic Analyses. Science Signaling. 6, ra70-ra70;
- Обо всех РНК на свете, больших и малых;
- Большие дела небольших молекул: как малые РНК дирижируют генами бактерий;
- Paul B. Mason, Kevin Struhl. (2003). The FACT Complex Travels with Elongating RNA Polymerase II and Is Important for the Fidelity of Transcriptional Initiation In Vivo. Mol. Cell. Biol.. 23, 8323-8333.