Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге
29 октября 2012
Разнообразия много не бывает: чем занимаются мобильные элементы генома в мозге
- 4497
- 9
- 10
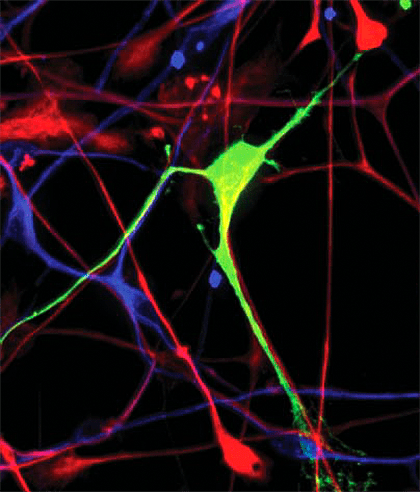
Ученые-нейробилоги сконструировали специальную кольцевую ДНК-плазмиду, которая содержит ретротранспозон L1. В его нуклеотидную последовательность особым образом встроен ген зеленого флуоресцентного белка. Клетка, в которую ввели такую плазмиду, начинает испускать зеленый флуоресцентный свет, только если ретротранспозон, содержащийся в плазмиде, прошел полный цикл самовоспроизведения: был скопирован и встроен в новый участок генома. Эта технология позволяет увидеть глазами клетки, в которых активны мобильные элементы генома, не только в культуре клеток в чашке Петри, но и в мозге живой мыши.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В то время как активность мобильных генетических элементов в половых клетках давно исследуется и заслуженно считается одним из двигателей эволюции, аналогичные процессы в соматических тканях долго оставались в тени. Большой неожиданностью стали экспериментальные данные об активности мобильных элементов — ретротранспозонов — в мозге человека и мыши. Эти факты дали основания для ряда интересных гипотез об участии ретротранспозонов в обеспечении работы мозга, в возникновении патологий нервной системы и о возможной адаптивной роли этих процессов в эволюции.
Конкурс «био/мол/текст»-2012
 Эта работа заняла первое место в номинации «Лучший обзор» конкурса «био/мол/текст»-2012.
Эта работа заняла первое место в номинации «Лучший обзор» конкурса «био/мол/текст»-2012.
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Индивидуальный опыт и заложенная генетическая программа — как они влияют на наше поведение, характер, умственные способности, внимание, память? Над этим вопросом ломали голову все, от биологов и психологов до молодых родителей, а посвященные ему научные работы легко займут небольшую библиотеку. И все же даже на этом натоптанном поле осталось место для новых открытий.
По общепринятому мнению все нервные клетки несут одинаковую генетическую информацию, а изменения в работе мозга и поведении определяются изменениями экспрессии определенных генов, что приводит к укреплению или ослабеванию связей между нервными клетками, которых в нашем мозге непредставимое множество — 100 миллиардов.
Однако американские нейробиологи Фред Гейдж и Элиссон Муотри вот уже несколько лет говорят о существовании новых механизмов, регулирующих не только экспрессию генов и уровень тех или иных белков в нервных клетках, но меняющих последовательность ДНК в каждой отдельной клетке. Эти предполагаемые механизмы связаны с работой мобильных генетических элементов — так называемых «прыгающих генов». Они представляют собой либо участки ДНК, способные сами себя «копировать и вставить» в ДНК в новом месте — ретротраспозоны, — либо фрагменты, которые могут быть «вырезаны и вставлены» — ДНК-транспозоны.
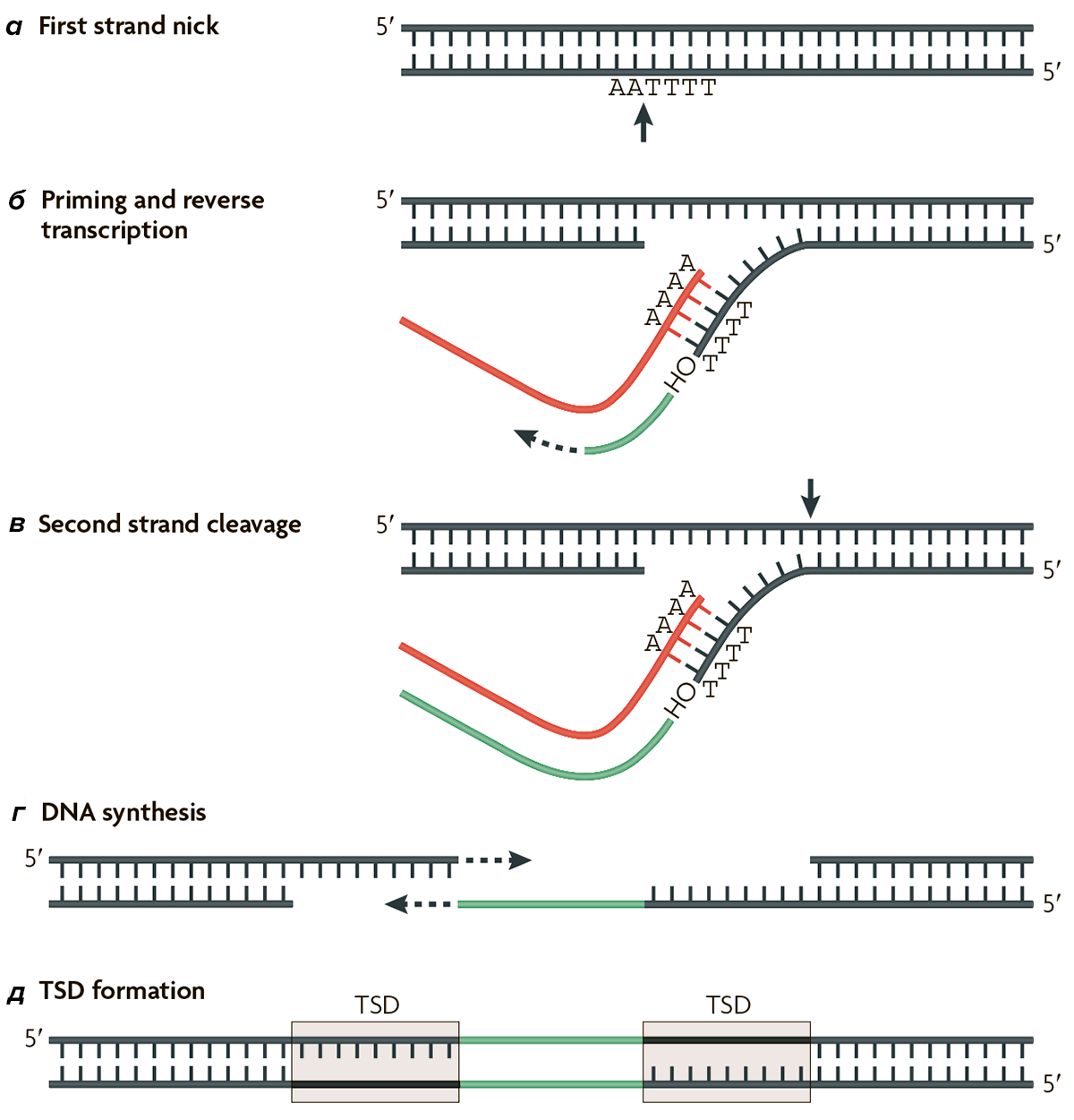
Рисунок 1. Интеграция ретротранспозона L1 в геном. С ретроэлемента копируется его РНК, которая затем транспортируется из клеточного ядра в цитоплазму; там на ней происходит синтез белков, которые кодирует элемент L1 — это белки ORF1 и ORF2. Затем оба белка связываются со своей мРНК и формируют таким образом рибонуклеопротеин, который транспортируется обратно из цитоплазмы в ядро. Там путем обратной транскрипции мРНК ретроэлемент L1 встраивается в новый участок генома. Образуется однонитевой разрыв на участке ДНК-мишени (а), начинается обратная транскрипция ДНК (зеленая нить) с РНК (красная нить) (б), образуется разрыв на второй нити ДНК (в) и инициируется синтез второй цепи ДНК (зеленая нить) (г), вследствие всего этого происходит дупликация участка ДНК, где происходило встраивание элемента L1 (д).
Предметом исследований группы Гейджа стал наиболее распространенный тип ретроэлементов — так называемый «длинный диспергированный повтор» LINE-1 (long interspersed element, сокращенно L1); он составляет около 17% генома человека и способен к автономному самовоспроизведению. Для копирования ретротранспозоны используют механизм обратной транскрипции — на матрице ДНК синтезируется РНК, которая сама используется как матрица для создания ДНК, которая затем интегрируется в геном. В отличие от других неавтономных типов ретроэлементов (Alu- и SVA-повторы) ДНК-последовательность L1 кодирует белки, необходимые для полного цикла самовоспроизведения. Человеческий геном содержит более 500 000 копий L1, из них полноценны и способны к самовоспроизведению не более сотни, а у мышей таких полноценных копий три тысячи.
«Биомолекула» уже писала про «жизнь» и структурную организацию ретротранспозона LINE-1: «Тайны „молекулярных паразитов“, или Как путешествовать по геному» [7]. — Ред.
Мобильные элементы могут существенно влиять на работу генов, расположенных в месте их встраивания (усиливать или, что случается гораздо чаще, нарушать их экспрессию) и, таким образом, на жизнь всей клетки. Так, вследствие встраивания ретроэлементов в участки генов, кодирующих белки, могут возникать мутации, нарушающие их экспрессию. Ретроэлементы участвуют в образовании двунитевых разрывов ДНК, могут провоцировать делеции, дупликации, инверсии последовательностей ДНК и прочие генетические безобразия, а кроме того, они могут встраиваться в регуляторные участки генов и влиять на их экспрессию, не меняя кодирующую белок последовательность.
Первым интересным фактом относительно активности L1 в мозге стал результат анализа транскриптома культуры стволовых клеток из мозга взрослых крыс: оказалось, что при дифференцировке нервных стволовых клеток в мультипотентные клетки-предшественники нейронов экспрессия L1 повышается в 1,5–2 раза. Это дало повод предполагать, что активность L1 может принимать участие в развитии нервной системы.
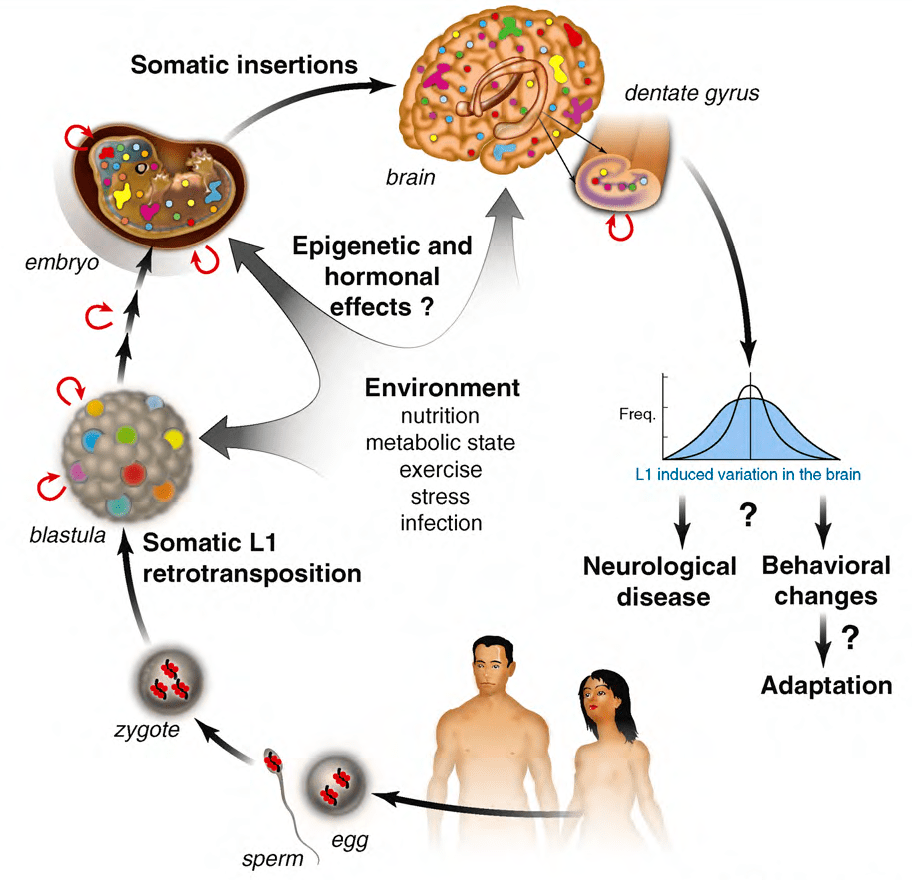
Рисунок 2. «Соматическая мозаичность» клеток мозга, вызванная активностью L1. Вопреки принятому ранее мнению, что ретротранспозоны активны преимущественно в половых клетках, стало ясно, что ретроэлементы L1 экспрессируются в соматических тканях, в том числе в мозге. По последним данным, ретротранспозиции в большом количестве происходят в соматических клетках эмбриона (показано красными стрелками).
Самокопирование ретроэлементов, произошедшее в мозге во время эмбрионального развития, может быть впоследствии обнаружено в различных областях мозга в группах клеток, имевших общего предшественника. Во взрослом мозге ретротранспозиции происходят только в нейрогенных областях, где рождаются новые клетки, а именно в зубчатой извилине гиппокампа (Dentate gyrus).
Вызванная активностью L1 «соматическая мозаичность» может способствовать повышению разнообразия среди клеток мозга, что может приводить к большему разнообразию в поведении организма в целом и способствовать его лучшей адаптации к окружающей среде. Взаимодействие организма с окружающей средой может в свою очередь влиять на интенсивность ретротранспозиций в мозге посредством еще до конца не ясных гормональных и эпигенетических механизмов.
Дальнейшие исследования показали, что ретроэлементы L1, по всей видимости, активизируются на ранних этапах эмбрионального развития нервной системы, однако эта активность поддерживается и в зрелом возрасте в определенных областях мозга, где образуются новые нервные клетки (нейрогенез; подробности далее). В двух растущих по соседству нервных клетках такая «мобилизация» L1, по-видимому, происходит независимо, и в конечном итоге эти уже дифференцированные нейроны содержат новые копии L1, которые в разных клетках попали в разные участки генома и, в зависимости от этого, могут по-разному изменять профиль экспрессии генов. Этот процесс приводит к так называемой «соматической мозаичности» нервной ткани.
Для наблюдения отдельных эпизодов ретротранспозиции в культурах клеток была создана специальная плазмида-индикатор активности L1, содержащая ген зеленого флуоресцентного белка , который вырабатывался клетками (и потому эти клетки светились зеленым) только когда элемент L1 был успешно скопирован в новый участок генома. Нуклеотидная последовательность гена зеленого белка в плазмиде была записана «в обратную сторону» и прервана интроном (некодирующим участком ДНК, который вырезается из РНК после ее считывания с ДНК). Эти и другие более мелкие ухищрения были необходимы для того, чтобы зеленый белок синтезировался только с тех трансгенных элементов L1, которые претерпели обратную транскрипцию и встроились в ДНК.
Зеленый флуоресцентный белок обрел широчайшее применение в биологии и биотехнологиях. За его открытие и внедрение в практику в 2008 году вручена Нобелевская премия: «Флуоресцирующая Нобелевская премия по химии» [8]. — Ред.
Исследователи вводили такую плазмиду в культуру стволовых клеток из мозга взрослой крысы и в культуру эмбриональных стволовых клеток мозга человека, а затем наблюдали, что происходит при их дифференцировке в мультипотентные нервные клетки-предшественнники, которые дают начало нейронам и двум типам глии.
Оказалось, что ретротранспозиции L1 происходят в культурах с низкой, но регистрируемой частотой (в культуре стволовых клеток мозга человека 8–12 случаев на 100 000 клеток; в культуре лимфоцитов активность L1 была практически нулевой), а через 48 часов после начала клеточной дифференцировки активность L1 значительно повышалась, и в итоге у нервных клеток-предшественников, выросших из эмбриональных стволовых клеток мозга человека, могла оказаться в 25 раз выше, чем в первоначальной культуре. Эти данные удивительны по двум причинам: во-первых активность L1 в нервных клетках-предшественниках нарушает устоявшуюся догму о неизменности генома нервных клеток. А во-вторых, ранее считалось, что такая активность L1 приурочена только к клеткам зародышевого пути; активность ретроэлементов в соматических тканях, а особенно в мозге, была огромной неожиданностью.
Как детектировать активность «прыгающих генов» не в культуре клеток, а в мозге живой мыши in vivo? Для этого была создана специальная трансгенная линия мышей, у которой любая клетка организма начинала испускать зеленый флуоресцентный сигнал, если в ее геноме происходила новая вставка L1. Эта система работала по такому же принципу, что и плазмида-индикатор, вживляемая в культуры клеток в более ранних опытах: последовательность гена зеленого белка была «записана» в обратную сторону и прервана интроном.
У таких мышей светящиеся зеленые клетки были видны только в половых клетках и в некоторых отделах мозга, в том числе в гиппокампе. Гиппокамп (в переводе — «морской конек») — область мозга, необходимая для когнитивных процессов и особенно для формирования памяти, а кроме того, это одна из двух областей мозга, где во взрослом возрасте у людей и млекопитающих еще происходит нейрогенез — рождение новых клеток. Именно эти новые клетки-предшественники были окрашены зеленым — а значит, в них происходили ретротранспозиции. Сейчас уже имеются данные о том, что для ретротранспозиций необходим процесс клеточного деления, а генерация новых клеток не происходит в мозге взрослого человека и взрослой мыши нигде, кроме небольших нейрогенных областей — поэтому основная активность ретроэлементов приходится на эмбриональное развитие мозга, когда еще происходит клеточная пролиферация. В нервной системе мышиного эмбриона после 10 дня эмбрионального развития (всего их 21) уже были видны клетки, содержащие зеленый флуоресцентный белок, а значит, претерпевшие ретротранспозиции L1.
У людей активность L1 была оценена косвенно при сравнении количества копий L1 в образцах разных тканей. В среднем клеточные ядра из образцов мозга содержали больше копий L1, чем ядра клеток сердца и печени; наиболее явными отличия были в гиппокампе и мозжечке. По оценкам в этих областях мозга нервные клетки взрослого человека претерпевают в среднем 80 «дополнительных» интеграций L1 по сравнению с клетками печени и сердца. Анализ этих данных значительно усложняла существенная вариабельность в количестве L1 не только в разных областях мозга, но и между разными индивидуумами.
Насколько случайна интеграция L1 в новые участки генома нервных клеток? В экспериментах с введением флуоресцентно меченого L1 в культуру стволовых клеток мозга крыс и человека большинство ретроэлементов встраивались в участки генов, активно работающих в нейронах. В одном случае это был ген белка постсинаптической плотности Psd-93, и его работа была нарушена, в другом — ген, кодирующий переносчик нейромедиатора таурина, в третьем — ген одного из белков обонятельных рецепторов. Всего было клонировано и секвенировано не очень большое число таких интеграций L1, и вопрос о его «предпочтениях», генах-мишенях и механизмах этих процессов остается открытым.
Сейчас уже стало ясно, что активность L1 может иметь негативные и даже драматические последствия для клетки и организма в целом. Примером тому — 65 известных случаев наследственных заболеваний, вызванных активностью ретроэлементов L1, SVA и Alu в клетках зародышевой линии; список включает в себя гемофилию, кистозный фиброз, синдром Аперта, мышечную дистрофию Дюшена, рак молочной железы и пр. Возникает вопрос, могут ли интеграции L1 в соматических тканях, в нервных клетках участвовать в развитии неврологических и психических патологий? Как наш организм может препятствовать непредсказуемым генетическим прыжкам?
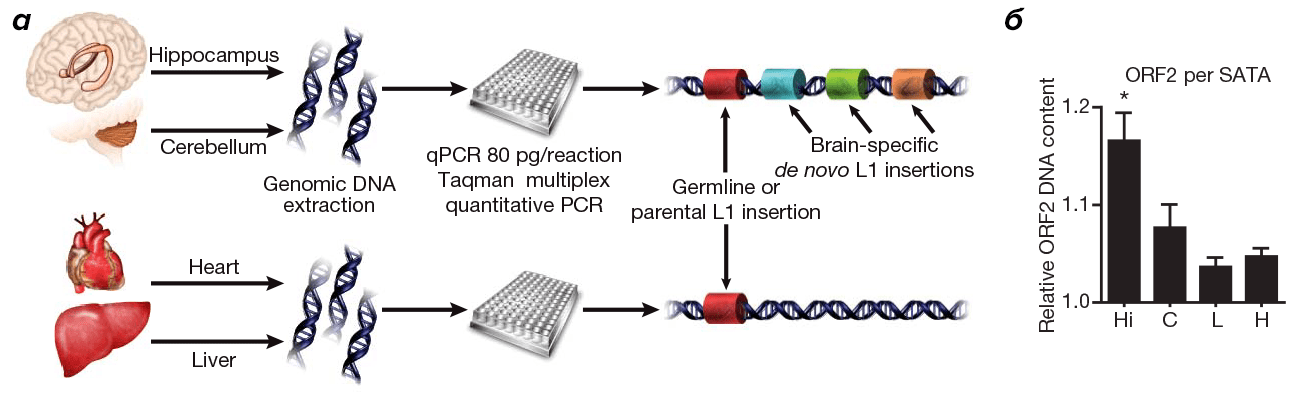
Рисунок 3. Результаты сравнительного анализа относительного количества копий L1 в мозге, сердце и печени человека. В двух отделах мозга — гиппокампе и мозжечке — число копий L1 было наибольшим (б: обозначены Hi и С), тогда как в сердце и печени их число было достоверно меньше (б: обозначены Н и L).
Мощные механизмы, подавляющие активность ретроэлементов в геноме человека, работают уже многие миллионы лет. Так, в самой нуклеотидной последовательности L1 заложены несколько регуляторных элементов, воздействуя на которые можно существенно подавлять его активность и транскрипцию. Здесь работает и одно из серьезнейших и универсальных орудий подавления экспрессии генов — метилирование ДНК. Было показано, что метилирование промотора L1 подавляет его активность, а мутации гена MeCP2 (нарушающие работу белка МеСР2 — транскрипционного репрессора, который связывается с метилированными участками ДНК и подавляет экспрессию находящихся там генов), стимулируют ретротранспозиции L1 в мозге. Аналогичное нарушение работы этого гена у человека может провоцировать психоневрологическое наследственное заболевание — синдром Ретта. Оно встречается почти исключительно у девочек и является следующей по частоте после синдрома Дауна специфической причиной тяжёлой умственной отсталости у девочек. Исследователи предполагают, что ретроэлементы могут участвовать в проявлении эффектов мутаций MeCP2 при этой патологии, однако каким именно образом, еще неясно.
Ввиду того, что последствия активности L1 непредсказуемы, возникает вопрос, почему эти элементы генома не были элиминированы в процессе эволюции? Деятельность ретроэлементов в клетках зародышевой линии по праву считается одним из двигателей эволюции человека ввиду их массовости и высокой активности в течение последних нескольких десятков миллионов лет. По приблизительным оценкам, 0,3% всех мутаций у людей обусловлены активностью ретроэлементов, а в клетках зародышевой линии частота ретротранспозиций L1 оценивается, по разным данным, в одну вставку на 20–200 рождений. По мнению Гейджа и Муотри, высокая активность L1 в мозге хоть и не наследуется, но способствует генерации большего количества генетически и функционально разнообразных нервных клеток у каждого отдельного индивидуума. Это может приводить к проявлению более широкого спектра когнитивных способностей и давать больше возможностей для адаптации к новым условиям среды. Широкую почву для спекуляций на этой почве дают данные о том, что наиболее активная в настоящее время линия L1 человека возникла около 2,7 млн. лет назад после отделения двуногих людей от шимпанзе, когда наши общие предки-гоминиды впервые начали использовать каменные орудия. И таким образом, ретроэлементы типа L1 могли оказаться одним из факторов, способствовавших появлению вида Homo sapiens.
Литература
- Tatjana Singer, Michael J. McConnell, Maria C.N. Marchetto, Nicole G. Coufal, Fred H. Gage. (2010). LINE-1 retrotransposons: mediators of somatic variation in neuronal genomes?. Trends in Neurosciences. 33, 345-354;
- Fred H. Gage, Alysson R. Muotri. (2012). What Makes Each Brain Unique. Sci Am. 306, 26-31;
- Alysson R. Muotri, Maria C. N. Marchetto, Nicole G. Coufal, Ruth Oefner, Gene Yeo, et. al.. (2010). L1 retrotransposition in neurons is modulated by MeCP2. Nature. 468, 443-446;
- Alysson R. Muotri, Vi T. Chu, Maria C. N. Marchetto, Wei Deng, John V. Moran, Fred H. Gage. (2005). Somatic mosaicism in neuronal precursor cells mediated by L1 retrotransposition. Nature. 435, 903-910;
- Nicole G. Coufal, José L. Garcia-Perez, Grace E. Peng, Gene W. Yeo, Yangling Mu, et. al.. (2009). L1 retrotransposition in human neural progenitor cells. Nature. 460, 1127-1131;
- Richard Cordaux, Mark A. Batzer. (2009). The impact of retrotransposons on human genome evolution. Nat Rev Genet. 10, 691-703;
- Тайны «молекулярных паразитов», или Как путешествовать по геному;
- Флуоресцирующая Нобелевская премия по химии.