
SciNat за декабрь 2023 #3: антитела против болезни Альцгеймера, вирусы против вирусов и дружелюбные змеи
17 декабря 2023
SciNat за декабрь 2023 #3: антитела против болезни Альцгеймера, вирусы против вирусов и дружелюбные змеи
- 380
- 0
- 0
Иллюстрация на обложке нового выпуска журнала Nature посвящена циклу опубликованных в нем масштабных исследований по картированию мозга мыши. Исследователи, работающие в рамках проекта по изучению клеток мозга BRAIN Initiative, представляют девять статей, которые картируют весь мозг мыши с беспрецедентной детализацией. Три статьи описывают транскриптомные и пространственные атласы клеток всего мозга мыши. Атласы отображают молекулярные сигнатуры, пространственную организацию и межклеточные взаимодействия тысяч типов клеток. Пара статей исследует связи между идентичностью нейронов и местом, где они распространяют свои аксоны. В трех других статьях исследуется эпигенетический ландшафт мозга мыши, изучаются регуляторные элементы в различных типах клеток. Наконец, в последней статье используются данные секвенирования одноклеточной РНК 17 видов позвоночных, чтобы исследовать эволюцию типов нейрональных клеток в сетчатке. — BICCN: The first complete cell census and atlas of a mammalian brain.
-
Автор
-
Редактор
Новый декабрьский дайджест SciNat спешит порадовать вас новостями из мира большой науки. Вы узнаете о том, как микробиом кишечника спасает нас, «объедая» болезнетворных бактерий. Как складывалась судьба индейских собак Северной Америки? Какие антитела используют для лечения болезни Альцгеймера? Правда ли, что змеи умеют заводить друзей, и можно ли победить вирусы при помощи других вирусов? Читайте в новом выпуске.
Микробиология
Разнообразие микробиома защищает от патогенов, блокируя им питательные вещества
Разнообразные виды бактерий, обитающие в нашем кишечнике, играют ключевую роль для здоровья человека. Одним из главных преимуществ нашей микробиоты является ее устойчивость к колонизации кишечника болезнетворными патогенными микроорганизмами. Было обнаружено множество механизмов, влияющих на способность микробиоты обеспечивать устойчивость к чужеродной колонизации, но эти механизмы часто зависят от контекста и конкретных штаммов или видов бактерий. В результате нам не хватало общих принципов, позволяющих предсказать, какие сообщества микробиоты будут защищать организм, а какие позволяют пришельцам основать колонии у нас в кишечнике.
В новом исследовании, опубликованном в журнале Science, ученые культивировали 100 симбионтов кишечника человека индивидуально с болезнетворными бактериями Klebsiella pneumoniae и Salmonella Typhimurium, а затем ранжировали симбионтов на основе их способности обеспечивать устойчивость к чужеродной колонизации. Однако в результате анализов оказалось, что даже самые эффективные виды симбионтов обеспечивали лишь частичную защиту от патогенов.
Тогда ученые объединили виды в разнообразные сообщества, насчитывающие до 50 видов, и обнаружили сочетания, при которых рост патогенов был значительно ограничен. Те же закономерности наблюдались, когда мышей с отсутствующей микрофлорой сначала заселяли подмножеством этих сообществ, а затем заражали патогеном. Таким образом, микробиомное разнообразие оказалось чрезвычайно важно для сопротивления колонизации, но также был важен и состав сообщества. Исследователи смогли объяснить эти закономерности способностью некоторых сообществ блокировать рост патогенов, потребляя питательные вещества, в которых нуждается сам патоген. Блокированию питательных веществ способствует как разнообразие, так и присутствие определенных ключевых видов, которые увеличивают перекрытие между использованием питательных веществ сообществом и патогеном. Включение ключевых видов, тесно связанных с патогеном, может иметь решающее значение для обеспечения защиты сообщества, поскольку обеспечивает более высокую степень их метаболического перекрытия.
Однако этого обычно недостаточно. Присутствие дополнительных, часто отдаленно родственных видов также необходимо для обеспечения блокировки питательных веществ и устойчивости к чужеродной колонизации. Наконец, ученые использовали отбор по принципу блокировки питательных веществ, чтобы in silico спрогнозировать состав более или менее защищающих сообществ для создания нового целевого штамма Escherichia coli, устойчивого к противомикробным препаратам. Эта работа показала, что можно успешно идентифицировать защитные сообщества из большого количества возможных комбинаций, используя как фенотипические признаки метаболического перекрытия, так и более общие данные геномного перекрытия.
Полученные результаты подтверждают идею о том, что более разнообразные микробиомы могут принести пользу здоровью, а устойчивость к колонизации является коллективным свойством сообществ микробиома; другими словами, один штамм является защитным только в сочетании с другими. Ключевое значение имеет совпадение профилей потребления питательных веществ между сообществом и патогеном. Подробнее — Microbiome diversity protects against pathogens by nutrient blocking, «Биомолекула»: «Микробные фармацевты внутри нас. Человеческий микробиом — спаситель и убийца», «Микробиом кишечника: мир внутри нас».
Геномика
Анализ ДНК раскрывает историю вымершей породы собак, которую коренные народы Америки разводили ради шерсти
Собаки — это не просто питомцы и компаньоны человека с первобытных времен. Зачастую они напрямую помогали в выживании человеческих популяций. Особенно это заметно в общинах коренных народов, расположенных вокруг моря Селиш — региона, занимающего десятки тысяч квадратных миль на северо-западе Тихого океана, недалеко от современного Ванкувера и Сиэтла. Однако народы прибрежных индейцев Селиш придумали новое применение для четвероногих питомцев — традицию ткачества из толстой шерсти особой породы собак. В новой работе журнала Science ученые изучили последовательность генома собаки индейцев Селиш по кличке Барашек, умершей в 1859 году. Этот анализ был объединен с историческими знаниями, предоставленными местными общинами коренных народов, чтобы собрать информацию о методах разведения и генетических модификациях, лежащих в основе этого исключительного фенотипа собак.
Барашек сопровождал этнографа Джорджа Гиббса в экспедиции по исследованию северо-западных границ (1857–1862 гг.), целью которой было решение пограничных вопросов между Соединенными Штатами и Великобританией. Шкурка Барашка сохранилась в коллекции Смитсоновского института в Вашингтоне (см. фото). Исследователи использовали образцы шкуры, чтобы получить последовательность генома, в которой каждый нуклеотид был прочитан в среднем чуть более трех раз. Авторы сравнили последовательность Барашка с последовательностями генома других животных, в том числе короткошерстной собаки, которая умерла в этом регионе (залив Семиахму на северо-западе Тихого океана) в 1858 году. Кроме того, было проведено сравнение с несколькими геномами собак, живших примерно от 5000 до 500 лет назад до прибытия европейских колонизаторов, а также с койотами и современными породами собак.
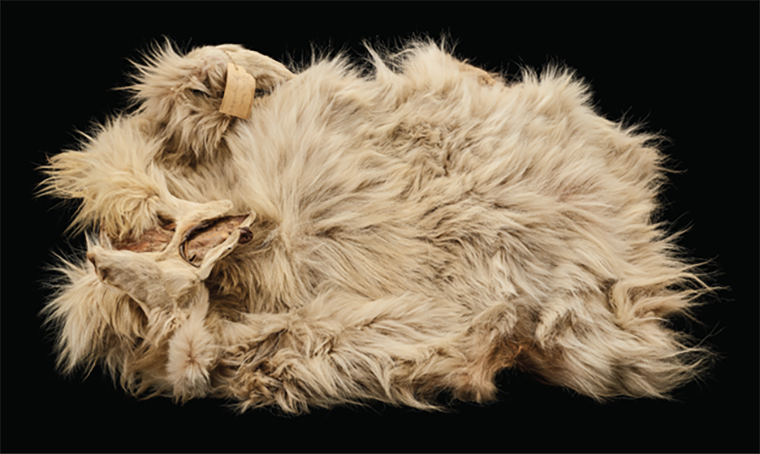
Шкурка собаки по кличке Барашек, питомца прибрежных индейцев Селиш, умершей в 1859 году. Шкура хранится в коллекциях Смитсоновского института в Вашингтоне, округ Колумбия.
The history of the Coast Salish “woolly dogs”, фото предоставлено Национальным музеем естественной истории
Митохондриальная ДНК Барашка (мтДНК) наиболее похожа на мтДНК собаки, которая жила на северо-западе Тихого океана примерно 1500 лет назад. Это указывает на прямую местную материнскую линию наследования, поскольку, как мы знаем, мтДНК передается только по наследству от матери к потомству. Короткошерстная собака из региона моря Селиш, напротив, несла еще один гаплотип мтДНК, происходящий из Европы, который в значительной степени заменил гаплотипы линий собак-аборигенов по мере колонизации Америки. Данные ядерного генома подтвердили, что геном Барашка в основном произошел от геномов собак до контакта с европейцами, но также имел ~16% европейских примесей. Это указывало на недавнюю историю этих примесей в его генеалогии, которые произошли вероятно, за 18–47 лет до его рождения.
Сохранение ~84% генома коренных американских собак в геноме Барашка контрастирует с повсеместным распространением европейских геномов, завезенных колонизаторами, и среди собак, которые сейчас населяют Америку. Это указывает на то, что народы прибрежных индейцев Селиш успешно сохраняли генетическую целостность своей линии собак в течение значительного периода времени после первого контакта с колонизаторами. Это, а также относительно ограниченные различия, выявленные между двумя копиями каждой из хромосом Барашка, перекликаются с информацией индейцев, которая указывают на то, что шерстистых собак разводили в изолированных загонах на прибрежных островах, чтобы снизить риск скрещивания с другими собаками.
Ученые также идентифицировали гены, в которых Барашек накопил избыток несинонимичных мутаций, которые влияют на кодируемый белок и, таким образом, потенциально имеют биологические последствия. Они отфильтровали гены, демонстрирующие несинонимичные мутации у современных пород собак и других собак коренных жителей Америки, чтобы получить список потенциальных генетических изменений, которые отвечают за фенотип шерсти собак побережья Селиш. Обзор литературы показал, что 28 отобранных генов-кандидатов участвуют в функционировании волосяных фолликул и росте волос. К ним относятся мотив KN и домены анкириновых повторов 2 (KANK2); гомологичный человеческий ген участвует в редкой врожденной аномалии кожи головы, которая вызывает фенотип «пушистых волос». Однако мутации, связанные с модификациями шерсти у современных пород собак, практически отсутствуют в геноме Барашка. Таким образом, общины прибрежных салиш создали линию коренных собак с отличными биологическими характеристиками. Точные сроки этого ее появления неясны, но археологические и генетические данные позволяют предположить, что возраст этой шерстистой породы собак датируется как минимум ~2000—5000 годами. — The history of the Coast Salish “woolly dogs”.
Дементология
Антитела, нацеленные на агрегаты бета-амилоида, замедляют снижение когнитивных показателей при болезни Альцгеймера
Современные клинические исследования показали, что три моноклональных антитела — адуканумаб, леканемаб и донанемаб — могут быть нацелены на отложения амилоида-β (Aβ) в мозге, замедляя когнитивное и функциональное снижение при ранней стадии болезни Альцгеймера (БА). Данные клинических исследований фазы 3 у лиц с БА с легкой симптоматикой демонстрируют, что снижение отложений Aβ имеет умеренную клиническую пользу. Это подтверждает центральный принцип гипотезы амилоидного каскада, которая предполагает, что отложения Aβ являются первопричиной, инициирующей БА. Однако они также показывают, что воздействие на отложения Aβ на симптоматической стадии заболевания не является панацеей. Кроме того, исследования подчеркивают ключевую роль клеточной визуализации и жидкостных биомаркеров в разработке методов лечения БА. Открытым остается вопрос побочных эффектов со стороны иммунитета пациентов на введение антител.
На протяжении десятилетий воздействие на Aβ было основополагающим подходом для разработки лечения БА. После многочисленных клинических неудач при различных подходах к лечению сторонники Aβ в качестве мишени и гипотеза амилоидного каскада забеспокоились, что нацеливание на Aβ может оказаться невозможным, даже если он действительно играет важную триггерную роль при БА. Кроме того, многие были обеспокоены тем, что воздействие на Aβ в симптоматической фазе БА, при котором присутствует значительная нейродегенерация, может не принести пользы. Действительно, агрегация и отложение Aβ начинается за 2–3 десятилетия до появления симптомов и сопровождается другими патологическими изменениями, включая накопление гиперфосфорилированного тау-белка.
У пациентов с очень ранними когнитивными нарушениями, вызванными БА, применение адуканумаба, леканемаба и донанемаба пока не является панацеей, но все же замедляет снижение когнитивных функций на ~25—30% в течение 18 месяцев. Такое лечение также связано с заметным снижением показателей биомаркеров патологии БА, включая амилоидную позитронно-эмиссионную томографию головного мозга (ПЭТ) и концентрации фосфорилированного тау в спинномозговой жидкости или плазме крови. Эти моноклональные антитела обладают общей способностью преимущественно связывать депонированный Aβ и активировать механизмы иммунного клиренса.
Эти общие свойства, вероятно, лежат в основе их влияния на биомаркеры БА и клиническое прогрессирование болезни, а также в основе их побочных эффектов. Учитывая отсутствие сообщений об эффективности антител со специфичностью к растворимому Aβ, селективное нацеливание на депонированный, агрегированный Aβ, по-видимому, является необходимым условием для эффективности лечения, равно как и создание олигомеров этих антител. Адуканумаб и леканемаб связывают агрегаты Aβ с более высокой степенью сродства по сравнению с мономером.
Результаты испытаний для каждого антитела скорее похожи, чем различны (разница в скорости замедления прогрессирования болезни <10%), поэтому трудно сделать вывод, действительно ли новые методы лечения различаются с точки зрения клинического эффекта — или существуют факторы, влияющие на относительную достоверность клинических испытаний. Продольные, основанные на омике исследования биомаркеров, наряду со строгим посмертным анализом мозга людей после лечения могут дать более четкую картину биологии, лежащей в основе пользы и риска лечения БА антителами. — Immunotherapies for Alzheimer’s disease, «Биомолекула»: «Альбумин VS Альцгеймер», «На руинах памяти: настоящее и будущее болезни Альцгеймера», «Болезнь Альцгеймера: ген, от которого я без ума».
Иммунология
Раннее развитие иммунных клеток легких человека и их роль в судьбе эпителиальных клеток
С рождения дыхательные пути обеспечивают защиту организма от респираторных патогенов и вдыхаемых токсинов, однако мало что известно о раннем развитии иммунных клеток легких. Используя транскриптомику отдельных клеток, ученые охарактеризовали иммунные клетки эмбриона и плода человека в развивающихся легких между 5 и 22 неделями после зачатия. Были обнаружены все стадии развития B-клеток, включая зрелые B-1-подобные клетки, что позволяет предположить, что легкие плода обеспечивают локальную нишу для созревания B-клеток. Миелоидные клетки были широко распространены, в том числе вблизи кончиков эпителия, и продуцировали ИЛ-1β, который индуцировал дифференцировку эпителиальных стволовых клеток в базальные клетки в органоидах легких плода. В совокупности эти данные позволили создать иммунный атлас развивающихся легких человека и предполагают участие иммунных клеток плода в управлении развитием легочного эпителия. —Early human lung immune cell development and its role in epithelial cell fate.
Нейробиология
Консервативные и дивергентные программы регуляции генов неокортекса млекопитающих
Дивергенция (видовое расхождение) цис-регуляторных элементов генома определяет видоспецифичные признаки, но как это проявляется в эволюции неокортекса на молекулярном и клеточном уровне, остается неясным. В новой статье журнала Nature ученые исследовали программы регуляции генов в первичной моторной коре человека, макаки, мартышки и мыши с использованием мультиомиксного анализа отдельных клеток. Была изучена экспрессия генов, доступность хроматина, метиломная ДНК и профили конформации хромосом более чем 200 000 клеток. На основе этих данных выведены доказательства того, что дивергенция экспрессии факторов транскрипции соответствует видоспецифичным ландшафтам эпигенома. Известно, что благодаря способности ДНК формировать петли и сложные структуры, гены и элементы генома, такие как энхансеры, могут находиться рядом друг с другом в пространстве клеточного ядра, несмотря на наличие длинного фрагмента ДНК, который их разделяет. Обнаружено, что консервативные и дивергентные регуляторные функции генов также отражаются в эволюции трехмерного генома. Мобильные элементы составляют почти 80% специфических для человека кандидатов цис-регуляторных элементов в клетках коры. С помощью машинного обучения ученые разрабатывают основанные на последовательностях предикторы потенциальных цис-регуляторных элементов у разных видов и демонстрируют, что геномный регуляторный синтаксис хорошо сохраняется у родственных животных — от грызунов до приматов. Наконец, ученые показали, что эпигенетическая консервативность в сочетании со сходством последовательностей помогает выявить функциональные цис-регуляторные элементы и повышает нашу способность интерпретировать генетические варианты, способствующие неврологическим заболеваниям и различным чертам характера. — Conserved and divergent gene regulatory programs of the mammalian neocortex.
Серпентология
Подвязочные змеи заводят друзей и организуют свое общество вокруг самок
Открытие, описанное в журнале Science, стало результатом первого в своем роде исследования тысяч диких змей.

Новые исследования показывают, что подвязочные змеи собираются в сообщества, возглавляемые пожилыми самками.
У подвязочных змей есть что-то общее со слонами, косатками и голыми землекопами: они образуют социальные группы, сосредоточенные вокруг самок. Согласно самому обширному полевому исследованию социального поведения змей, оказалось, что у пресмыкающихся есть четкие «сообщества», а самки действуют как лидеры, которые связывают группы животных вместе и направляют их.
Экологи долгое время считали, что змеи — асоциальные одиночки, которые проводят время вместе только ради основных функций, таких как спаривание и спячка. Однако в 2020 году Морган Скиннер, поведенческий эколог из Университета Уилфрида Лорье, и его коллеги в лабораторных экспериментах показали, что у содержащихся в неволе подвязочных змей есть «друзья» — конкретные змеи, чью компанию они предпочитают другим. Тем не менее, исследований диких змей не было, «потому что они очень скрытны и их трудно найти», — говорит Скиннер.
Затем он узнал, что Министерство транспорта Онтарио профинансировало беспрецедентное долгосрочное исследование огромной популяции подвязочных змей Батлера (Thamnophis Butleri) в Виндзоре, Канада. Экологи начали следить за ползунами размером с флейту в 2009 году, чтобы уберечь их от строительства близлежащей дороги. Они регулярно ловили змей на территории исследования площадью 250 гектаров, используя опознавательные метки. Таким образом они отследили более 3000 особей в течение 12 лет.
Чтобы выяснить это, Скиннер, Хэйзелл и их коллеги объединились, используя идеи «социальных сетей» из человеческой психологии. Они представляли отдельных змей как отдельные точки или узлы в сети. Когда в один и тот же день в одном месте были пойманы две змеи, исследователи отмечали это событие линией, соединяющей их узлы. За прошедшие годы было установлено, что змеи не бродят независимо и беспорядочно, а образуют четкие «сообщества», говорит Скиннер. Эти группы «друзей», предпочитавших компанию друг друга, насчитывали в среднем от трех до четырех змей, но некоторые из них достигали 46 змей.
Эти данные не просто подтвердили предыдущие лабораторные выводы Скиннера о дружбе пресмыкающихся. Самки змей явно были гораздо более общительными, чем самцы, а самок постарше чаще всего встречали среди друзей других змей. Когда исследователи изобразили каждое сообщество змей как сеть связанных узлов, эти пожилые самки, как правило, образовывали центры своей сети. Кроме того, более молодые члены сообщества, казалось, «следовали» за старшими, появляясь там, где тех ранее находили. — Garter snakes make friends, organize their society around females, «Биомолекула»: «Как увидеть тепло?».
Вирусология
Бороться с вирусами при помощи вирусов? «Генный драйв» предлагает новую стратегию борьбы с инфекциями
Если ваша иммунная система или лекарства не могут остановить вирусную инфекцию, почему бы не направить вирус против самого себя? Эту провокационную идею сейчас пытаются реализовать несколько лабораторий. Они изучают, может ли преднамеренное введение сконструированных вирусов людям, которые заражены естественными родственниками этих вирусов, «ввести» в них чужеродный ген, который в конечном итоге уничтожит инфекцию.
Ни одна лаборатория пока не смогла победить инфекцию у животных таким способом, но теперь группа ученых показала, что это теоретически возможно. Этот генетический драйв использует редактор генома CRISPR для проведения генетической операции, которая ускоряет распространение гена через потомство. До сих пор наибольшее внимание ученые уделяли добавлению генных драйвов к таким животным, как грызуны и комары, для контроля их численности. Но в препринте статьи на прошлой неделе команда исследователей сообщила о подобном эффекте с вирусом герпеса-1 (ВПГ-1). Когда мышам были привиты как сконструированные, так и немодифицированные вирусы герпеса, генный драйв конвертировал до 90% нативного вируса в организме животного — возможно, этого достаточно, чтобы предотвратить возникновение таких симптомов, как болезненные герпесные высыпания, вызванные инфекцией простого герпеса-1. Второй группе удалось внедрить генные драйверы в вирус простого герпеса-1, который растет в инфицированных клетках в лабораторных чашках.
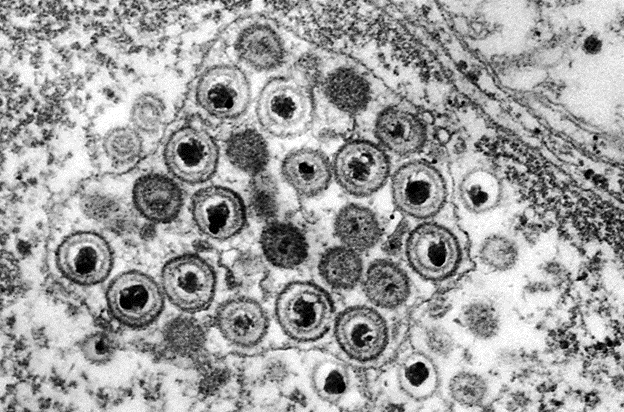
Когда несколько герпесвирусов заражают ядро клетки (показано на рисунке), они иногда обмениваются генами — поведение, которое известно под термином «генный драйв» может быть использовано для их уничтожения.
Работа по внедрению вирусного генного драйва далека от излечения инфицированного вирусом человека. Никто не знает, например, какую генетическую модификацию должен распространить этот механизм, чтобы подавить инфекцию. Но другие ученые видят в этом потенциал. Новые исследования «убедительны», говорит Ребекка Шапиро, молекулярный микробиолог из Университета Гвельфа, экспериментировавшая с генными драйвами у грибов. «Это открывает множество интересных возможностей для использования такого рода методов генного драйва для модификации вирусных популяций и, возможно, использования их в качестве новых терапевтических средств».
Исследователи развили генные драйвы в основном у животных, которые размножаются половым путем. Они создали генетически модифицированных самок или самцов, чьи шансы передать ген их потомству значительно превышают 50% — типичный менделевский шанс на то, что потомок унаследует определенный вариант гена. Большинство экспериментов направлено на распространение модификаций, которые убивают потомство или делают его бесплодным, что является возможной стратегией борьбы с вредителями. Однако такая работа до сих пор проводилась только в лабораториях из-за опасений, что выпуск в живую природу животных с генным драйвом может иметь ужасные последствия, такие как случайное уничтожение целого вида или причинение вреда животным, которые не являются целью вмешательства.
В отличие от людей, вирусы не занимаются генным сексом друг с другом при размножении. Они просто приказывают инфицированным клеткам читать свои гены и производить новые вирусы. Но если несколько вирионов заражают одну клетку — как это происходит с вирусами герпеса — они часто совершают нечто похожее на совокупление, случайным образом меняя генетические последовательности внутри ядра. Эта «рекомбинация» приводит к появлению вирусного потомства, которое распространяет новые геномы, а генный драйв захватывает этот естественный процесс, вызывая и усиливая генетические изменения, которые в конечном итоге могут вывести из строя целую популяцию вирусов.
Три года назад вирусологи Мариус Вальтер и Эрик Вердин из Института исследований старения Бака продемонстрировали, что генный драйв возможен в вирусе герпеса. В экспериментах на клеточных культурах они показали, что вирусы человеческого цитомегаловируса (hCMV), наделенные генным драйвом, созданным на основе CRISPR, могут распространять этот драйв на другие hCMV в инфицированных клетках. Генный драйв в основном состоял из генетических последовательностей, кодирующих два компонента CRISPR: фермент, разрезающий ДНК, известный как Cas, и направляющую РНК, которая направляет фермент в определенное место вирусного генома, где он разрывает ДНК. Исследователи присоединили к комплексу ген флуоресцентного маркера, чтобы можно было отслеживать движение по мере того, как цепная реакция распространяет его на еще большее количество вирусов герпеса.
Исследование также показывает, что генный драйв может сократить, если не уничтожить, популяцию вируса. Гидовая РНК перевела импульс на парковку внутри определенного вирусного гена. На самом деле мишень не была выбрана для сдерживания вируса, но ген кодировал белок, который защищает патоген от иммунитета хозяина. Когда вставка отключила ген, это снизило уровень защитного белка и сделало вирус более уязвимым. — Fighting viruses with viruses? ‘Gene drive’ offers new strategy to beat infections, «Биомолекула»: «Биоконтроль популяций в современном мире».






