
Микробные фармацевты внутри нас. Человеческий микробиом — спаситель и убийца
20 сентября 2019
Микробные фармацевты внутри нас. Человеческий микробиом — спаситель и убийца
- 2571
- 0
- 8
Кишечные микроорганизмы под сканирующим электронным микроскопом
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Давно не новость, что микробиом может влиять на многие важнейшие процессы в организме хозяина. Удивительно лишь то, что до сих пор в этом вопросе достаточно белых пятен, одно из которых — это влияние микроорганизмов на биотрансформацию всего, что человек тянет в рот, и не только.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Известный канадский врач достаточно метко охарактеризовал одну из важнейших проблем, стоящих в медицине: «Если бы пациенты не были такими разными, медицина вполне могла бы быть наукой, а не искусством» [1].
Уильям Ослер, конечно, ничего не знал о генетике. Но даже в XIX веке было широко известно, что люди очень по-разному реагируют на одни и те же лекарства, которые, к слову, могут быть дорогостоящими и опасными, а иногда — и то, и другое вместе.
Предполагалось, что расшифровка последовательности трех миллиардов букв, составляющих наш геном, наконец, распутает генетическую основу каждой болезни и позволит учесть бóльшую часть различий между людьми. Но все стало только сложнее. Самым поразительным оказалось то, что генов у человека вовсе не 100 000, а всего лишь около 20 000, причем различия между этими генами не полностью объясняют широкую изменчивость среди людей [2].
Обитатели нашего кишечника в совокупности кодируют на порядки больше генов, чем весь геном человека. Похоже, это и есть одна из деталей, влияние которой на болезни и действие лекарств мы пока упустили. Все это генетическое разнообразие охватывает богатый набор ферментов, потенциально способных принять участие во многих процессах, в том числе, и в метаболизации лекарств [3].
Темный лес нашего внутреннего мира
Наше тело колонизировано триллионами различных микроорганизмов, среди которых встречаются представители более чем тысячи видов, относящихся к бактериям, грибам и даже археям [4]. Большая их часть обосновалась в кишечнике, что создает некоторые трудности для их изучения, но, на первый взгляд, небольшие. Казалось бы, что сложного в том, чтобы взять пробу из кала и культивировать его обитателей на питательной среде?
Так долгое время и изучали микрофлору. Но с появлением технологии секвенирования — установления последовательности нуклеотидов в ДНК — выяснилось, что те микроорганизмы, которых мы научились культивировать, составляют всего около 7–10% разнообразия всех обитателей нашего кишечника. Бóльшая часть микроорганизмов настолько приспособилась к его специфичным условиям, что моментально гибнет, стоит им лишиться привычного окружения. Внутри нашего тела микроорганизмы образуют сложные многовидовые сообщества, в которых взаимодействуют настолько тесно, что каждый из них может погибнуть без своих соседей. Вот и приходится изучать их по фрагментам ДНК, полученных с калом.
Метагеномика — это наука об изучении генетического разнообразия микроорганизмов, полученных непосредственно из среды. В данном случае — из кишечника. Она изменила наше понимание микробного мира, позволив обойти необходимость выделять и культивировать отдельные виды, — теперь мы можем судить о никогда ранее не виданных таксонах по последовательностям ДНК, полученным напрямую из микробного сообщества [5].
Обычно для анализа метагенома используют расшифровку последовательности гена, кодирующего 16S рРНК — молекулу, входящую в состав рибосомы. Часть этого гена очень консервативна, то есть универсальна для огромного числа организмов. Но некоторые его внутренние области варьируют, и с их помощью можно отслеживать пути эволюции.
Изучение генов микробного сообщества привело к появлению понятия микробиома — совокупности всех генов сообщества микроорганизмов. Микроорганизмы выполняют многие важнейшие функции в нашем организме: расщепление растительных полисахаридов, которые не усваиваются хозяином, биосинтез витаминов и аминокислот, детоксикация ядов, развитие иммунной системы хозяина и многое другое. От них зависят разнообразные процессы, на первый взгляд, никак от микроорганизмов не зависящие, — от нарушений метаболизма до психических заболеваний [6–9].
В 2008 году группа ученых из США запустила проект «Микробиом человека» (Human Microbiome Project, HMP), чтобы составить перепись населения хотя бы части обитателей нашего организма. Цель проекта — установить особенности взаимодействия хозяина и его симбионтов в норме и при патологических состояниях. Уже расшифровано более трех миллионов генов — это в 150 раз больше, чем все количество генов в нашем геноме [10], [11].
И все же сегодня фармакогенетика и фармакогеномика [12] нацелены в основном на изучение генома человека, а не совокупности генов микробиоты. Поэтому ее воздействие на метаболизм лекарств остается почти неизученным, хотя открытие такого влияния датируется почти веком [13], [14].
Как стрептококковую инфекцию лечили красителем
В истории этого открытия кроется настоящая драма — с нацистами, арестом, больной дочерью и Нобелевской премией, от которой пришлось отказаться. Но обо всем по порядку.
Немецкий ученый Герхард Домагк исследовал антибактериальный эффект красителей на гемолитических стрептококках — возбудителях рожистого воспаления, родильной горячки и гнилокровия (как тогда называли сепсис).
Кирпично-красный краситель синтезировали в попытке создать хорошую текстильную краску, родственную анилину. Позже ее назвали пронтозилом.
Эксперименты с пронтозилом на клетках не показали его антибактериальной активности, однако она уже была отмечена на мышах. Как это возможно? Оказалось, что кишечные микроорганизмы восстанавливают азо-связь пронтозила, превращая его в антибиотик сульфаниламид (рис. 1). Такая модификация влияет на широкий спектр соединений, и лишь недавно мы начали понимать, что биотрансформация лекарств кишечной микрофлорой может иметь куда большее значение, чем казалось ранее.
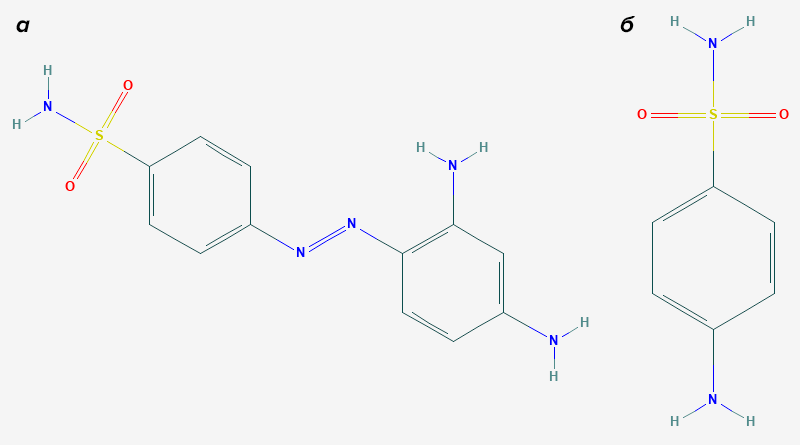
Рисунок 1. Краситель пронтозил (а) и продукт его метаболизма кишечной микрофлорой — сульфаниламид (б), обладающий антибактериальными свойствами

Рисунок 2. Герхард Домагк
Но тогда об этом ничего известно не было. И надо же было такому случиться, что до каких-либо серьезных испытаний пронтозила Домагку (рис. 2) пришлось его применить — причем применить на собственной дочери. Она уколола палец во время шитья, после чего развилось острое заражение крови. Лучшим вариантом была ампутация, в худшем дочь могла умереть — и Домагк решился дать ей дозу пронтозила. На мышах он показал хороший результат, но ни одного исследования на людях до того момента не проводилось, и нельзя было сказать, какая доза может помочь, а какая — убить. К счастью, все обошлось — дочь Домагка выздоровела, а после этого препарат попал в массовое производство [15].
Но здесь история не заканчивается. Шел 1939 год, Гитлер запретил своим подданным принимать Нобелевскую премию вскоре после того, как немецкому журналисту присудили премию мира за борьбу с милитаризмом в Германии. Но Домагк не отказался от своей награды, после чего был арестован гестапо. Конечно, вскоре он изменил свое решение, и о премии пришлось забыть. Лишь восемь лет спустя, через два года после окончания войны, он смог получить свой диплом лауреата.
После этого Герхард Домагк переключился на изучение химиотерапии для лечения рака, а его открытие было забыто на долгие годы. Полученный из красителя антибиотик по-прежнему использовали, но никто не взялся исследовать влияние микробиома на трансформацию химических веществ — в то время для этого попросту не было необходимых технологий.
Биотрансформация
Большинство лекарственных средств подвергается в организме биотрансформации — комплексу физико-химических и/или биохимических реакций, в результате которых соединение превращается в метаболит, который из организма вывести легче (рис. 3). Такие метаболиты, как правило, менее активны и менее токсичны, но иногда могут образовываться как более токсичные, так и более активные соединения.
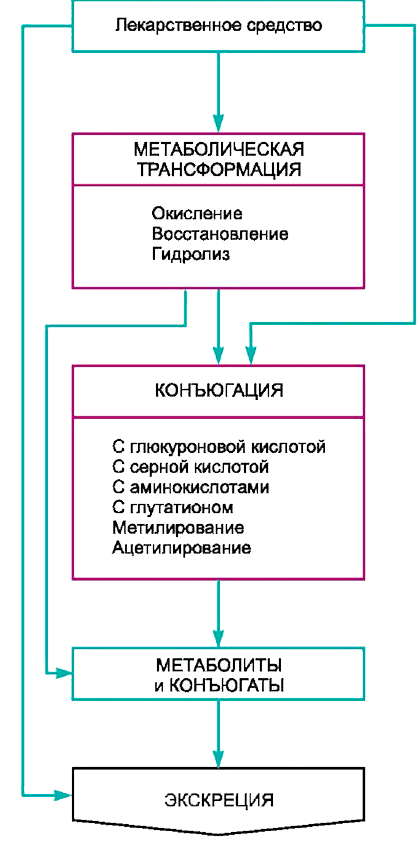
Рисунок 3. Путь лекарственного средства
Харкевич Д.А. «Фармакология»
Биотрансформация протекает в основном в печени, однако метаболизм может происходить и в тканях ЖКТ, легких, коже, плазме крови. Разные гены, формирующие ферментативную активность у разных людей, приводят к разному действию одних и тех же лекарств.
Выводятся лекарственные средства и их метаболиты в основном с мочой и желчью, причем при желчевыведении они могут модифицироваться повторно. Экскреция с желчью дает возможность бактериям еще раз активировать препарат в кишечнике (рис. 4), вызывая повышенную токсичность (пример этого явления — метаболизм иринотекана, широко используемого для лечения колоректального рака [16]).
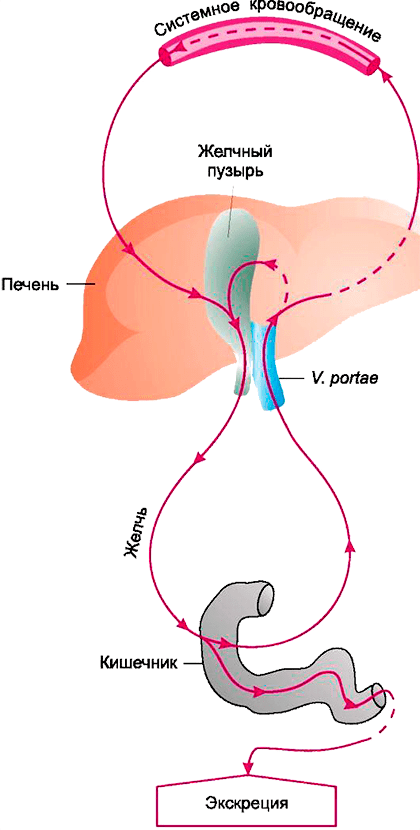
Рисунок 4. Кишечно-печеночная циркуляция веществ
Харкевич Д.А. «Фармакология»
Прямое влияние микробиоты на биотрансформацию
Микробиота нашего организма (включая кишечную, влагалищную и внутриопухолевую микрофлору) может напрямую метаболизировать ксенобиотики в активные, неактивные или токсичные метаболиты (рис. 5). Она также может косвенно влиять на биотрансформацию через изменение экспрессии генов хозяина.
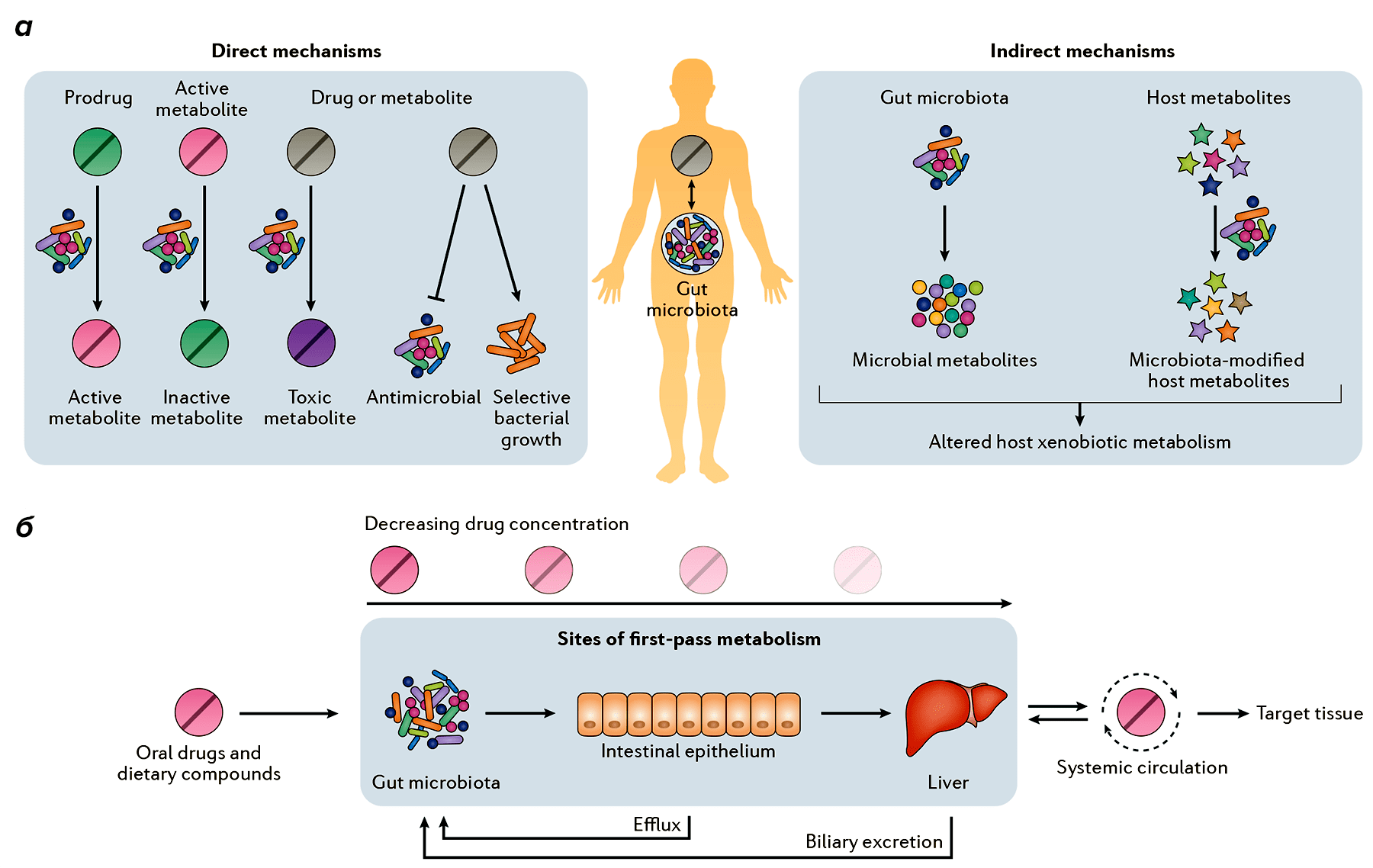
Рисунок 5. Влияние микробиоты кишечника на метаболизм лекарств. а — Кишечная микробиота может напрямую метаболизировать лекарства в активные, неактивные или токсичные метаболиты. Помимо этого, продукты ее нормальной жизнедеятельности и модифицированные продукты жизнедеятельности хозяина также могут участвовать в превращениях лекарств. б — До попадания в кровоток и ткани-мишени лекарства, принятые перорально, подвергаются метаболизму в кишечнике и печени.
Большое значение имеет и скорость поглощения лекарств. Плотность кишечных микроорганизмов увеличивается в подвздошной и толстой кишках, до которых лекарство может и не дойти. Зато метаболиты лекарств могут повторно сталкиваться с кишечной микробиотой после желчевыведения.
Микробиота кишечника может участвовать в биотрансформации десятков фармацевтических препаратов, меняя их эффективность и/или побочные эффекты.
Непрямое влияние микробиоты на биотрансформацию
Некоторые микроорганизмы пропускают лекарства прямо сквозь себя, модифицируя их по пути. Но этим влияние микробиоты не исчерпывается. Еще она способна влиять на экспрессию генов хозяина, то есть на то, как и в каком количестве с гена синтезируется белок.
Сравнение нормальных мышей и мышей, выращенных в стерильных условиях (отчего в их кишечнике отсутствуют микроорганизмы), показало, что микробиота влияет на экспрессию нескольких генов хозяина, участвующих в метаболизации и транспорте лекарств. Это влияние может быть локальным (в клетках кишечника) и отдаленным, влияющим на орган, чрезвычайно важный при детоксикации — печень [17]. Например, с изменением экспрессии генов в печени метаболизируются барбитураты — группа лекарств, применяемых для наркоза и снижения судорожной активности [18].
Вывод
Несмотря на важность проблем, которые приносит непредсказуемая модификация лекарств микроорганизмами, у нас все еще нет возможности ее контролировать или хотя бы полностью предвидеть.
Авторы исследования, опубликованного в июне 2019 года в Nature, провели тест для оценки влияния 76 штаммов кишечных микроорганизмов человека на 271 препарат (рис. 6) [22].
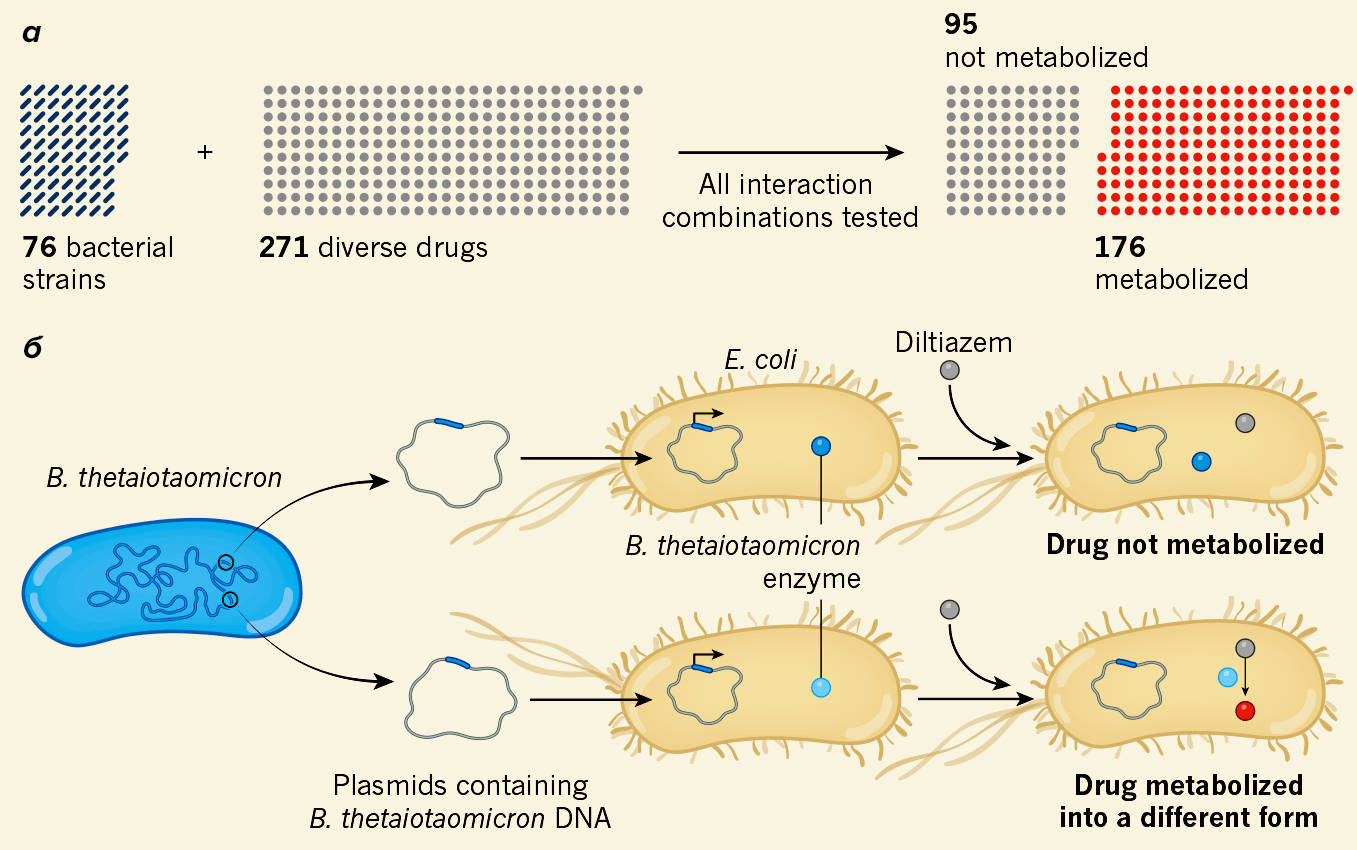
Рисунок 6. Изучение метаболизма лекарств кишечной микробиотой. а — Из тестируемых препаратов 65% были метаболизированы тем или иным штаммом. б — Bacteroides thetaiotaomicron — бактерия, метаболизирующая огромное количество препаратов. Для выявления ферментов, которые она при этом использует, фрагменты ее ДНК, кодирующие определенные белки, переносили в ДНК кишечной палочки, после чего она тоже начинала метаболизировать эти лекарства.
Лекарства выбрали при этом так, чтобы обеспечить максимальное разнообразие с точки зрения их структуры. В результате оказалось, что из всех препаратов 176 метаболизировались хотя бы одним из штаммов, причем модификации были совершенно разными: окисление, восстановление, ацетилирование и другие. При этом метаболит лекарства не обязательно мог быть только один [3].
Конечно, важность такого влияния микробиоты потрясает. И тем более удивительно, что знаем мы о нем удручающе мало. Бóльшая часть лекарств назначается перорально, и даже препараты, вводимые инъекционно, могут достигать кишечника, а значит — все они сталкиваются с нашей микрофлорой, и не только кишечной. Регулирование ее численности и состава в соответствии с нашими потребностями — цель, к которой мы стремимся, но между нашим пониманием и способностью применять знания все еще остается большой разрыв.
Одна из самых острых проблем медицины — нехватка антибиотиков, к которым у бактерий пока еще нет устойчивости. Нам известны тысячи антибиотиков, но применяют из них лишь сотни — остальные слишком токсичны для человека. Но токсичность хотя бы части соединений удастся понизить, если модифицировать их в соответствии с метаболизмом нашей микрофлоры.
Многие жизненно важные лекарства, не попавшие в практику именно из-за высокой токсичности, могут вернуться на рынок, если принимать их вместе с ингибиторами, нацеленными на микробные ферменты, участвующие в нежелательной биотрансформации. Таким же способом можно повысить эффективность многих лекарств.
Что и говорить, метаболизм бактерий, влияющий почти на все, чем мы пытаемся себя лечить, мешает даже в уничтожении рака (рис. 7) [19], [23]!
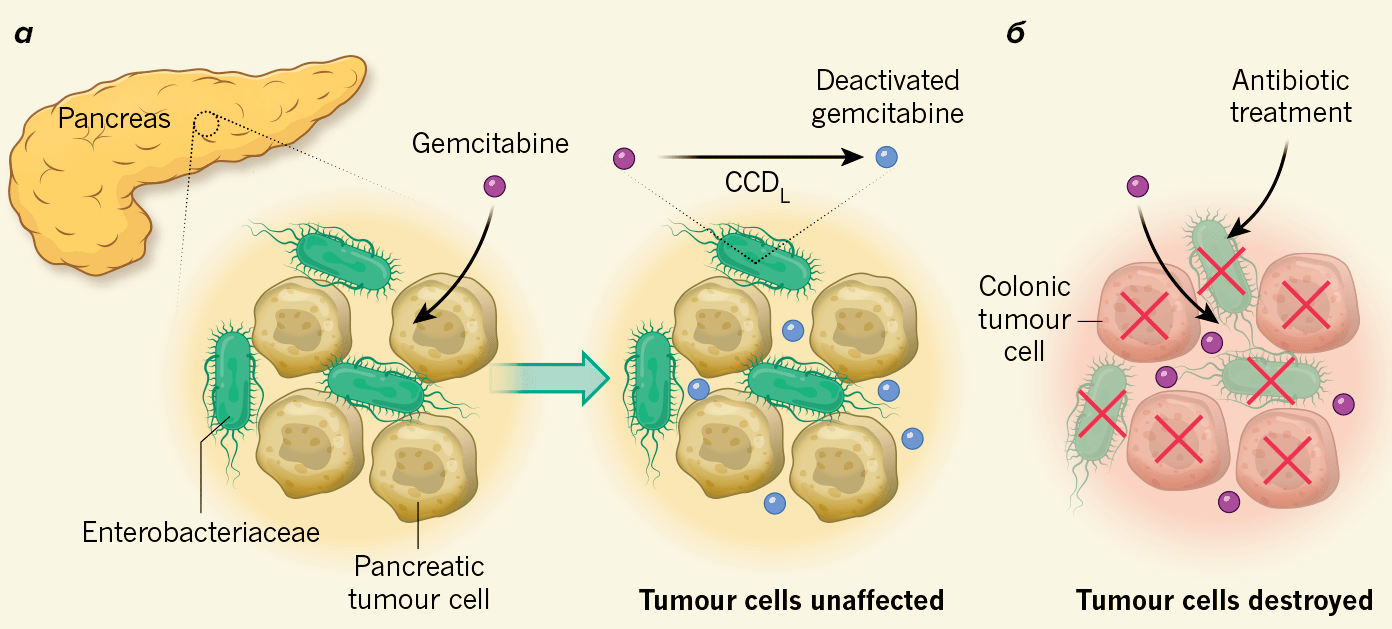
Рисунок 7. Бактерии могут деактивировать лекарства против рака. а — Авторы проанализировали образцы, выделенные из раковой опухоли поджелудочной железы человека, и обнаружили, что в них содержатся бактерии семейства Enterobacteriaceae. Они несут фермент цитидиндеаминазу, дезактивирующую препарат для химиотерапии — гемцитабин. б — Авторы изучили взаимосвязь между присутствием бактерий рода Enterobacteriaceae и эффективностью препарата. При уничтожении бактерий антибиотиком препарат убивал опухолевые клетки, в противном случае он терял эффективность.
Процессы биотрансформации, которые осуществляет огромная фабрика ферментов внутри нас — популяция микроорганизмов, — очень сложны и плохо изучены. В настоящее время список лекарств, проверенных на модификацию микрофлорой [20], очень мал, а ведь их тысячи и тысячи. Применение антибиотиков в сочетании с другими лекарствами подвергает пациента риску неожиданного проявления токсичности лекарства или вовсе потери его эффективности. Изучение этого вопроса требует большой работы ученых из разных дисциплин, таких, как фармакология, токсикология, микробиология, молекулярная биология, биоинформатика и аналитическая химия.
Литература
- The Lancet. (2010). Uncertainty in medicine. The Lancet. 375, 1666;
- International Human Genome Sequencing Consortium. (2004). Finishing the euchromatic sequence of the human genome. Nature. 431, 931-945;
- Michael Zimmermann, Maria Zimmermann-Kogadeeva, Rebekka Wegmann, Andrew L. Goodman. (2019). Mapping human microbiome drug metabolism by gut bacteria and their genes. Nature. 570, 462-467;
- Ruth E. Ley, Daniel A. Peterson, Jeffrey I. Gordon. (2006). Ecological and Evolutionary Forces Shaping Microbial Diversity in the Human Intestine. Cell. 124, 837-848;
- Rogan Carr, Shai S. Shen-Orr, Elhanan Borenstein. (2013). Reconstructing the Genomic Content of Microbiome Taxa through Shotgun Metagenomic Deconvolution. PLoS Comput Biol. 9, e1003292;
- Чего от нас хотят микробы?;
- Микробиом кишечника: мир внутри нас;
- Новые функции кишечной микрофлоры;
- Почему так сложно похудеть, или Влияние кишечной микробиоты на метаболизм;
- Jason Lloyd-Price, IBDMDB Investigators, Cesar Arze, Ashwin N. Ananthakrishnan, Melanie Schirmer, et. al.. (2019). Multi-omics of the gut microbial ecosystem in inflammatory bowel diseases. Nature. 569, 655-662;
- Wenyu Zhou, M. Reza Sailani, Kévin Contrepois, Yanjiao Zhou, Sara Ahadi, et. al.. (2019). Longitudinal multi-omics of host–microbe dynamics in prediabetes. Nature. 569, 663-671;
- Фармакогеномика: изучение генов на службе персонализированной медицины;
- Ronald Bentley. (2009). Different roads to discovery; Prontosil (hence sulfa drugs) and penicillin (hence β-lactams). J Ind Microbiol Biotechnol. 36, 775-786;
- A.T. Fuller. (1937). IS p-AMINOBENZENESULPHONAMIDE THE ACTIVE AGENT IN PRONTOSIL THERAPY ?. The Lancet. 229, 194-198;
- Gerhard Domagk — Biographical. (2019). NobelPrize.org;
- Lynda R. Wiseman, Anthony Markham. (1996). Irinotecan. Drugs. 52, 606-623;
- Ramy K. Aziz, Shaimaa M. Hegazy, Reem Yasser, Mariam R. Rizkallah, Marwa T. ElRakaiby. (2018). Drug pharmacomicrobiomics and toxicomicrobiomics: from scattered reports to systematic studies of drug–microbiome interactions. Expert Opinion on Drug Metabolism & Toxicology. 14, 1043-1055;
- Britta Björkholm, Chek Mei Bok, Annelie Lundin, Joseph Rafter, Martin Lloyd Hibberd, Sven Pettersson. (2009). Intestinal Microbiota Regulate Xenobiotic Metabolism in the Liver. PLoS ONE. 4, e6958;
- Christian Jobin. (2017). Bacterial snack attack deactivates a drug. Nature. 550, 337-339;
- Peter Spanogiannopoulos, Elizabeth N. Bess, Rachel N. Carmody, Peter J. Turnbaugh. (2016). The microbial pharmacists within us: a metagenomic view of xenobiotic metabolism. Nat Rev Microbiol. 14, 273-287;
- Links between gut microbes and depression strengthened. (2019). Nature. 566, 7-7;
- Kim Lewis, Philip Strandwitz. (2019). Microbes make metabolic mischief by targeting drugs. Nature. 570, 453-454;
- Кишечная микрофлора: третий нелишний в иммунотерапии рака.






