
SciNat за декабрь 2025 #2: маленькие тираннозавры, CAR-T-клетки против рака и самонагревающиеся растения
14 декабря 2025
SciNat за декабрь 2025 #2: маленькие тираннозавры, CAR-T-клетки против рака и самонагревающиеся растения
- 93
- 0
- 0
Обнаружен маленький тираннозавр. Тираннозавр рекс — один из самых знаковых и известных динозавров в поп-культуре. Однако на протяжении десятилетий он также является объектом споров. В центре дебатов находится окаменелый череп, обнаруженный в 1940-х годах. Казалось, что он принадлежит более мелкому родственнику тираннозавра. Первоначально описанный как новый вид — Nanotyrannus lancensis, этот череп затем был определен как череп молодого тираннозавра. В этом номере Nature ученые представляют доказательства, которые должны разрешить этот спор. Авторы описывают новый скелет небольшого тираннозавра, найденный в формации Хелл-Крик в Монтане. Останки исключительно хорошо сохранились, и исследователи смогли определить, что это была молодая взрослая особь, а значит, маленькие тирранозавры (нанотираннусы) действительно сосуществовали наравне со своими большими сородичами. — Nanotyrannus and Tyrannosaurus coexisted at the close of the Cretaceous.
-
Автор
-
Редактор
Из второго декабрьского выпуска дайджеста SciNat вы узнаете, как ученые научились бороться с раком, генетически модифицируя иммунные клетки внутри тела пациента. Новые исследования нейробиологов проливают свет на работу ансамблей нейронов при создании и поддержании воспоминаний. Обнаружен белок, нарушающий число хромосом в делящихся раковых клетках. Внедрение светочувствительных белков в нервы, вероятно, поможет нам в лечении различных болезней. Внезапное открытие одного из первых способов опыления, задолго до появления ярко окрашенных цветов — древние растения еще во времена динозавров научились нагреваться, чтобы привлекать насекомых.
Медицина, онкология
Первым пациентам помогли клетки, борющиеся с раком, которые были выращены в их же организме
Иммунные CAR-T-клетки эффективно лечат некоторые виды рака крови, включая множественную миелому, но их традиционное создание вне организма занимает около месяца, требует сложной генетической модификации, дорого стоит и сопровождается токсичной химиотерапией. Из-за этого часть пациентов не успевает получить лечение.
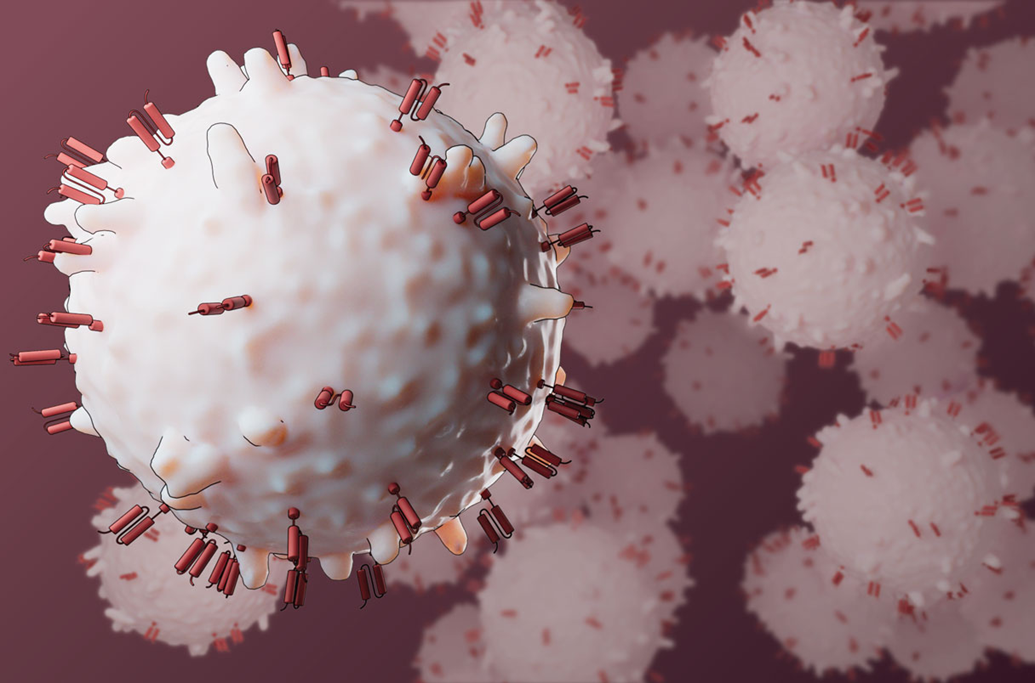
Исследователи используют генную терапию in vivo для создания Т-клеток с рецепторами (красные), нацеленными на раковые клетки.
Новая стратегия предполагает создание CAR-T-клеток прямо в организме (in vivo) с помощью доставки гена CAR в Т-клетки пациента. Предварительные клинические данные показывают, что такой подход может быть быстрее и потенциально безопаснее. В двух небольших клинических испытаниях у пациентов с ранее неизлечимой множественной миеломой введение лентивирусов, несущих ген CAR, привело к исчезновению раковых клеток из костного мозга, а у некоторых — и к регрессу опухолей вне костного мозга.
Побочные эффекты включали снижение давления, необходимость кислородной поддержки и легкий синдром высвобождения цитокинов, но все пациенты восстановились, а тяжелые реакции встречались реже, чем при классической CAR-T-терапии. Тем не менее, лентивирусы вызывают опасения, так как встраиваются в ДНК клеток и потенциально могут повышать риск вторичных опухолей, поэтому за пациентами требуется длительное наблюдение.
Параллельно развиваются альтернативные подходы, в частности, использование липидных наночастиц для доставки РНК CAR. Такой метод не изменяет геном Т-клеток, действует временно и может снизить риск побочных эффектов. Подобные технологии уже тестируются не только при раке, но и при аутоиммунных заболеваниях.
Хотя традиционные CAR-T-клетки обеспечивали ремиссию на годы, пока неизвестно, дадут ли методы in vivo столь же долговременный эффект. Несмотря на это, направление быстро развивается, клинические испытания продолжаются, и технология рассматривается как перспективный шаг к более доступной и быстрой иммунотерапии. — The first patients have been helped by cancer-fighting cells made directly in their bodies, «Биомолекула»: «Клетки, которые лечат людей».
Белок, разрезающий двухцепочечную ДНК, способствует нарушению хромосомного набора в клетках рака человека
Опухолевые клетки часто содержат аномальное количество хромосом в результате неправильного разделения хромосом во время деления клетки. Эти фрагменты генетического материала могут быть заключены в мембрану, образуя небольшие ядроподобные структуры, называемые микроядрами. Эти структуры часто разрываются, обнажая хроматин (ДНК и связанные с ней белки) в агрессивной среде цитоплазмы, что может привести к масштабному повреждению ДНК в процессе, называемом хромотрипсисом, или разрушением и перемешиванием хромосом. В новой статье, опубликованной в журнале Science, ученые сообщают, что цитоплазматический белок NEDD4-связывающий белок 2 (N4BP2) может быть ответственен за хромотрипсис. — Chromosome shattering in cancer.
Медицина, нейробиология
Может ли добавление световых датчиков к нервным клеткам отключить боль, эпилепсию и другие расстройства?
За последние два десятилетия оптогенетика стала одним из ключевых инструментов современной нейронауки. Метод основан на внедрении в нейроны светочувствительных белков — опсинов, которые позволяют включать или подавлять активность конкретных клеток с помощью световых импульсов. Это дало исследователям возможность детально изучать нейронные цепи, управляющие поведением, движением и влияющими на развитие неврологических заболеваний.
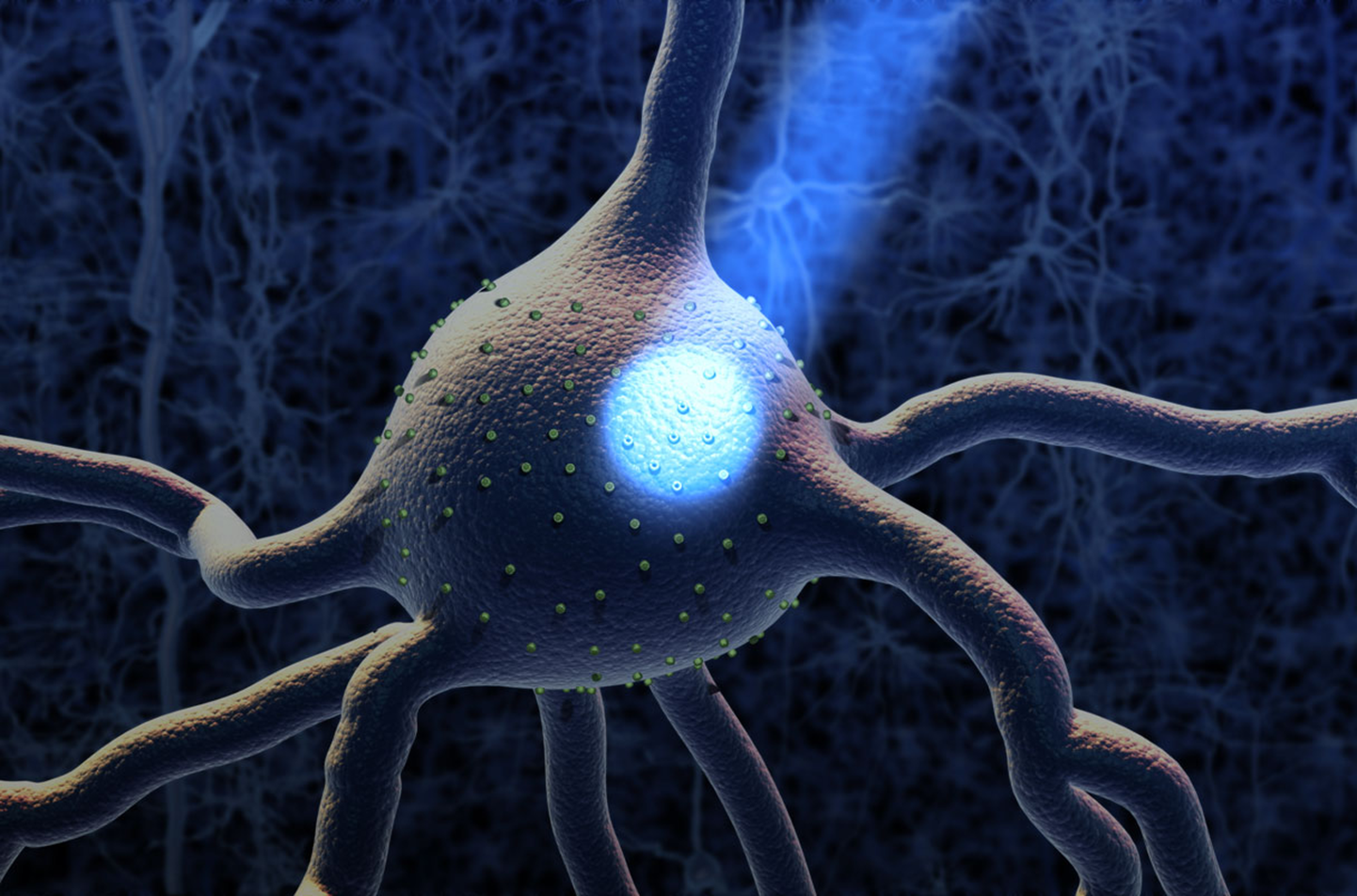
Белки (зеленые), позволяющие исследователям управлять нейронами с помощью света, в будущем могут изменить нейрональные клетки и нейронные цепи, вызывающие различные заболевания головного мозга.
По мере накопления фундаментальных знаний оптогенетика начала рассматриваться и как потенциальный метод лечения. По сравнению с уже применяемыми методами электрической или магнитной стимуляции мозга, она обеспечивает гораздо более точное воздействие, позволяя регулировать активность строго определенных типов нейронов, не затрагивая соседние клетки.
Пока единственным оптогенетическим подходом, дошедшим до клинических испытаний, остается лечение некоторых форм потери зрения. В этом случае опсины вводятся в клетки сетчатки, которые в норме не воспринимают свет, что частично компенсирует утрату фоторецепторов. Ранние результаты показали восстановление способности ориентироваться в пространстве и различать объекты, хотя полноценное восстановление зрения пока недостижимо.
Эти успехи, а также открытие более чувствительных и избирательных опсинов, стимулировали разработку методов воздействия на периферические нервы и глубокие структуры мозга. Эксперименты на животных продемонстрировали перспективность оптогенетики при эпилепсии, боковом амиотрофическом склерозе (БАС) и хронической боли. В частности, исследуются способы поддержания функции глотания при БАС за счет активации мышц языка, а также подавление болевых сигналов тройничного нерва.
Отдельное направление связано с лечением эпилепсии и болезни Паркинсона путем точечного подавления патологической активности в гиппокампе или подкорковых ядрах. В отличие от глубокой стимуляции мозга, которая воздействует на большие области ткани, оптогенетика позволяет регулировать работу отдельных нейронных цепей, сохраняя баланс между возбуждающими и тормозными клетками.
Ключевые трудности связаны с безопасной доставкой генов опсинов в нервные клетки и их долгосрочным воздействием. Вирусные векторы могут вызывать иммунные реакции, а постоянная экспрессия чужеродных белков остаеся предметом опасений. Для снижения рисков разрабатываются опсины, реагирующие на красный свет, который глубже проникает в ткани и требует меньшей мощности излучения.
Несмотря на нерешенные проблемы, исследователи считают развитие оптогенетической терапии оправданным. Высокая точность, гибкость и потенциал персонализированного воздействия делают ее одним из наиболее перспективных направлений в лечении сложных неврологических заболеваний. — Can adding light sensors to nerve cells switch off pain, epilepsy, and other disorders?, «Биомолекула»: «Оптогенетика».
Кортикальные глутаматергические и ГАМКергические сигналы поддерживают стабильность гиппокампа, обусловленную процессом обучения
Мозг хранит воспоминания не в отдельных клетках, а в виде ансамблей нейронов — групп клеток, которые активируются вместе. Чтобы память была полезной, такие ансамбли должны обладать двумя, на первый взгляд, противоположными свойствами: стабильностью, чтобы воспоминание сохранялось, и гибкостью, чтобы оно могло адаптироваться к новым условиям. Как мозгу удается поддерживать этот баланс, остается одним из центральных вопросов нейронауки.
Изображение нейронов мозга.
Важную роль в формировании памяти играет гиппокамп, а особенно его область CA3. Здесь пирамидные нейроны формируют так называемые клетки места — нейроны, активирующиеся в определенных участках пространства. Эти пространственные карты могут перестраиваться при изменении среды, но при обучении постепенно стабилизируются, позволяя животным ориентироваться и запоминать контекст. Особенность CA3 заключается в развитых рекуррентных связях, которые делают эту область хорошо приспособленной для формирования и повторной активации ансамблей памяти.
Контекстуальную информацию в гиппокамп поставляет энторинальная кора, причем не только с помощью возбуждающих глутаматергических (LEC-GLU), но и тормозных ГАМК-ергических (LEC-GABA) дальних проекций. Хотя такие связи давно известны, их совместная роль в работе локальных цепей CA3 оставалась малоизученной. Исследователи предположили, что именно взаимодействие этих двух типов входов помогает настраивать активность ансамблей в процессе обучения.
Эксперименты показали, что глутаматергические входы из латеральной энторинальной коры напрямую возбуждают пирамидные нейроны CA3, но одновременно включают мощное опережающее торможение через локальные интернейроны. Это торможение ограничивает как соматические, так и дендритные спайки. ГАМК-ергические входы действуют иначе: они подавляют часть тормозных интернейронов, тем самым ослабляя опережающее торможение. В результате возникает дисингибиция, которая избирательно усиливает спайковую активность сомы пирамидных нейронов, не затрагивая дендриты.
Такое тонкое управление возбуждением и торможением усиливает рекуррентную активность в CA3 — ключевой механизм стабилизации нейронных ансамблей. Когда у мышей во время обучения искусственно подавляли либо LECGLU-, либо LECGABA-входы, животные хуже справлялись с задачами на пространственно-контекстное обучение. При этом воспроизведение уже сформированных воспоминаний почти не страдало, что указывает на роль этих входов именно в процессе обучения и стабилизации карт.
На уровне ансамблей это проявлялось в нестабильных «картах места»: нейронные представления разных сред становились менее различимыми и не закреплялись со временем. Компьютерное моделирование подтвердило, что при нарушении любого из двух типов энторинальных входов CA3-ансамбли хуже реактивируются, даже несмотря на различия в их схемах воздействия на сеть.
В целом, работа показывает, что глутаматергические и ГАМК-ергические дальние проекции из энторинальной коры действуют не как противоположные силы, а как согласованная система. Их совместное влияние на возбуждение, торможение и дисингибицию позволяет гиппокампу одновременно сохранять устойчивые воспоминания и адаптироваться к новым условиям — ключевое свойство памяти живого мозга. — Cortical glutamatergic and GABAergic inputs support learning-driven hippocampal stability, «Биомолекула»: «Спокоен как GABA».
Вирусология
Военные США финансируют разработку инструментов искусственного интеллекта для ускорения моделирования вирусных вспышек
Во время пандемии COVID-19 эпидемиологи широко использовали компьютерные модели для прогнозирования распространения вируса и оценки эффективности мер, таких как маски, вакцинация и ограничения на поездки. Однако многие из этих моделей оказались сложными, непрозрачными и трудными в настройке, так как представляли собой большие массивы устаревшего кода и работали как «черные ящики».

В 2024 году руководители программы Агентства перспективных оборонных исследований (DARPA), направленной на ускорение научного моделирования с помощью инструментов искусственного интеллекта, встретились в лаборатории визуализации данных Техасского университета в Остине.
После пандемии DARPA запустило программу ASKEM, направленную на упрощение и ускорение научного моделирования с помощью инструментов на основе искусственного интеллекта. Цель программы — сделать модели более понятными, гибкими и доступными, особенно в условиях кризисов, когда требуется быстрое принятие решений и не хватает специалистов по моделированию.
Инструменты ASKEM позволяют автоматизировать создание и обновление моделей на более высоком уровне абстракции. Системы ИИ анализируют научную литературу, извлекают уравнения и ключевые знания, а также преобразуют исследовательские наработки, включая Jupyter-блокноты, в формализованные модели. Кроме того, были разработаны графические интерфейсы, позволяющие редактировать модели без прямой работы с кодом и одновременно документировать все допущения и изменения.
Независимое тестирование показало, что инструменты ASKEM позволяют создавать модели значительно быстрее — до 83% по сравнению с традиционными подходами — и повышают доверие к результатам за счет прозрачности. Модели успешно применялись к сложным сценариям, включая одновременную циркуляцию нескольких вирусов и анализ влияния вакцинации на затраты здравоохранения.
Большая часть разработок ASKEM имеет открытый исходный код и уже опубликована. Хотя пока неясно, насколько широко эти инструменты будут приняты научным сообществом, разработчики рассчитывают, что они помогут исследователям быстрее и эффективнее создавать модели для самых разных задач в области общественного здравоохранения и за его пределами. — U.S. military funds AI tools to speed modeling of viral outbreaks.
Ботаника, энтомология
Эти растения способны нагреваться — ученые наконец-то выяснили, почему

Исследователи пометили жуков ультрафиолетовыми красителями, чтобы отслеживать их перемещения между мужскими и женскими растениями саговника. На этом снимке жук приближается к трещине в шишке женского саговника. Эти трещины позволяют жуку проникнуть внутрь шишки и опылить ее, и обычно они теплее, чем другие части шишки.
Ученые обнаружили новый древний способ, которым растения привлекали насекомых-опылителей до появления ярких цветов. Некоторые древние голосеменные растения — саговники, похожие на пальмы, — используют тепло для привлечения жуков. Их репродуктивные конусы способны резко повышать температуру, становясь значительно теплее окружающего воздуха, и при этом излучать инфракрасное тепло, которое насекомые могут обнаружить на расстоянии.
Саговники, существующие с времен динозавров, развили эту стратегию для привлечения специализированных жуков-опылителей. Мужские конусы сначала нагреваются, привлекая жуков к пыльце, а позже, через несколько часов, нагреваются женские конусы, чтобы насекомые переносили пыльцу между растениями. Это создает последовательный «термический маршрут» для переноса пыльцы.
Эксперименты показали, что сами по себе инфракрасные сигналы достаточно привлекательны: даже искусственные структуры, нагретые и испускающие инфракрасное излучение, привлекали жуков. Это говорит о том, что тепло служит не только для усиления запаха, но и как отдельный сигнал. Жуки обладают специализированными терморецепторами на своих усиках-антеннах, которые позволяют им ощущать небольшие изменения температуры и ориентироваться по инфракрасному излучению, что особенно важно в ночное время, когда они активны. Эти рецепторы эволюционно настроены на определенный температурный диапазон, в который попадают температурные изменения саговников.
Такой способ опыления, основанный на тепле, предположительно появился очень давно, задолго до появления цветущих растений и развитой цветового восприятия у насекомых. В ходе эволюции, с появлением бабочек и пчел, растения начали использовать визуальные сигналы, но тепловой механизм остается важной составляющей древних взаимоотношений между растениями и насекомыми.
Эти результаты открывают новую перспективу на понимание того, как могли работать древние системы опыления и какие сигналы использовали растения и опылители задолго до появления привычных нам ярких цветов. — Infrared radiation is an ancient pollination signal.






