
Клетки, которые лечат людей
18 декабря 2020
Клетки, которые лечат людей
- 4604
- 0
- 24
Уже сегодня есть клеточные средства терапии, которые доказали свою эффективность и рутинно применяются на практике. Рисунок в оригинальном разрешении.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Новостей о клеточной терапии становится всё больше. Мы много слышим о стволовых клетках, которые якобы помогают от множества болезней. Немного меньше — об успехах клеточной терапии в лечении редких наследственных и онкологических заболеваний. В рамках спецпроекта по генной и клеточной терапии разберемся, в каком состоянии сейчас находится эта область, какие тут применяются технологии, какие есть проблемы и успехи.
Генная и клеточная терапии

Спецпроект о генной и клеточной терапиях, тернистом пути их развития, первых успехах и надеждах, а также о сложностях регулирования, производства и изучения этих новейших методов лечения.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Мы уже не раз писали [1], что клеточную и генную терапию можно рассматривать как третью волну лекарственных средств — после низкомолекулярных соединений и белковых биотехнологических препаратов. У каждого из этих «поколений» лекарств есть свои плюсы и минусы, поэтому сейчас они успешно сосуществуют и дополняют друг друга. Так, низкомолекулярные препараты относительно просты с точки зрения контроля производства, часто принимаются перорально, лучше распределяются в ткани за счет небольшого размера молекулы, но они зачастую не так избирательны, слишком быстро выводятся из организма и нередко обладают токсическим воздействием на печень, почки и другие органы.
Лекарства следующей волны — антитела и другие белки — гораздо более селективны, позволяют модулировать белок-белковые взаимодействия (что часто недоступно малым молекулам), дольше не выводятся из организма. С другой стороны, чаще всего это инъекционные препараты (и лечение ими сложнее); они хуже распределяются в ткани, чем низкомолекулярные вещества (и, например, почти совсем не попадают за гематоэнцефалический барьер ); и они гораздо сложнее с точки зрения производства и контроля качества [2].
На «Биомолекуле» выходила статья «Антитело: лучший способ распознать чужого» [3] в рамках спецпроекта об антителах.
Объяснения терминов, выделенных полужирным шрифтом, можно найти в «Словарике» в конце статьи.
Наконец, третья волна лекарств, к которым относятся клеточные и генные терапии, позволяют регулировать процессы в организме на новом уровне, действуя не на отдельные мишени [4], а изменяя генетическую последовательность, влияя на способы ее считывания или задействуя возможности целых клеток, такие как способность активироваться в ответ на внешние стимулы, мигрировать в нужные места, делиться и дифференцироваться. Конечно, это следующий шаг в сложности и дороговизне производства, но технологии не стоят на месте, и новая волна терапий постепенно прокладывает себе дорогу к пациентам. За деталями «эволюции» лекарств отсылаем читателя к материалу «Три поколения лекарств» [1].
В рамках спецпроекта «12 биологических методов в картинках» на «Биомолекуле» выходила статья о клеточных технологиях [5]. Из нее можно узнать об основных понятиях и методах в области работы с клетками, о клеточных культурах, о стволовых клетках и об их применении в биомедицине. Клеточные терапии, о которых пойдет речь в этой статье, — наверное, наиболее сложный из существующих сейчас видов лечения. Каждая клетка — уникальный живой объект, состоящий из миллионов и миллиардов молекул, постоянно изменяющийся во времени. В отличие от всех остальных лекарств, клеточные препараты обладают обратной связью: из них можно даже делать своего рода логические элементы: клетки, которые будут активироваться или, к примеру, выделять белки только в ответ на определенный стимул при отсутствии другого стимула. Расскажем подробнее о том, в какой части пути сейчас находятся клеточные терапии и какие у них перспективы.
Виды клеточных терапий
Как уже говорилось раньше [1], в каком-то смысле и переливание крови можно считать клеточной терапией, но современная история начинается с трансплантации стволовых клеток костного мозга. В 1950-х годах обнаружили, что эта процедура способна помочь при большинстве онкогематологических заболеваний и при ряде наследственных болезней. С помощью химиотерапии научились уничтожать клетки костного мозга пациента, а затем восстанавливать их популяцию за счет пересаженных клеток.
Лучших результатов чаще удается достичь при помощи аллогенной трансплантации, когда пересадка происходит от донора. Другой метод — аутологичная трансплантация, когда клетки забирают у самого пациента. Однако генетические заболевания так не вылечить, потому что все клетки пациента содержат один и тот же генетический дефект, а при онкогематологических чаще происходит рецидив, потому что в аутологичном материале могут остаться опухолевые клетки. C другой стороны, аллогенная трансплантация предъявляет очень строгие требования к донорскому материалу, чтобы не возникло отторжения в форме смертельно опасной реакции «трансплантат против хозяина» (РТПХ), при которой пересаженные иммунные клетки атакуют организм реципиента.
Возможность отбирать клетки, культивировать их перед введением пациенту, воздействовать на них низкомолекулярными и белковыми факторами, а потом и модифицировать их генетически открыла путь к созданию гибких и эффективных средств терапии, которые сейчас постепенно завоевывают всё больше ниш.
Когда речь идет о клеточной терапии, мы в основном говорим о технологиях, использующих клетки с той или иной степенью стволовости (то есть способные делиться и дальше). Терминально дифференцированные клетки, используемые для лечения, — это упомянутое выше переливание крови, кожные графты для лечения ожогов и ран. Этих технологий мы дальше в статье касаться не будем.
Мезенхимальные стволовые клетки (МСК) впервые были применены у человека более 20 лет назад [6]. Исследователи продемонстрировали возможность отбора, размножения ex vivo и введения обратно пациентам с онкогематологическими заболеваниями мезенхимальных стволовых клеток костного мозга [7]. Помимо костного мозга, их выделяют, например, из жировой ткани, пуповины, зубной пульпы. Иммуномодулирующие, противовоспалительные, ангиогенные (способствующие росту сосудов) и антиапоптотические свойства МСК вселяют надежду, что их удастся использовать в терапевтических целях, и они изучаются в сотнях клинических исследований. Однако ряд КИ уже провалился, не достигнув первичной конечной точки, что несколько охладило энтузиазм ученых. На настоящий момент в США не зарегистрирован ни один препарат на основе МСК, в ЕС это Alofisel (компании TiGenix/Takeda) для лечения анальных фистул при болезни Крона, в Канаде — Prochymal (компания Osiris) для лечения реакции «трансплантат против хозяина».
К сожалению, энтузиазм вокруг стволовых клеток породил черный рынок клиник, которые предлагают людям незарегистрированные и непроверенные методы терапии стволовыми клетками как в косметологии, так и по медицинским показаниям. Очевидно, помимо отсутствия доказательной базы по эффективности и безопасности, они не могут обеспечить должный уровень производства и контроля качества. Такие клиники не только опасны для клиентов, но и наносят удар по репутации стволовых клеток, которые исследуются научными методами и чьи разработчики придерживаются законных способов работы с клетками. FDA и минздравы разных стран ведут с такими клиниками борьбу, стараются образовывать население, однако полностью искоренить их не удается в связи с высоким спросом у людей.
Плюрипотентные стволовые клетки (которые получают из эмбрионов) пытались долгое время приспособить для регенерации различных органов — например, сетчатки, спинного мозга, миокарда, поджелудочной железы при диабете 1 типа. Эти клетки выделяют из пуповинной крови, они обладают неограниченным потенциалом деления и теоретически могут дифференцироваться в клетки любого типа. Однако для них характерен ряд проблем: есть риск образования опухолей, существует этическая проблема получения материала из эмбрионов, а также риск генетической нестабильности. Более перспективен подход на основе индуцированных плюрипотентных стволовых клеток (ИПСК), про которые мы поговорим ниже.
Упомянутая ранее трансплантация стволовых клеток костного мозга проводится с гемопоэтическими (кроветворными) стволовыми клетками (ГСК, или HSC — hematopoietic stem cells). Это клетки, дающие начало всем клеткам крови: эритроцитам, тромбоцитам, лимфоцитам и другим [8]. Опыт, наработанный при трансплантации стволовых клеток, позволил создать методы их модификации ex vivo, то есть вне организма пациента. Модификация проводится, как правило, с помощью вирусов, меняющих геном клетки, или с помощью средств геномного редактирования: CRISPR/Cas9, TALENs, ZFNs и более новых (об их применении к технологии CAR-T «Биомолекула» уже писала [9]). В случае редких генетических заболеваний модификации подвергаются ГСК пациента, и в них исправляется генетический дефект. Затем клетки вводятся обратно пациенту и дают начало клонам клеток крови, способным к нормальному функционированию. О примерах подобной терапии подробнее говорилось в первой статье спецпроекта: «Генная терапия: познакомьтесь с лекарствами будущего» [10]. CAR-T и их аналоги, о которых в основном дальше пойдет речь, — это незрелые Т-лимфоциты, способные к множеству циклов деления, миграции в соответствующие места («ниши») и дальнейшей дифференциации, поэтому они тоже относятся к стволовым клеткам.
Стволовые клетки другого происхождения также применяются в некоторых нишевых показаниях — в основном для восстановления поврежденных органов. Так, аутологичные предшественники хондроцитов (Spherox компании co.don) используются для лечения дефектов хряща, а стволовые клетки роговицы (Holoclair компании Holostem) — для лечения ожогов глаз.
CAR-T
CAR-T — это Т-лимфоциты с химерным антигенным рецептором. На «Биомолекуле» выходил подробный обзор про их структуру, получение и применение: «Способны ли CAR-T-клетки уничтожить опухоль?» [11], поэтому здесь мы кратко повторим только основные вещи.
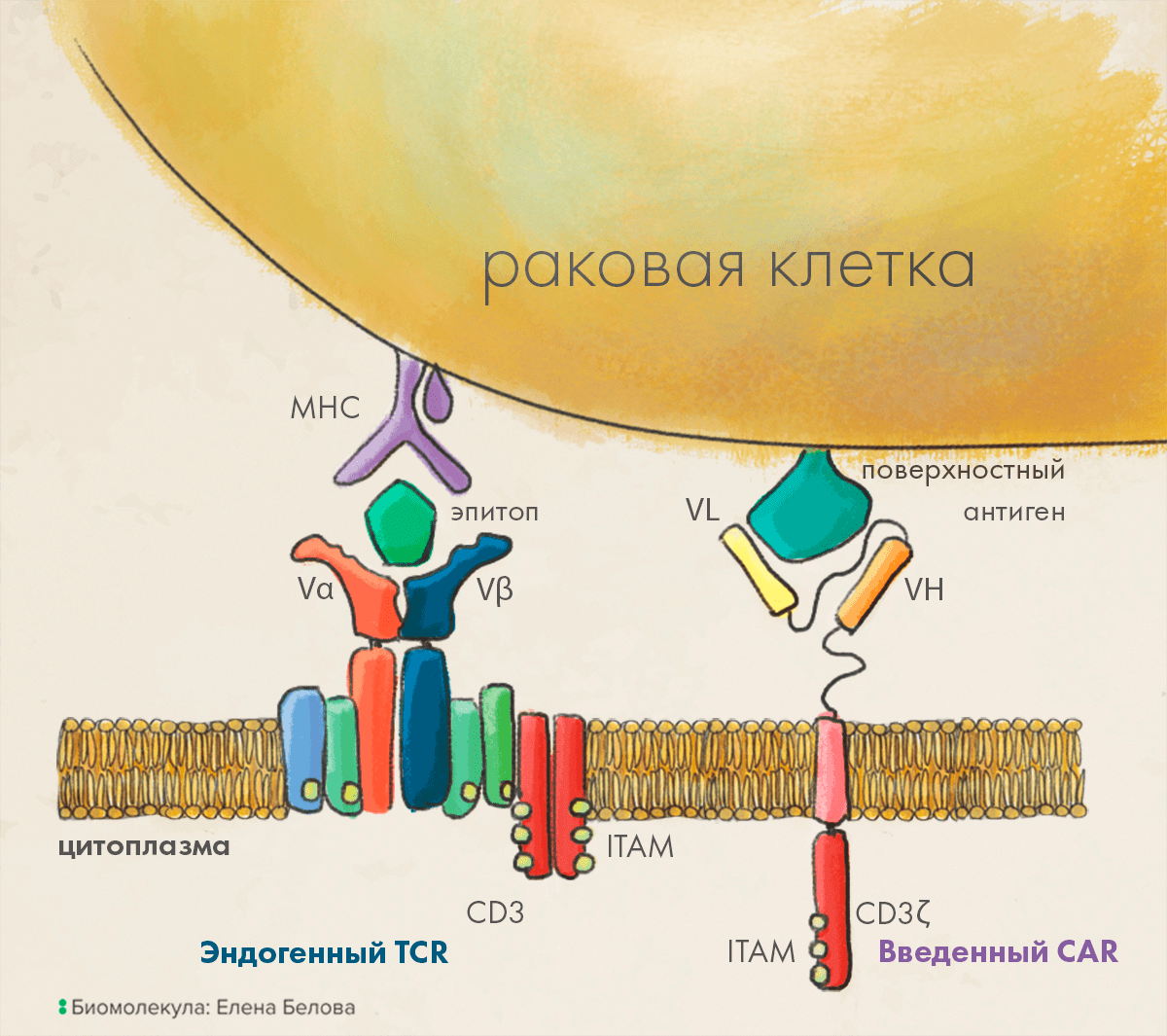
Рисунок 1. CAR-T и TCR: общее и различное. На картинке изображен фрагмент мембраны Т-лимфоцита, который сблизился с опухолевой клеткой. Слева: Т-клеточный рецептор (TCR) — комплекс из нескольких трансмембранных белков. Внеклеточная часть TCR узнает комплекс из антигенного пептида и белка МНС на поверхности клетки, с которой сблизился Т-лимфоцит. После связывания сигнал через вспомогательные белки передается на CD3ζ (CD3-дзета). Он несет несколько активирующих аминокислотных мотивов (immunoreceptor tyrosine-based activation motif, ITAM), передающих сигнал дальше в клетку. Справа: Химерный антигенный рецептор (CAR), внеклеточная часть которого образована фрагментом антитела, состоящим из вариабельных доменов VL и VH и распознающим поверхностный антиген на опухолевой клетке. Внутри у CAR — сигнальный домен обычного TCR (CD3ζ).
иллюстрация Елены Беловой по [28]
Обычные Т-лимфоциты несут на поверхности Т-клеточный рецептор (TCR): сложный комплекс мембранных белков, обеспечивающих узнавание Т-клеткой антигена, к которому она специфична, на поверхности другой клетки. Каждая Т-клетка узнает с высокой специфичностью только один антиген, причем Т-клеточный рецептор «стыкуется» с молекулой MHC на поверхности другой клетки, распознавая при этом «закрепленный» в МНС пептид, против которого и специфична Т-клетка. Ученые говорят, что происходит распознавание пептида «в контексте» МНС. Если пептид распознан, то Т-клетка активируется и, в зависимости от типа клетки, либо убивает другую клетку (цитотоксический Т-лимфоцит, или Т-киллер, или CTL, или CD8-клетка), либо выделяет вещества (цитокины), способствующие антительному иммунному ответу и активации других клеток иммунной системы (Т-хелпер, или Th, или CD4-клетка). В CAR-T генноинженерными методами (теми самыми вирусами или средствами геномного редактирования, о которых говорилось в первой статье спецпроекта [10]) вставлен ген химерного рецептора. Он называется химерным, потому что он искусственно составлен из фрагментов двух разных белков: снаружи у него антительный фрагмент, узнающий белок на поверхности раковой клетки (VL-VH на рис. 1), а внутри — активирующие клетку белковые домены (CD3ζ-ITAM там же).
Сейчас зарегистрированы три CAR-T-продукта второго поколения: Kymriah, Yescarta и в июле 2020 года — Tecartus (о первых двух мы уже рассказывали [10]). Все они узнают белок CD19 на поверхности клеток крови и предназначены для лечения В-клеточных лимфом и лейкемий, при которых бласты (злокачественные трансформированные клетки крови) зачастую несут этот маркер. Эти продукты произвели революцию в лечении тяжелых форм онкогематологических заболеваний, давая надежду таким пациентам, у которых раньше ее не было. Теперь же у 30–40% пациентов, даже исчерпавших все опции терапии и перенесших трансплантацию костного мозга, наблюдаются долговременные ответы (онкологи всё еще осторожно предпочитают не использовать слово «излечение», а в англоязычном мире даже суеверно говорят «с-word», чтобы только не употребить cure).
Первые эксперименты проводились с CAR’ами первого поколения, содержащими только активирующий домен обычного TCR (он называется CD3ζ, или CD3-дзета). Этого оказалось недостаточно для противоопухолевой активности, поэтому к внутриклеточной части химеры стали добавлять стимулирующие домены от других рецепторов (CD28, 4-1BB) (рис. 2) [12].
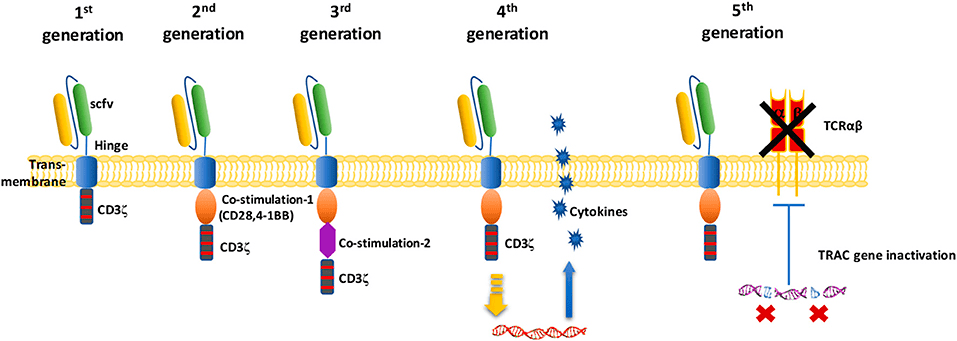
Рисунок 2. Поколения CAR-T. У CAR-T первого поколения имелся только один внутриклеточный активирующий домен — CD3ζ. CAR-T второго поколения дополнительно содержат один костимулирующий домен, третьего — два. Все зарегистрированные на рынке продукты относятся ко второму поколению, преимущества третьего в клинике пока не продемонстрированы. CAR-T четвертого поколения обеспечивают дополнительную экспрессию генов активирующих цитокинов (IL-12, IL-18, IL-15) Т-клетками, а CAR-T пятого поколения — одновременную инактивацию гена TRAC, отвечающего за синтез одной из цепей TCR.
CAR-T четвертого и пятого поколений имеют дополнительные модификации, призванные повысить эффективность и безопасность конструкций. После введения в организм (о том, как их получают, см. ниже) они способны размножаться, уничтожать клетки с целевым белком на поверхности и длительное время находиться в организме (в том числе, в костном мозге), формируя иммунологическую память, что должно предотвращать рецидивы. От костимуляторных доменов зависит способность к сопротивлению иммуносупрессорному микроокружению опухоли и к развитию Т-клеток памяти, уровень сигналинга в отсутствие антигена, персистентность [13].
О роли клеточных ниш и структуре микроокружения опухолей можно прочесть в статье «Опухолевые разговоры, или Роль микроокружения в развитии рака» [14].
Однако у CAR-T есть ряд проблем, которые заставляют модифицировать существующие подходы и выдумывать новые. Во-первых, у всех трех зарегистрированных препаратов высокий уровень серьезных нежелательных явлений, которые могут быть даже фатальными: в первую очередь это цитокиновый шторм и нейротоксичность. Связывание CAR с антигеном вызывает активацию и размножение CAR-T-клеток. Они могут быть избыточными и приводить к излишней активации врожденного иммунитета, выбросу воспалительных цитокинов (прежде всего IL-6) — отсюда название «цитокиновый шторм», — что в тяжелых случаях приводит к полиорганной недостаточности и смерти. В некоторых случаях нарушается гематоэнцефалический барьер, что приводит к нейротоксичности. В ранних исследованиях CAR-T нередки были случаи смерти от этих осложнений. Сейчас их научились лечить, однако всё равно это опасно.
Во-вторых, у части пациентов развивается CD19-отрицательный рецидив (появляются злокачественные клетки, не несущие на поверхности маркер CD19, с которым связывается CAR-рецептор на поверхности CAR-T).
Ну и, в-третьих, несмотря на многочисленные попытки создать CAR-T с другой специфичностью, в особенности для лечения сóлидных опухолей, они пока не возымели успеха. Возможно, в ближайшее время будет зарегистрирован новый CAR-T-продукт, специфичный против BCMA — маркера на поверхности клеток множественной миеломы. Однако это тоже онкогематологическое заболевание. О причинах неудач в солидных опухолях и способах с ними справиться мы поговорим ниже.
Все зарегистрированные CAR-T — аутологичные, процесс их производства достаточно сложный, индивидуализированный и дорогой. О том, как получают аутологичные CAR-T-клетки, подробно написано в первой статье нашего спецпроекта [10]. Вкратце, у пациента отбирают Т-лимфоциты, генетически модифицируют их так, чтобы они выставляли на поверхности CAR-T нужной специфичности. Тем временем пациенту проводят процедуру уничтожения его собственного костного мозга, а затем вводят суспензию клеток CAR-T (рис. 3). Cебестоимость этого процесса начинается от $50 000, а производство занимает не менее трех недель. Эту проблему помогли бы решить аллогенные CAR-T и их аналоги, и такие подходы разрабатываются (мы упомянем о них далее).
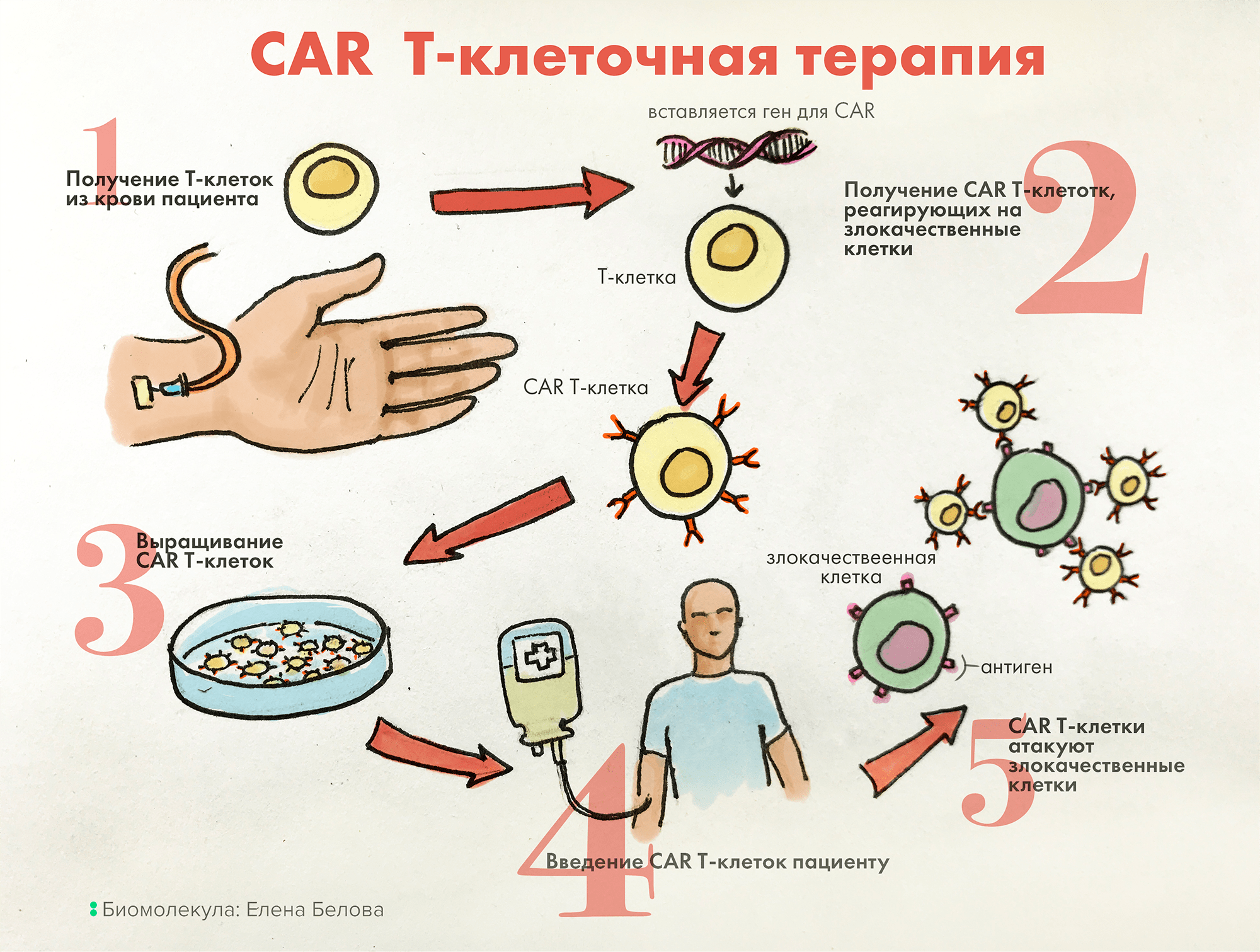
Рисунок 3. Схема получения CAR-T. Т-лимфоциты извлекают у пациента (в случае аутологичных CAR-T) или у здорового донора (в случае аллогенных), модифицируют их гéном, кодирующим CAR (см. рис. 1; это делается с помощью вирусных или невирусных систем доставки гена в клетку — векторов). Полученные клетки размножают и активируют, а затем вводят пациенту, где они начинают бороться с опухолью.
иллюстрация Елены Беловой из [10]
Пути решения проблем
Безопасность
Для повышения безопасности CAR-T разрабатывают новые подходы, которые обеспечивали бы такую же активность Т-клеток в отношении опухолей, как у зарегистрированных продуктов, но не приводили бы к цитокиновому шторму и нейротоксичности.
У обычных CAR-T химерный рецептор активен постоянно, что может приводить к избыточной активации клеток там и тогда, когда это не нужно. Возникла гипотеза, что модуляция активности CAR-T в пространстве и времени могла бы снизить токсичность без ущерба для эффективности. Один из примеров такого подхода — присоединение к CAR-рецептору метки для деградации, которая инактивируется малой молекулой. Состояние по умолчанию для такой конструкции — выключенное, а при добавлении малой молекулы на поверхности Т-лимфоцита появляется активный CAR.
Повысить специфичность, а, следовательно, и безопасность CAR-T можно с помощью логического элемента AND-NOT. Речь идет о том, чтобы помимо CAR экспонировать на поверхности Т-лимфоцита ингибирующий рецептор, лиганд которого присутствует преимущественно на здоровых клетках: тогда здоровые клетки не пострадают от контакта с CAR-T. Так, была создана Т-клетка, у которой транзиентная (то есть непостоянная, проходящая) презентация CAR на поверхности начинается только после связывания еще одного рецептора (EGFRvIII в данном случае) с опухолевым антигеном и транслокации транскрипционного фактора в ядро [15]. Так удается добиться исключительно локальной экспрессии гена CAR и избежать уничтожения нормальных клеток, несущих мишень CAR. Кроме того, уничтожаются не только те клетки, которые вызывают активацию Т-лимфоцитов, но и EGFRvIII-негативные клетки — главное, чтобы на поверхности была мишень CAR. Это должно снизить вероятность резистентности опухоли.
Другой способ обеспечения безопасности — введение генов, которые позволят уничтожить CAR-T в случае их избыточной активации. Так, введение гена индуцируемой каспазы-9 позволило уничтожить более 90% химерных клеток в течение 30 минут при введении низкомолекулярного индуктора. Есть подходы на основе выставления на клетках рецепторов CD20 или EGFR, против которых есть антитела (ритуксимаб, цетуксимаб), уничтожающие клетки с такими поверхностными маркерами.
Порой увеличения безопасности удается добиться просто изменением свойств внеклеточной части химерного рецептора. Так, компания Autolus взяла за основу Kymriah, но заменила антиген-связывающий домен [16]. Домен Autolus связывается с CD19 c такой же скоростью, как у Kymriah, но гораздо быстрее отсоединяется. За счет этого удалось добиться почти полного отсутствия серьезного цитокинового шторма и нейротоксичности.
Кроме цитокинового шторма и нейротоксичности важный аспект безопасности — необходимость проводить деплецию собственных клеток костного мозга пациента для лучшего «приживления» CAR-T. Эта процедура называется прекондиционированием, и для нее используют цитотоксические препараты, такие как бусульфан, циклофосфамид, флударабин. Они токсичны и часто плохо переносятся пациентами, и некоторым из-за этого приходится вообще отказывать в процедуре. Поэтому любые модификации клеток и методов, которые позволяют избежать прекондиционирования или хотя бы снизить дозу, весьма востребованы [17].
Эффективность
Несмотря на довольно высокую эффективность анти-CD19 CAR-T, улучшения возможны и в области терапии онкогематологических заболеваний. Не у всех пациентов наблюдаются долговременные ответы: часть не отвечает на терапию сразу, у других со временем развивается рецидив — чаще всего из-за потери злокачественными клетками антигена CD19. Чтобы справиться с этой проблемой, разрабатывают CAR-T двойной специфичности: например, CD19/CD20 или CD19/CD22, которые должны снизить вероятность появления резистентности.
Еще одна причина резистентности к терапии CAR-T — иммунный ответ на внеклеточную часть CAR, которая является чужеродным белком для организма пациента. Особенно вероятен иммунный ответ, если внеклеточный домен мышиного происхождения. Сейчас для решения этой проблемы чаще всего используют технологии гуманизации, описанные в статье «Биотехнология антител» [2].
Проблема сóлидных опухолей
Как упоминалось выше, в терапии солидных опухолей CAR-T пока не удалось добиться успеха, в отличие от онкогематологических заболеваний. Рассмотрим причины этого и возможные пути решения.
Для проникновения Т-лимфоцитов в солидные опухоли и проявления там противоопухолевой активности существуют как механические, так и иммунологические препятствия. Сóлидные (ударение на первый слог) опухоли так называются потому, что чаще всего это плотные образования — опухолевая строма, состоящая как из злокачественных клеток, так и из поддерживающих клеток, в том числе, иммунного характера. Помимо того, что Т-лимфоцитам трудно проникнуть в опухоль и подобраться к злокачественным клеткам, на их пути возникают иммуносупрессорные барьеры, обеспечивающие активную защиту злокачественного образования. Опухоль коварно ставит ряд клеток иммунной системы себе на службу — так, регуляторные Т-клетки (Treg) и миелоидные супрессоры (myeloid derived supressor cells, MDSC) выделяют противовоспалительные и иммуносупрессорные медиаторы, такие как IL-10, TGFβ и другие, подавляющие активность CAR-T. На поверхности опухолевых клеток экспонируются рецепторы, снижающие активность Т-клеток, например, PD-L1 — один из рецепторов иммунных контрольных точек (immune checkpoint). Кстати, за антитела против рецепторов иммунных контрольных точек PD-1 и CTLA-4 [18], которые совершили революцию в иммуноонкологии, в 2018 году дали Нобелевскую премию [19].
Опухолевое микроокружение формирует у клеток характерную иммуносупрессорную метаболическую картину. Всё это приводит к так называемому истощению Т-клеток (T-cell exhaustion). Истощенные Т-клетки не способны эффективно уничтожать опухоль, и срок их жизни короче, чем у нормальных активных Т-лимфоцитов.
Довольно остроумный способ заставить микроокружение опухоли работать на CAR-T — введение в них дополнительных химерных рецепторов, которые в ответ на воздействие иммуносупрессорных цитокинов IL-10, IL-13, IL-4 не подавляли бы активность Т-клетки, а, наоборот, стимулировали ее. Для этого создают химерный рецептор (не CAR, а другой), у которого внеклеточная часть связывает цитокин, а внутриклеточная заменяется на активаторные домены рецептора IL-2/IL-15 [20].
Итак, необходимы специальные ухищрения, чтобы заставить Т-клетки работать в опухоли. С CAR-T это пока получается сделать только у животных, но не у человека, что поднимает вопрос о валидности и предиктивной силе существующих животных моделей.
Например, в разработке находятся такие подходы, как удаление с поверхности ингибирующих рецепторов (к примеру PD-1). Другой подход — перепрограммирование клеточного метаболизма. От того, как клетка использует питательные вещества, зависят ее активность и фенотип, который она приобретет. Так, окислительный распад жирных кислот соответствует фенотипу клеток центральной памяти (Tcm), а аэробный гликолиз — фенотипу клеток-эффекторов памяти (Tem). CAR-T после введения в организм распределяются по степени дифференциации, которая влияет на их эффективность и продолжительность существования. Дело в том, что, дифференцируясь и теряя стволовость, Т-лимфоциты становятся всё более активными с точки зрения уничтожения злокачественных клеток, но и всё менее долгоживущими, теряя способность к пролиферации и образованию клеток памяти. Важно найти правильный баланс между наиболее активными фенотипами Т-клеток — Te и Tem (эффекторы и эффекторы памяти), и более стволовыми Tn (наивные), Tscm (stem-cell memory — стволовые клетки памяти), Tcm (центральной памяти) (рис. 4) [21].
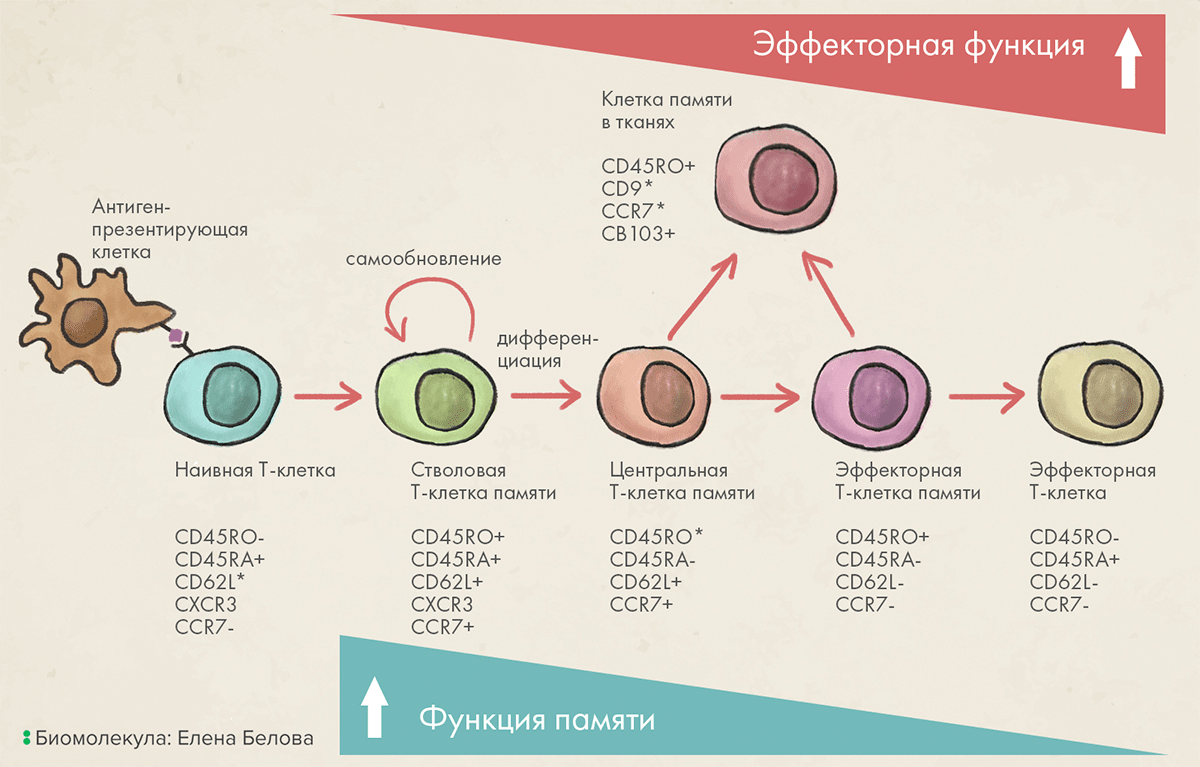
Рисунок 4. По мере дифференцировки у Т-клеток усиливается эффекторная функция, но ослабевает функция памяти. Наивные Т-клетки — это те, которые еще не встречались со своим антигеном. После встречи с антигеном Т-лимфоцит активируется, делится и образует различные субпопуляции клеток разного назначения. Стволовые Т-клетки памяти (Tscm) и центральные Т-клетки памяти (Tcm) не самые эффективные с точки зрения борьбы с опухолями и патогенами, но они способны к самообновлению и поддержанию популяции активных клеток с высоким стволовым потенциалом. Самые активные — эффекторные Т-клетки памяти (Tem) и особенно эффекторные клетки. Последние терминально дифференцированы и не способны к самообновлению и пополнению пула клеток памяти. Тканевые резидентные Т-клетки памяти (Trm) формируются из Tcm и Tem и представляют собой долгоживущую популяцию Т-клеток, которые активируются при повторной встрече с патогеном в барьерных тканях.
иллюстрация Елены Беловой по [21]
Ученые тратят довольно много усилий для оптимизации фенотипического состава клеток, в частности, важную роль играет IL-15, отвечающий за поддержание стволового потенциала клеток. Не менее важно и правильное сочетание CD4 (T-хелперы) и CD8 (цитотоксические Т-лимфоциты), а также более мелкие фенотипические детали (не вдаваясь в подробности, можно упомянуть, что Т-хелперы 1 типа (Th1) более эффективны в поддержании противоопухолевого иммунитета, чем Th2).
На рисунке 5 представлены другие стратегии увеличения времени присутствия в организме (персистентности) CAR-T [17].
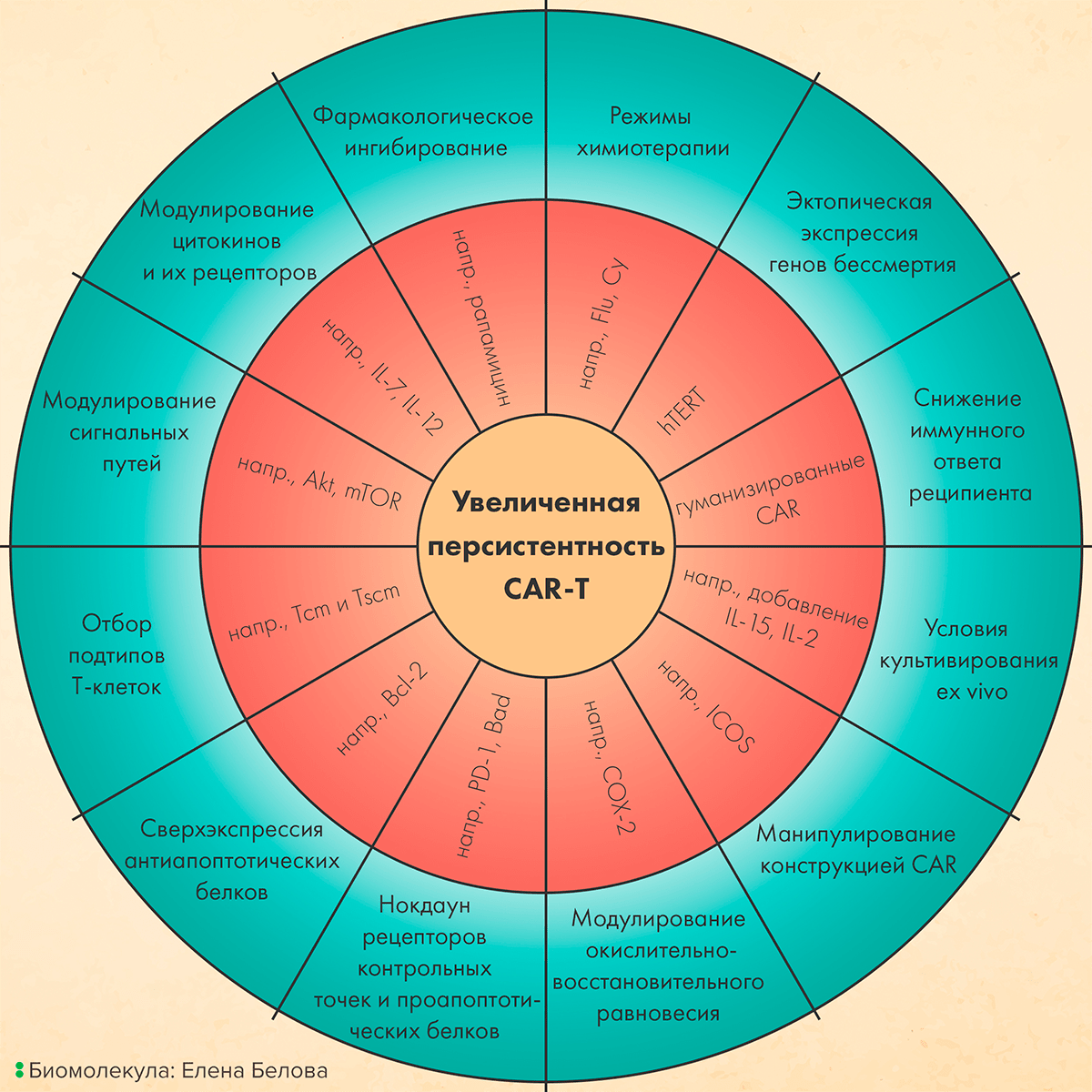
Рисунок 5. Стратегии увеличения персистентности CAR-T-клеток. Во внешнем круге (на зеленом фоне) представлены стратегии увеличения персистентности Т-клеток, а во внутреннем (на розовом фоне) — те воздействия и молекулы, которые при этом затрагиваются. Расшифровка сокращений: Flu — флударабин; Cy — циклофосфамид; hTERT — теломераза; IL-2, IL-15 и т.д. — интерлейкины-2, -15; ICOS — Inducible T-cell COStimulator, один из белков иммунных контрольных точек; COX-2 — циклооксигеназа-2; PD-1 — один из белков иммунных контрольных точек; Bad — проапоптотический белок семейства Bcl-2; Bcl-2 — антиапоптотический белок; Tcm — центральные Т-клетки памяти; Tscm — стволовые Т-клетки памяти; Akt — протеинкиназа B, один из сигнальных белков; mTOR — mammalian target of rapamycin, регулятор множества клеточных процессов.
Проблемы производства
Как уже было сказано, основная проблема аутологичных клеток (см. схему их получения на рис. 3) — это индивидуализированность терапии, когда лекарственный продукт получают в единственном экземпляре для одного человека. Понятно, что никаких производственных мощностей не хватит, чтобы лечить аутологичным методом более распространенные болезни. Аутологичная терапия — наиболее персонализированный метод лечения, поэтому лекарства третьего поколения пока подходят ничтожной доле всех больных. Время получения такого продукта — не менее трех недель, и некоторые пациенты с быстро прогрессирующими опухолями просто не могут столько ждать. А у некоторых пациентов продукт не удается создать, потому что в их крови может не хватать Т-лимфоцитов. В итоге, от 5 до 30% пациентов не получают эту терапию, хотя могли бы [22].
Поэтому большие надежды возлагаются на аллогенные методы терапии (рис. 6), которые позволяют на основе донорского материала получить продукт сразу для сотен пациентов. Его называют off the shelf, то есть «с полки».
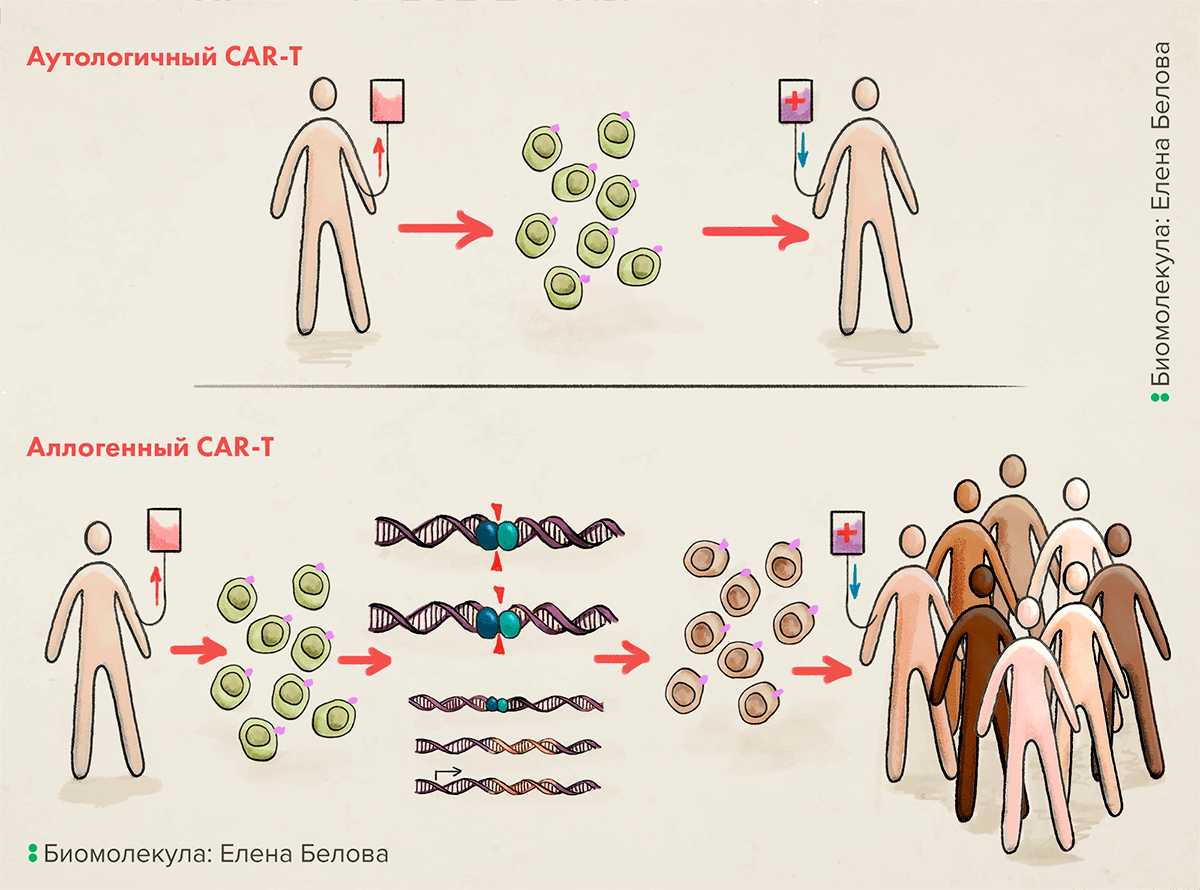
Рисунок 6. Сравнение аутологичного и аллогенного методов получения CAR-T. При аутологичном методе получения клетки отбирают у пациента, генетически модифицируют их так, чтобы они синтезировали CAR, а потом вводят обратно пациенту. При аллогенном методе ген, кодирующий CAR, вводят в Т-лимфоциты здорового донора. При этом нужно «отключить» TCR, чтобы снизить вероятность РТПХ.
иллюстрация Елены Беловой по Current report Sangamo Therapeutics, Inc.
Тут есть две главные проблемы:
- чужие Т-лимфоциты с высокой вероятностью будут атаковать ткани пациента и вызывать реакцию «трансплантат против хозяина» (РТПХ);
- чужие Т-лимфоциты по идее могут обладать меньшей персистентностью (длительностью пребывания в организме), чем свои клетки.
Первую проблему, скорее всего, удастся решить с помощью инактивации гена, кодирующего обычный TCR. Именно взаимодействие TCR донорских клеток с МНС чужеродных клеток хозяина отвечает за развитие РТПХ. Вторую проблему все разработчики решают по-разному, и пока прошло недостаточно времени, чтобы можно было уверенно говорить о превосходстве того или иного подхода, хотя первые успехи уже имеются (см. врезку).
Важное преимущество аллогенного подхода — клетки можно дозировать много раз, в отличие от аутологичных CAR-T, где для получения новой дозы для каждого пациента придется снова проводить процедуру сбора клеток и генно-инженерные манипуляции.
CAR-T за пределами онкологии
Поскольку Т-клетки, помимо уничтожения опухолей, играют ключевую роль в контроле инфекций и развитии аутоиммунных заболеваний [23], естественно, предпринимаются усилия, чтобы поставить их на службу и для лечения этих болезней. Так, было довольно много попыток создать CAR-T для борьбы с ВИЧ, однако ни одна из них пока успехом не увенчалась — главным образом, из-за слишком короткого времени присутствия клеток в организме [24].
На доклинической стадии находятся CAR-T-клетки против ряда других вирусных заболеваний: гепатита В и С, цитомегаловируса, а также против грибковых инфекций [24]. У людей с хроническими вирусными инфекциями Т-клетки, которые должны бороться с вирусом, убивая зараженные им клетки, малочисленны и истощены. Поэтому вполне логично выглядит идея создания CAR-T, «настроенных» против вирусных антигенов: они всегда активны и по идее должны обеспечивать эффективное уничтожение зараженных вирусами клеток и формирование иммунологической памяти [24].
Применение CAR-T для аутоиммунных заболеваний только входит в клинические исследования, и данных пока нет. Однако эксперименты на животных обнадеживают: подобно уничтожению лейкемических клеток В-клеточной природы, CAR-T способны уничтожать аутоиммунные В-клетки, продуцирующие антитела против собственных антигенов организма [25] (об этой работе «Биомолекула» уже писала [26]). Другая идея — модифицировать регуляторные Т-клетки таким образом, чтобы поставить их себе на службу. Введение Treg при аутоиммунных заболеваниях не раз уже проваливалось в клинике, в частности, в исследованиях по рассеянному склерозу и РТПХ. Но есть надежда, что какие-то генно-инженерные модификации смогут повысить проникновение Treg в целевые органы, увеличить их персистентность и ингибирующую активность.
Не CAR-T, но тоже клеточные убийцы опухолей
Недостатки обычных CAR-T привели к мысли использовать для клеточной терапии опухолей другие платформы (не Т-лимфоциты): например, опухоль-инфильтрирующие лимфоциты (tumor infiltrating lymphocytes, TILs — см. врезку), натуральные киллеры (NK) или γδT-клетки.
Далеко не всем известные γδT-клетки занимают небольшую долю во всем множестве Т-лимфоцитов. Хотя эти клетки по своим поверхностным маркерам и происхождению определенно относятся к Т-клеткам, они обладают чертами клеток врожденного иммунитета (например, подобно NK-клеткам, они имеют рецептор NKG2D). γδT-клетки проявляют селективную цитотоксичность по отношению к опухоли, синтезируют провоспалительные цитокины IFN-γ и TNF-α. Механизм их селективности к опухоли до конца не ясен. Предположительно, они реагируют на антигены, которые клетки экспонируют в результате стресса, и которые встречаются на многих злокачественных клетках [20]. Однако несмотря на свои многообещающие свойства, эти клетки пока не продвинулись дальше исследований первой фазы. В частности, их довольно трудно получать.
NK-клетки имеют лимфоидное происхождение, однако относятся к ветви врожденного иммунитета. Они «профессиональные убийцы», и для опухолевой терапии важно, что им не нужно предварительно обучаться, в отличие от Т-клеток. Решение о том, убить клетку или нет, принимается на основе тонкого баланса между активирующими и ингибирующими сигналами. Поэтому с помощью различных модификаций и ухищрений ученые пытаются добиться специфической и высокой активности против опухолевых клеток. Пока накопленные клинические данные свидетельствуют о том, что NK-клетки не вызывают ни цитокинового шторма, ни РТПХ, характерных для Т-клеток.
NK-клетки, как и Т-клетки, подвержены ингибирующему воздействию опухолевого микроокружения. В попытках создать NK, устойчивые к нему, вводятся различные модификации: CAR-NK, несущие химерный рецептор для распознавания конкретного антигена; или NK, синтезирующие IL-15 для повышенной активации и персистентности клеток. Именно в этой области нашла применение технология индуцированных плюрипотентных стволовых клеток (ИПСК), которую мы упоминали выше. Компании Fate Therapeutics удалось создать линию ИПСК, из которой она теперь с успехом получает как NK, так и T-клетки. Пожалуй, это самая продвинутая разработка на основе ИПСК с наибольшим опытом применения у людей: четыре программы уже находятся в клинических исследованиях на десятках людей, получены первые обнадеживающие данные по безопасности и эффективности.
Нельзя здесь не упомянуть о дендритных клетках (ДК), так как первой одобренной клеточной терапией рака стал сипулейцел-Т: дендритные клетки пациента, инкубированные ex vivo c химерным белком, состоящим из антигена РАР, характерного для рака простаты, и GM-CSF — цитокина, способствующего созреванию ДК. Идея была в том, что ДК будут презентировать фрагменты РАР Т-лимфоцитам, и те атаковать опухоль. После ряда неудач компании всё-таки удалось провести формально успешное исследование фазы III, которое показало увеличение медианной выживаемости на четыре месяца. Сипулейцел-Т был зарегистрирован FDA в 2010 году, однако из-за небольшого спроса, сложности и дороговизны производства компания, которая разработала продукт, обанкротилась. Другие разработки на основе ДК также пока не увенчались успехом.
Что нас ждет?
В настоящий момент клеточные технологии, как и генные [10], с одной стороны, переживают бум, но с другой — всё еще находятся в колыбели. В предыдущей статье спецпроекта мы видели, сколько у них сложностей в производстве [27], однако это решаемые задачи технического характера.
По мере прогресса перед клетками будут открываться всё новые и новые возможности терапии, ведь кому, как не им «знать», как лучше реагировать на меняющуюся среду внутри организма и помогать его излечению. Нам же нужно их правильно модифицировать.
Нынешнее состояние клеточной терапии можно сравнить с ранними годами авиации, когда самолеты были простыми, неуклюжими и падали через раз, но уже тогда на них можно было перелететь через Атлантику. Теперь же мы летаем на «Боингах», сложность которых трудно себе вообразить, и этот прогресс занял не так уж много времени. Надеемся, аналогичное развитие ждет и клеточные технологии.
Литература
- Три поколения лекарств;
- Биотехнология антител;
- Антитело: лучший способ распознать чужого;
- Поиск лекарственных мишеней;
- 12 методов в картинках: клеточные технологии;
- Erin A. Kimbrel, Robert Lanza. (2020). Next-generation stem cells — ushering in a new era of cell-based therapies. Nat Rev Drug Discov. 19, 463-479;
- Lazarus H.M., Haynesworth S.E., Gerson S.L., Rosenthal N.S., Caplan A.I. (1995). Ex vivo expansion and subsequent infusion of human bone marrow-derived stromal progenitor cells (mesenchymal progenitor cells): implications for therapeutic use. Bone Marrow Transplant. 16(4), 557–564;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- От слов к делу: технологию CRISPR-Cas впервые применили для лечения онкозаболеваний;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Lijun Zhao, Yu J. Cao. (2019). Engineered T Cell Therapy for Cancer in the Clinic. Front. Immunol.. 10;
- Mihe Hong, Justin D. Clubb, Yvonne Y. Chen. (2020). Engineering CAR-T Cells for Next-Generation Cancer Therapy. Cancer Cell. 38, 473-488;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Kole T. Roybal, Levi J. Rupp, Leonardo Morsut, Whitney J. Walker, Krista A. McNally, et. al.. (2016). Precision Tumor Recognition by T Cells With Combinatorial Antigen-Sensing Circuits. Cell. 164, 770-779;
- Sara Ghorashian, Anne Marijn Kramer, Shimobi Onuoha, Gary Wright, Jack Bartram, et. al.. (2019). Enhanced CAR T cell expansion and prolonged persistence in pediatric patients with ALL treated with a low-affinity CD19 CAR. Nat Med. 25, 1408-1414;
- Leila Jafarzadeh, Elham Masoumi, Keyvan Fallah-Mehrjardi, Hamid Reza Mirzaei, Jamshid Hadjati. (2020). Prolonged Persistence of Chimeric Antigen Receptor (CAR) T Cell in Adoptive Cancer Immunotherapy: Challenges and Ways Forward. Front. Immunol.. 11;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Shabnum Patel, Rachel A. Burga, Allison B. Powell, Elizabeth A. Chorvinsky, Nia Hoq, et. al.. (2019). Beyond CAR T Cells: Other Cell-Based Immunotherapeutic Strategies Against Cancer. Front. Oncol.. 9;
- Irene Sarkar, Subhadip Pati, Abhishek Dutta, Udit Basak, Gaurisankar Sa. (2019). T-memory cells against cancer: Remembering the enemy. Cellular Immunology. 338, 27-31;
- Elad Jacoby, Terry J. Fry. (2020). CAR 2.0: The Next Generation of Synthetic Receptor–Based Cellular Therapy for Cancer. Chimeric Antigen Receptor T-Cell Therapies for Cancer. 199-208;
- Иммунитет: борьба с чужими и… своими;
- Michelle Seif, Hermann Einsele, Jürgen Löffler. (2019). CAR T Cells Beyond Cancer: Hope for Immunomodulatory Therapy of Infectious Diseases. Front. Immunol.. 10;
- Colby R. Maldini, Gavin I. Ellis, James L. Riley. (2018). CAR T cells for infection, autoimmunity and allotransplantation. Nat Rev Immunol. 18, 605-616;
- Ученые опять вылечили волчанку у мышей: когда ждать терапии для человека?;
- Генные и клеточные лекарства: сложное регулирование для сложных продуктов;
- Hiroshi Fujiwara. (2014). Adoptive Immunotherapy for Hematological Malignancies Using T Cells Gene-Modified to Express Tumor Antigen-Specific Receptors. Pharmaceuticals. 7, 1049-1068.







