
SciNat за февраль 2023 #2: созревание мозга и митохондрий, пептидо-нуклеиновые кислоты против рака и разрешение 50-летнего ихтиологического спора
12 февраля 2023
SciNat за февраль 2023 #2: созревание мозга и митохондрий, пептидо-нуклеиновые кислоты против рака и разрешение 50-летнего ихтиологического спора
- 408
- 0
- 0
На обложке свежего номера Science — цветы губастика, или обезьянового цветка. Окраска его лепестков в основном зависит от антоцианов и каротиноидов, синтез которых хорошо охарактеризован. Однако у губастиков есть тайное умение — они способны менять окраску в зависимости от того, кто опыляет цветок: пчелы или колибри. В этом процессе участвует локус YELLOW UPPER (YUP), который не кодирует белок, а является источником малых регуляторных РНК. Они блокируют накопление каротиноидов, и цветок теряет желтую окраску. Такой контроль дает растению не только разнообразие оттенков, но и преимущество в репродукции. — Unusual suspects in flower color evolution, Taxon-specific, phased siRNAs underlie a speciation locus in monkeyflowers.
-
Автор
-
Редактор
В новых номерах топовых журналов читайте о том, как развивается кора головного мозга и отпечатки пальцев, а также об искусственном метилировании промоторов и повторном использовании гистонов.
Иммунология
Синдром мультисистемного воспаления проявляется у тех, кто не может контролировать силу иммунного ответа
Хотя дети в целом переносят ковид лучше, чем взрослые, у 0,1% из них возникает синдром мультисистемного воспаления. Резкое повышение температуры, сыпь, боль в животе и воспаление сердца, легких, мозга приводят детей на больничную койку, и. к сожалению, некоторые из них никогда с нее не встанут. Этот синдром не возникает исключительно из-за заражения SARS-CoV-2, а может появляться из-за других инфекций. Причина этого, как оказалось, не недостаточная защита от вируса, а наоборот — слишком острый ответ на заражение.
Исследователи из Рокфеллеровского института проанализировали геномы детей, у которых развивался синдром. Как оказалось, у некоторых из них присутствуют мутации в генах пути OAS-рибонуклеазы L. Из-за этих мутаций активируется альтернативный путь MAVS (mitochondrial antiviral signaling protein), который вовлекает дендритные клетки, фагоциты, макрофаги и моноциты. Такой массивный иммунный ответ приводит к резкому увеличению провоспалительных цитокинов, интерферонов и других факторов, вызывая мультисистемное воспаление. — Inborn errors of OAS–RNase L in SARS-CoV-2–related multisystem inflammatory syndrome in children, «Биомолекула»: «А или Г: невидимое преимущество».
Биология развития
Митохондрии объяснили, почему наш мозг развивается медленней мышиного
Кора головного мозга что у человека, что у мышонка развивается и после рождения. Но у мыши до зрелости проходит всего несколько недель, а у человека — месяцы и годы. Такое долгое развитие помогает нашему мозгу достичь оптимальной функциональности и пластичности. Но что заставляет нейроны коры развиваться столько, сколько нужно? На этот вопрос попытались ответить бельгийские исследователи.
Они проследили за развивающимися нейронами в коре головного мозга мыши и человека, уделив особое внимание митохондриям: их морфологии, функции, экспрессии генов. Оказалось, что у новорожденных митохондрии в нейронах мелкие, и созревают со временем. Однако у человека они медленнее набирают окислительную активность при метаболизме глюкозы. Если фармакологически или генетически ускорить метаболизм в митохондриях, то нейроны созревают быстрее, как у мыши, так и у человека. Однако именно этот механизм, по-видимому, дает время нашему мозгу стать человеческим, а мозгу мышонка — мышиным. — Mitochondria metabolism sets the species-specific tempo of neuronal development, «Биомолекула»: «Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить».
Как развиваются отпечатки пальцев?
Отпечатки пальцев у человека начинают формироваться на 13-й неделе развития с появления первичных гребней кожи, которые затем формируют уникальный узор папиллярных линий. Этот процесс, безусловно, имеет генетическую составляющую. Тем не менее, отпечатки пальцев у монозиготных близнецов разные, а точный механизм их появления неизвестен. Предполагалось, что в этом процессе участвует либо простая деформация эпителия, либо межклеточное взаимодействие. Как оказалось, эти механизмы сложнее, чем мы думали. Исследователи изучили распределение РНК на кончиков пальцев у эмбрионов человека и обнаружили РНК компонентов трех сигнальных путей. Первые два (WNT и BMP) располагались полосками, тогда как РНК третьего пути (EDAR) сопровождала полоски WNT. Благодаря нокауту таких генов у мышей показали, что WNT стимулирует деление эпителиальных клеток, формируя возвышенности. BMP, наоборот, подавляет деление клеток, приводя к образованию бороздок. EDAR же контролирует распределение возвышенностей и борозд: без него возникали бы не полоски, а отдельные точки-возвышенности.
Узор же формируется в трех точках подушечки пальца: в середине, на кончике (под ногтем) и у фаланги. Возвышенности и борозды распространяются от них волнами, на которые влияют также окружающая среда и анатомическое строение. — The developmental basis of fingerprint pattern formation and variation, «Биомолекула»: «Развитие и эпигенетика, или История о Минотавре».
Эпигенетика
Наследование эпигенетической информации, возможно, возможно (во всяком случае, в искусственных условиях)
Эпигенетическая наследственность у млекопитающих — до сих пор предмет споров молекулярных биологов. Несмотря на то, что признаки ее показаны в ряде исследований (например, связанная с избытком или недостатком питания у родителей передача потомкам измененной экспрессии генов), отсутствует механизм, описывающий этот феномен. В процессе эмбрионального развития эпигеном млекопитающих проходит через два раунда «стирания» эпигенетических меток (метильных групп на ДНК, а также модификаций гистонов). Первый происходит перед имплантацией эмбриона, второй — во время образования гамет. Как удается эпигенетическим меткам такое пережить — неизвестно. Исследователи из США разработали метод направленного метилирования ДНК промоторов и применили его в эмбриональных стволовых клетках мыши. Они метилировали промоторы генов Ankrd26 и Ldlr, имитируя одну из причин возникновения ожирения и повышения уровня холестерина у людей. Используя эти клетки, они получили химерных мышей, у которых наблюдались такие же нарушения метаболизма. Кроме того, эффект передавался потомству из поколения в поколение по отцовской линии, вплоть до правнуков химер. Авторы предполагают, что повторное метилирование промоторов Ankrd26 и Ldlr возникает уже на стадии поздней бластоцисты и сохраняется во время образования половых клеток. — Transgenerational inheritance of acquired epigenetic signatures at CpG islands in mice, «Биомолекула»: «Наследование и эпигеном».
Все коровые гистоны повторно используются при репликации
Репликация ДНК — это не только копирование генетической, но и эпигенетической информации. Для того, чтобы сохранить функциональность клетки, при образовании второго набора хромосом нужно точно восстановить распределение гистонов, их варианты и модификации. Гистоны H3 и Н4 временно теряют связь с ДНК и восстанавливают свое положение после прохождения репликационной вилки. Однако на удивление мало известно о том, как ведут себя гистоны H2A-H2B. Как оказалось, этот процесс происходит независимо от гистонов Н3-Н4, а ведущую роль в распределении их по дочерним цепям ДНК играет POLA1 — каталитическая субъединица ДНК-полимеразы. Гистоны H2A-H2B, а также их модификации H2AK119ub1, H2BK120ub1 и вариант H2A.Z быстро восстанавливают свое положение. При этом H2AK119ub1 играет дополнительную функцию, восстанавливая распределение H3K27me3. Таким образом, эпигенетический ландшафт быстро восстанавливается после репликации и передается следующим поколениям клеток. — Recycling of modified H2A-H2B provides short-term memory of chromatin states.
Клиническая генетика
Как редкие мутации участвуют в развитии многофакторных заболеваний
В развитии многофакторных заболеваний участвуют как редкие, так и распространенные генетические варианты. Роль первых чаще всего остается неизвестной: не только из-за встречаемости, но и из-за сложности установления связи с другими генетическими вариантами и негенетическими факторами. К счастью, анализ больших баз данных генетической информации помогает оценить их влияние. Благодаря почти 400 тысячам экзомов в Биобанке Великобритании удалось определить, что редкие варианты участвуют в развитии заболеваний через те же гены и биологические пути. Также ученые оценили «геномную нагрузку» — какая часть редких вариантов участвует в развитии заболевания. Всего 1,3% участвует в этом процессе, и самый большой эффект имеют очень редкие варианты, которые полностью прекращают работу генов, в которых они расположены. Еще один интересный, но логичный вывод: редкие варианты наблюдаются в достаточно небольшом количестве генов, в основном тех, которые менее чувствительны к нарушению функции. Авторы надеются, что это поможет в разработке новых таргетных лекарств. — Polygenic architecture of rare coding variation across 394,783 exomes, «Биомолекула»: «Код жизни: прочесть не значит понять».
Дефекты в биомолекулярных конденсатах могут вызывать серьезные заболевания
Еще один вопрос, связанный с генетическими вариантами: как варианты белок-кодирующих генов связаны с заболеваниями? Для большей части из них ответ неочевиден, так как они располагаются во внутренне-неупорядоченных участках белковой молекулы. Функции таких участков описаны плохо, но предполагается, что они обеспечивают формирование биомолекулярных конденсатов, один из примеров которых — ядрышко. Проанализировав геномы детей с синдромом BPTAS (брахифалагия, полиактилия, аплазия/гипоплазия большеберцовой кости) они обнаружили мутацию в гене HMGB1. Продукт этого гена — белок, который участвует в подвижности клеток, экцизионной репарации оснований и образовании петлей хроматина. Обнаруженная мутация, как выяснилось, нарушает структуру и функцию ядрышка в клетках пациентов и, по-видимому, играет роль в патогенезе заболевания. Авторы создали каталог вариантов белков с неупорядоченными участками, которые могут также участвовать в развитии других заболеваний. — Aberrant phase separation and nucleolar dysfunction in rare genetic diseases, «Биомолекула»: «Разделяй и властвуй: роль разделения фаз в жизни клетки».
Онкология
Пептидо-нуклеиновые кислоты против глиобластомы. Еще одна надежда?
Глиобластома — одна из самых коварных и смертельных форм онкологических заболеваний с медианной выживаемостью всего лишь 15 месяцев. В настоящее время лечение представляет собой удаление опухоли и последующую химио- и радиотерапию. Однако поиск оптимального лечения постоянно продолжается. МикроРНК miR-10b и miR-21 связаны с плохим прогнозом, поэтому являются перспективными мишенями для лечения глиобластомы. Инактивировав их, можно убрать еще один фактор сопротивления раковых клеток. Американские исследования предлагают попробовать для этого пептидо-нуклеиновые кислоты (ПНК). В таких полимерах сахарно-фосфатный остов нуклеиновых кислот заменен на N-(2-амино)глицин. ПНК могут связываться с нуклеиновыми кислотами, в том числе и с микроРНК. Авторы создали ПНК, связывающие участок miR-10b и miR-21, погрузили их в полимерные наночастицы и ввели их в мозг мышиных моделей глиобластомы. В сочетании с химиотерапией темозоломидом, такие частицы увеличивали выживаемость у мышей, а значит, у нас появился еще один возможный препарат. — Anti-seed PNAs targeting multiple oncomiRs for brain tumor therapy, «Биомолекула»: «Отступают, но не сдаются: что помогает опухолевым клеткам противостоять лекарственной терапии».
Эволюционная биология
Как разделялись костистые рыбы: разрешен 50-летний спор
Костистые рыбы составляют практически половину современных позвоночных, однако их эволюция до сих пор неясна. В особенности, непонятны ранние события: как разделились ветви настоящих костистых рыб (к которым относятся данио рерио, караси, щуки и другие), элопоморфов (к которым относятся угри и мурены), а также остеоглоссоморфов (к которым относится южноамериканская рыба арапаима). Различные исследования объединяли в одну группу то первых и вторых, то вторых и третьих. Наконец, благодаря генетическим исследованиям удалось показать их эволюционные взаимоотношения.
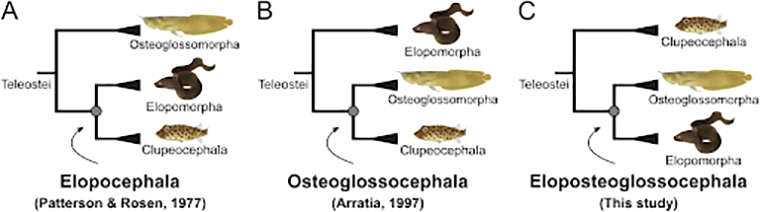
Ученые проанализировали опубликованные геномы различных групп рыб, в частности, угрей и мурен из группы элопоморфов, и продемонстрировали, что остеоглоссоморфы и элопоморфы относятся к одной кладе, когда так настоящие костистые рыбы — к другой. — Genome structures resolve the early diversification of teleost fishes, «Биомолекула»: «Кое-что о рыбах (18+)».





