SciNat за июнь 2025 #4: архей-паразит, искусственные ферменты и секреты нейропатической боли
22 июня 2025
SciNat за июнь 2025 #4: архей-паразит, искусственные ферменты и секреты нейропатической боли
- 267
- 0
- 1
На обложке журнала Science Signaling на этой неделе показано окрашивание на лактилирование лизина (красный) в ганглиях задних корешков у мышей после повреждения нерва.
А в нашем дайджесте вы найдете подробности работы, в которой авторы показывают, что секреция амфирегулина из поврежденной нервной ткани способствует нейропатической боли у мышей через опосредованные гликолизом изменения в экспрессии генов в сенсорных нейронах. — Amphiregulin contributes to neuropathic pain by enhancing glycolysis that stimulates histone lactylation in sensory neurons.
-
Автор
-
Редактор
В новом дайджесте «Биомолекулы» вы узнаете самые свежие новости с переднего края мировой науки! Среди них — один из самых маленьких геномов архей, факторы, связанные с нейропатической болью, новые искусственные ферменты и повышение эффективности мРНК-вакцин. Все это и многое другое вы найдете ниже.
Молекулярная биология
Знаете все о биосинтезе белка? А вот и нет!
Процесс биосинтеза белка, который происходит на рибосомах во всех живых клетках, завершается распознаванием стоп-кодона мРНК и гидролизом пептидил-тРНК, что приводит к высвобождению из рибосомы только что синтезированного полипептида. Несмотря на то, что этот процесс изучен со всех сторон и занял прочное место во всех учебниках биохимии и даже школьной биологии, механизмы некоторых ферментативных реакций находились скорее в области предположений. Одной из таких реакций является гидролиз пептидил-тРНК, который опосредуется фактором высвобождения пептидов (RF) и происходит на этапе терминации трансляции, когда рибосома достигает стоп-кодона мРНК. Долгое время предполагалось, что в процесс гидролиза вовлечена молекула воды, однако из-за отсутствия модели рибосомы на этом этапе трансляции это не было доказано. Группа исследователей из США и России в своей работе, опубликованной в журнале Science, сообщают о создании структуры бактериальной рибосомы в комплексе с пептидил-тРНК и RF в состоянии высвобождения полипептида. Оказалось, что в активном центре пептидилтрансферазы молекула воды отсутствует, а вместо нее в процессе гидролиза принимает участие 2’-ОН группа аденозина (А76), входящего в состав тРНК (см. схему ниже). Таким образом, происходит автогидролиз тРНК, который обеспечивает строгий контроль процесса терминации трансляции. — Mechanism of release factor–mediated peptidyl-tRNA hydrolysis on the ribosome, «Биомолекула»: «Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?».
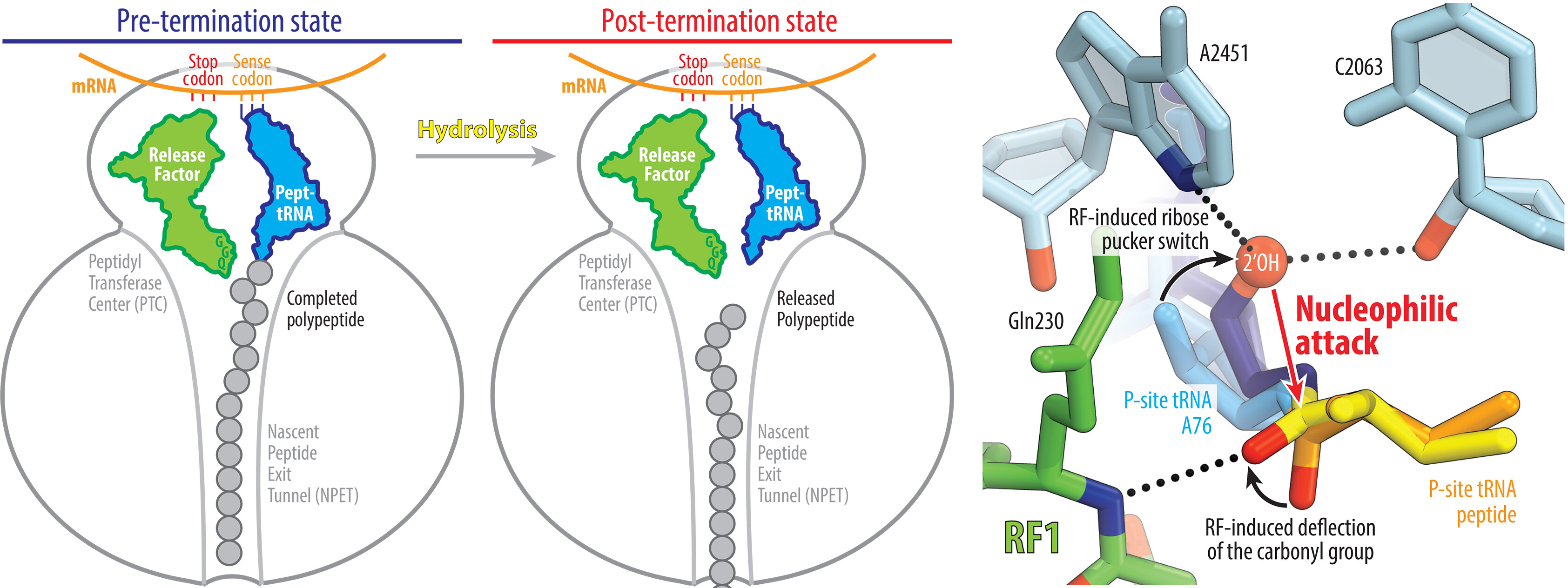
Механизм высвобождения пептида на рибосоме. Слева: фактор высвобождения пептидов RF распознает стоп-кодон в мРНК и запускает гидролиз пептидил-тРНК через свой GGQ—мотив—содержащий домен. Справа: RF индуцирует перестройку пептидил-тРНК, что приводит открытию эфирной карбонильной группы пептидил-тРНК и нуклеофильной атаки соседним 2′-OH рибозы A76 и стабилизация переходного состояния амином основной цепи RF.
Биохимия
Искусственные ферменты скоро «догонят» природных собратьев
Природные ферменты являются высокоселективными и эффективными катализаторами. Напротив, разработанные искусственно ферменты обычно демонстрируют скорости на порядки ниже их природных аналогов. Международная группа исследователей разработала новый метод проектирования эффективных ферментов с использованием фрагментов природных белков. Авторы утверждают, что современные достижения в фолдинге белков, искусственном интеллекте и высокопроизводительном скрининге дают возможность создавать более «точные» модели ферментов, которые могут правильно ориентировать измененные исследователями фрагменты белка в его природном «шаблоне» и тем самым повышают его стабильность и эффективность как катализатора. Они сосредоточились на создании элиминазы Кемпа, фермента, который катализирует несуществующую в природе реакцию. Им удалось сконструировать фермент, скорость которого превышает все известные искусственные модели на два порядка и сопоставима с таковой в природе. Одной из особенностей этой модели стало изменение фрагмента фермента, который ранее считался консервативным, так как считалось, что этот мотив должен оставаться неизменным для сохранения каталитической активности модели. — Complete computational design of high-efficiency Kemp elimination enzymes.
Неврология
Амфирегулин — еще один фактор, связанный с нейропатической болью
Нейропатическая боль связана с повреждением периферических нервов и выделением клетками провоспалительных цитокинов. Группа ученых из Ханчжоу (Китай) обнаружила и изучила новый механизм, управляющий секрецией цитокинов через регуляцию генной экспрессии в клетках чувствительных нейронов. Ключевым игроком в новом механизме является трансмембранный белок амфирегулин, который известен как аутокринный фактор, вовлеченный в регуляцию роста и деления клеток, а также регенерации тканей. Авторы исследования обнаружили, что взаимодействие амфирегулина с рецептором эпидермального фактора роста (EGFR) вызывает усиление окисления глюкозы с помощью гликолиза и увеличение уровня лактата. Накопление лактата в клетке приводит к необычной посттрансляционной модификации гистонов, лактилированию (lactylation), т.е. присоединению лактата к остаткам лизина в молекуле белка. Такая модификация гистонов вызывает увеличение экспрессии генов, кодирующих факторы, усиливающие воспаление и боль. Также исследователи показали, что «выключение» гена AREG, кодирующего амфирегулин, подавляет болевой синдром, вызванный травмой у мышей. Авторы надеются, что дальнейшее изучение этого механизма приведет к появлению новой мишени для разработки обезболивающих препаратов. — Amphiregulin contributes to neuropathic pain by enhancing glycolysis that stimulates histone lactylation in sensory neurons, «Биомолекула»: «Молекулярная биология боли».
Как микроглия вызывает аллодинию и причем тут прунинг
Еще одна публикация заставит нас глубже погрузиться в механизмы нейропатической боли. Аллодиния — повышенная чувствительность к механическим неболевым стимулам, которая часто сопровождает этот вид боли. Считается, что в такой процесс вовлечены интернейроны, экспрессирующие протеинкиназу Сγ (ПКСγ). При хронической боли интернейроны ПКСγ активируются и передают сигнал от механорецептора и чувствительного нейрона ноцицептивному интернейрону второго порядка, который посылает сигнал выше в структуры ЦНС, вызывая возникновение боли. Механизмы активации интернейронов ПКСγ до сих пор плохо изучены. Жоу (Zou) и соавторы обнаружили, что одним из способов «растормаживания» интернейронов ПКСγ может быть прунинг со стороны микроглии. Прунинг — это процесс «обрезания» некоторых синапсов для увеличения эффективности синаптической сети. Авторы также смогли определить несколько факторов, которые могут провоцировать активацию прунинга и растормаживание интернейронов. Среди них такие белки, как ядерный рецептор X печени, компонент каскада комплемента C1q и аполипопротеин E. Таким образом, изучение микроглиальной активации может дать больше информации о механизмах развития аллодинии при нейропатической боли. — Microglial pruning of glycinergic synapses disinhibits spinal PKCγ interneurons to drive pain hypersensitivity in mice, «Биомолекула»: «Нейродегенерации, или Массовые вымирания нейронов».
Иммунология
Интерлейкин 12 улучшает иммунологическую память CD8-Т-лимфоцитов
Вакцины на основе липидных наночастиц (LNP), содержащих мРНК антигена, хорошо зарекомендовали себя в период пандемии COVID-19, поскольку вызывают устойчивые иммунные реакции и обеспечивают защиту от инфекционных заболеваний. Тем не менее, эффект от вакцинации LNP может быть кратковременным, что приводит к необходимости частых ревакцинаций. Эмили Аунинс (Emily Aunins) и ее соавторы предлагают оригинальный способ усилить иммунологическую память, добавив в состав LNP мРНК, кодирующую интерлейкин-12 (IL-12). Оказалось, что подобная «добавка» усиливает активность цитотоксических Т-лимфоцитов (CD8-Т-лимфоцитов) и улучшает их память. Кроме того, LNP—IL-12 обеспечивают бóльшую защиту после заражения Listeria monocytogenes и в модели меланомы B16F0. Эта работа показывает, что на величину иммунного ответа можно влиять в том числе такими неспецифическими воздействиями. — An Il12 mRNA-LNP adjuvant enhances mRNA vaccine–induced CD8 T cell responses, «Биомолекула»: «мРНК-вакцина на страже коллективного иммунитета: за что вручили Нобелевскую премию в 2023 году».
Биология клетки
Тонкие настройки органогенеза: как плексин и семафорин регулируют миграцию клеток
Эпителиально-мезенхимальный переход (ЭМП) — это процесс, в котором плотно связанные друг с другом эпителиальные клетки приобретают способность к миграции и дифференциации в другие типы тканей. При этом клетки, участвующие в ЭМП, зачастую могут иметь черты как эпителиальных, так и мезенхимных, в зависимости от их локализации. Понимание того, как изменения в локальной архитектуре при контакте между клетками обеспечивают возникающую коллективную динамику при их миграции, является ключевой задачей для подобных исследований. Бишоф (Bischoff) и соавторы изучили процесс ЭМП в ходе контактно-регулируемой миграции клеток при формировании яичка у дрозофилы (Drosophila spp.) и влияние на этот процесс двух белков — плексина и семафорина. Плексины — это класс трансмембранных рецепторов, а семафорины являются их лигандами. Их взаимодействие приводит к возникновению внутриклеточных сигнальных каскадов, регулирующих процессы роста, а также развитие рака. Авторы исследования установили, что плексин регулирует клеточную архитектуру во время миграции и, таким образом, отвечает за создание определенной формы яичек за счет того, что делает клетки более мезенхимальными, то есть динамичными и способными к миграции. А недостаток плексина или избыток семафорина, наоборот, приводит к сохранению клетками эпителиальных черт с характерными межклеточными контактами. Авторы полагают, что межклеточные взаимодействия в период морфогенеза органов играют большее значение, чем считалось ранее, и планируют дальнейшее изучение этого процесса. — Plexin/Semaphorin antagonism orchestrates collective cell migration and organ sculpting by regulating epithelial-mesenchymal balance.
Микробиология
Маленький архей помог приоткрыть дверь в мир эволюции вирусов
Группа японских ученых под руководством доктора Такуро Накоямы (Takuro Nakayama) обнаружила новый микроорганизм, доказательством существования которого является лишь его геном, содержащий 189 кодирующих белки генов. Микроба назвали Sukunaarchaeum в честь японского божества Сукуно-Бикона, отличающегося маленьким ростом. Следы этого организма, а точнее, его ДНК, были обнаружены в одноклеточной водоросли из группы динофлагеллят Citharistes regius, в которой, судя по всему, паразитирует этот «малыш». Найденный микроорганизм отнесли к археям, домену безъядерных организмов, которые отличаются и от бактерий, и от эукариот. Ученых поразило то, что в геноме Sukunaarchaeum закодированы только те гены, которые обеспечивают его самовоспроизведение — и при этом полностью отсутствуют гены, отвечающие за метаболизм и другие клеточные функции. Это может означать, что микроорганизм практически полностью зависит от C. regius и демонстрирует стратегию, типичную для вирусов, которая направлена исключительно на самовоспроизведение. Сторонники гипотезы регрессивной эволюции предполагают, что найденный организм может быть промежуточным звеном между примитивным археем и вирусом. Однако авторы исследования пока стараются не делать далеко идущих выводов и планируют поиск других подобных организмов. Они уже нашли несколько похожих геномов и в настоящее время ищут в них генетические связи с другими археями. Подробнее об исследовании — в заметке журнала Science. — Microbe with bizarrely tiny genome may be evolving into a virus, препринт статьи на biorxiv.org: A cellular entity retaining only its replicative core: Hidden archaeal lineage with an ultra-reduced genome, «Биомолекула»: «Маленький, да удаленький: самые маленькие клетки».
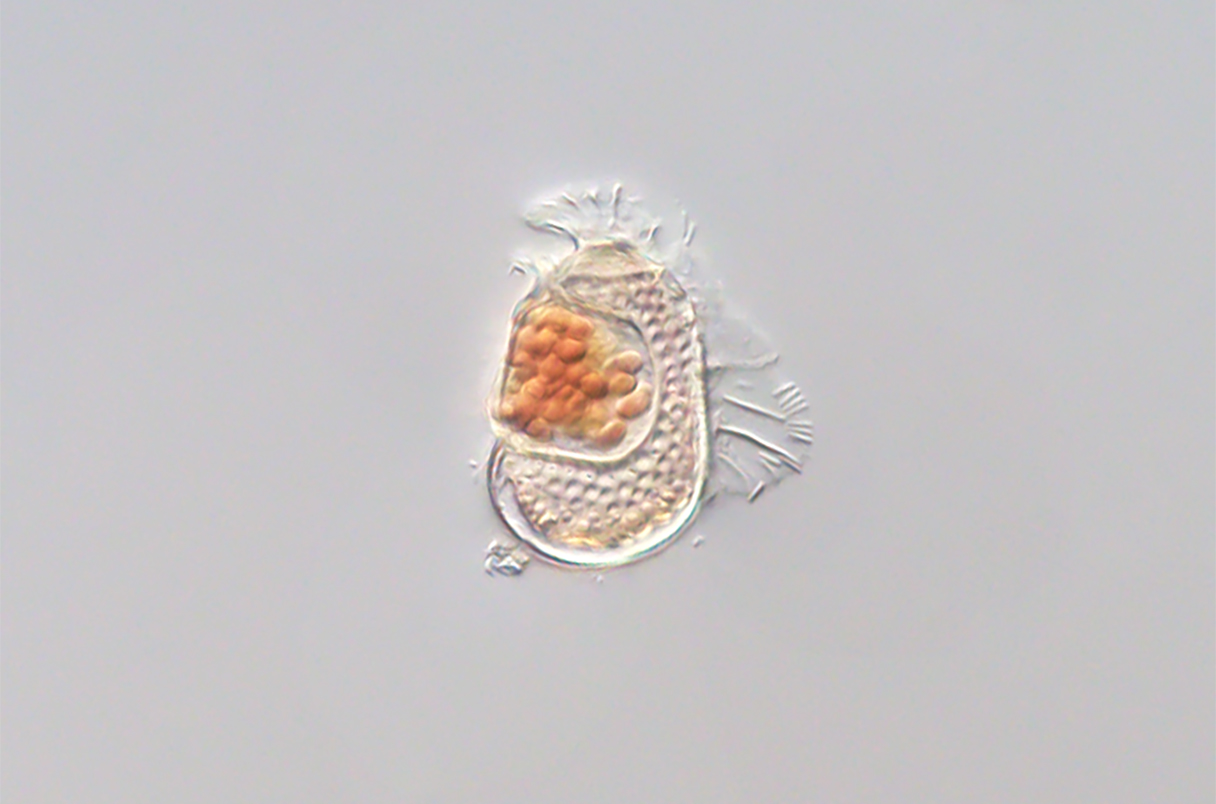
Динофлагеллят Citharistes regius, внутри которого обнаружен Sukunaarchaeum.
Антропология
Африка помогает раскрыть секреты экологической пластичности человека
Все современные жители Евразии ведут свою родословную от небольшой популяции, вышедшей из Африки около 50 000 лет назад. При этом многочисленные ископаемые доказательства говорят о более ранних миграциях из Африканского континента. Подобное противоречие может быть связано с тем, что переселения более ранних групп в Азию и Европу были неудачными. Эмили Халлет и ее коллеги попытались разобраться с причинами неудач ранних переселенцев из Африки. Оказалось, что более позднему расселению людей предшествовала экспансия на самом Африканском континенте. Исследовали проанализировали характер расположения археологических находок, предшествующих периоду успешной миграции людей в Евразию, и установили, что 120 000 лет назад человек начал заселять более разнообразные природные ниши, в том числе леса и пустыни, а пика этот процесс достиг около 70 000 лет назад. Авторы подчеркивают, что это не обязательно следствие увеличения численности человеческих популяций. Заселение новых ниш может быть связано с изменениями климата, которые могли заставить людей того периода активнее осваивать новые территории. Адаптации, которые сформировались у людей в тот период, стали основой для той экологической пластичности, которая позволила им распространить экспансию на север и занять новые территории в Азии и Европе, а потом и во всем остальном мире. — Major expansion in the human niche preceded out of Africa dispersal.
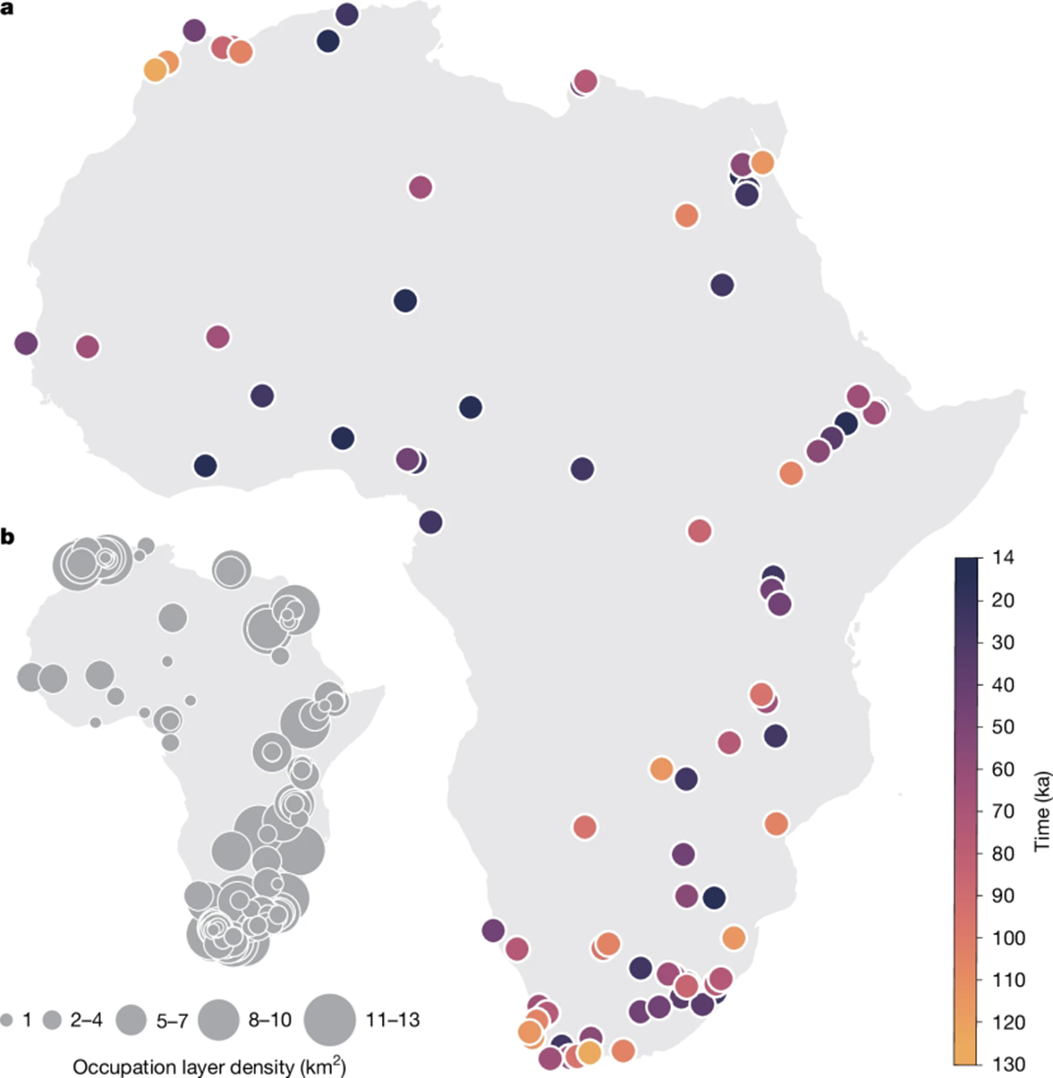
(а) — местоположение и временные диапазоны археологических памятников; (б) — плотность археологических слоев, использованных в исследовании, на квадратный километр.