Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
29 октября 2021
Трансляция: как и зачем ингибировать биосинтез белка в собственных клетках?
- 4325
- 0
- 11
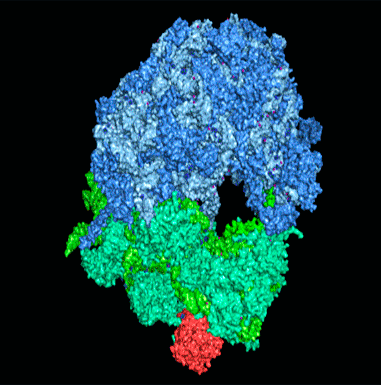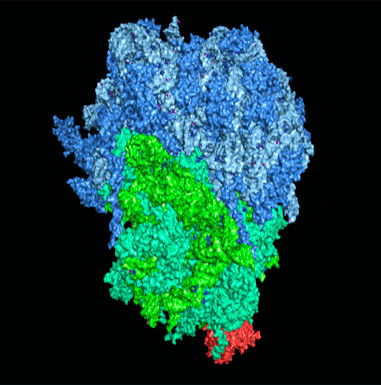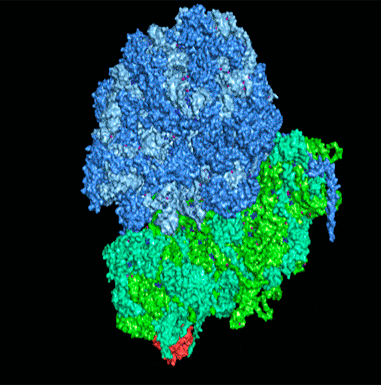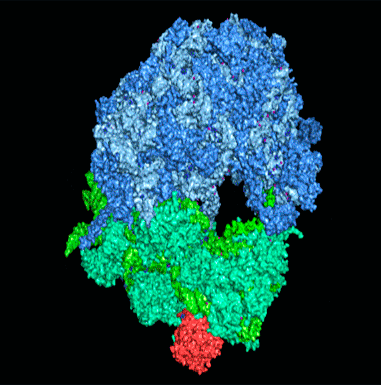
3D-структура эукариотической рибосомы
визуализация автора статьи с использованием скрипта проф. Ненада Бана на основе структуры рибосомы 4V88 [17]
Статья на конкурс «Био/Мол/Текст»: Биосинтез белка (трансляция) — ключевой процесс клеточного метаболизма, в ходе которого специальные молекулярные машины — рибосомы, — раскодируя последовательность нуклеотидов в матричной РНК, производят полипептидную цепь. Как и к любым другим биомолекулам, к компонентам трансляционного аппарата можно подобрать ингибиторы. Подавление трансляции в эукариотических клетках с помощью малых молекул в последние годы всё чаще применяется при терапии различных заболеваний (в том числе генетических). Казалось бы, для чего ингибировать процесс, который обеспечивает клетку строительным материалом, ферментами, регуляторами и прочими необходимыми для жизни компонентами? Дело в том, что часто при раковой трансформации или вирусной инфекции рибосомы начинают «подыгрывать» врагу, смещая трансляцию в сторону «нежелательных» мРНК. Например, вирусы, чтобы качнуть чашу весов в свою сторону, могут использовать множество интересных механизмов для модификации клеточной трансляции. Таким образом, лекарства, которые подавляют биосинтез белка, могут намного сильнее затормозить рост клеток, вышедших из-под контроля, нежели «законопослушных». Это их свойство и используется при терапии.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания Cytiva.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Я работаю в лаборатории системной биологии старения в отделе взаимодействия вирусов с клеткой НИИ физико-химической биологии имени А.Н. Белозерского МГУ. На втором курсе моя курсовая работа была связана с поиском ингибиторов трансляции у эукариот и созданием базы таких ингибиторов. Данная статья подготовлена по материалам обзора, опубликованного в спецвыпуске журнала «Биохимия» [1].
Молекулярный аппарат трансляции и его консервативность
Трансляционный цикл на множестве этапов может быть нарушен или замедлен многочисленными и разнородными по химическому строению ингибиторами. Ключевые компоненты трансляционного аппарата клетки — это рибосомы и факторы трансляции (белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла), а также большое количество вспомогательных белков, необходимых для обеспечения синтеза нужными материалами: например, аминоацил-тРНК-синтетазы (АРСазы) — ферменты, соединяющие тРНК с соответствующей ей аминокислотой; или регуляторы биосинтеза белка — компоненты сигнальных путей, связанных с трансляцией. При подборе ингибиторов нельзя не учитывать, что многие из этих молекул есть у всех живых организмов, и некоторые из них довольно консервативны. А значит, одни и те же вещества могут действовать как на про-, так и на эукариот, что не всегда приемлемо.
Каждый живой организм на Земле может быть отнесен к одному из трех доменов жизни: это максимально удаленные друг от друга в эволюционном смысле группы — эукариоты (здесь ищите самые известные царства: животных, растений и грибов), бактерии и археи [2]. Эта удаленность означает, что они давно разошлись (то есть их последний общий предок жил давно [3]), и у представителей групп накопилось множество отличий. Но есть и признаки, по которым представители различных доменов похожи друг на друга. Речь идет об основополагающих признаках: например, способности удваивать ДНК, синтезировать на ее основе РНК и в конце концов получать закодированный в ней белок. Трансляция относится к самым консервативным биологическим процессам.
При ближайшем рассмотрении оказывается, что устройство белоксинтезирующего аппарата довольно схоже у представителей разных доменов. К примеру, основные факторы инициации и элонгации у бактерий имеют гомологов у архей, а рибосомы архей по многим аспектам строения очень напоминают рибосомы эукариот (что даже позволило создать из рибосом дрожжей гибридные рибосомы, в которых одна из субъединица очень напоминала рибосомную субъединицу архей [4]). В пределах этих трех доменов есть отличия, но мы видим, что трансляционная машинерия в целом очень консервативна, и таких отличий не так много. Это является несомненным свидетельством общности (монофилетичности) происхождения жизни.
Ингибиторы трансляции как антибиотики
Чаще всего исследователям приходится подбирать ингибиторы биосинтеза белка у бактерий и заботиться о том, чтобы они не действовали на эукариот, так как это позволяет применять такое вещество в качестве антибиотика. Больше половины используемых сейчас антибиотиков подавляет именно трансляцию, действуя на рибосому , [5]. И здесь на первый план зачастую выходят те тонкие различия, которые все-таки можно отыскать в строении аппарата трансляции у представителей разных доменов.
Подробнее про различные классы антибиотиков и про то, как они действуют, можно прочитать в статье «Биомолекулы» «Антибиотики vs Бактерии. “Война Бесконечности” или всему есть предел?» [6].
Однако в этой статье речь пойдет об ингибиторах эукариотической трансляции — ведь многие из них служат мощными противоопухолевыми и антивирусными препаратами, используются для иммуносупрессии при пересадке органов или для обезболивания. Некоторые из этих веществ рассматривают даже как возможное «лекарство от старости». Но перед тем как переходить к их рассмотрению, нам придется вспомнить основные этапы трансляционного цикла.
Трансляционный цикл
Чтобы оценить все разнообразие ингибиторов биосинтеза белка, давайте для начала ознакомимся с теми этапами трансляционного цикла, на которые может быть направлено их действие. Эти этапы изображены на рисунке 1 (кликнув на элемент, вы можете прочитать про него подробнее в «Википедии»). Кстати, некоторые этапы этого сложного процесса до сих пор плохо изучены.
Рисунок 1. Трансляционный цикл эукариот (с подсказками!) и избранные сигнальные каскады, влияющие на него. Также показаны самые известные и изученные ингибиторы цикла (черная рамка означает принципиально другой механизм действия). Вещества сгруппированы в соответствии со стадиями синтеза белка, в которых участвуют их мишени. Стадии обозначены кодами. Инициация трансляции: i.1 — связывание eIF2 с Met-тРНК и образование тройного комплекса eIF2/Met-тРНКi/GTP (TC); i.2 — взаимодействие eIF4A и eIF4G; i.3 — взаимодействие eIF4E и eIF4G; i.4 — связывание eIF4E с m7G-кэпом на 5′-конце мРНК; i.5 — ингибирование хеликазной (расплетающей мРНК) активности eIF4A при посадке eIF4F на мРНК и последующем рибосомном сканировании; i.6 — узнавание AUG-кодона при сканировании; i.7 — взаимодействие eIF5B с 60S-субъединицей; i.8 — взаимодействие eIF6 с 60S-субъединицей; i.9 — присоединение 60S-субъединицы к 48S преинициаторному комплексу (48S PIC) с образованием 80S инициаторного комплекса (80S IC). Элонгация и сопутствующие реакции: e.1 — аминоацилирование тРНК; e.2 — диссоциация eEF1A/GDP после доставки аминоацил-тРНК (Аа-тРНК); e.3 — продвижение полипептида в рибосомном тоннеле; e.4 — декодирование; e.5 — пептидилтрансферазная реакция; e.6 — транслокация; e.7 — диссоциация eEF2/GDP после транслокации. Терминация: t.1 — узнавание стоп-кодона; t.2 — гидролиз пептидил-тРНК. Рециклинг: r.1 — диссоциация 60S-субъединицы. Коды модуляторов сигнальных каскадов: s.1–s.3 — активаторы киназ фактора eIF2; s.4 — ингибиторы фосфатаз фактора eIF2; s.5 — ингибиторы киназы PI3K; s.6 — ингибиторы активного центра киназы mTOR; s.7 — аллостерические ингибиторы mTOR в составе комплекса mTORC1. Рисунок позаимствован из нашей статьи в журнале «Биохимия» [1]. Более полная его версия с поясняющими таблицами доступна на сайте базы ингибиторов EuPSIC
Схема может показаться сложной, но в действительности это не так. Попробуйте выхватить взглядом желтую 40S-субъединицу (в свободном от других компонентов трансляции виде ее можно найти рядом со стадией i.1) и пройтись по циклу, как в настольной игре, посмотрев на все, что успевает с ней за это время произойти. Особенно любознательным предлагаем покликать по элементам схемы и прочитать о каждом из этапов дополнительно.
Этапы трансляции
Трансляционный цикл принято подразделять на несколько этапов:
- Инициация (i) — подготовка к синтезу белка: загрузка матричной РНК (мРНК) и первой транспортной РНК (инициаторной Met-тРНКi) в рибосому.
- Элонгация (e) — непосредственно чтение матричной РНК и синтез полипептида; на этой стадии рибосома проводит наибольшее количество времени. Данный этап можно разделить на присоединение к рибосоме тРНК, заряженной аминокислотой (аминоацил-тРНК, Аа-тРНК), пептидилтрансферазную реакцию и транслокацию.
- Терминация (t) — завершающий этап, включающий остановку рибосомы и отсоединение синтезированного белка.
- Рециклинг (r) — разборка терминировавшей рибосомы на субъединицы и их уход с мРНК, а также высвобождение последней «разряженной» тРНК.
Отдельно происходит активация аминокислот с помощью аминоацил-тРНК-синтетаз (см. e.1 на рисунке 1).
Некоторые трансляционные факторы известны уже очень давно, для них понятна функция, известны ортологи у архей и бактерий (подробнее про гомологичные взаимоотношения генов можно прочитать здесь [7]) и выяснено, являются ли они строго необходимыми для синтеза белка — ведь некоторые вирусные мРНК, например, могут обходиться без целого ряда факторов инициации трансляции [8], [9]. Роль других участников была открыта относительно недавно. Примером таких белков служат факторы DENR и MCTS1 (см. область рециклинга (r) на рисунке 1), изучением которых, кстати, занимается наша лаборатория.
На рисунке 1 (см. s.1, s.2) также изображена часть путей внутриклеточного сигналинга, которые непосредственно регулируют трансляцию. Кроме того, существует еще и сложнейший процесс сборки рибосомы из рибосомной РНК и белков, который протекает по большей части в ядре. Его также можно подавить низкомолекулярными веществами, но о них известно гораздо меньше, а их специфичность часто оставляет желать лучшего.
Типы ингибиторов
С ингибиторами трансляции удобно знакомиться, если классифицировать их согласно мишеням, на которые они воздействуют.
Ингибиторы эукариотической рибосомы
Многие из ингибиторов действуют на рибосомы. При этом они могут быть универсальными (подавлять трансляцию у всех доменов живого), а могут — специфичными (например, к рибосоме эукариот или даже каких-то узких таксономических групп). Специфичность действия, как правило, определяется тонкими различиями в строении места связывания: структурные исследования показывают, что часто достаточно замены одного нуклеотида в рРНК или разницы в единственной аминокислотной позиции рибосомного белка, чтобы конфигурация участка не позволяла ингибитору связаться. Подавляющее большинство ингибиторов рибосомы действует на стадии элонгации, однако существуют и другие типы, перечисленные в таблице 1 (заметьте, что пункты могут перекрываться).
| Типы ингибиторов | Классы химических веществ и известные представители | Краткие комментарии |
|---|---|---|
| Рибосом-направленные ингибиторы инициации трансляции | Эдеин, MDMP, eIFsixty-4 | Небольшая группа ингибиторов, механизмы действия которых сильно различаются. Основной механизм — нарушение взаимодействия с лигандами: блокирование связывания факторов инициации или нарушение аккомодации инициаторной тРНК (рис. 1: i.6–i.9). |
| Рибосом-направленные ингибиторы элонгации (кроме веществ, вызывающих ошибки декодирования) | Анизомицин, гомохаррингтонин, трихотецины, квассиноиды, амикумацин A, циклогексимид, эметин, лиссоклимид, гигромицин B, тетраценомицин X и другие | Большая и разнообразная по химическому строению и механизмам действия группа. Могут действовать на транспептидацию, транслокацию, вызывать преждевременную терминацию или блокировать пептидный тоннель. Как правило, связываются с функциональными сайтами рибосомы. Эти сайты вместе с избранными ингибиторами, присоединенными к рибосоме, можно изучить на рис. 5. Интересно, что некоторые ингибиторы элонгации, действующие на ее самые начальные стадии, часто путают с ингибиторами инициации. Самым известным таким ингибитором является гомохаррингтонин (рис. 2). Все ингибиторы, представленные на рисунке 5, кроме TC007 и паромомицина, относятся именно к данному типу (рис. 1: e.3, e.5, e.6). |
| Вещества, вызывающие ошибки декодирования | Аминогликозиды (преимущественно с 2-DOS кольцом) и ряд других ингибиторов [6] | Основное место связывания таких веществ на эукариотической рибосоме — декодирующий центр малой субъединицы (спираль h44, см. рис. 5). Это связывание вызывает стабилизацию той конформации, которую рибосома должна принимать при наличии «правильной» аминоацил-тРНК в А-сайте. В результате реакция по переносу остатка аминокислоты может произойти, даже если там находится не соответствующая кодону тРНК, что вызывает ошибки декодирования, а также «проскок» стоп-кодона (подробнее это описано ниже на примере аталурена) — рис. 1: e.4. |
| Рибосомные ингибиторы, влияющие на терминацию | Аминогликозиды, гиролин | Совсем небольшая группа ингибиторов. У эукариот вещества, специфично блокирующие собственно терминацию (высвобождение полипептида), изучены плохо. Поэтому список ингибиторов t.1 в основном представлен веществами из предыдущего списка (e.4), т.к. их влияние на точность декодирования сказывается в том числе и на узнавании стоп-кодона, что вызывает его «проскок». Подтвержденным ингибитором высвобождения пептида у эукариот является, пожалуй, пока только гиролин (рис. 1: t.1, t.2). |
| Ингибиторы рибосомного рециклинга | Некоторые аминогликозиды, бацифелацин и неоквассин | Пока что веществ, которые бы специфично действовали на эту стадию, не обнаружено, но, возможно, это просто вопрос времени. Механизмы рециклинга и вовлеченные в него факторы сильно различаются у эукариот и бактерий, а у архей эта стадия изучена особенно плохо (рис. 1: r.1). |
Если классифицировать по сайтам связывания, то выделяют: ингибиторы пептидилтрансферазного центра; ингибиторы транслокации, узнающие E-сайт; ингибиторы, связывающиеся в пептидном тоннеле; ингибиторы, взаимодействующие с декодирующим центром; ингибитор, связывающийся с ГТФаза-активирующим центром (пока достоверно описан только один такой пример).
Пока не так много веществ этого типа допущены до практического применения (самое известное из них — гомохаррингтонин (рис. 2)), но их число постепенно растет. Клинические и доклинические испытания проходили, например, такие ингибиторы пептидилтрансферазного центра, как ликорин, нарциклазин и бруцеантин, а ингибитор транслокации эметин используется как антигельминтное и противомалярийное средство.
Чтобы понять, как именно ингибиторы могут подавлять активность рибосомы, полезно вспомнить ее общее строение. Это удобно сделать с помощью интерактивного аплета (см. рис. 5).
Рисунок 5. Пристальный взгляд на эукариотическую рибосому. В верхней кнопочной панели можно изучить структурные элементы рибосомы. Для того чтобы узнать о структурном элементе или сайте связывания, наведите курсор на кнопку. В нижней панели можно найти распространенные ингибиторы, которые действуют на разные части эукариотической рибосомы, визуализированные в предыдущем разделе. В виде на лиганд взаимодействующие основания выделены оранжевым. Встроенный в статью этот апплет очень маленький, поэтому рекомендуем открыть полноэкранную версию.
- Чтобы увидеть лиганд-белковые взаимодействия, можно кликнуть на лиганд в режиме его просмотра.
- Из-за большого размера структур и их сложности для просмотра рекомендуется пользоваться компьютером со стабильным подключением.
- При переходе между видом рибосомы и видом на лиганд структура перезагружается.
- К сожалению, выделение структурных элементов из прошлого раздела в структурах с ингибиторами не поддерживается.
- В будущем рисунок будет совершенствоваться, при клике на хищную рибосому читатель может найти более совершенную версию, которая периодически обновляется.
Для показа структурных элементов использована структура дрожжевой рибосомы, полученная методом криоэлектронной микроскопии группой Р. Бекманна (6SNT). Для визуализации используется веб-плагин MolStar.
Ингибиторы трансляционных факторов
Трансляционные факторы — белки, помогающие рибосоме реализовывать разные этапы трансляционного цикла. Чаще всего эти факторы жизненно необходимы для нормального синтеза белка в клетках или митохондриях/пластидах, которые, как правило, тоже имеют свой трансляционный аппарат.
Эта группа веществ взаимодействует с факторами в растворе, блокируя их активность или препятствуя присоединению к рибосоме (во втором случае они могут контактировать не только с фактором, но и с рибосомой, что приводит к неоднозначности в классификации: иногда их относят к ингибиторам рибосомы).
Ингибиторы факторов инициации трансляции
Инициация трансляции в эукариотических клетках устроена сложнее, чем у бактерий: факторов инициации здесь больше, и многие из них являются эукариот-специфичными. Поэтому и набор мишеней для ингибиторов довольно разнообразен. Со всем многообразием факторов инициации и их набором у трех доменов живого удобно ознакомится в таблице 2.
Наиболее перспективными с точки зрения применения в клинике блокаторами этой стадии являются, пожалуй, ингибиторы РНК-хеликазы eIF4A, которые демонстрируют яркую антивирусную активность. В частности, два вещества, относящиеся к семейству рокаглатов, — сильвестрол и зотатифин — в данный момент проходят клинические испытания на больных COVID-19 [12], [13]. Вообще, биосинтез белка является «ахиллесовой пятой» многих вирусов, поскольку большинству клеток обычно не нужно синтезировать белки в таких количествах, как при вирусной инфекции, и незараженная клетка может безболезненно пережить невысокие концентрации трансляционных ингибиторов, которые убьют инфицированную или просто заблокируют размножение вируса.
| Бактерии | Археи | Эукариоты | Функция |
|---|---|---|---|
| — | aIF2 (α, ß, γ) [3V11]

|
eIF2 (α, ß, γ) [6FYX]

|
Связывается с инициаторной Met-тРНКi и доставляет ее на рибосому при инициации трансляции, при распознавании старт-кодона гидролизует связанный с ним ГТФ. |
~IF3*
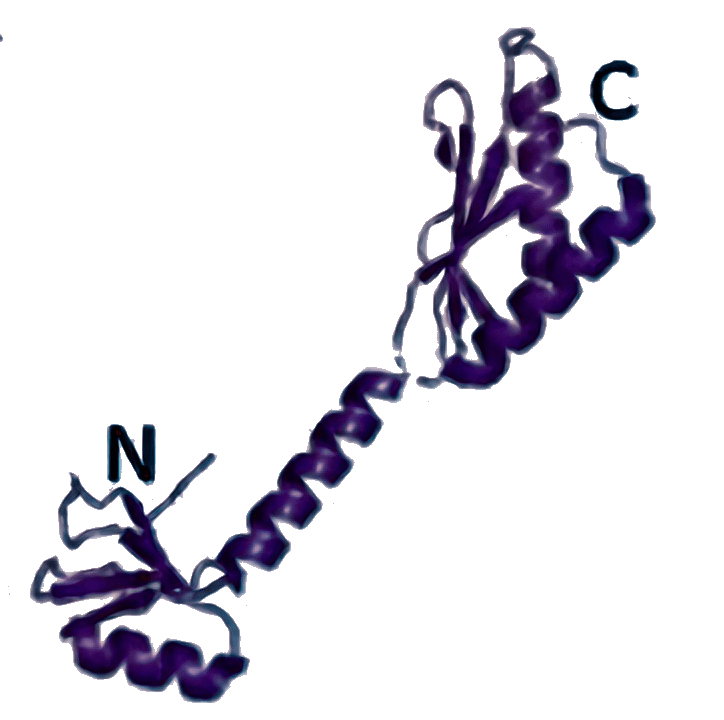
|
aIF1 [4MO0]

|
eIF1 [6FYX]
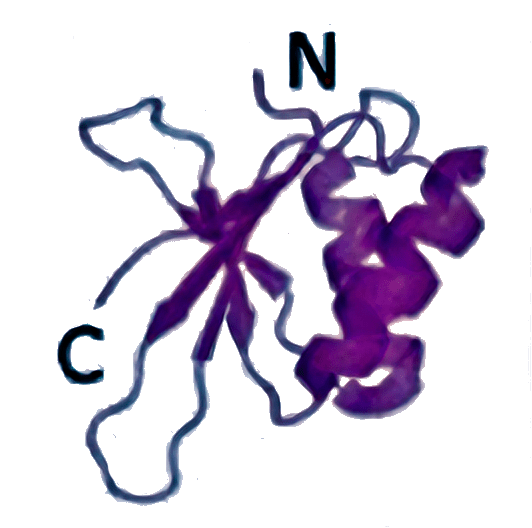
|
Отвечает за распознавание правильного старт-кодона (у бактерий также за узнавание инициаторной тРНК). |
IF1 [3I4O]
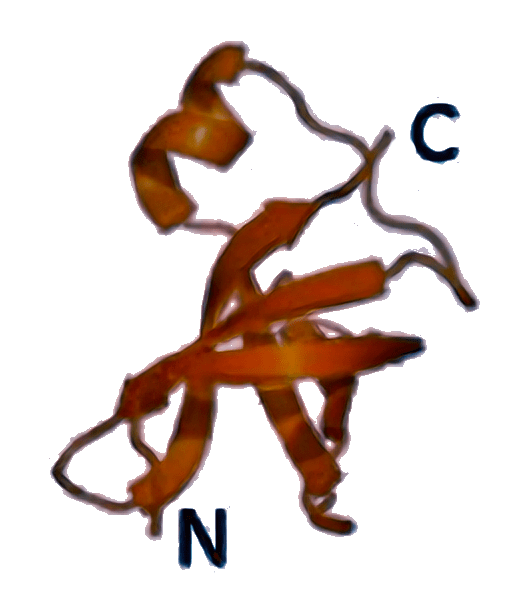
|
aIF1A [4MNO]
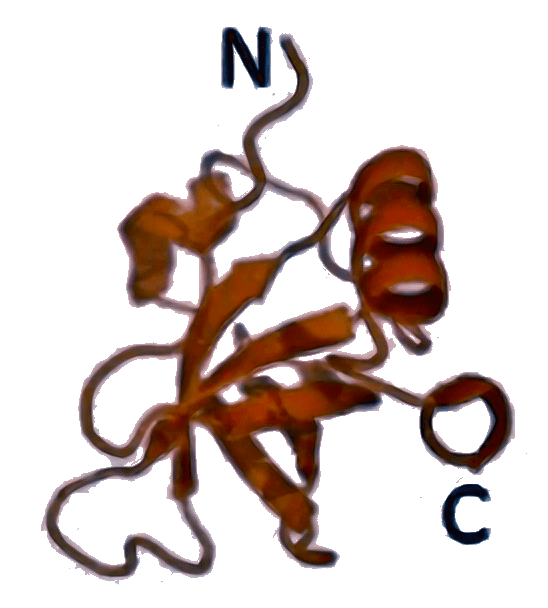
|
eIF1A [6FYX]
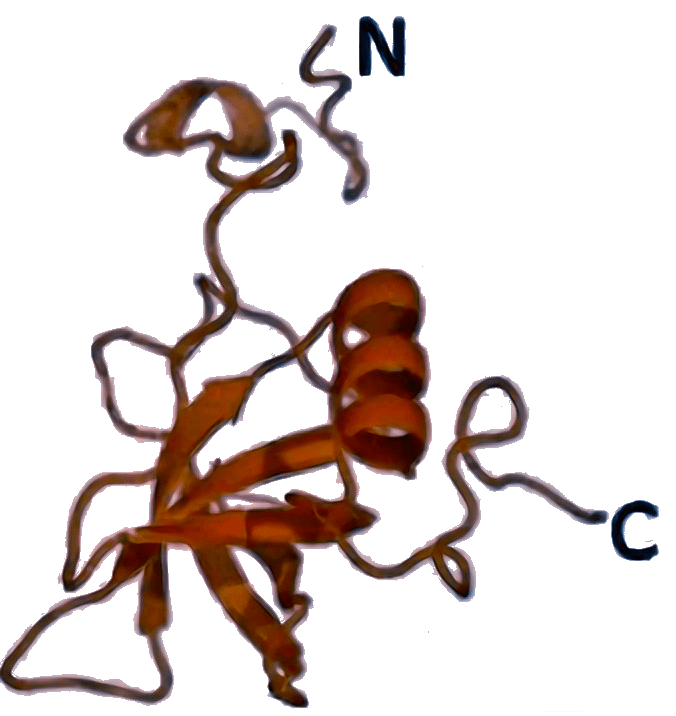
|
Защищает А-сайт рибосомы от преждевременной посадки второй тРНК, участвует в распознавании старт-кодона и в стабилизации связывания других факторов (IF2/eIF5B и др.). |
IF2 [5LMV]
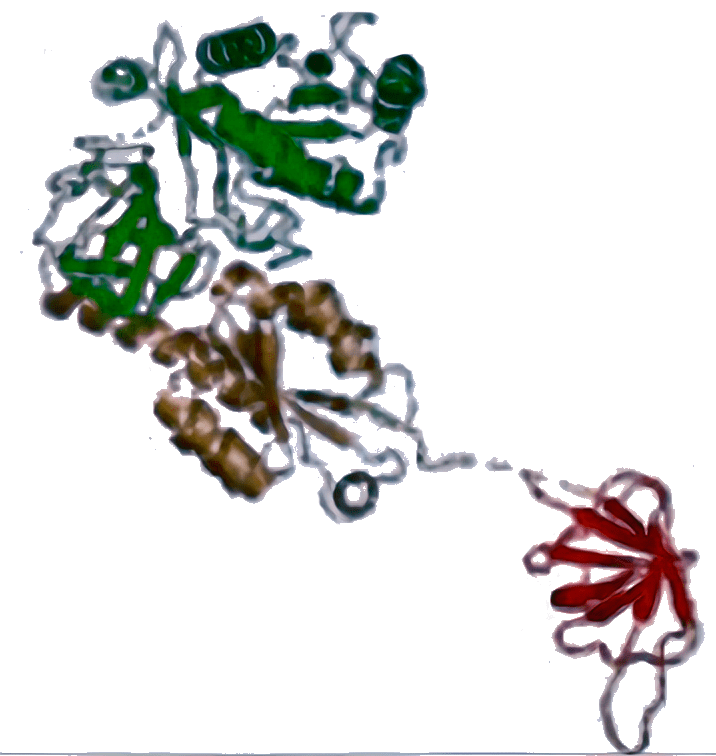
|
aIF5B [1G7T]
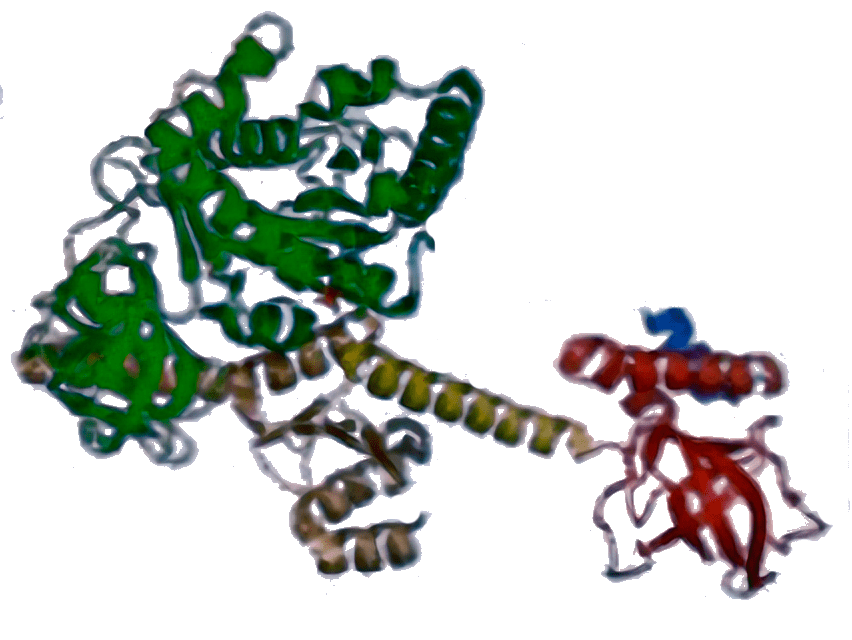
|
eIF5B [4N3N]
|
Стабилизирует связывание Met-тРНКi (у бактерий — fMet-тРНКi) с рибосомой, участвует в присоединении большой субъединицы, контролируя его правильность путем своевременного гидролиза ГТФ. |
| — | — | eIF5 | Является ГТФаза-активирующим белком для фактора eIF2, участвует в узнавании старт-кодона. |
| — | aIF2B (α, ß, δ?)** | aIF2B (α, ß, γ, δ, ε) | Обеспечивает обмен «использованного» ГДФ, связанного с eIF2, на ГТФ. |
| — | — | eIF3 (от 6 до 13 субъединиц у разных эукариот) | Принимает участие в связывании 40S-субъединицы с мРНК и в привлечении других факторов. |
| — | (aIF4A?) | eIF4F (4A, 4G, 4E) | У эукариот состоит из трех субъединиц: eIF4E связывает 5′-кэп (модифицированный гуанозин на 5′-конце мРНК эукариот), РНК-хеликаза eIF4A разворачивает вторичную структуру мРНК, а eIF4G обеспечивает привлечение преинициаторного комплекса и сканирование; играет ли aIF4A архей какую-то роль в инициации трансляции, доподлинно неизвестно. |
| — | — | eIF4B | Помогает РНК-хеликазе eIF4A |
|
* — IF3 бактерий не гомологичен a/eIF1, но очень похож на него по пространственной структуре. ** — Каталитические γ- и ε-субъединицы у архей отсутствуют, поэтому вопрос о наличии целостного aIF2B и даже об участии остальных субъединиц в трансляции неясен: на этот счет в научной литературе до сих пор ведутся споры. |
|||
Ингибиторы факторов элонгации
На данный момент известно большое количество ингибиторов фактора eEF2 (транслоказы), однако некоторые вещества действуют и на eEF1A, доставляющий аминоацил-тРНК. Бóльшая часть и тех, и других препятствует диссоциации факторов с рибосомы после гидролиза ГТФ, что блокирует цикл элонгации. Некоторые их этих ингибиторов (сордарин и его производные) обладают специфичностью к eEF2 грибов, но не связываются с фактором из человеческих клеток, что позволяет использовать их в качестве противогрибковых средств. Среди известных веществ из этой категории нельзя не упомянуть плитидепсин (аплидин), который, согласно работе, недавно опубликованной в журнале Science, показывает хорошие результаты в борьбе с вирусом SARS-CoV-2 [15].
Ингибиторы аминоацил-тРНК-синтетаз
Помимо рибосом и фактор-направленных ингибиторов, специфичное влияние на биосинтез белка могут оказывать вещества, блокирующие вспомогательные компоненты трансляционной машинерии — в первую очередь ингибиторы аминоацил-тРНК-синтетаз (АРСаз). Фундаментальной основой трансляции является генетический код (соответствие между триплетами нуклеотидов и аминокислотами). Осуществляют это соответствие не столько рибосома (хотя в ее функции, разумеется, входит контроль правильного декодирования триплетов — то есть соответствия тРНК кодону в мРНК), сколько АРСазы, навешивающие аминокислотный остаток на нужную тРНК. Из примерно 20 аминоацил-тРНК-синтетаз эукариот (точное их число может варьировать от вида к виду) специфичные ингибиторы известны как минимум для семи.
При ингибировании АРСаз в клетке уменьшается концентрация Аа-тРНК, и темпы трансляции снижаются. От этого сильнее всего страдают клетки с высокой интенсивностью белкового синтеза — к примеру, иммунные и раковые. Поэтому ингибиторы АРСаз имеют важное медицинское значение: они обладают иммуносупрессорным эффектом и применяются при лечении опухолей. Их также используют в качестве фунгицидов и антималярийных препаратов. Большинство ингибиторов этого типа высокоспецифичны по отношению к конкретным АРСазам, однако вещество пурпуромицин препятствует присоединению аминокислотного остатка к любой тРНК. На рисунке 1 ингибиторы АРСаз обозначены e.1.
Самыми известными являются следующие пары «ингибитор—АРСаза»: таваборол и лейцил-тРНК-синтетазы, боррелидин и треонил-тРНК-синтетазы. Таваборол уже прошел клинические испытания и применяется для лечения грибка ногтей, т.к. оказалось, что он способен инактивировать редактирующий активный центр лейцил-тРНК-синтетазы грибов, при этом не ингибируя АРСазу человека. Боррелидин рассматривается в качестве противоракового препарата, потому что он обладает антиангиогенной активностью, что мешает некоторым типам рака «проращивать» сосуды к опухолям для их эффективного питания. К сожалению, применению ингибиторов АРСаз в клинике часто мешает низкая биодоступность, которую пытаются повысить с помощью эффективных методов доставки лекарства.
Ингибиторы сигнальных путей, связанных с регуляцией трансляции
Существует несколько сигнальных путей, которые тонко регулируют трансляцию на разных уровнях. Эти пути образуют сложную сеть и на схеме отображены лишь частично. Ключевые регуляторные каскады, контролирующие эффективность трансляции в клетке, — это пути PI3K/AKT/mTOR и MAPK/ERK/Mnk, а также набор киназ α-субъединицы фактора eIF2. Ингибиторы mTOR представляют особую ценность из-за выраженных комплексных эффектов на организм, у них множество применений в медицине: к примеру, они используются при лечении рака или как иммуносупрессоры при трансплантациях органов. Самый известный пример лекарств последнего типа — это рапамицин (сиролимус), который ингибирует один из двух комплексов киназы mTOR (mTORC1). С этим лекарством, а также с другими ингибиторами mTOR связаны и надежды на замедление темпов старения: показано, что некоторые из этих веществ ощутимо продлевают период здоровой жизни у мышей [16]. На рисунке 1: s.1–s.9.
Подробнее ознакомиться с ингибиторами эукариотической трансляции можно в научном обзоре, опубликованном в спецвыпуске журнала «Биохимия» [1], и на специализированном сайте EuPSIC, одним из создателей которых является автор данной статьи.
Немного о научной группе
Наша лаборатория расположена в отделе взаимодействия вирусов с клеткой НИИ физико-химической биологии имени А.Н. Белозерского МГУ. Основные направления исследований — изучение механизмов биосинтеза белка, молекулярная вирусология и анализ возрастных изменений в живых организмах на молекулярном и клеточном уровне. В отделе работают несколько научных сотрудников, аспирантов и множество студентов, руководитель отдела — к.б.н. Сергей Дмитриев. В исследованиях мы применяем широкий арсенал методов молекулярной биологии, генной инженерии, биохимии, системной биологии и биоинформатики. Со списком публикаций отдела можно ознакомиться на сайте МГУ.
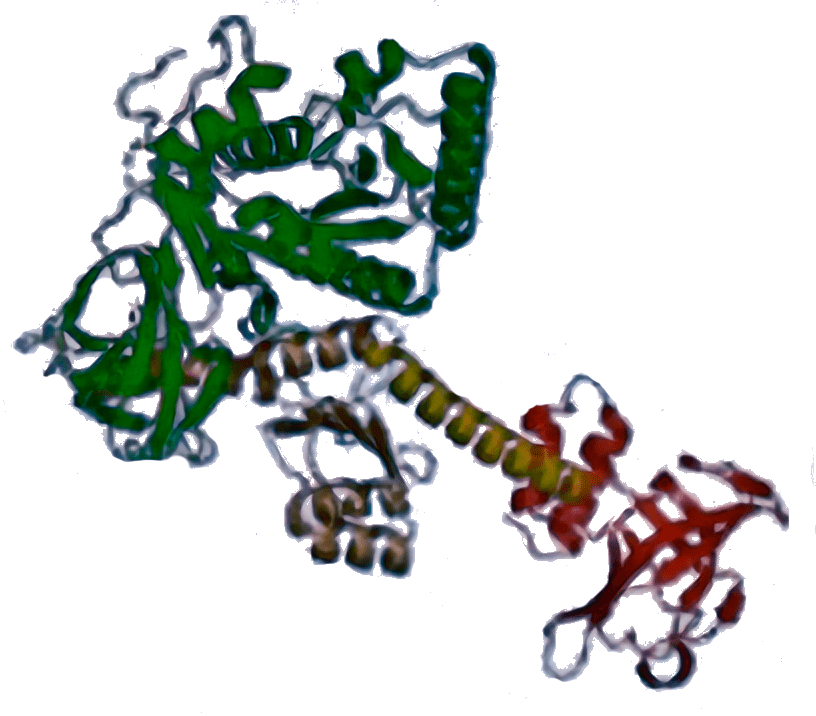
Рисунок 6. Структуры из нашей лаборатории. А пока можете посмотреть на структуры белков, которыми занимается лаборатория и которые были получены нашими партнерами с помощью рентгеноструктурного анализа и криоэлектронной микроскопии. Также вы можете открыть полноэкранную версию апплета.
Литература
- S. E. Dmitriev, D. O. Vladimirov, K. A. Lashkevich. (2020). A Quick Guide to Small-Molecule Inhibitors of Eukaryotic Protein Synthesis. Biochemistry Moscow. 85, 1389-1421;
- Карл Вёзе (1928–2012);
- В диких условиях: как жил последний всеобщий предок LUCA;
- Tiina Tamm, Ivan Kisly, Jaanus Remme. (2019). Functional Interactions of Ribosomal Intersubunit Bridges in Saccharomyces cerevisiae. Genetics. 213, 1329-1339;
- Jinzhong Lin, Dejian Zhou, Thomas A. Steitz, Yury S. Polikanov, Matthieu G. Gagnon. (2018). Ribosome-Targeting Antibiotics: Modes of Action, Mechanisms of Resistance, and Implications for Drug Design. Annu. Rev. Biochem.. 87, 451-478;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Под «генную гармошку»;
- Ivan I. Sorokin, Konstantin S. Vassilenko, Ilya M. Terenin, Natalia O. Kalinina, Vadim I. Agol, Sergey E. Dmitriev. (2021). Non-Canonical Translation Initiation Mechanisms Employed by Eukaryotic Viral mRNAs. Biochemistry Moscow. 86, 1060-1094;
- Noam Stern-Ginossar, Sunnie R. Thompson, Michael B. Mathews, Ian Mohr. (2019). Translational Control in Virus-Infected Cells. Cold Spring Harb Perspect Biol. 11, a033001;
- Michel Cassan, Jean-Pierre Rousset. (2001). . BMC Mol Biol. 2, 3;
- MARINA MANUVAKHOVA, KIM KEELING, DAVID M. BEDWELL. (2000). Aminoglycoside antibiotics mediate context-dependent suppression of termination codons in a mammalian translation system. RNA. 6, 1044-1055;
- Gaspar Taroncher-Oldenburg, Christin Müller, Wiebke Obermann, John Ziebuhr, Roland K. Hartmann, Arnold Grünweller. (2021). Targeting the DEAD-Box RNA Helicase eIF4A with Rocaglates—A Pan-Antiviral Strategy for Minimizing the Impact of Future RNA Virus Pandemics. Microorganisms. 9, 540;
- Christina Skofler, Florian Kleinegger, Stefanie Krassnig, Anna Maria Birkl-Toeglhofer, Georg Singer, et. al.. (2021). Eukaryotic Translation Initiation Factor 4AI: A Potential Novel Target in Neuroblastoma. Cells. 10, 301;
- Emmanuelle Schmitt, Pierre-Damien Coureux, Ramy Kazan, Gabrielle Bourgeois, Christine Lazennec-Schurdevin, Yves Mechulam. (2020). Recent Advances in Archaeal Translation Initiation. Front. Microbiol.. 11;
- Kris M. White, Romel Rosales, Soner Yildiz, Thomas Kehrer, Lisa Miorin, et. al.. (2021). Plitidepsin has potent preclinical efficacy against SARS-CoV-2 by targeting the host protein eEF1A. Science. 371, 926-931;
- Aleksandra S. Anisimova, Alexander I. Alexandrov, Nadezhda E. Makarova, Vadim N. Gladyshev, Sergey E. Dmitriev. (2018). Protein synthesis and quality control in aging. Aging. 10, 4269-4288;
- Adam Ben-Shem, Nicolas Garreau de Loubresse, Sergey Melnikov, Lasse Jenner, Gulnara Yusupova, Marat Yusupov. (2011). The Structure of the Eukaryotic Ribosome at 3.0 Å Resolution. Science. 334, 1524-1529.