
мРНК-вакцина на страже коллективного иммунитета: за что вручили Нобелевскую премию в 2023 году
03 октября 2023
мРНК-вакцина на страже коллективного иммунитета: за что вручили Нобелевскую премию в 2023 году
- 1975
- 0
- 2
Нобелевские лауреаты этого года: Каталин Карико и Дрю Вайсман.
Рисунок в полном размере.
иллюстрация Анастасии Самоукиной
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
В 2023 году лауреатами Нобелевской премии по физиологии и медицине стали Каталин Карико и Дрю Вайсман. Эти исследователи десятилетиями изучали перспективы использования вакцин на основе мРНК и изобрели способ модификации РНК, благодаря которому создание таких вакцин стало возможно. Их работы легли в основу самых современных прививок против «прославившегося» COVID-19 — знаменитых Comirnaty от Pfizer/BioNTech и Moderna. (В скобках отметим, что, хотя последняя пандемия и принесла нам целый букет действенных вакцин — тот же «Спутник V», — но именно мРНК-вакцины по праву считаются самыми инновационными.)
Конец 2019 года, без сомнения, запомнился всем появлением нового вирусного заболевания, которое в мгновение ока распространилось по всему миру. COVID-19 — потенциально тяжелая острая респираторная инфекция, вызываемая коронавирусом SARS-CoV-2, — оказала огромное влияние на экономику, культуру и историю всего человечества [1]. Как только стал понятен истинный масштаб пандемии, началась разработка многочисленных вакцин, которые могли бы остановить волну заболеваний. Можно сказать без преувеличения, что над этой проблемой трудились лучшие умы человечества, задействуя огромные ресурсы. В результате несколько вакцин были одобрены в рекордно короткие сроки, причем две из самых быстро прошедших проверку и наиболее эффективных вакцин — Pfizer/BioNTech и Moderna — были произведены с использованием новой технологии — мРНК, упакованной в липосомы. Разработка этих вакцин, да и вообще любых вакцин на основе мРНК, была бы невозможна без Каталин Карико и Дрю Вайсмана.
Цельновирусные и субъединичные вакцины
Чтобы рассказать всю историю целиком и не запутаться, стоит обратиться к азам — базовые принципы работы всех прививок мы излагали в статье «История вакцинации» [4]. Если коротко, то нужно взять вирус, против которого необходимо выработать иммунитет; ослабить его или вовсе инактивировать (чтобы пациент не заразился); и затем ввести препарат в организм. По сути, иммунная система получает вирусную частицу целиком (но в незаразной форме), и это индуцирует иммунный ответ. Когда же (впоследствии) в организм попадает настоящий (болезнетворный) вирус, к нему уже есть антитела. Вакцинация в ходу уже довольно давно — например, еще в 1951 году за разработку вакцины против вируса желтой лихорадки Макс Тейлер был удостоен Нобелевской премии по физиологии и медицине.
Драматичная история борьбы с желтой лихорадкой описана в материале «Мир до и после изобретения вакцин» [5]. А подробнее про разработку вакцин и вакцинацию в целом читайте в материалах «Разработка вакцин: чем и как имитировать болезнь?» [6] и «Вакцинация для взрослых: как и зачем?» [7].
Другой подход более сложен — вместо введения целой вирусной частицы в организм доставляются отдельные белки оболочки вируса, и иммунная система приучается на них реагировать (рис. 1). Такие вакцины называются субъединичными — из-за того, что они содержат только отдельные вирусные антигены: субъединицы поверхностных белков. Это позволяет уменьшить в вакцине содержание белка и, следовательно, снизить ее аллергенность. Кроме того, в то время как инактивированный вирус в теории имеет шанс вновь «ожить» и заразить владельца, с субъединичной вакциной такое в принципе невозможно. Субъединичные вакцины широко применяются в наши дни: например, для вакцинации от папилломавируса [8] или гриппа [9], [10].
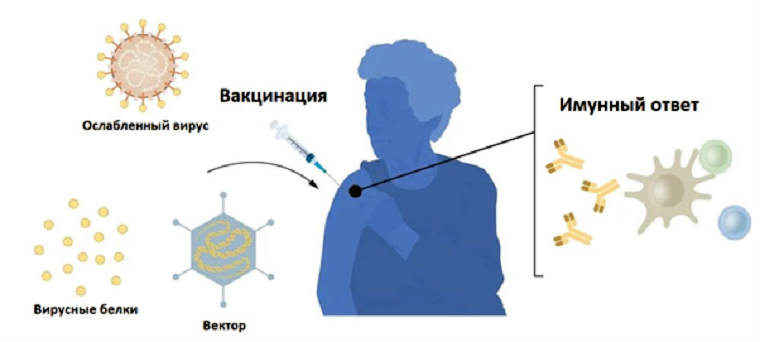
Рисунок 1. Два основных принципа работы противовирусных вакцин. В основе первого принципа лежит индукция иммунного ответа с помощью ослабленного вируса (или его отдельных белков), в основе второго — использование вектора (модифицированного вируса-доставщика) с нужными белками, к которым организм должен выработать антитела.
У этих вакцин есть недостаток — они требуют солидной производственной мощности, так как нужный для получения частиц или отдельных белков вирус можно размножить только на клеточных культурах. Получение субъединичных и вирусных векторных вакцин также требует работы с клеточными культурами. К тому же, работа с клеточными культурами в целом требует высокой квалификации и стерильности, что делает процесс производства вакцин таким сложным.
На сцене появляется мРНК
Однако есть и другой способ — зачем выращивать клетки для получения белка, если наш организм может синтезировать его самостоятельно? В вакцину можно поместить не сам вирусный белок, а мРНК — последовательность, его кодирующую. Буква «м» означает матричную РНК — это молекула РНК, которая содержит информацию об аминокислотной последовательности, нужной для синтеза определенного белка. Клетка организма, в которую попадет мРНК, ее прочтет и сможет синтезировать с нее нужный белок; затем он попадет в кровь, и иммунные клетки начнут вырабатывать против него антитела.
Звучит отлично, к тому же вакцины на основе нуклеиновых кислот не будут требовать таких производственных мощностей. Они кажутся более простыми и гибкими в производстве, ведь последовательность РНК можно будет изменить, если вирус, к примеру, мутирует. Первые попытки создания таких вакцин начались еще в 1990 году [11], но исследователи сразу же столкнулись с проблемой.
Дело в том, что наша иммунная система — это не единственная противовирусная защита нашего организма. Внутри каждой клетки есть белки, повреждающие чужеродную РНК, и разумеется, попадание молекулы мРНК внутрь цитоплазмы сразу вызывало бы цитокиновый ответ — острую реакцию иммунной системы на раздражитель. К тому же, процесс синтеза белка нужно оптимизировать — в цитоплазме любой клетки много различных молекул мРНК, и заставить клетку синтезировать много белка с нескольких попавших внутрь молекул мРНК непросто. А в ином случае эффект вакцины просто будет незаметен.
И здесь мы переходим к Каталин Карико — венгерской ученой, которая экспериментировала с различными формами РНК, стремясь оптимизировать экспрессию терапевтических белков. В 1997 году она основала свою собственную группу на кафедре нейрохирургии Пенсильванского университета. У нее было сильное стремление продвигать платформу мРНК, и она исследовала различные компоненты транскрибируемой in vitro мРНК, чтобы определить требования для оптимальной экспрессии белка в клетках и тканях млекопитающих [13].
В конце 1990-х годов Карико объединилась с Дрю Вайсманом — ученым-врачом, интересующимся фундаментальной иммунологией и разработкой вакцин. Он поступил на работу в Пенсильванский университет в 1997 году и занимался изучением того, как вирусы взаимодействуют с рецепторами-мишенями на различных типах клеток иммунной системы. Карико и Вайсман объединились, и результатом их работы стала прорывная публикация в 2005 году [14]. Они заметили, что дендритные клетки (клетки иммунитета, специализирующиеся на презентации антигенов) распознают транскрибируемую in vitro мРНК как чужеродное вещество, что приводит к их активации и высвобождению сигнальных молекул воспаления. Однако мРНК из цитоплазмы других клеток не вызвала такой же реакции. Были протестированы различные модификации мРНК, и оказалось, что Toll-like рецепторы (TLR) , находящиеся на поверхности и на внутренних мембранах клеток, попросту не связываются с мРНК, если она предварительно была модифицирована, что позволяет организму отличать «свою» РНК от «чужой» — например, вирусной. В исследовании было описано прямое влияние модификаций оснований мРНК на цитокиновый ответ, и стало ясно, что эукариотические мРНК, в которых в изобилии присутствуют такие модификации, его не стимулируют.
Разумеется, открытие такого масштаба, как врожденный иммунитет на базе Toll-подобных рецепторов, тоже не могло остаться незамеченным: «Иммунологическая Нобелевская премия (2011)» [15].
Стоит упомянуть, что в прокариотических организмах — бактериях и археях — РНК подвергается значительно меньшему числу модификаций [16]. У эукариот на данный момент описано более сотни модификаций РНК, и они имеют важное значение для регуляции внутренних процессов клетки.
Получается, чтобы избежать острой реакции иммунной системы, вводимую мРНК нужно модифицировать, то есть изменить структуру оснований, из которых состоит эта молекула. Карико и Вайсман продемонстрировали, что мРНК, в которой уридин (одно из четырех оснований, из которых состоят все молекулы РНК) был заменен на псевдоуридин, транслируется эффективней, что приводит к высокой продукции белка в клетках. К тому же клетки нормально реагируют на такую мРНК и синтезируют с нее закодированный белок (рис. 2) [17].
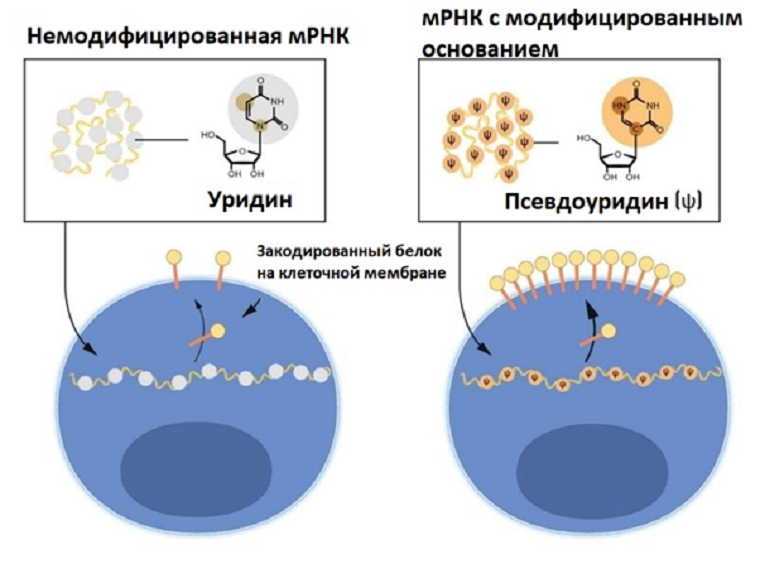
Рисунок 2. Наглядная разница в структуре уридина и псевдоуридина, а также в количестве синтезируемого в клетке белка с молекулы мРНК.
После этого открытия несколько компаний вплотную занялись исследованиями вакцин на основе модифицированной мРНК. Именно благодаря заранее проведенным исследованиям, к примеру, начавшейся разработке вакцины от вируса Зика [18], компании BioNTech и Moderna быстро приступили к разработке вакцины против COVID-19, а крупномасштабные инвестиции сократили время клинических испытаний, что позволило выпустить вакцину в рекордные сроки. В этих вакцинах уридин в мРНК был заменен уже на N1-метилпсевдоуридин (M1ψ), чтобы ускорить трансляцию белка и избежать побочных воспалительных реакций. Еще одна вакцина — CureVac немецкого производства — тоже содержала мРНК, однако она была немодифицированной, а потому малоэффективной [19].
Стоит отметить исключительное упорство Карико. Ее первая заявка на грант для исследования мРНК не была одобрена, что привело к понижению ее в должности университетом в 1995 году. Однако она продолжила исследования в этом направлении и в итоге заняла должность вице-президента BioNTech RNA Pharmaceuticals (а впоследствии стала старшим вице-президентом в 2019 году). Сейчас она продолжает исследования в области генной терапии на основе матричной РНК.
Пандемия, безусловно, подстегнула разработку мРНК-вакцин, однако все это было бы невозможно без заранее проведенных исследований [21] и труда многих ученых из разных стран. Давайте помнить, что одно из решающих открытий было совершено в 2005 году, когда и был заложен фундамент для дальнейших успехов.
На основе пресс-релиза Нобелевского комитета.
Литература
- 2019-nCoV: очередной коронованный убийца?;
- «Спутник V» и не только: сказ об аденовирусных вакцинах;
- Результаты 1/2 фаз испытания российской вакцины от COVID-19: разбираем статью в The Lancet;
- История вакцинации;
- Мир до и после изобретения вакцин;
- Разработка вакцин: чем и как имитировать болезнь?;
- Вакцинация для взрослых. Как и зачем;
- Margaret Stanley. (2017). Tumour virus vaccines: hepatitis B virus and human papillomavirus. Phil. Trans. R. Soc. B. 372, 20160268;
- Неуловимый грипп;
- Много — не значит хорошо: «Ультрикс», «Гриппол», «Совигрипп» — что выбрать?;
- Simon J. Draper, Jonathan L. Heeney. (2010). Viruses as vaccine vectors for infectious diseases and cancer. Nat Rev Microbiol. 8, 62-73;
- Что такое ДНК-вакцины и с чем их едят?;
- K Karikó, A Kuo, E S Barnathan. (1999). Overexpression of urokinase receptor in mammalian cells following administration of the in vitro transcribed encoding mRNA. Gene Ther. 6, 1092-1100;
- Katalin Karikó, Michael Buckstein, Houping Ni, Drew Weissman. (2005). Suppression of RNA Recognition by Toll-like Receptors: The Impact of Nucleoside Modification and the Evolutionary Origin of RNA. Immunity. 23, 165-175;
- Иммунологическая Нобелевская премия (2011);
- Patrick A. Limbach, Pamela F. Crain, James A. McCloskey. (1994). Summary: the modified nucleosides of RNA. Nucl Acids Res. 22, 2183-2196;
- Katalin Karikó, Hiromi Muramatsu, Frank A Welsh, János Ludwig, Hiroki Kato, et. al.. (2008). Incorporation of Pseudouridine Into mRNA Yields Superior Nonimmunogenic Vector With Increased Translational Capacity and Biological Stability. Molecular Therapy. 16, 1833-1840;
- Norbert Pardi, Michael J. Hogan, Rebecca S. Pelc, Hiromi Muramatsu, Hanne Andersen, et. al.. (2017). Zika virus protection by a single low-dose nucleoside-modified mRNA vaccination. Nature. 543, 248-251;
- Pedro Morais, Hironori Adachi, Yi-Tao Yu. (2021). The Critical Contribution of Pseudouridine to mRNA COVID-19 Vaccines. Front. Cell Dev. Biol.. 9;
- «Спутник V», «ЭпиВакКорону», «Модерну» делать будем? Ликбез по вакцинам против коронавируса;
- Ugur Sahin, Katalin Karikó, Özlem Türeci. (2014). mRNA-based therapeutics — developing a new class of drugs. Nat Rev Drug Discov. 13, 759-780;
- Elie Dolgin. (2021). The tangled history of mRNA vaccines. Nature. 597, 318-324;
- Oliver J Watson, Gregory Barnsley, Jaspreet Toor, Alexandra B Hogan, Peter Winskill, Azra C Ghani. (2022). Global impact of the first year of COVID-19 vaccination: a mathematical modelling study. The Lancet Infectious Diseases. 22, 1293-1302;
- Kuan Peng, Xue Li, Deliang Yang, Shirley C.W. Chan, Jiayi Zhou, et. al.. (2023). Risk of autoimmune diseases following COVID-19 and the potential protective effect from vaccination: a population-based cohort study. eClinicalMedicine. 63, 102154.





