
SciNat за октябрь 2025 #4: вакцины и рак, растения-паразиты и теломеразные тайны нематоды
26 октября 2025
SciNat за октябрь 2025 #4: вакцины и рак, растения-паразиты и теломеразные тайны нематоды
- 153
- 0
- 0
Поделись хорошим настроением. На обложке свежего выпуска журнала Science изображены два индивидуально помеченных шмеля, используемых в эксперименте по так называемому «аффективному заражению». Аффективное заражение — это когда эмоции передаются от одного существа к другому, и оно считается важной частью эмпатии. До сих пор его изучали только у социальных позвоночных (например, млекопитающих и птиц), а о его наличии у беспозвоночных было неизвестно. Поэтому ученые провели эксперимент со шмелями, используя метод, который показывал, как эмоции влияют на решения. Сначала шмелей натренировали на незнакомых цветках с разным вознаграждением (сладким соком). Затем исследователи заметили, что шмели, которые общались с сородичами, получившими позитивный стимул, быстрее и охотнее садились на те же цветы незнакомого цвета — это значило, что они «подхватили» позитивное отношение других шмелей к этим цветам. Дополнительные опыты показали, что эмоции могут передаваться даже без прямого контакта, просто через зрительное наблюдение. Выводы исследования говорят о том, что такое заражение эмоциями — это древний механизм, который есть не только у позвоночных, но и у социальных насекомых. — Positive affective contagion in bumble bees.
-
Автор
-
Редактор
Из нового выпуска дайджеста SciNat вы узнаете о роли антибиотиков в Африке и почему растения-паразиты не нападают на своих родственников. Еще вас ждут новости о том, что вакцины от COVID-19 мобилизуют иммунитет против рака, а новые эксперименты с нематодами раскрывают секреты работы теломеразы. Также читайте о том, как сезонная диета влияет на ваши циркадные ритмы и какие новые инструменты для интерактомики белков создали биоинформатики.
Эпидемиология
Профилактическое применение азитромицина спасает жизни уязвимых детей, но может спровоцировать развитие устойчивости к антибиотикам
В бедных и отдаленных регионах мира каждый десятый ребенок умирает в возрасте младше 5 лет из-за инфекций, плохого питания, малярии и отсутствия своевременной медицинской помощи. Исследования показывают, что регулярный прием антибиотика азитромицина (два раза в год) может снизить смертность примерно на 15–50%, особенно среди младенцев, защищая от множественных инфекций и спасая десятки тысяч жизней ежегодно. Этот дешевый и безопасный препарат уже применялся для борьбы с трахомой — глазной инфекцией, приводящей к слепоте, — и помог искоренить болезнь в многих странах.
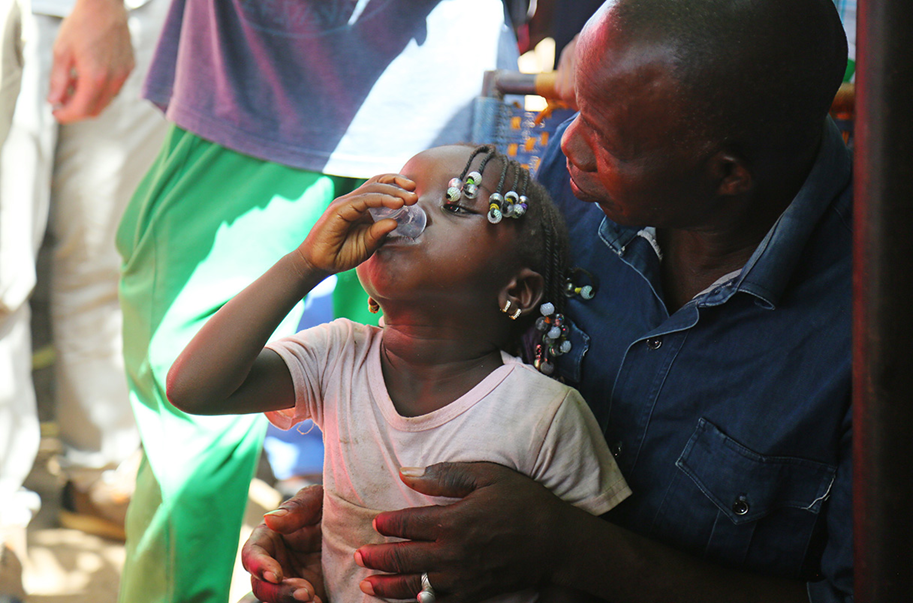
Ребенок в Джолибе, Мали, получает дозу азитромицина в июне в рамках программы массового введения лекарств, которая ориентирована на детей по всей стране в возрасте до 5 лет.
В 2020 году Всемирная организация здравоохранения (ВОЗ) одобрила массовое назначение лекарств (MDA) с азитромицином, но только для детей 1–11 месяцев в регионах с высокой смертностью, чтобы минимизировать риск развития устойчивости к антибиотикам. Однако недавнее крупное исследование в Мали (NEJM, 2024), охватившее почти 150 тыс. младенцев, показало, что такой ограниченный подход неэффективен: ежеквартальные или двухразовые дозы не снизили смертность по сравнению с плацебо. Это подтверждает другие данные из Нигера и противоречит предыдущему исследованию MORDOR, где польза была заметна для детей до 5 лет.
Массовое применение антибиотиков вызывает споры: с одной стороны, оно спасает жизни уязвимых детей, с другой — рискует создать устойчивость к препаратам, которая ударит по тем же сообществам в будущем. Эксперты из университетов Ибадана и Бостона подчеркивают моральную дилемму: трудно сказать, что хуже — текущая смертность или долгосрочный кризис устойчивости. «Дом горит, дети умирают — почему медлим?» — спрашивают одни; другие боятся «бомбы замедленного действия».
Несмотря на опасения, Нигерия, Мали, Нигер и Буркина-Фасо продвигают национальные MDA-программы, охватывающие почти 17 млн детей, поддерживаемые консорциумом REACH (финансируется фондом Гейтса). ВОЗ планирует пересмотреть рекомендации в 2025 году, чтобы сбалансировать доступ к антибиотикам и сохранение их эффективности. — ‘I fear we are sitting on a time bomb.’ Scientists debate mass distribution of antibiotics in Africa.
Неожиданный бонус от вакцин против COVID-19: усиление эффективности лечения рака
Исследования показали, что мРНК-вакцины от COVID-19 могут значительно улучшить результаты лечения рака, особенно в комбинации с иммунотерапией. На Конгрессе Европейского общества медицинской онкологии в Берлине исследователи из Онкологического центра имени М. Д. Андерсона представили данные, согласно которым пациенты с запущенным раком кожи и легких, вакцинированные мРНК до или в течение 100 дней после начала приема ингибиторов контрольных точек, жили дольше. У больных раком легких медиана выживаемости удвоилась — с 20,6 до 37,3 месяцев.
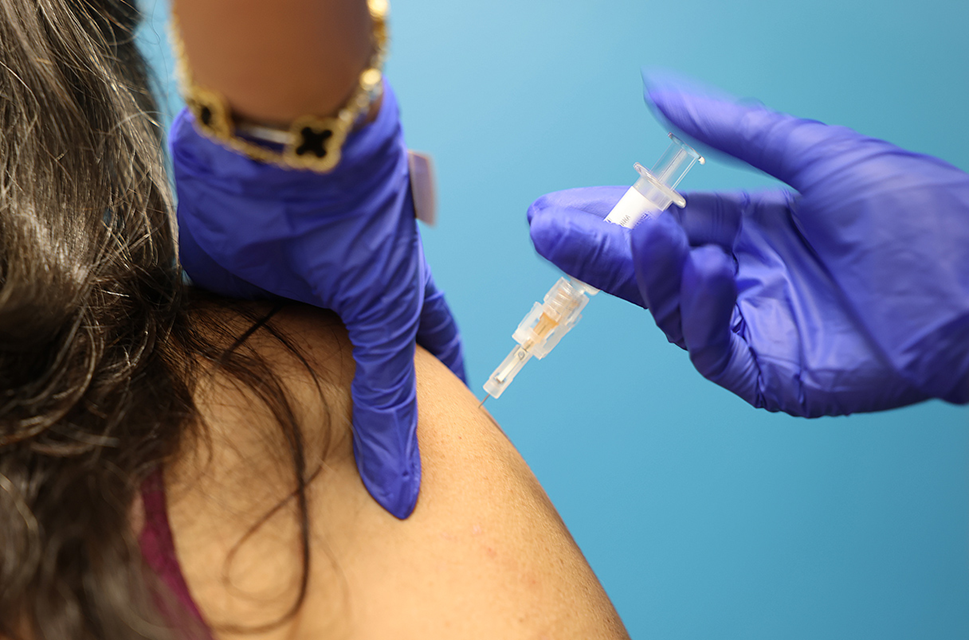
Вакцинация против COVID-19 с использованием матричной РНК, по-видимому, повышает эффективность одного из видов иммунотерапии рака.
Результаты подтверждаются ретроспективным анализом более 1000 историй болезни и экспериментами на мышах, где мРНК-вакцина усиливала противоопухолевый эффект иммунотерапевтических препаратов. Эксперты, такие как Райан Салливан и Марк Слифка, отметили сильную связь между вакцинацией и повышением выживаемости, хотя требуются проспективные исследования для подтверждения. Группа планирует клиническое испытание для дальнейшей проверки.
Механизм действия связан с активацией иммунной системы: мРНК запускает высвобождение цитокинов, включая интерферон типа 1, который мобилизует иммунные клетки против опухолей. Это позволяет ингибиторам контрольных точек блокировать защитные механизмы рака, усиливая атаку на опухоли. Исследования предполагают, что эффект не зависит от конкретного белка, кодируемого мРНК, что открывает путь к универсальным вакцинам.
Эти открытия подчеркивают неиспользованный потенциал мРНК-технологии для лечения рака, генетических заболеваний и инфекций. Однако политические барьеры, включая сокращение финансирования в США под руководством Дональда Трампа и планы запретов вакцин, создают риски. Исследователи надеются на поддержку от других источников, видя в этом начале новых возможностей. — A surprise bonus from COVID-19 vaccines: bolstering cancer treatment, «Биомолекула»: SARS-CoV-2.
Ботаника
Почему растения-паразиты не нападают на своих родственников?
Паразитические растения живут за счет других растений, и среди самых разрушительных из них — ведьмины сорняки (Striga hermonthica), которые уничтожают основные зерновые культуры Африки и угрожают существованию миллионов людей. Хотя многие паразитические растения могут заражать широкий спектр хозяев, случаи нападения одного паразита на другой крайне редки, что позволяет предположить, что они могут распознавать своих сородичей. Заражение зависит от гаустория, трубчатой структуры, которая образуется, когда паразиты обнаруживают химические сигналы, полученные от хозяина, известные как факторы, индуцирующие гаусторий. Гаусторий простирается от верхушки проростка паразитического растения и проникает в корень хозяина, обеспечивая доступ к воде и питательным каналам. В новом выпуске журнала Science ученые сообщают, что паразитические растения избегают паразитизма со стороны родственных видов, инактивируя собственные сигналы гаустория посредством процесса маркировки глюкозой, глюкозилирования. Это открытие дает нам новые возможности для селекции сельскохозяйственных культур, которые будут испускать аналогичные неактивные сигналы для защиты от паразитических растений. — The paradox of kin avoidance in parasitic plants, «Биомолекула»: «Фитонематоды — кукловоды молекулярного уровня».

Стрига (Striga hermonthica) — облигатный корневой паразитический сорняк, представляющий серезную угрозу глобальной продовольственной безопасности и производству проса в странах Африки к югу от Сахары.
Палеонтология
Разнообразие динозавров до падения астероида

Динозавры во время падения метеорита. Иллюстрация Натальи Ягельской.
Находки поздних динозавров из Новой Мексики проливают свет на разнообразие верхнего мелового периода. Массовое вымирание нептичьих динозавров 66 миллионов лет назад часто связывают с падением астероида, но продолжаются споры о том, были ли экосистемы динозавров ослаблены до катастрофы. Новые раскопки в Нью-Мексико дарят нам новый взгляд на последние дни динозавров, увеличивая число известных видов, существовавших за 400 тысяч лет до катастрофы.
Используя радиоизотопное датирование и магнитостратиграфию, авторы нового исследования журнала Science показывают, что вымершие виды из Нью-Мексико были современниками фауны формации Хелл-Крик (Северная Америка). Это указывает на разделение динозавров на экологически различные северные и южные биомы в последние 10 миллионов лет мелового периода, опровергая идею о предшествующем упадке.
Несмотря на рост оценок разнообразия в маастрихте, оно всё еще ниже пика кампанского века и выше, чем в большинстве других позднемеловых эпох. Предполагается, что экосистемы могли восстановиться после предыдущих изменений, но окончательный анализ требует глобальных и непрерывных данных о биоразнообразии.
Для понимания роли сокращения биоразнообразия в вымирании необходимы качественные метаданные и новые открытия. Точные датировки и контекст помогают устранить пробелы в палеонтологической летописи, что может изменить гипотезы о хрупкости экосистем динозавров до катастрофы. — Dinosaur diversity before the asteroid, «Биомолекула»: «Золотой век палеонтологии».
Интерактомика
Прогнозирование белок-белковых взаимодействий в протеоме человека
Белки — это настоящие «рабочие лошадки» в наших клетках. Они не действуют в одиночку, а образуют огромные сети взаимодействий, которые управляют всем: от дыхания и пищеварения до иммунного ответа и умственной активности. Эти белок-белковые взаимодействия (ББВ, или PPI — protein-protein interactions) — ключ к пониманию жизни, но составить полную карту всех таких связей в человеческом организме (интерактом) — настоящий вызов. Ученые успешно справились с этим для простых организмов, вроде дрожжей или бактерий, используя коэволюционный анализ (когда белки из разных видов сравниваются, чтобы найти эволюционные связи) и нейросети глубокого обучения (Deep Learning). Но для человека всё сложнее.
Почему так? Во-первых, многие человеческие белки уникальны для высших эукариот (организмов с ядром, как животные и растения), и их эволюционная история относительно короткая. Это значит, что «сигналы» коэволюции между взаимодействующими белками слабы — как если бы пытаться найти общие черты у двух людей, чьи семьи разошлись всего пару поколений назад. Во-вторых, человеческий интерактом невероятно сложен: много слабых и кратковременных взаимодействий, которые трудно уловить существующими инструментами DL. Они часто «шумят» или теряются в данных.
Чтобы преодолеть это, исследователи решили не просто использовать стандартные данные, а собрать гигантские наборы. Во-первых, они набрали белковые последовательности из неаннотированных черновиков эукариотических геномов (это как черновики генетических карт) и даже неассемблированных геномных прочтений (фрагментов ДНК, которые еще не собраны в полную картину). Это позволило создать «омиические MSA» — множественные выравнивания последовательностей, которые в семь раз глубже, чем те, что строятся на общедоступных данных эукариотических белков. Представьте: если раньше у вас было 100 образцов для сравнения, то теперь — 700!
Во-вторых, они сосредоточились на доменах — эволюционных и структурных «кирпичиках» белков. Из 200 миллионов предсказанных белковых структур (полученных с помощью ИИ) они извлекли данные о междоменных взаимодействиях. Это расширило обучающую выборку для предсказания PPI в 16 раз. На основе этих огромных данных разработали новую нейросеть: RoseTTAFold2-PPI (RF2-PPI). Она оптимизирована для высокой точности и скорости, работает лучше, чем конкуренты вроде ColabFold или AlphaFold3, и требует куда меньше вычислительных ресурсов.
Результаты впечатляют. Ученые создали масштабируемый конвейер: комбинацию коэволюционного анализа и DL для проверки 190 миллионов возможных пар человеческих белков. В итоге предсказано более 29 тысяч PPI с точностью около 80% и полнотой от 10 до 30% (то есть сеть находит 10–30% всех реальных взаимодействий, но с высокой уверенностью). Для дальнейшего анализа взяли подмножество почти 18 тысяч высоко достоверных связей, из которых около 3600 — совершенно новые, ранее не описанные.
Что это дает? Предсказанные взаимодействия особенно богаты связями с трансмембранными белками. Это показывает силу метода в сложных биологических контекстах. Например, сеть предсказала взаимодействия G-белковых рецепторов (важных для передачи сигналов в клетке) с их «нижестоящими» эффекторами (исполнителями команд), «вышестоящими» лигандами (молекулами, запускающими процесс) или модуляторами (регуляторами). Это помогает понять, как работают гормоны, нейротрансмиттеры и даже лекарства.
Связь с болезнями тоже очевидна. Сопоставив прогнозы с ассоциированными с заболеваниями мутациями (одноаминокислотными вариантами), нашли 4950 PPI, где мутации локализованы прямо в интерфейсе взаимодействия. Это подсказывает молекулярные механизмы генетических нарушений — например, почему мутация в белке вызывает рак или неврологические болезни.
Наконец, бинарные прогнозы (пары взаимодействующих белков) позволили реконструировать более сложные белковые комплексы. Например:
- Тубулиновый полиглутамилазный комплекс (связан с микротрубочками, которые как «рельсы» в клетке, важны для деления клеток и транспорта).
- Несколько комплексов, участвующих в биогенезе ресничек (крошечных «антенн» на клетках, помогающих в движении и сенсорных функциях).
- Новые компоненты для комплекса поддержания теломер (защитных «колпачков» на концах хромосом, предотвращающих старение ДНК).
- Комлекса GPI-GnT, который катализирует первый этап биосинтеза GPI-якоря (системы, прикрепляющей белки к мембранам).
сотни тысяч взаимодействий среди 200 миллионов возможных пар человеческих белков. Уверенное предсказание 10–30% из них — огромный шаг к долгосрочной цели: полной вычислительной карте человеческого протеома. Это откроет новые горизонты в биологии, медицине и даже разработке лекарств, помогая лечить болезни, связанные с нарушенными взаимодействиями белков. Кто знает, может, скоро мы сможем «починить» сломанные сети взаимодействия в клетках. — Predicting protein-protein interactions in the human proteome, «Биомолекула»: «12 методов в картинках: протеомика», «Искусственный интеллект в биологии».
Молекулярная биология
Теломеразная РНК нематоды перемещается по интронам генов, экспрессия которых повышается в зародышевой линии
Укорачивание теломер (специальных защитных «колпачков» на концах хромосом) запускает процесс клеточного старения: клетки перестают делиться, стареют и умирают. Но есть фермент теломераза, который способен удлинять эти колпачки, предотвращая укорочение. Теломераза состоит из белковой части (каталитической субъединицы) и РНК-матрицы, и она особенно активна в раковых клетках (где помогает им бесконтрольно размножаться) и стволовых клетках (для поддержания роста тканей). В зародышевых клетках (тех, что дают начало новому поколению) теломераза тоже работает на полную, чтобы передать потомству длинные теломеры и обеспечить выживание вида. Но как именно она активируется в разных тканях и передается через поколения — загадка для ученых.
Исследователи выбрали крошечную нематоду Caenorhabditis elegans (червяка, живущего всего три дня) как модельный организм. Ее короткий жизненный цикл позволяет быстро изучать изменения через поколения. Хотя теломеразная РНК — ключевой компонент теломеразы — была найдена у многих организмов, у нематод ее долго не обнаруживали. Вероятно, потому, что она пряталась в необычном месте генома, не в стандартных генах, а в «скрытых» областях.

Иллюстрация модельного организма нематоды Caenorhabditis elegans.
Чтобы найти эту таинственную РНК, исследователи создали специальный штамм червей, где каталитическая субъединица теломеразы (TRT-1) была помечена «флажком» (FLAG-меткой). Затем они очистили РНК, связанную с этой меткой, используя продвинутый метод eCLIP. Таким образом они нашли длинную некодирующую РНК (днРНК) под названием terc-1, спрятанную во втором интроне (вставке внутри гена) другого гена — nmy-2, который кодирует немышечный миозин II и работает только в зародышевой линии.
Мутации в terc-1 приводили к постепенному укорочению теломер и бесплодию через поколения — доказательство, что эта РНК действительно функциональная часть теломеразы. Более того, похожие «сестры» terc-1 нашли в интронах nmy-2 у родственников червя — C. briggsae и C. japonica, что говорит о древнем эволюционном происхождении. Несмотря на различия в последовательностях, структура РНК оказалась консервативной: с доменом CR4/5, H/ACA-боксом и уникальным «стеблем» для нематод, но без стандартной псевдоузловой структуры.
Дополнительные эксперименты показали, что terc-1 связывается с комплексом дискерина (нужным для создания других РНК) и зависит от него и кофактора TCAB-1. Ее «предшественник» — кусок, вырезанный из пре-мРНК nmy-2, — сначала полиаденилируется (добавляется «хвост»), а потом обрезается ядерной экзосомой, образуя зрелую terc-1. Это путь созревания отличается от того, что у других многоклеточных организмов.
Чтобы проверить, важно ли место в геноме, ученые «пересадили» terc-1 в интроны разных генов. Только вставки в гены, активные в зародышевой линии, восстанавливали «бессмертие» потомства и спасали популяцию. Экспрессия terc-1 только в зародышевых клетках была достаточной, чтобы поддерживать длинные теломеры через поколения — значит, длина теломер у червей в основном зависит от зародышевой линии.
Открытие показывает, как теломеразная РНК «перехватывает» интроны генов, активных в зародышевой линии, чтобы удлинять теломеры для будущих поколений и обеспечивать выживание вида. Этот механизм, названный «интронным перехватом», подчеркивает, насколько гибки некодирующие РНК в эволюции. Возможно, подобная стратегия используется и другими РНК, участвующими в развитии и наследовании. Это не только раскрывает тайны теломер, но и может помочь понять старение, рак и даже генетические болезни у людей. — Nematode telomerase RNA hitchhikes on introns of germline–up-regulated genes, «Биомолекула»: «Кодирующие некодирующие РНК», «Модельные организмы: нематода».
Ненасыщенные жиры изменяют фосфорилирование биологических часов, согласуя циркадные ритмы с сезонами у мышей
Представьте себе ваш организм как огромные биологические часы, которые «тикают» примерно каждые 24 часа, регулируя сон, бодрствование, голод и обмен веществ. Эти циркадные (суточные) ритмы управляются специальным механизмом в клетках — петлей обратной связи. В ней — белки CLOCK и BMAL1, которые запускают производство своих собственных «тормозов» — PER (период) и CRY (криптохром). Когда эти тормозные белки накапливаются, они замедляют процессы, а потом цикл повторяется. Но если часы сломаются (из-за генетики или внешних факторов), то — прощай нормальный сон, аппетит и вес. Им на смену придет ожирение и бессонница.
Наши внутренние часы не идеальны: их «тик» длится не ровно 24 часа, а чуть больше или меньше. Поэтому им нужна помощь извне, чтобы синхронизироваться с реальным днем и ночью. Свет — главный «настройщик», но, как оказалось, еда тоже играет огромную роль. Диета с высоким содержанием жиров (HFD) может сбить эти часы, нарушая сон и бодрствование. Но почему часы реагируют на питание, которое не всегда следует строгому 24-часовому ритму? Ученые нашли ответ в сезонных адаптациях: зимой дни короче, летом — длиннее, и нашему телу приходится подстраиваться, чтобы выживать.
Ключ к разгадке — специальная модификация белка PER2. В гипоталамусе (центре мозга, отвечающем за голод и сон) фосфорилирование (добавление фосфатной группы) к аминокислоте серин в позиции 662 (PER2-S662) меняет фазу ритмов. Это как поворот стрелки часов: фосфорилирование помогает адаптироваться к сезонным изменениям. Зимой, когда ночи длиннее, организму нужно «опережать» ритмы, чтобы не тратить энергию зря. Летом, с короткими ночами, — «задерживать». Но HFD мешает этому: мыши на такой диете плохо адаптировались к зимним циклам, зато легко — к летним. Диета с ограничением калорий давала обратный эффект.
Эксперименты показали, что голодание резко снижает фосфорилирование PER2-S662, сдвигая ритмы вперед и меняя гены, производящие метаболиты из полиненасыщенных жирных кислот (ПНЖК) — важных жиров для клеточных мембран. А частичная гидрогенизация кукурузного масла (превращение ПНЖК в мононенасыщенные МНЖК) усиливала фосфорилирование, помогая мышам лучше подстраиваться под лето, но не под зиму. Мыши с мутацией PER2-S662G (серин заменен на глицин, фосфорилирование невозможно) даже на HFD быстро перестраивались на зимний режим.
Почему это важно для нас? Зимой в природе в еде больше ПНЖК (для гибкости мембран в холод), что служит сигналом для адаптации. Но современная жизнь — обработанная еда и круглосуточный свет — создает «сезонное рассогласование»: часы не синхронизируются с реальностью, что повышает риск ожирения и бессонницы. Так что следите за питанием — оно не только кормит тело, но и настраивает ваши внутренние часы. — Unsaturated fat alters clock phosphorylation to align rhythms to the season in mice, «Биомолекула»: «Снова о циркадных ритмах».
Видеоверсия дайджеста SciNat за октябрь 2025.





