«Штирлиц! А вас я попрошу остаться», или Лизогенизация умеренным бактериофагом
26 ноября 2018
«Штирлиц! А вас я попрошу остаться», или Лизогенизация умеренным бактериофагом
- 1433
- 0
- 3
Электронная микрофотография вирионов φKO2.
[1] и рисунок автора статьи
-
Автор
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Научное сообщество начало познавать явление лизогении еще в 20-е годы XX века. Тогда заметили, что после многократных пассажей отдельных бактериальных колоний и их длительного размножения в антифаговой сыворотке в бактериальных культурах всё равно остаются фаги. Как можно охарактеризовать это явление спустя столетие, отбросив былые сомнения, задавшись новыми вопросами и следуя данным проведенных исследований? Предлагаем вашему вниманию биографию умеренного фага, после проникновения в бактерию ставшего внутриклеточным компонентом многих поколений ее потомков.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
«С вашим коварством какое наше сравнится»
Вирусы бактерий, или бактериофаги , делят на две категории — вирулентные фаги и умеренные. Главное их различие состоит в этапах жизненных циклов. Сущность феномена лизогенизации бактерий, или превращения их в лизогены, заключается в сохранении фага внутри бактериальной клетки в форме профага — для клетки до поры до времени непатогенного, однако потенциально способного привести к ее гибели. Такой образ «жизни» характерен для умеренных фагов [1], [2]. Называть неинфекционное состояние фага профагом предложили в 1950 году сотрудники Института Пастера Андре Львов и Антуанетт Гутман. Они провели опыты с отдельными клетками штамма Bacillus megaterium в камере с микроманипуляторами и показали, что даже если при делении бактерий свободного фага в среде нет, дочерние клетки всё равно могут его продуцировать [3].
Получить общее представление об этих созданиях — их облике, происхождении и интересных способностях — позволяет статья «Пожиратели бактерий: убийцы в роли спасителей» [4]. — Ред.
Обобщенная схема вариантов развития событий в жизненных циклах бактериофагов представлена на рисунке 1. После заражения клеток вирулентные фаги вступают в продуктивный (литический) цикл с образованием фаговых частиц и последующим лизисом клеток. Умеренные же фаги в ходе лизогенного цикла встраивают свой геном в бактериальную хромосому и остаются в неактивном состоянии до воздействия каких-либо внешних факторов [5]. Схема, изображенная на рисунке, репрезентативна для большинства известных умеренных фагов (Inovirus, Epsilon15-, phiC31-, Stx-, P4-, P22-, SfV-, P2- и Mu-подобных) [6], в том числе и для одного из немногих модельных объектов молекулярной биологии — фага λ. Этот значимый для истории биологии бактериофаг был открыт Эстер Ледерберг в 1951 году при работе со штаммом Escherichia coli K-12 [7], [8]. Современное представление об интеграции генома фага λ в бактериальную хромосому подразумевает att-сайт-специфическую рекомбинацию кольцевой ДНК фага и бактериальной хромосомы с участием продукта гена int — интегразы. Этот процесс проиллюстрирован в разделе, посвященном трансдукции.

рисунок автора статьи
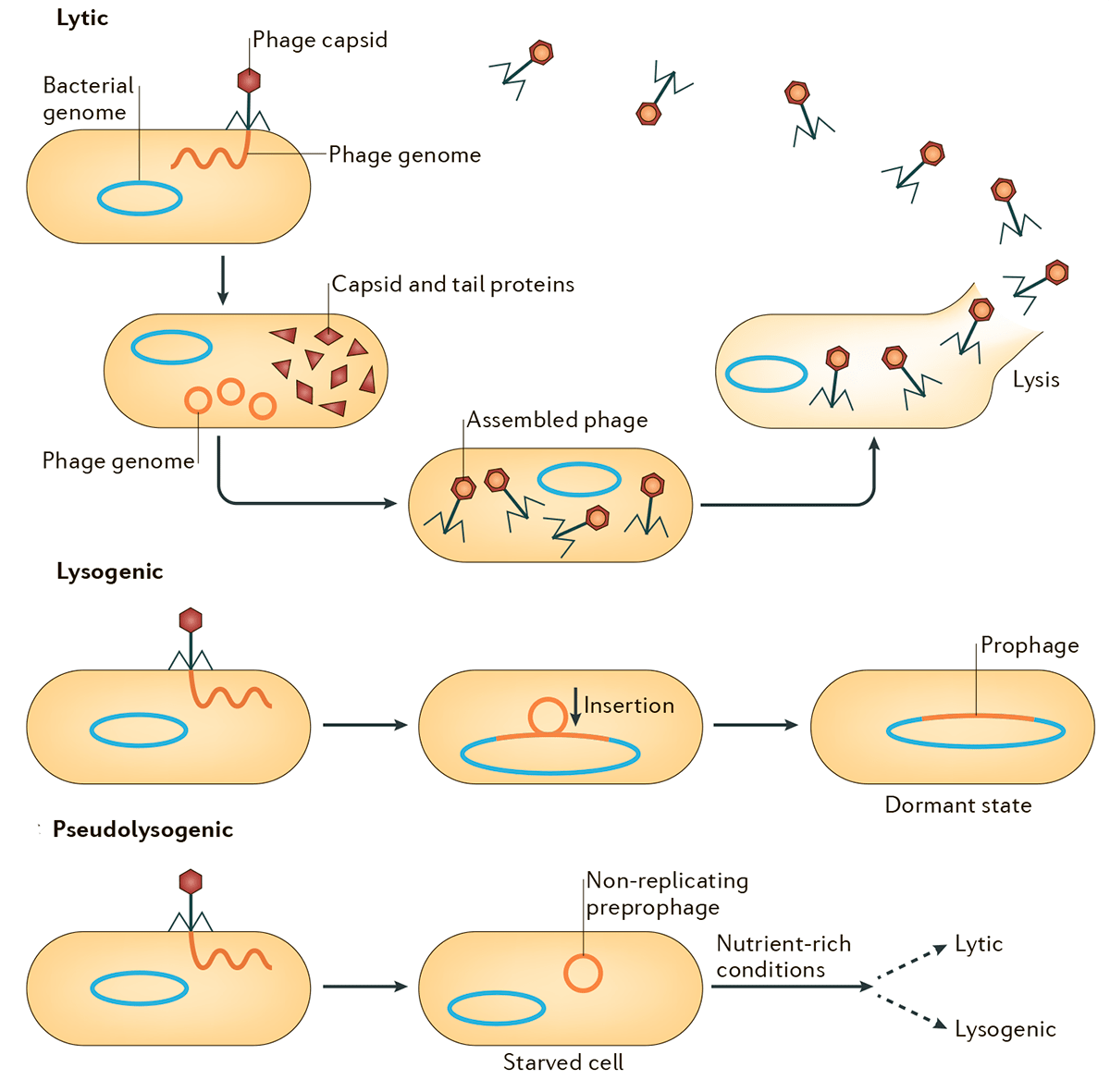
Рисунок 1. Схема литического, лизогенного и псевдолизогенного циклов. Лизогенный цикл может переключаться на литический, что будет сопровождаться продукцией частиц умеренного бактериофага и лизисом клеток. Псевдолизогения — нестабильное состояние фага, который не смог начать репликацию или стать профагом, — часто встречается при недостатке питательных веществ.
Однако, как и следует ожидать от Природы, такая форма пребывания умеренного фага в инфицированной клетке не может быть единственно возможной.
«Характер — нордический, выдержанный. С товарищами по работе поддерживает хорошие отношения»
Бактерия Klebsiella oxytoca — оппортунистический патоген человека и животных, способный вызывать бронхопневмонию, воспаление мочевых путей, септицемию и колит [9], [10]. В 1980-е годы в Швеции из смазочно-охлаждающей жидкости для металлообработки выделили необычный штамм K. oxytoca, CCUG 15788, устойчивый к высокому содержанию Ni2+ в среде [11], [12]. Тщательный электрофоретический и рестрикционный анализ геномной ДНК выявил в клетках CCUG 15788 две крупные плазмиды, правда, за устойчивость к никелю отвечали не они, а хромосома. Плазмида размером 160 т.п.н. оказалась стандартной, кольцевой, а вот меньшая, размером около 50 т.п.н., — линейной, что очень не типично для γ-протеобактерий [12]. Именно линейная плазмида, названная pKO2, через годы преподнесла исследователям сюрприз.
О сущности электрофореза и других способов разделения и очистки молекул наглядно рассказано в статье «12 методов в картинках: очистка молекул и разделение смесей» [13]. — Ред.

рисунок автора статьи
«Ясность — это одна из форм полного тумана»
Свет на сущность этого генетического элемента, pKO2, удалось пролить лишь к 2004 году. Полногеномное секвенирование выявило, что 51 601-п.н. pKO2 представляет собой ни что иное, как профаг (заглавный рисунок) [1]. Так к «KO2» добавилось любимое первооткрывателями и порицаемое номенклатурными комитетами «фи». Анализ 64 предсказанных генов φKO2 выявил его родство с бактериофагом-плазмидой N15. Высокая степень идентичности, в частности, была показана для генов сегрегации (необходимы для разделения плазмидных копий между дочерними клетками при делении бактерии), протеломеразы (прокариотической теломеразы — фермента, превращающего кольцевую фаговую ДНК в линейного профага с концами-шпильками), репликазы и репрессора профага. В то же время гены головки, хвостового отростка и лизиса у φKO2 и N15 не были гомологичны (рис. 2). Зато в геноме φKO2 нашли предполагаемые гомологи бактериальных генов dinI и umuD, вовлеченных в SOS-ответ (реакцию клетки на генотоксический стресс) [1].
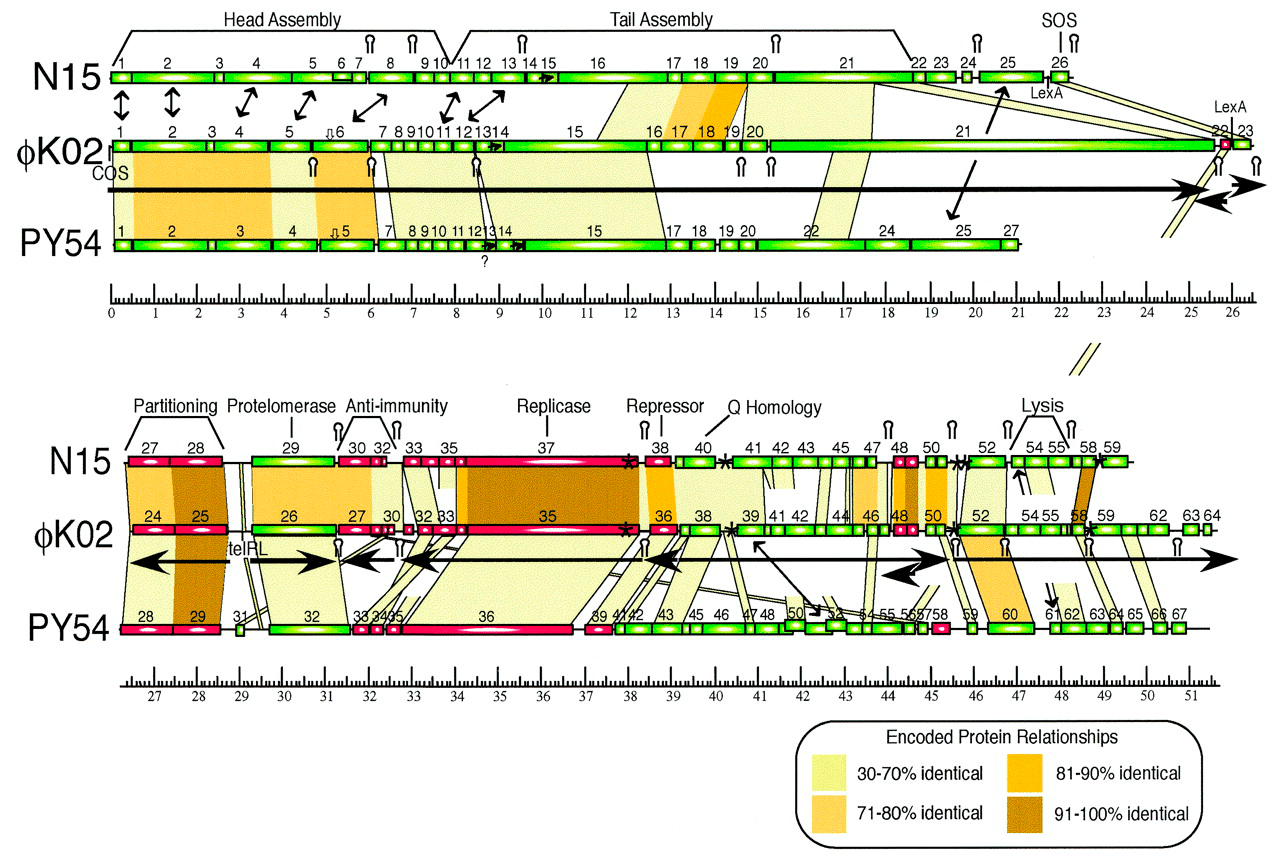
Рисунок 2. Карта генома φKO2. Геномы фагов φKO2, N15 и PY54 (новый фаг-плазмида, описанный уже во время подготовки статьи [1]) изображены с масштабной линейкой, отражающей т.п.н. φKO2. Предсказанные гены обозначены прямоугольниками (зелеными — транскрибируемые вправо, красными — влево). Желто-коричневые зоны соединяют гомологичные области пары геномов (чем темнее цвет, тем выше идентичность). Гены, обозначенные SOS (22 и 23 у φKO2), контролируются SOS-ответом хозяина. Участок telRL служит местом линеаризации фаговой ДНК, осуществляемой протеломеразой (продуктом гена 26). Под картой генома φKO2 длинными горизонтальными стрелками обозначены предсказанные транскрипционные единицы. Двусторонние стрелки указывают на гены с подобными функциями, но без значительного сходства в последовательностях. Звездочки обозначают предполагаемые «центромеры», то есть сайты сборки сегрегационного аппарата (продуктов генов 24 и 25 у φKO2), а шпильки («стебельки с петлями») — возможные ρ-независимые терминаторы транскрипции (над картой N15 и под картой φKO2).
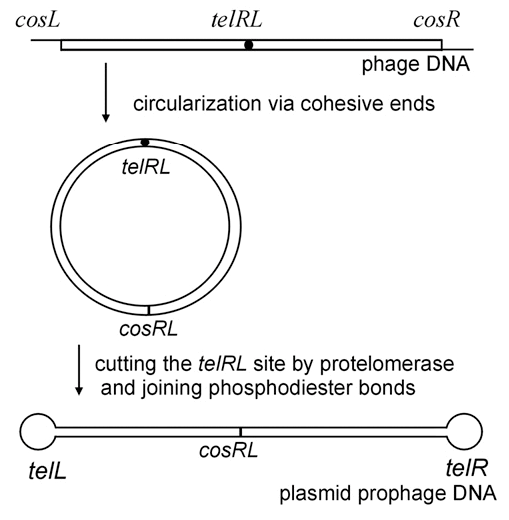
Рисунок 3. Механизм конверсии ДНК N15-подобных фагов в линейную плазмиду. Участки cosL и cosR — одноцепочечные концы связывания («липкие» концы); cosRL — сайт, образовавшийся после лигирования «липких» концов; telRL — неразрезанный сайт-мишень для протеломеразы; telL и telR — левый и правый концы-шпильки профага, образованные с помощью протеломеразы.
Охарактеризованный ранее фаг N15 представляет пока немногочисленную группу бактериофагов, профаги которых способны существовать в виде плазмид . N15 — первый исследованный пример линейной ДНК с ковалентно замкнутыми концами (теломерами) у прокариот [14]. Семья теломерных фагов-плазмид сейчас включает лямбдоидные N15, pY54 и φKO2 (Siphoviridae), а также фаги ΦHAP-1, VHML, VP882, Vp58.5 и vB_VpaM_MAR морских γ-протеобактерий (Myoviridae). У всех них очень схожи гены протеломераз и репликативного аппарата, а также модулей контроля лизогении [15].
Профаг-плазмида может находиться в клетке в нескольких формах (рис. 3). После внедрения в бактерию фаговая ДНК замыкается путем «склеивания» коротких комплементарных концов (cos). Однако для реализации лизогенного цикла фаг должен стать линейной плазмидой. Для этого фаговая протеломераза «открывает» его кольцевую ДНК, но уже в совершенно другом месте, сайте telRL (сайт формирования теломер). А именно — в его центральной палиндромной области 5′-CCATTATACGC|GCGTATAATGG-3′, которая оказалась абсолютно идентичной у N15 и φKO2 [1], [14]. Та же самая протеломераза сшивает в петлю две нити ДНК на каждом из образовавшихся концов профага.
Об увлекательной мешанине в мире прокариотических генетических элементов рассказывает обзор «Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов» [16]. — Ред.
«Штирлиц играл, что называется, ва-банк»

рисунок автора статьи
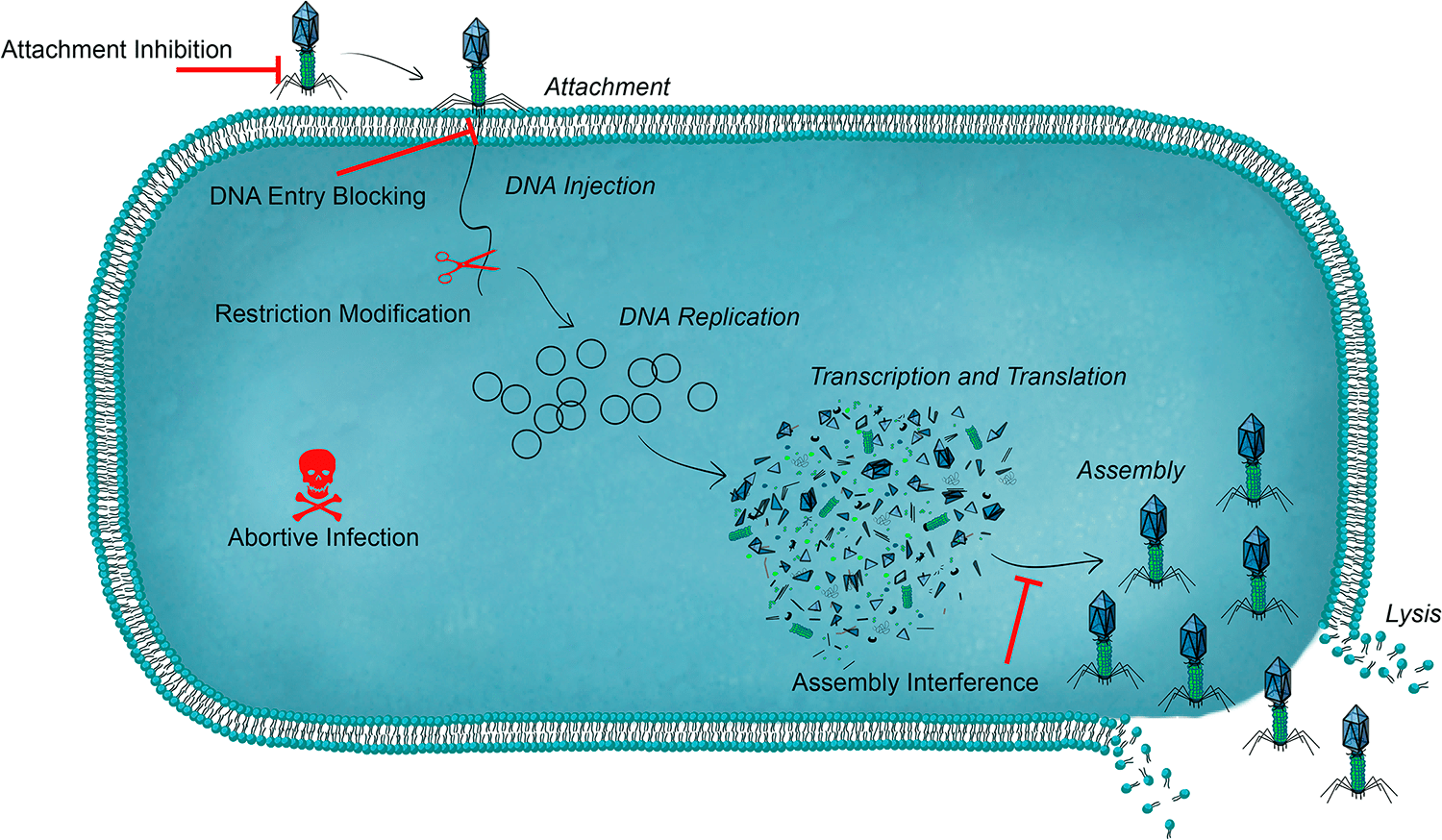
Внедрение бактериофага, умеренного или вирулентного, в бактериальную клетку связано с риском для вируса и требует молекулярной продуманности и подготовки для успешного выполнения лизогенной или продуктивной программ. Для каждой стадии жизненного цикла вируса у бактерии есть специальные антифаговые барьеры и капканы (рис. 4а).
- Чтобы предотвратить прикрепление фага к клетке, бактерия может модифицировать соответствующий рецептор, снизить его доступность за счет фазового переключения его экспрессии, выстроить физические барьеры — капсулы и другие внеклеточные полимеры.
- На следующем этапе инфицирования может сработать механизм блокады инъекции фаговой ДНК, в котором участвуют мембранные белки других фагов — тех, что обосновались в этом бактериальном клоне раньше и не желают ни с кем делить хозяина.
- Внутри клетки чужеродную ДНК ждет система рестрикции-модификации, которая представлена эндонуклеазой рестрикции, расщепляющей чужеродную ДНК, и метилтрансферазой, защищающей собственную ДНК метилированием.
- Самая альтруистичная линия защиты называется системой абортивной инфекции. Ее механизмы разнообразны, но преследуют одну единственную цель — ценой собственной, то есть хозяйской, гибели или бактериостаза не допустить образования и выхода зрелых фаговых частиц. Часто такие системы кодируются профагами или плазмидами.
- Еще один способ противодействия фагам — интерференция на этапе сборки частиц: фаговая инвазия может активировать PICI (хромосомные острова, индуцируемые фагами), которые с помощью разных ухищрений упаковываются в фаговый капсид вместо родной ДНК фага. Правда, при выходе таких частиц, как и в предыдущем случае, хозяйская клетка гибнет. А фаг-неудачник становится невольным помощником в распространении по бактериальной популяции PICI, часто кодирующих факторы вирулентности бактерий [17].
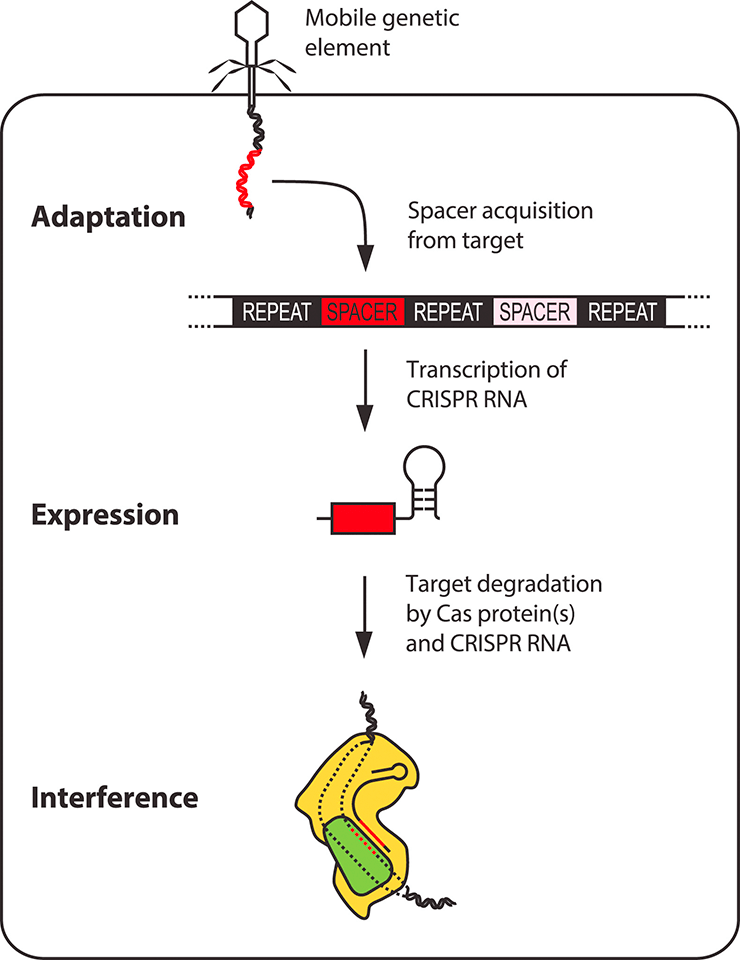
- Система CRISPR-Cas обеспечивает адаптивный иммунитет к специфическим последовательностям нуклеотидов [18]. Основными компонентами этой системы являются особые хромосомные локусы CRISPR и белки Cas. CRISPR содержат уникальные последовательности (спейсеры), позаимствованные у чужеродного генетического материала — фагов и плазмид. Считанная с CRISPR РНК служит гидом, направляющим «молекулярные ножницы» Cas к новым вторженцам, содержащим зафиксированные в CRISPR последовательности и, следовательно, подлежащим разрушению (рис. 4б) [19].
«Он спал глубоко и спокойно, но ровно через 20 минут он проснется. Это тоже одна из привычек, выработанная годами»
Но преодолеть перечисленные барьеры — это еще не всё. Для успешной реализации лизогенного сценария умеренный бактериофаг должен обладать механизмом торможения литического цикла развития. Ключевую роль в переключении программы жизненного цикла бактериофага играют закодированные в геноме фага антагонистические репрессоры. Так, у φKO2 и N15 есть область иммунитета immB, содержащая гены репрессора профага CB, литического репрессора Cro и антитерминатора Q, подобные генам cI, cro и q модельного фага λ (рис. 5). Однако количество операторов, с которыми связываются репрессоры CB (CI) и Cro, у λ и теломерных φKO2/N15 неодинаково — шесть и пять соответственно [20], [21].
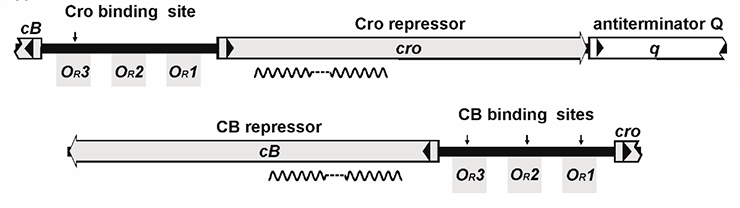
Рисунок 5. Репрессия транскрипции φKO2. Репрессор CB связывается с тремя операторами OR (между генами cB и cro) и двумя операторами OL (между cB и геном репликазы, repA). В этих зонах находится ряд промоторов, поэтому CB репрессирует транскрипцию cro, собственного гена, поздних генов, а также repA, что предполагает участие CB в контроле репликации плазмиды. Репрессор Cro связывается только с оператором OR3 и подавляет транскрипцию cB, но не своего собственного гена. Белки Q и Cro инициируют транскрипцию генов сборки фаговых частиц.
Для фага λ показано, что лизогенный сценарий реализуется благодаря транскрипции гена cI, продукт которого подавляет синтез антагонистического (мешающего лизогенизации) репрессора Cro. Если же белка CI становится слишком много, он подавляет и транскрипцию собственного гена. Однако недавно охарактеризовали роль еще одного белка фага λ, вовлеченного в контроль его жизненного цикла, — CII. Стабильность CII, а следовательно, его концентрация в клетке определяет, какой из репрессоров будет синтезироваться. Cодержание же CII в клетке зависит от внешних факторов, в том числе от активности бактериальных протеаз, способных его деградировать [22]. Лизогенный цикл λ протекает в бактериальной хромосоме, теломерные же фаги ведут плазмидный образ «жизни», и поэтому многие их гены должны в той или иной мере работать и в лизогенном состоянии(например, гены репликации и системы сегрегации плазмид). А это предполагает более сложную регуляцию транскрипции у бактериофагов-плазмид [15].
«Контрразведчик должен знать всегда, как никто другой, что верить в наше время нельзя никому, порой даже самому себе. Мне — можно»
Роль умеренных, а иногда и вирулентных, фагов в микромире не ограничивается уничтожением с той или иной эффективностью своих хозяев. Бактериофаги — агенты горизонтального переноса генов и, соответственно, мощная движущая сила эволюции прокариот. А значит, в биографиях отдельных людей и человечества в целом они тоже оставляют заметные следы.
Находясь в клетках бактерий, умеренные фаги могут придавать своим хозяевам новые свойства — осуществлять лизогенную конверсию. Например, изменять морфологию колоний, ферментативную активность, бактериальные антигены, чувствительность к антибиотикам и другим веществам, а также к гомологичным фагам [3], [23–24]. Первой системой, на которой продемонстрировали лизогенную конверсию, была бактерия Corynebacterium diphtheriae. Ее штамм именно после инфицирования умеренным фагом β стал токсигенным [3]. В таблице приведены некоторые примеры фаговых генов, ответственных за патогенность бактерий.
| Бактерия | Фаги | Кодируемые фагом гены вирулентности и их продукты |
|---|---|---|
| C. diphtheriae | Beta | tox — дифтерийный токсин |
| E. coli | Stx | stx1, stx2 — шига-токсины; stk — тирозинкиназа, влияющая на передачу сигналов; cif, espI/nleA, espI, espK, espEU/tccP, nleI — эффекторные белки системы секреции III типа (T3SS), способствующие вторжению в клетки жертвы |
| λ | lom — белок внешней мембраны, обеспечивающий связывание с эпителиальными клетками; bor — белок внешней мембраны, помогающий уклоняться от иммунитета |
|
| CP-933C | Факторы, регулирующие синтез T3SS | |
| S. enterica | φSopE | sopE — T3SS-эффектор |
| Gifsy-1 | gipA, gogB — факторы, способствующие колонизации пейеровых бляшек и выживанию в макрофагах | |
| Gifsy-2 | sodC1 — фермент-антиоксидант, способствующий выживанию в макрофагах; sseI — T3SS-эффектор |
|
| Gifsy-3 | sspHI — T3SS-эффектор | |
| P. aeruginosa | D3 | Факторы, меняющие свойства внешней мембраны, а потому препятствующие фагоцитозу |
| S. mitis | SM1 | pblA, pblB — поверхностные белки, необходимые для прикрепления к тромбоцитам |
| C. jejuni | CJIE1 | Факторы, облегчающие адгезию и инвазию |
| V. cholerae | CTX | ctx — холерный токсин |

рисунок автора статьи
Помимо собственных генов фаги способны переносить в инфицируемые клетки и генетический материал предыдущего хозяина (фрагменты его хромосомы или мобильных генетических элементов). Этот процесс называется трансдукцией. Тех бактерий, чью ДНК фаг переносит, называют донорами, а тех, что этот материал принимают, — реципиентами. С помощью неспецифичной, или общей, трансдукции может передаваться любой признак: это происходит при случайном захвате в вирусную частицу фрагмента генома бактерии. При специфичной трансдукции фаговые частицы переносят из генома бактерии строго определенные маркеры. На это способны, как правило, только умеренные фаги — те, что встраиваются в бактериальный геном в строго определенных местах [2]. Классический пример специфичной трансдукции фагом λ бактериальных локусов gal и bio (или их частей) представлен на рисунке 6. В результате такой трансдукции возможно приобретение бактерией-реципиентом способности к утилизации галактозы и/или синтезу биотина, если, конечно, ранее она была лишена этих свойств [25].
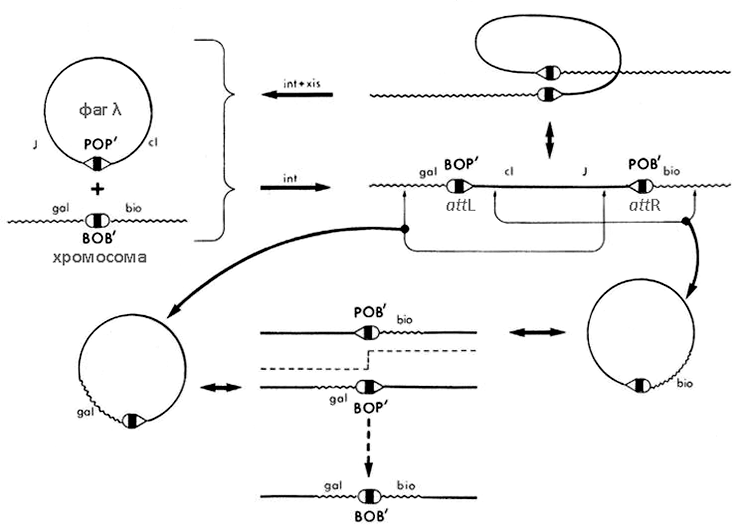
Рисунок 6. Трансдукция локусов gal и bio с помощью фага λ. Интеграция кольцевого фага в хромосому бактерии происходит путем сайт-специфической рекомбинации между фаговым сайтом POP′ и бактериальным BOB′ (эти последовательности называют att-сайтами, от англ. attachment — прикрепление). Этот процесс требует участия кодируемой фагом интегразы (Int). BOB′ на хромосоме кишечной палочки расположен между оперонами gal и bio. После встраивания фага образуются два гибридных сайта — BOP′ (левый, attL, прилегающий к gal) и POB′ (правый, attR, прилегающий к bio). Обратная реакция, вырезание профага, предполагает рекомбинацию между BOP′ и POB′ с получением BOB′ и POP′ (исходная ситуация) и требует участия фаговых Int и Xis (эксцизионазы). Фаг, «прихвативший» бактериальный gal и несущий BOP′, как и фаг, трансдуцирующий bio и несущий POB′, образуются в тех редких случаях, когда происходит Int-независимая рекомбинация в сайтах, отличных от attL и attR. Фаги, содержащие сайт BOB′ и переносящие и gal, и bio одновременно, образуются путем Int-зависимой рекомбинации между att-сайтами фага с gal и фага с bio при их совместном инфицировании одной клетки.
[25], рисунок с изменениями
«Сегодня [...] мир еще не завоеван, и поэтому полковник Максим Максимович Исаев едет в Берлин. Он едет работать»

рисунок автора статьи
Умеренные фаги образуют устойчивые ассоциации с бактериями-хозяевами. Для образования лизогенной бактерией фаговых частиц необходимо воздействие особых факторов, часто очень сильное. Известно, что в популяции лизогенных бактериальных штаммов всегда есть некоторое количество вирусных частиц. Это объясняется спонтанным высвобождением бактериофагов.
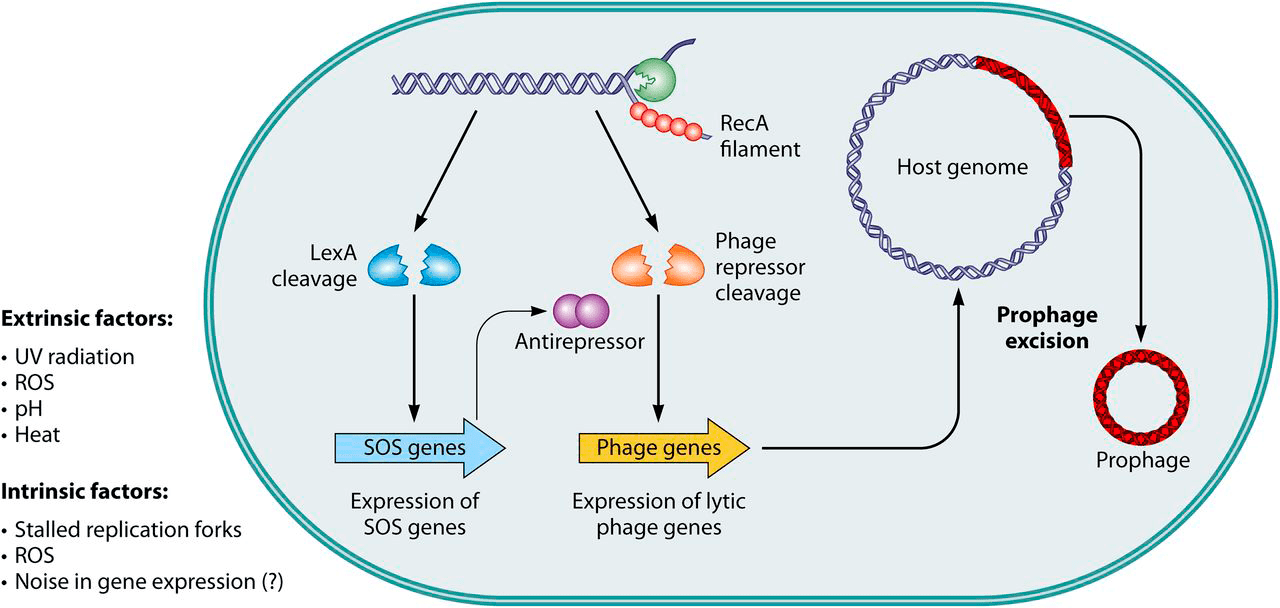
Фаговая индукция — переключение лизогенного цикла профага на литический, продуктивный — может быть обусловлена случайностями в экспрессии генов (генетический шум) или включением SOS-ответа, например, при повреждении ДНК УФ-облучением или активными формами кислорода (АФК). Объясняется это просто: во время SOS-ответа выводится из строя репрессор, поддерживающий профаг в неактивном состоянии, и запускается экспрессия литических генов.
Обобщенная схема активации продукции фаговых частиц представлена на рисунке 7а [26]. Повысить вероятность их выхода из клеток можно направленным воздействием физических, химических и биологических факторов.
- Из физических факторов индуцирующее действие показано для УФ-излучения, видимого света после предварительной сенсибилизации бактериальной культуры красителем, ионизирующего излучения, высокой температуры, высокого гидростатического давления, ультразвука и высушивания.
- Из химических — для глутатиона, серной, сероводородной и азотистой кислот, сульфатиазола, иприта, галогензамещенных аналогов урацила.
- Из биологических — для некоторых антибиотиков, ферментов, бактериоцинов и др. [3].
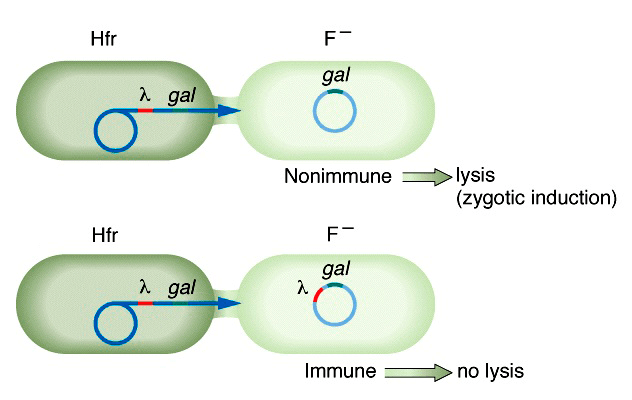
На рисунке 7б представлен еще один, необычный, вариант индукции профагов, связанный со снятием репрессии фаговых генов при попадании фага в цитоплазму новой, свободной от профага и, следовательно, репрессоров, клетки. Такая индукция называется зиготной и наблюдается при скрещивании лизогенной клетки-донора (Hfr) с нелизогенным реципиентом (F−) [27].
И всё же повторим, что устойчивый союз умеренного фага с бактерией разрушается лишь в экстремальных условиях: вирус, как правило, вынужденно покидает «тонущий корабль» — хозяина, получившего угрожающие жизни травмы. Ну а если всё не так плохо — фаг готов и далее выполнять свою тайную миссию…

рисунок автора статьи
В качестве заключения
Мир простых на первый взгляд бактериальных вирусов по мере углубления его изучения оказывается всё более многоликим. Одних из них можно брать в союзники на антимикробные сражения, другие внезапно проявляют себя лизисом полезных для человека культур. И того хуже: заручившись поддержкой прокариотического хозяина, кто-то из них провоцирует вспышку опасной инфекции у эукариот. Ну а кто-то прекрасно справляется с переносом между бактериями метаболических генов или даже целых путей.
Умеренные бактериофаги сыграли важную роль в становлении понятий молекулярной биологии. Благодаря исследованиям фага λ получены представления о сайт-специфической и общей рекомбинации, положительной и отрицательной регуляции генов, репликации ДНК. И даже относительно недавно описанные теломерные бактериофаги уже нашли применение в биотехнологии: линейные плазмидные векторы в ряде случаев показали преимущество над суперскрученными кольцевыми плазмидами, способными к образованию крестообразных структур и реорганизации. К тому же на их основе можно создавать низкокопийные векторы, пригодные для экспрессии генов токсичных продуктов.
Несмотря на то, что умеренные фаги говорят лаконично на языке последовательности нуклеотидов и обладают сдержанными потребностями, в их коллективную историю несомненно еще будут вписаны интересные открытия и практические изобретения.
Литература
- S. R. Casjens, E. B. Gilcrease, W. M. Huang, K. L. Bunny, M. L. Pedulla, et. al.. (2004). The pKO2 Linear Plasmid Prophage of Klebsiella oxytoca. Journal of Bacteriology. 186, 1818-1832;
- Адамс М. Бактериофаги. М.: «Иностр. лит.», 1961. — 527 с.;
- Габрилович И.М. Лизогения. Минск: «Беларусь», 1970. — 88 с.;
- Пожиратели бактерий: убийцы в роли спасителей;
- Ron Feiner, Tal Argov, Lev Rabinovich, Nadejda Sigal, Ilya Borovok, Anat A. Herskovits. (2015). A new perspective on lysogeny: prophages as active regulatory switches of bacteria. Nat Rev Micro. 13, 641-650;
- Louis-Marie Bobay, Eduardo P.C. Rocha, Marie Touchon. (2013). The Adaptation of Temperate Bacteriophages to Their Host Genomes. Molecular Biology and Evolution. 30, 737-751;
- Sherwood R. Casjens, Roger W. Hendrix. (2015). Bacteriophage lambda: Early pioneer and still relevant. Virology. 479-480, 310-330;
- Allan Campbell. (2007). Phage Integration and Chromosome Structure. A Personal History. Annu. Rev. Genet.. 41, 1-11;
- Alison Darby, Kvin Lertpiriyapong, Ujjal Sarkar, Uthpala Seneviratne, Danny S. Park, et. al.. (2014). Cytotoxic and Pathogenic Properties of Klebsiella oxytoca Isolated from Laboratory Animals. PLoS ONE. 9, e100542;
- Lavan Singh, M.P. Cariappa, Mandeep Kaur. (2016). Klebsiella oxytoca: An emerging pathogen?. Medical Journal Armed Forces India. 72, S59-S61;
- Mattsby-Baltzer I., Sandin M., Ahlström B., Allenmark S., Edebo M., Falsen E. et al. (1989). Microbial growth and accumulation in industrial metal-working fluids. Appl. Environ. Microbiol. 55 (10), 2681–2689;
- Ralf-Dietmar Stoppel, Maria Meyer, HansG�nter Schlegel. (1995). The nickel resistance determinant cloned from the enterobacterium Klebsiella oxytoca: conjugational transfer, expression, regulation and DNA homologies to various nickel-resistant bacteria. Biometals. 8;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Nikolai V. Ravin. (2011). N15: The linear phage–plasmid. Plasmid. 65, 102-109;
- Nikolai V. Ravin. (2015). Replication and Maintenance of Linear Phage-Plasmid N15. Microbiology Spectrum. 3;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Kimberley D. Seed. (2015). Battling Phages: How Bacteria Defend against Viral Attack. PLoS Pathog. 11, e1004847;
- Просто о сложном: CRISPR/Cas;
- Devashish Rath, Lina Amlinger, Archana Rath, Magnus Lundgren. (2015). The CRISPR-Cas immune system: Biology, mechanisms and applications. Biochimie. 117, 119-128;
- Jens Hammerl, Claudia Jäckel, Erich Lanka, Nicole Roschanski, Stefan Hertwig. (2016). Binding Specificities of the Telomere Phage ϕKO2 Prophage Repressor CB and Lytic Repressor Cro. Viruses. 8, 213;
- Jens A. Hammerl, Claudia Jäckel, Eugenia Funk, Sabrina Pinnau, Christin Mache, Stefan Hertwig. (2016). The diverse genetic switch of enterobacterial and marine telomere phages. Bacteriophage. 6, 1-10;
- Jiri Vohradsky. (2017). Lambda phage genetic switch as a system with critical behaviour. Journal of Theoretical Biology. 431, 32-38;
- Cristina Howard-Varona, Katherine R Hargreaves, Stephen T Abedon, Matthew B Sullivan. (2017). Lysogeny in nature: mechanisms, impact and ecology of temperate phages. ISME J. 11, 1511-1520;
- Emily V. Davies, Craig Winstanley, Joanne L. Fothergill, Chloe E. James. (2016). The role of temperate bacteriophages in bacterial infection. FEMS Microbiology Letters. 363, fnw015;
- Landy A. and Ross W. (1977). Viral integration and excision: structure of the lambda att sites: DNA sequences have been determined for regions involved in lambda site-specific recombination. Science. 197 (4309), 1147–1160;
- Arun M. Nanda, Kai Thormann, Julia Frunzke. (2015). Impact of Spontaneous Prophage Induction on the Fitness of Bacterial Populations and Host-Microbe Interactions. J. Bacteriol.. 197, 410-419;
- Griffiths A.J.F., Gelbart W.M., Miller J.H. et al. Modern genetic analysis. NY: W. H. Freeman, 1999.