Слово из четырёх букв
23 марта 2010
Слово из четырёх букв
- 2218
- 1
- 3
Футуристы, трансгуманисты и киберпанки видят в возможности управления жизнью на молекулярном уровне основу будущего технологического и общественного уклада
-
Автор
-
Редакторы
Одним из наиболее удивительных открытий в биологии XX века стала расшифровка генетического кода, причём особенно трудно было понять, что такой код существует. Пожалуй, самым поразительным свойством этого «языка» является его универсальность — за исключением некоторых «диалектов», он одинаков для всех доменов жизни на Земле. В начале XXI века учёные сумели «перепрошить» генетический код, добавляя к стандартным аминокислотам неприродное звено, кодируемое стоп-кодоном в матричной РНК и считываемое при участии «ортогональных» тРНК. (Правда, при этом в белкé может быть только одно нестандартное звено.) Теперь дело поворачивается в сторону полностью «настраиваемых» белков: английским исследователям удалось создать рибосому, считывающую за раз не три, а четыре нуклеотида, что потенциально позволяет использовать для дизайна биополимеров более 250 неприродных аминокислот.
Расшифровка генетического кода стала одним из впечатляющих проявлений работы научной мысли в XX веке. На осознание самого факта существования генетического кода — то есть, однозначного соответствия последовательностей ДНК и кодируемых в ней белков — ушло более века, в то время как на его расшифровку не потребовалось и десятилетия. Промежуточными вехами на этом пути стали принцип матричного дублирования, принадлежащий Н. К. Кольцову, идеи Э. Шрёдингера о кодировании информации в химической структуре генов, модель двойной спирали ДНК Дж. Уотсона и Ф. Крика и неожиданный вклад физика Г.А. Гамова в формулировку проблемы триплетного генетического кода. Увенчали эту цепочку работы Ф. Крика с сотрудниками, экспериментально открывшими хрестоматийные качества генетического кода — триплетность, слитность, ориентированность и вырожденность [1].
Поразительно, но генетический код практически одинаков для всех известных на Земле организмов, и это продолжает подтверждаться с появлением всё новой и новой геномной информации. Конечно, этот код не является чем-то статичным: он продолжает эволюционировать, что позволяет объяснить небольшие отличия, наблюдаемые у разных организмов (архебактерий, микоплазм, некоторых простейших) или даже для отдельных субклеточных органелл (митохондрий) [2]. Однако человеку мало изучить, как устроено живое: примеряя на себя роль творца, он стремится воспроизвести или даже создать жизнь «с нуля» [3], в связи с чем учёные снискали уже немалую дозу праведного негодования со стороны не столь любознательно настроенных групп граждан.
Новомодная парадигма, получившая название синтетической биологии, подходит к изучению устройства жизни не разбирая её на части, а, наоборот, стараясь воспроизвести её на основе элементарных блоков, фактически стерев границу между живой и неживой материей. Сторонники этого подхода крайне заинтересованы в получении белковых молекул с новыми свойствами (в том числе, включающих неприродные аминокислоты), не говоря уже о более «приземлённых» фармакологах и биотехнологах, для которых такие белки могут в прямом и переносном смысле стать золотой жилой. (Всё это совсем не означает, впрочем, что потенциал природных белков и белков, построенных из природных аминокислот, исчерпан.)
Число различных неприродных аминокислот, которые можно «встроить» в белóк генетическим (а не синтетическим) путём, естественно ограничено числом доступных кодонов — трёхбуквенных «слов», из которых состоит язык генетического кода. Хотя всего двадцать (22, если считать пирролизин и селенцистеин) природных аминокислот кодируются аж 64 кодонами, высокая вырожденность кода приводит к тому, что все триплеты «заняты», и даже использование синонимичных кодонов для вставки нестандартных аминокислот нежелательно, поскольку это может нарушить работу всей системы в целом.
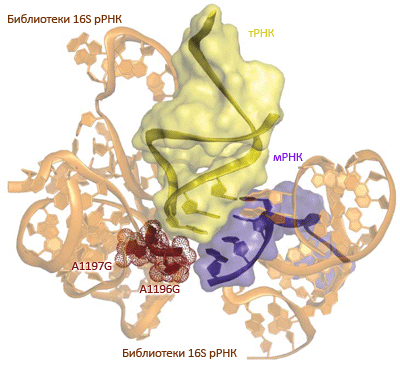
Рисунок 1. Молекулярная «селекция» рибосом, распознающих квадруплетные кодоны. Селекция основана на библиотеках 16S рРНК в «ортогональной» рибосоме ribo-X, ранее созданной в лаборатории Чина [5]; замены в рРНК затронули в сумме 127 нуклеотидов. Две замены, расположенные вблизи сайта связывания тРНК, привели к тому, что один из вариантов (он получил название Q1) может эффективно декодировать квадруплетные кодоны, сохранив при этом способность считывать «стандартные» триплеты. (Кстати, эффективность распознавания квадруплета и доля ошибочных прочтений тут не хуже, чем у обычных рибосом.)
Селекция была основана на устойчивости к антибиотику хлорамфениколу, которая возникала только в том случае, если рибосоме удавалось прочесть ген устойчивости, расположенный «за замком» квадруплетного кодона AAGA в генетической конструкции, специально для целей селекции добавляемой в среду. (Также добавляли «дизайнерский» вариант сериновой тРНК, антикодон в которой длиной те же четыре нуклеотида — UCUU.)
Британские исследователи из Кембриджа идут по пути «освобождения рибосомы»: их задачей стало расширение репертуара неприродных аминокислот, которые можно одновременно ввести в синтезируемый белóк. Последнее достижение лаборатории Джейсона Чина (Jason Chin) — создание модифицированных рибосом, способных считывать генетический код не триплетами, а квадруплетами (по 4 основания), что потенциально позволяет кодировать до 256 (!) аминокислот [4]. Путём молекулярной селекции учёные «вывели» мутантный вариант рибосомы (она получила название Q1 — см. рисунок 1), эффективно распознающую квадруплеты (для целей селекции в «квадруплетной» рамке считывания был закодирован ген устойчивости к антибиотику). Конечно, будь все рибосомы в клетке такими, это стало бы летальным, но они существуют независимо от «нормальных» рибосом и не мешают им синтезировать клеточные белки (то есть, тоже являются ортогональными).
Способность «квадруплетной» рибосомы Q1 считывать не только природные триплеты, но и «слова из четырёх букв» (квадруплеты) позволяет использовать её для вставки в белок множества неприродных аминокислот одновременно, что было невозможно раньше. Для начала был получен вариант белкá кальмодулина, в который ввели две неприродные аминокислоты, содержащие азидную и алкиновую группы. При пространственном сближении эти аминокислоты соединяются по механизму Хьюсгена (напоминает реакцию Дильса-Альдера) и создают в белке дополнительное «ребро жёсткости» (рис. 2). Исследователи отмечают, что это подтверждает практическую пользу квадруплетных рибосом для задач биоинженерии и синтетической биологии.
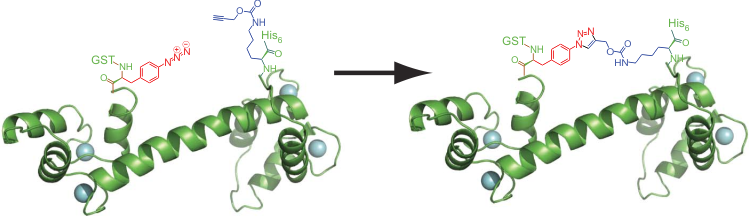
Рисунок 2. Генетически закодированная циклизация кальмодулина посредством Cu(I)-зависимой реакции Хьюсгена. Вместо первого и последнего остатка в кальмодулин помощью квадруплетной рибосомы и соответствующих ортогональных тРНК и аминоацил-тРНК-синтетаз были вставлены неприродные аминокислоты: пара-азидо-фенилаланин и N6-[(2-пропинилокси)карбонил]-лизин, соответственно. (Использовались квадруплетный кодон AGGA и «стандартный» стоп-кодон UAG.) На расшифрованной пространственной структуре видно, что эти два остатка действительно участвуют в «клик-реакции», образуя сшивку, которую сложно получить другими способами.
Однако создание квадруплетной рибосомы — это только часть задачи, что видно хотя бы из того, что для циклизации кальмодулина использовали только один квадруплетный кодон, а второй «по старинке» был стандартным для этих целей стоп-кодоном UAG. Видимо, дело в том, что у исследователей не нашлось двух взаимно ортогональных квадруплетных пар тРНК/тРНК-синтетаза. «Получив рибосому, способную считывать массу кодонов-“пустышек”, задаёшься вопросом, где же достать тРНК и соответствующие синтетазы, которые позволили бы использовать этот потенциал?» — вопрошает Чин [7]. Однако он сам же себе уже и ответил в научной печати — его лаборатория опубликовала первую работу по созданию пар ортогональных тРНК/аминоацил-тРНК-синтетаз, внося в них по определённой программе мутации [6]. Эта возможность открывает путь к тотальной «настройке» белкá, в который в будущем можно будет вставлять практически любые звенья, не ограничиваясь лишь двадцатью природными, и многие учёные уже назвали эти достижения новой эрой в биоинженерии.
Невероятно, что оказалось возможным взять такой невообразимо сложный механизм как трансляция белка и «перепрошить» его в своих целях, но это, кажется, только начало.
Литература
- Ратнер В.А. (2000). Генетический код как система. «Соросовский образовательный журнал». 6, 17–22;
- Эволюция генетического кода;
- Смыслы «жизни»;
- Heinz Neumann, Kaihang Wang, Lloyd Davis, Maria Garcia-Alai, Jason W. Chin. (2010). Encoding multiple unnatural amino acids via evolution of a quadruplet-decoding ribosome. Nature. 464, 441-444;
- Kaihang Wang, Heinz Neumann, Sew Y Peak-Chew, Jason W Chin. (2007). Evolved orthogonal ribosomes enhance the efficiency of synthetic genetic code expansion. Nat Biotechnol. 25, 770-777;
- Heinz Neumann, Adrian L. Slusarczyk, Jason W. Chin. (2010). De NovoGeneration of Mutually Orthogonal Aminoacyl-tRNA Synthetase/tRNA Pairs. J. Am. Chem. Soc.. 132, 2142-2144;
- Arnaud C.H. (2010). Expanding the genetic code. Chemical & Engineering News.