
«Солнечный» витамин в другом свете: новые исследования терапевтических свойств витамина D
24 февраля 2021
«Солнечный» витамин в другом свете: новые исследования терапевтических свойств витамина D
- 7494
- 2
- 4
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Пандемия COVID-19 спровоцировала активный поиск новых средств предотвращения её дальнейшего развития. В ожидании создания самого мощного из них — безопасной, эффективной и доступной вакцины — на нас отовсюду буквально сыплются новости об обнаружении самого эффективного средства против коронавируса. При внимательном рассмотрении далеко не все из них оказываются достоверными и научно обоснованными. Однако за некоторыми сообщениями действительно стоят реальные научные исследования, на основе которых возможно сделать осмысленные оценки эффективности исследуемых веществ. Иногда ранее неизвестные полезные свойства находят и у старожилов мировой фарминдустрии. Так, очередную «новую жизнь» на фоне пандемии обретает витамин D. Будет ли она долгой, покажут будущие исследования. Мы же поговорим о том, что известно о «солнечном» витамине на сегодняшний день.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Цель одна — средства разные
В борьбе с распространением нового вирусного заболевания можно выделить несколько стратегий. Самой эффективной из них является массовая вакцинация. На «Биомолекуле» есть целая рубрика, в которой подробно разбираются разные вопросы, связанные с вакцинами и вакцинацией, включая результаты испытания вакцин против SARS-CoV-2. Тем не менее, недостаточно только создать безопасную и эффективную вакцину, необходимо также сделать её широко доступной. Для формирования коллективного иммунитета нужно вакцинировать подавляющее большинство людей популяции (>¾). Как правило, для этого необходимы не только огромные производственные мощности, но и большое количество времени.
С другой стороны, возможно использовать низкомолекулярные вещества, прямым или косвенным образом предотвращающие развитие SARS-CoV-2 в организме человека. Создание такого лекарственного препарата «с нуля», от молекулы до упаковки на аптечной полке, занимает, по меньшей мере, десять лет. При этом успех предприятия никем не гарантирован: на каждой из стадий разработки и апробации препарата может произойти фатальный провал. Особенно уязвим к подобному негативному сценарию этап клинических исследований. Если говорить о нынешней пандемии, то через десять лет населению планеты будет, вероятнее всего, будет доступен ряд безопасных и эффективных вакцин. Следовательно, острая необходимость в больших партиях лекарства отпадёт, и затраты на его разработку рискуют не окупиться.
Можно пойти другим путём: выбрать уже представленный на рынке лекарственный препарат и исследовать его эффективность в лечении новой болезни. Например, перечень предлагаемых и рекомендуемых Всемирной организацией здравоохранения (ВОЗ) международных непатентованных наименований содержит порядка 10 000 позиций — есть из чего выбирать!
Исследования новых терапевтических свойств уже известных фармацевтических препаратов проводятся постоянно и повсеместно. Иногда они приводят к удивительным открытиям, впоследствии спасающим множество человеческих жизней.
Всем известный препарат ацетилсалициловой кислоты под торговым наименованием «Аспирин» был зарегистрирован компанией Bayer в 1899 году как альтернатива салицилату натрия с меньшим количеством побочных эффектов при лечении ревматизма (рис. 1) [1]. Сегодня, спустя 120 лет с начала массового использования ацетилсалициловой кислоты в медицине, спектр её применения невероятно расширился. Ацетилсалициловая кислота входит в список важнейших лекарственных средств ВОЗ. Эта организация рекомендует использовать ацетилсалициловую кислоту при лечении: лёгкой и умеренной боли, острой мигрени, преходящих скелетно-мышечных болей, дисменореи, для снижения температуры, а также при остром инфаркте миокарда и ишемическом инсульте. Судьба другого детища компании Bayer, сверстника аспирина, диацетилморфина, была, напротив, трагичной. Компания Bayer продавала диацетилморфин с 1898 по 1910 год в качестве средства подавления кашля под наименованием «Героин», который ныне вовсе не используется в качестве лекарственного средства из-за быстро развивающейся физической и психической зависимости (рис. 1).

Рисунок 1. Два препарата от Bayer, Аспирин (слева) и Героин (справа), 1899 год.
История фармакологии знает немало примеров, когда существующие препараты буквально обретали «новую жизнь» после обнаружения их ранее неизвестных терапевтических свойств. Например, зидовудин, нуклеозидный ингибитор обратной транскриптазы вируса иммунодефицита человека (ВИЧ), был создан в качестве противоракового агента. И лишь спустя 20 лет обнаружили, что он блокирует репликацию ВИЧ-1. Силденафил («Виагра») изначально был синтезирован как средство для улучшения кровоснабжения миокарда при лечении стенокардии и ишемической болезни сердца. Метформин, описанный почти 100 лет назад как сахароснижающее средство, «воскрес» только в конце прошлого века, став одним из самых популярных препаратов при лечении сахарного диабета II типа [2]. Сейчас активно исследуют его недавно обнаруженные геропротекторные свойства [3].
Иногда на помощь могут прийти и рецепты из народной медицины. Блестящим примером служат работы китайской исследовательницы Юю Ту (Youyou Tu), специалиста в области традиционной китайской медицины, команда которой в 1971 году менее чем за год провела скрининг более 100 однокомпонентных и комбинированных экстрактов травяных сборов. Они обнаружили, что экстракт полыни однолетней (Artemisia annua) обладает 95–100% эффективностью против малярии в моделях на мышах и обезьянах (рис. 2) [4]. Годом позже было выделено действующее вещество артемизинин, которое впоследствии помогло спасти миллионы человеческих жизней. В 2015 году Юю Ту была присуждена Нобелевская премия по физиологии или медицине за её открытия, касающиеся новой терапии против малярии [5].

Рисунок 2. Полынь однолетняя и Юю Ту.
Примечательно, что у артемизинина и его производных обнаружили также и противораковую активность; сейчас на эту тему уже проводят клинические исследования [6]. Предвосхищая следующий вопрос читателя, отвечу: да, его производные уже попробовали использовать против SARS-CoV-2, и результаты исследований in vitro говорят, что «перспективы светлые» [7], [8]. Совсем недавно даже была опубликована работа по влиянию двухкомпонентного препарата, содержащего артемизинин, на течение COVID-19 у людей [9]. Результаты обнадёживают, хотя само исследование проведено на низком с точки зрения доказательной медицины уровне: небольшая выборка (23 против 18 пациентов в контрольной группе, все с подтверждённым диагнозом COVID-19); отсутствовала рандомизация пациентов; исследование было открытым (участники знали, что они принимают).
Необходимо отметить, что ко всем подобным предварительным положительным результатам стоит относиться с весьма сдержанным оптимизмом. Многие из вас, наверное, помнят историю про другой противомалярийный препарат хлорохин и его производное гидроксихлорохин, которые изначально рассматривали в качестве эффективных препаратов для лечения COVID-19. Так, в середине июня Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) отозвало разрешение на их использование при лечении COVID-19. В официальном заявлении причиной указаны данные клинических испытаний, согласно которым хлорохин и его производное гидроксихлорохин не оказывают никакого влияния на смертность или ускорение выздоровления при COVID-19.
Этот и другие описанные примеры ярко демонстрируют, что исследования препаратов не останавливаются после их появления на аптечных прилавках. Сегодня в связи с пандемией во многих лабораториях мира учёные неустанно тестируют сотни старожилов фармрынка на предмет активности против SARS-CoV-2. Не слишком утрируя, можно сказать, что против коронавируса сейчас испытывают чуть больше, чем всё, что в теории может сработать. Поэтому при оценке очередной заявленной эффективности чего-либо стоит в первую очередь обращать внимание на качество проведённых исследований: следование стандартам доказательной медицины в дизайне эксперимента. Одним из старожилов фарминдустрии, который в этой связи сейчас активно исследуется, стал витамин D. О нём и пойдет речь далее.
Краткое досье на «солнечный» витамин
Витамин D включает в себя группу биологически активных жирорастворимых веществ, среди которых наиболее распространены витамин D2 (эргокальциферол) и витамин D3 (холекальциферол). Витамин D2 может поступать в организм человека только с пищей. Например, им богаты грибы, особенно те, что предварительно были выдержаны на солнце [10]. Связано это с тем, что содержащийся в клеточных мембранах грибов эргостерол при воздействии ультрафиолета превращается эргокальциферол. Источниками витамина D3 служат жирные сорта рыбы, такие как макрель, сардина и, в особенности, лосось [10]. В отличие от витамина D2, который может поступать только с пищей, витамин D3 синтезируется в коже под воздействием ультрафиолетового излучения диапазона B (290–315 нм). Свет поглощается 7-дегидрохолестеролом с образованием превитамина D3, который затем самопроизвольно превращается в витамин D3.
Небольшое исследование, проведённое на женщинах в возрасте 55–70 лет, выявило, что именно солнечный свет был их основным источником витамина D. Весна и лето обеспечивали >80% его общего годового потребления (витамин D, как и все жирорастворимые витамины способен накапливаться в организме в жировой ткани и печени) [11]. Авторы, тем не менее, обращают внимание на то, что это соотношение может значительно отличаться в зависимости от региона и рациона конкретной группы людей.
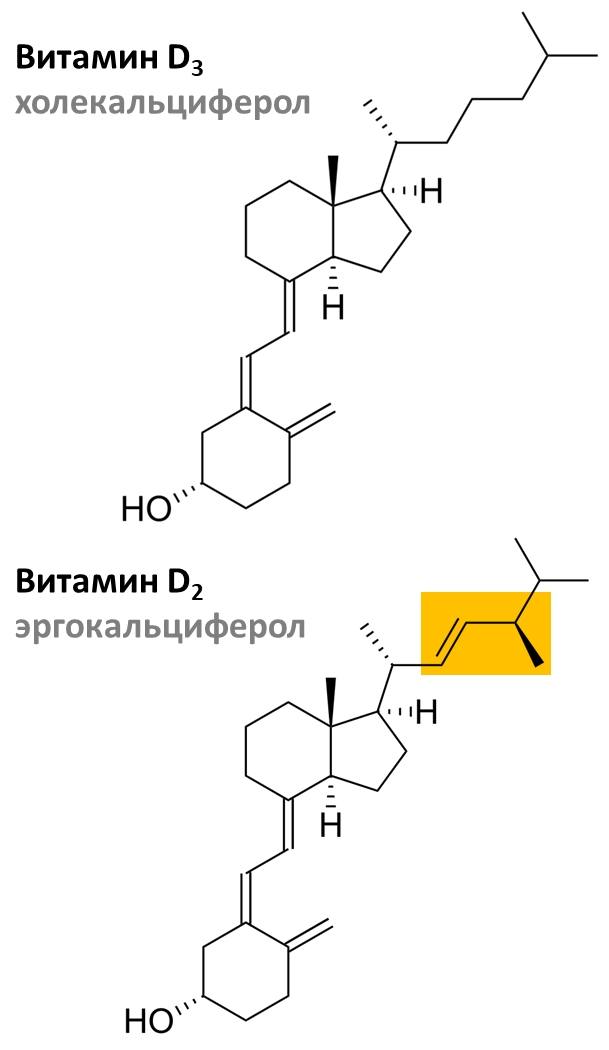
Рисунок 3. Структурные формулы витаминов D3 и D2. Жёлтым показаны отличия в строении холекальциферола от эргокальциферола.
рисунок автора статьи
Химически эргокальциферол и холекальциферол отличаются наличием в молекуле двойной связи между 22 и 23 атомами углерода и метильной группы при 24 атоме углерода (рис. 3). В организме человека оба эти вещества обладают схожей биологической активностью.
Независимо от источника происхождения, оказавшись в кровяном русле, витамин D связывается с витамин D-связывающим белком, а попав в печень, претерпевает гидроксилирование (добавление OH-группы) по 25 атому углерода. Эту реакцию катализирует один из ферментов цитохрома P450 CYP2R1, а на выходе получается 25(OH)D (кальцифедиол) (рис. 4). Именно 25(OH)D является основной циркулирующей в кровотоке формой витамина D, концентрацию которой измеряют для определения статуса человека по витамину D. Кальцифедиолу необходимо ещё одно превращение для перехода в активную форму. Происходит оно преимущественно в клетках почек, где в митохондриях другой фермент цитохрома P450 CYP27B1 присоединяет гидроксильную группу к 1 атому углерода. Биологически активная форма витамина D 1,25(OH)2D (кальцитриол) опосредует его основную функцию: поддержание гомеостаза кальция в организме [10]. В цитоплазме клеток тонкого кишечника кальцитриол взаимодействует со своим рецептором (VDR, vitamin D receptor). Комплекс 1,25(OH)2D–VDR, в свою очередь, уже в ядре образует комплекс с рецептором ретиноевой кислоты X (RXR, Retinoid X receptor) и белком нуклеопорином p62. Комплекс 1,25(OH)2D–VDR–RXR связывается с чувствительными к нему последовательностями ДНК (VDRE) ряда генов, регулируя их экспрессию (рис. 4). Одним из таких генов является ген эпителиального кальциевого канала. Его повышенная экспрессия позволяет большему количеству кальция поступать в клетку, где витамин D-зависимый кальций-связывающий белок кальбиндин опосредует перенос кальция в кровоток [10], [12].
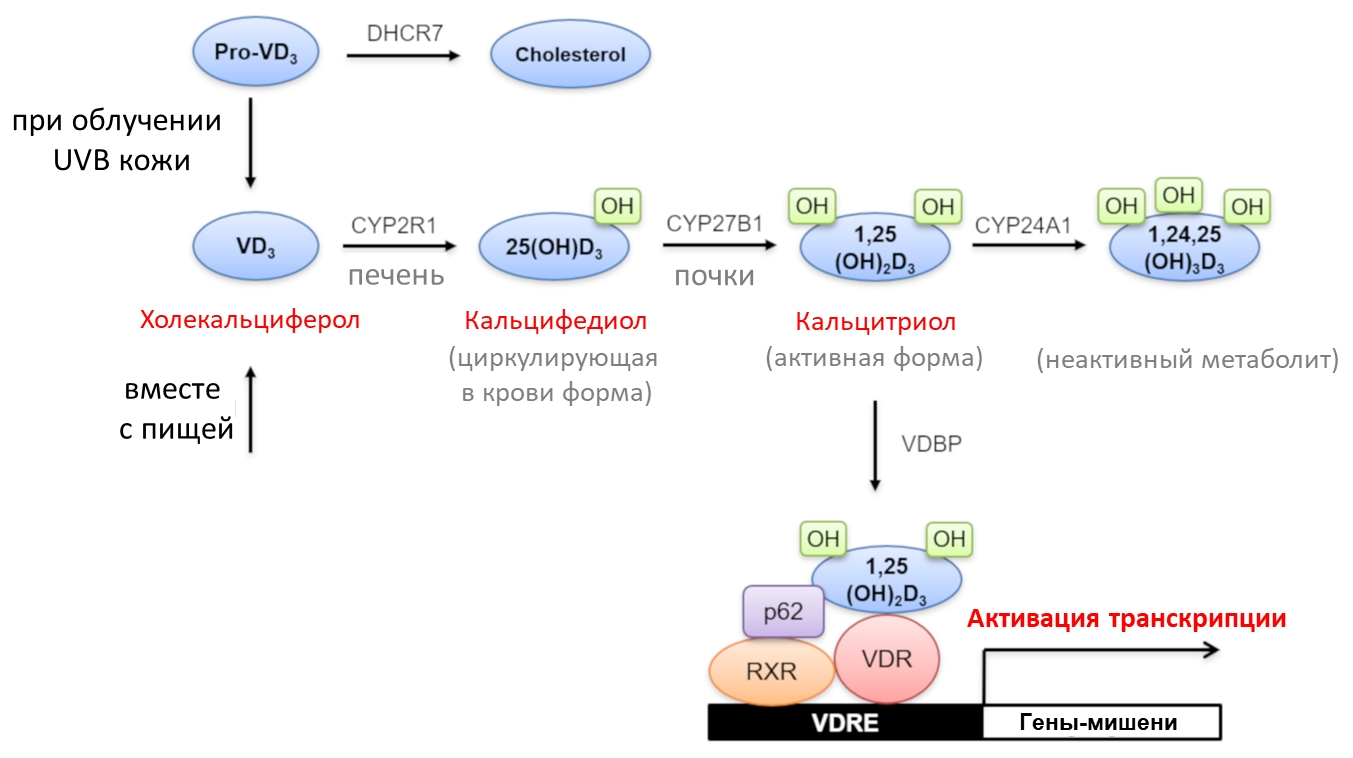
Рисунок 4. Схема синтеза, метаболизма и биологического действия витамина D. VD3 — витамин D3; DHCR7 — 7-дегидрохолестеринредуктаза (DHCR7); UVB — ультрафиолет диапазона B; 25(OH)D3 — 25-гидроксивитамин D3, кальцифедиол; 1,25(OH)2D3 — 1,25-дигидроксивитамин D3, кальцитриол; RXR — рецептор ретиноевой кислоты X; VDR — рецептор витамина D; VDRE — Vitamin D response element, последовательность ДНК в промоторной области гена, регулируемого витамином D; CYP2R1, CYP27B1, CYP24A1 — ферменты цитохрома P450; p62 — нуклеопорин, участвующий в перемещении белков между цитоплазмой и ядром.
адаптировано из [12]
Острый дефицит витамина D в организме прежде всего сказывается на состоянии костей, приводя к развитию рахита у детей и остеомаляции у взрослых (рис. 5). Детский рахит характеризуется задержкой роста, мышечной слабостью, деформацией скелета, гипокальциемией и периодическими судорогами. При остеомаляции наблюдается деминерализация костной ткани, ведущая к деформации костей скелета и, как следствие, частым переломам [10].

Рисунок 5. Рахит у детей, вызванный дефицитом витамина D в организме. Как только ребёнок начинает стоять, давление на нижние конечности приводит либо к внутреннему (genu valgum), либо к внешнему (genu varum) сгибанию большеберцовой и бедренной костей.
Дальнейшие исследования показали, что экспрессия рецепторов витамина D далеко не ограничена клетками тонкого кишечника: они были обнаружены почти во всех тканях организма [13]. Сейчас известно свыше 200 генов, на экспрессию которых может влиять витамин D [14]. Эти факты не могли не навести исследователей на мысль о других, не ограничивающихся поддержанием кальциевого гомеостаза и неизвестных эффектах влияния витамина D на здоровье человека.
Легче ли болеть с витамином D?
Сегодня большинство авторов сходится во мнении, что концентрация кальцифедиола в крови ниже 75 нмоль/л (30 нг/мл) указывает на его дефицит в организме человека, а падение концентрации ниже 25–30 нмоль/л (10–12 нг/мл) чревато серьезным риском развития остеомаляции [15]. К сожалению, во втором десятилетии XXI века острый дефицит витамина D даже в развитых странах далеко не редкость. К примеру, от него страдает каждый десятый европеец, а доля людей с умеренным дефицитом витамина D в странах Европы доходит до 40% [15]. При этом ежедневный приём 1000 МЕ витамина D способен полностью устранить его недостаток в организме [16].
1 МЕ (Международная единица) для витамина D (холе- или эргокальциферола) равняется 25 нг.
С 1920-х годов, когда установили ключевую роль витамина D в предотвращении рахита, интерес исследователей к влиянию витамина на здоровье человека не ослабевает. К настоящему времени накопилось большое количество работ, указывающих на его связь с широким спектром заболеваний, включая болезни сердца и некоторые типы рака. В систематическом обзоре, опубликованном в журнале The Lancet Diabetes & Endocrinology в начале 2014 года, авторы проанализировали 290 проспективных когортных и 172 рандомизированных интервенционных исследований, в которых оценивалось влияние витамина D на показатели здоровья, исключая болезни скелета, у лиц в возрасте 18 лет и старше. Многие проспективные когортные исследования показали связь между низкими концентрациями витамина D в сыворотке крови и широким спектром острых и хронических заболеваний (сердечно-сосудистых, метаболических, инфекционных и даже психических). Однако рандомизированные интервенционные исследования не подтвердили, что повышение концентрации витамина D в крови может изменить вероятность возникновения или клиническое течение этих болезней. Авторы заключили, что связь между недостатком витамина D и нарушениями здоровья, о которых сообщают проспективные когортные исследования, не является причинной, а его низкий уровень в сыворотке крови выступает скорее маркером плохого состояния здоровья. Однако отмечают, что ежедневный приём 20 мкг витамина D пожилыми людьми, по-видимому, несколько снижает смертность от всех причин. Исследователи объясняют это тем, что из-за старения и изменения образа жизни у пожилых людей нарушено восстановление его дефицита, вызванного плохим здоровьем. В связи с этим, добавление низких доз витамина D в рацион приводит к небольшому увеличению выживаемости этой группы людей [17].
Чуть более оптимистичны в своих выводах специалисты Международной некоммерческой организации по изучению эффективности методов лечения при помощи доказательной медицины «Кокрейн» (Cochrane). В том же 2014 году вышел их метаанализ, посвященный влиянию витамина D на смертность среди взрослых людей. Авторы пришли к выводу, что приём витамина D3 снижает смертность от всех причин, и этот эффект наиболее выражен у пожилых людей. В то же время, совместный приём других форм витамина D, кальцифедиола и кальцитриола, не влияет на смертность и даже чреват риском развития гиперкальциемии. Отдельно подчёркивается, что не обнаружено существенной разницы в смертности у людей, принимающих витамин D3 в дозах больших, чем 800 МЕ в день. Не удалось выявить и какое-либо влияние приёма витамина D на смертность среди людей, которые изначально не страдали от дефицита витамина [18].
В 2017 году в другом крупном метаанализе заново проанализировали индивидуальные данные пациентов (IPD) от восьми независимых исследований из Норвегии, Германии, Исландии, Дании и Нидерландов. Особенностью IPD метаанализа является повторная обработка «сырых» данных, полученных непосредственно от исследователей, опубликовавших оригинальные работы. Совокупно заново были проанализированы данные от ~27 000 пациентов, собранные за 10,5 лет наблюдения, в течение которых 6802 пациента скончались. Оказалось, что отношение рисков смерти от всех причин по отношению к группе с минимальной смертностью (концентрация витамина D 75–99,99 нмоль/л) у групп с его концентрациями 40–49,99, 30–39,99 и <30 нмоль/л составляют в среднем 1,15, 1,33 и 1,67, соответственно (рис. 6) [19]. Это означает, что люди, испытывающие острый дефицит витамина D (<30 нмоль/л) умирали в течение времени наблюдения в среднем в 1,67 раза чаще, чем люди из контрольной группы с наименьшим показателем смертности.
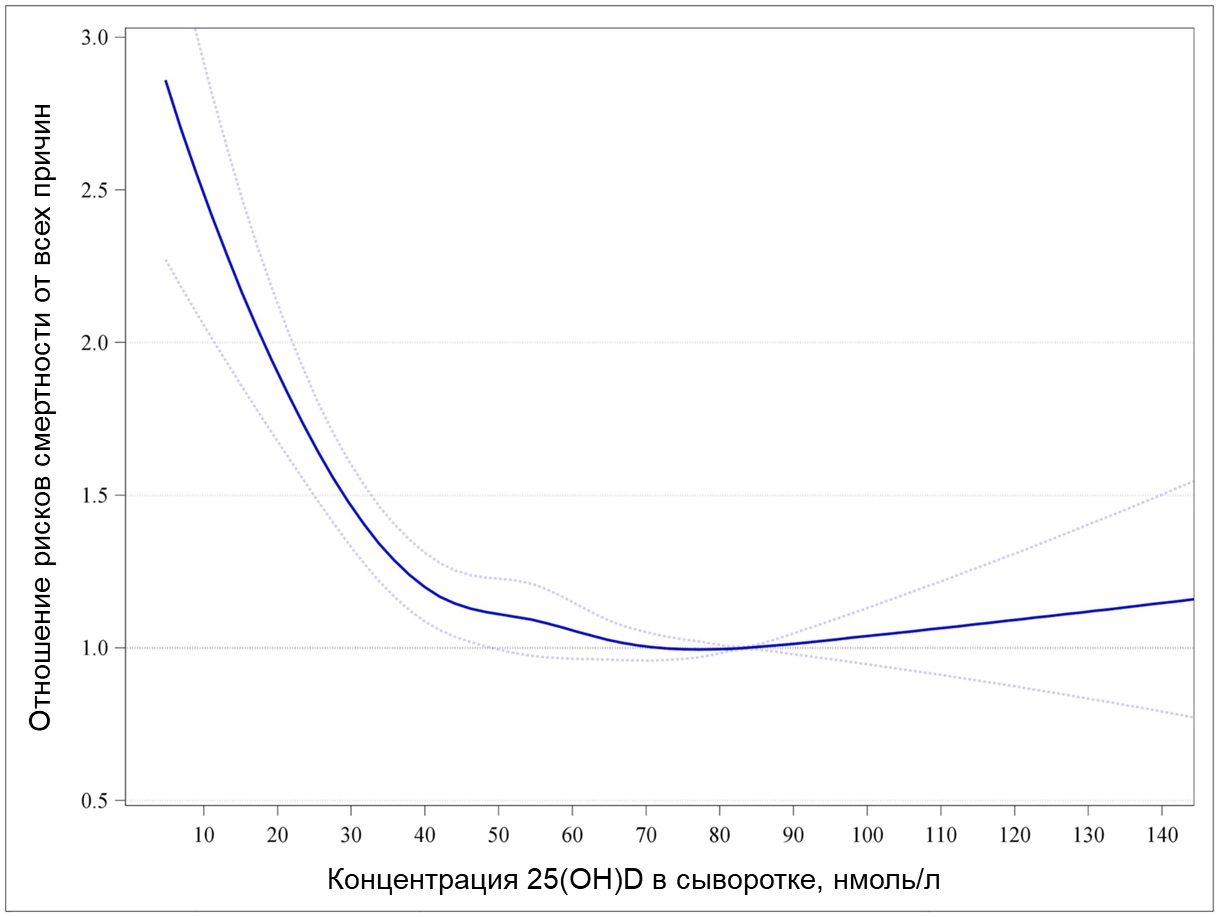
Рисунок 6. Динамика соотношения рисков смерти от всех причин и концентрации 25(OH)D в сыворотке крови. Риски смерти от всех причин (синяя линия с 95% доверительным интервалом) у разных групп соотносятся с контрольной группой с его концентрацией 75–99,99 нмоль/л, в которой наблюдали наименьшую смертность.
адаптировано из [19]
Авторы также отмечают, что, несмотря на ограниченную статистическую возможность оценить связь между витамином D и смертностью у людей с его концентрацией выше 125 нмоль/л, явных указаний на токсичность больших концентраций витамина D в крови выявлено не было [19].
Двумя годами позже, исследуя смертность в течение 10,4 лет и концентрацию витамина D в сыворотке крови у ~10 000 людей из Исландии, Германии и Норвегии, другой коллектив авторов пришел к схожим результатам. Наблюдаемое отношение рисков смерти от всех причин было самым высоким (1,76) у людей с его дефицитом (<30 нмоль/л) по сравнению с контрольной группой [20].
Серьёзным ограничением этих работ является то, что в них проводили только одно измерение концентрации витамина D в один момент времени. Как мы знаем, этот показатель может значительно меняться в зависимости от рациона или уровня солнечной инсоляции. Также, несмотря на высокое качество анализа данных (большие выборки и учёт множества различных факторов, включая возраст, пол, индексы массы тела, сезон забора крови и др.), эти исследования носят корреляционный характер. Мы не можем однозначно утверждать, что низкий уровень витамина D есть причина увеличения смертности. Возможно, существует какой-то фактор X, приводящий к параллельному снижению концентрации витамина D в крови и значительно повышающий шанс умереть. Для выяснения этого необходимы исследования другого рода, а именно интервенционные («исследования с вмешательством»). В таких исследованиях зарегистрированное лекарственное средство используют способом, отличным от описанного в зарегистрированной же инструкции, например, для лечения другого заболевания.
В одном из них (рандомизированном двойном слепом плацебо-контролируемом исследовании) оценивали влияние приёма витамина D3 в дозе 2000 МЕ и 1 г ненасыщенных жирных кислот омега-3 ежедневно на частоту возникновения сердечно-сосудистых заболеваний и рака у мужчин и женщин старше 50 лет в США. Всего в эксперименте участвовало около 26 000 человек. За время наблюдения рак был диагностирован у 1617 участников эксперимента (793 случая в группе витамина D и 824 в группе плацебо), а основное сердечно-сосудистое событие (чаще всего инфаркт миокарда или инсульт) произошло у 805 участников (396 в группе витамина D и 409 в группе плацебо). После статистической обработки результатов авторы заключили, что приём витамина D и омега-3 не снижал частоту возникновения рака или сердечно-сосудистых патологий по сравнению с плацебо. Не было обнаружено статистически значимых различий в смертности между группами от рака молочной железы, рака простаты и колоректального рака, а также от инфаркта миокарда и инсульта [21]. В этом исследовании стоит обратить внимание на одну деталь. Среди ~16 000 участников, давших согласие на забор крови до начала эксперимента, средняя концентрация витамина D в сыворотке была 77 нмоль/л, и только 12,7% участников имели уровни ниже 50 нмоль/л. Таким образом, подавляющее большинство испытуемых не испытывало дефицита по витамину D. А как мы помним из данных другой работы, вероятность смерти от всех причин значительно возрастает лишь при сильном дефиците по витамину D (<30 нмоль/л). Начиная с 40 нмоль/л и выше, эта вероятность практически не изменяется (рис. 6).
Сегодня, в пандемию COVID-19, в ожидании вакцинации люди остро нуждаются в лекарственном препарате, эффективно снижающем тяжесть переносимого заболевания. Внимание исследователей вновь привлек «солнечный» витамин, и интерес к нему разгорелся с новой силой.
Витамин D и COVID-19
Наряду с предполагаемой связью уровня витамина D с онкологическими и сердечно-сосудистыми заболеваниями, была обнаружена его возможная связь с развитием инфекции дыхательных путей. IPD метаанализ 25 рандомизированных контролируемых исследований (около 11 000 участников в возрасте от 0 до 95 лет) выявил, что приём витамина D достоверно снижал риск развития острой инфекции дыхательных путей у всех участников. При этом эффекты витамина D были значительно более выражены у людей с его изначальным дефицитом [22].
COVID-19 также является острым инфекционным респираторным заболеванием. Логичным шагом было бы посмотреть, как течение этой болезни связано со статусом человека по витамину D. Свою роль здесь сыграли и наблюдения — группы с самым высоким риском развития тяжелой формы COVID-19, как правило, соответствуют группам риска острого дефицита витамина D в организме. Здесь речь идёт о пожилых людях, страдающих ожирением и/или гипертонией, сердечно-сосудистыми заболеваниями, диабетом. Также в обе эти группы попадают этнические субпопуляции людей, чья кожа от природы богата меланином, живущие за пределами тропической зоны [23].
Хочу сразу оговорить, что большинство имеющихся данных по витамину D и COVID-19 являются предварительными. Многие работы на сегодняшний день опубликованы без рецензирования в репозиториях препринтов открытого доступа bioRxiv и medRxiv. А те немногие, что были опубликованы в рецензируемых научных журналах, носят ретроспективный и корреляционный характер. Приведу несколько из них.
Корреляционный анализ между средними концентрациями витамина D в крови и количеством случаев COVID-19 (включая случаи со смертельным исходом) в странах Европы выявил отрицательную корреляцию между ними. Такая же картина наблюдалась и для количества смертей, вызванных COVID-19 (рис. 7) [24].
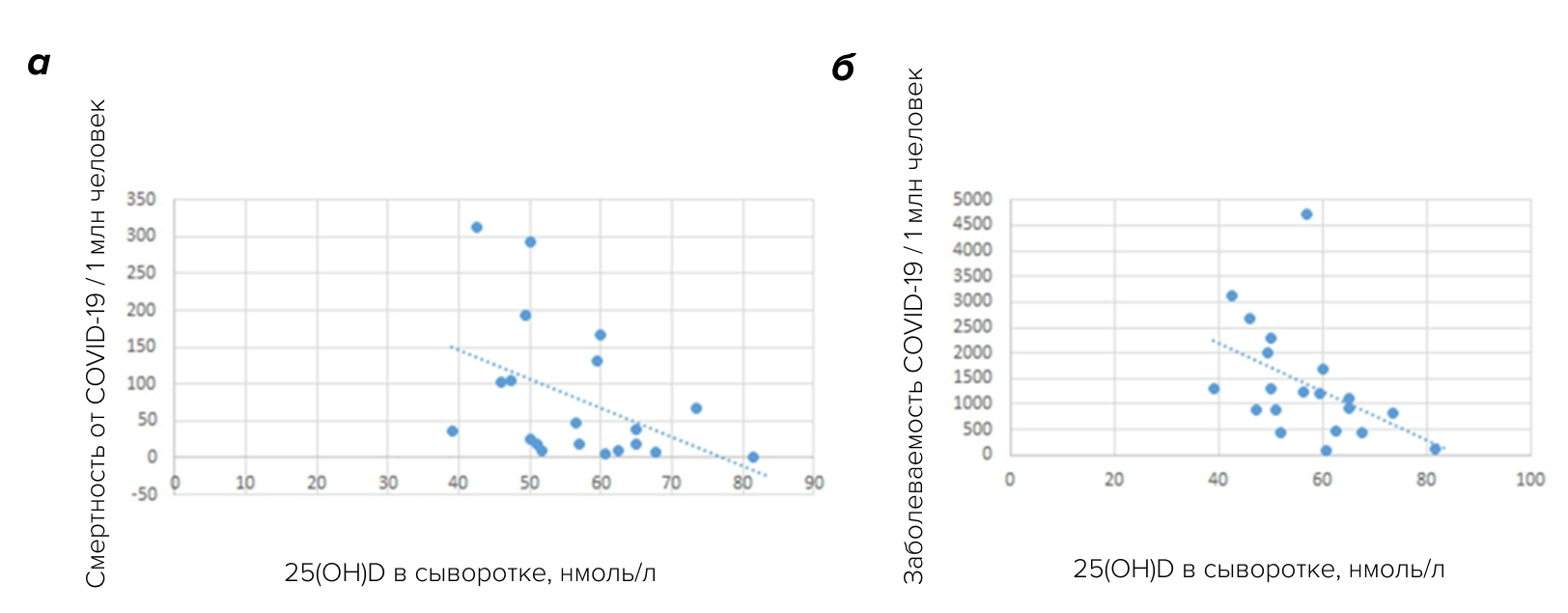
Рисунок 7. Корреляция между смертностью от COVID-19 (а), его выявленными случаями (б) и средним уровнем витамина D (25(OH)D) в сыворотке крови населения каждой страны.
адаптировано из [24]
Авторы честно указывают на ограничения работы: например, количество выявленных случаев заболевания в стране зависит от количества проведённых тестов, равно как и от мер, принимаемых каждой страной для предотвращения распространения инфекции. Кроме того, на оценку смертности от COVID-19 могут сильно влиять различия в медицинских стандартах в разных европейских странах.
В другой небольшой работе, вышедшей в начале сентября, авторы оценивали, связан ли статус по витамину D перед тестированием на COVID-19 с результатами теста [25]. Использовали данные 489 пациентов, у которых имелись результаты измерения уровня витамина D не ранее, чем за год до тестирования на COVID-19. Было выявлено, что 25% участников имели дефицит витамина до тестирования. Среди 172 участников, у которых последнее измерение уровня витамина D показало его дефицит (<20 нг/мл), 19% дали положительный результат на COVID-19. Тогда как совокупно в трёх других группах, недефицитных по витамину D (>20 нг/мл), доля людей с положительным тестом составила 12% (рис. 8). Положительный результат теста также был связан с возрастом старше 50 лет и с тёмным цветом кожи человека.
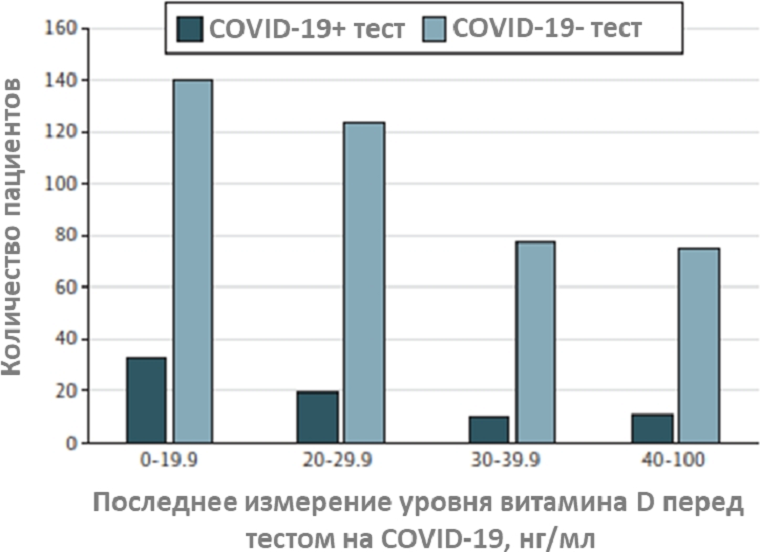
Рисунок 8. Распределение между последним измеренным уровнем витамина D в интервале между 1 годом и 14 днями до тестирования на COVID-19 и результатами теста. По результатам теста на COVID-19 показано меньшее количество пациентов, распределённых по категориям с недефицитными уровнями витамина D (>20 нг/мл) по сравнению с пациентами с его дефицитом (<20 нг/мл).
адаптировано из [25]
В другом исследовании, основанном на анализе данных Британского биобанка для свыше полумиллиона человек, не обнаружено потенциальной связи между концентрацией витамина D и риском заболеть COVID-19. Не выявлено и то, что концентрация витамина может объяснить расовые различия в заболеваемости [26]. Но у этого исследования есть одно серьёзное ограничение: данные по концентрации витамина D в сыворотке были собраны в период с 2006 по 2010 год. Насколько информативны могут быть данные четырнадцатилетней давности? За это время многие из участников могли кардинально изменить свой образ жизни, из-за чего изменилась бы не только концентрация витамина D в крови, но и множество других параметров, потенциально влияющих на заболеваемость COVID-19.
В другой недавней работе также оценили связь между концентрацией витамина D в крови и заболеваемостью COVID-19 в период март-июнь 2020 года у ~190 000 пациентов в США. Авторы обнаружили, что положительный тест на COVID-19 чаще встречался у пациентов с дефицитом витамина D (12,5%), чем у пациентов с адекватными значениями витамина и у тех, чей уровень витамина D был повышен (8,1% и 5,9%, соответственно). На этом основании заключают, что заболеваемость COVID-19 сильно и обратно коррелирует со статусом по витамину D, причём эта взаимосвязь сохраняется вне зависимости от широты, расы, пола и возраста (рис. 9) [27]. Опять же, данные по концентрации витамина D в крови, включённые в исследование, были собраны в интервале 12 месяцев до тестирования на COVID-19.
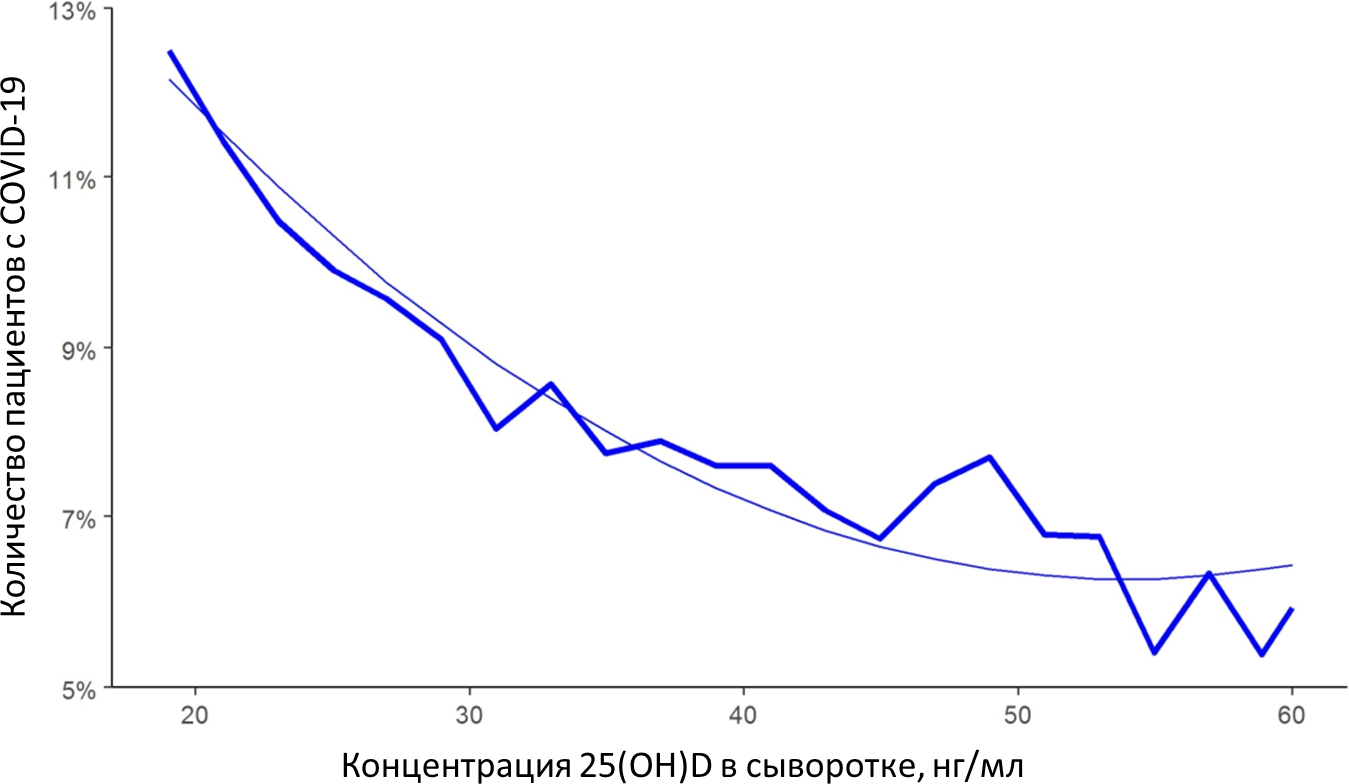
Рисунок 9. Показатели заболеваемости COVID-19 и концентрация 25(OH)D в сыворотке крови. Гладкая линия представляет полином, соответствующий данным по концентрации 25(OH)D (ось х) и количеству положительных случаев COVID-19 (ось y).
адаптировано из [27]
Ознакомившись с этими новыми результатами, у многих, наверное, возникает всё тот же закономерный вопрос: является ли дефицит витамина D одним из факторов развития COVID-19, или же у тяжелобольных людей наблюдается снижение уровня витамина D вследствие общего плохого состояния здоровья? На этот вопрос, к сожалению, нет однозначного ответа. Однако сейчас известны пути активации как врожденной, так и адаптивной иммунной системы, в которых витамин D является ключевым игроком. Ниже будут рассмотрены механизмы, за счёт которых витамин может снижать инфекционную заболеваемость у людей.
Как это может работать: предполагаемые механизмы
В 2006 году было показано, что активация Толл-подобных рецепторов макрофагов человека повышает экспрессию рецептора витамина D и витамин D-1-гидроксилазы (о ней мы говорили выше — именно этот фермент отвечает за образование активной формы витамина D, кальцитриола). Кальцитриол, в свою очередь, запускает экспрессию антимикробного пептида кателицидина, повреждающего мембрану микроба и тем самым уничтожающего его (в этом исследовании использовали возбудителей туберкулёза Mycobacterium tuberculosis) [28]. Толл-подобные рецепторы — это рецепторы плазматической мембраны иммунокомпетентных клеток, распознающие консервативные молекулярные фрагменты бактерий, вирусов, грибов и паразитических простейших и активирующие систему врожденного иммунитета. Ранее было замечено, что у темнокожего населения США повышена восприимчивость к туберкулёзу наряду с пониженной концентрацией витамина D в сыворотке крови. Авторы показали, что добавление к культуре моноцитов (одного из типов иммунных клеток) сыворотки от афроамериканцев в отличие от сыворотки, полученной от европейцев, не приводит к эффективной экспрессии кателицидина. Тогда как внесение в эту сыворотку витамина D извне кратно увеличивало экспрессию моноцитами этого противомикробного пептида (рис. 10).
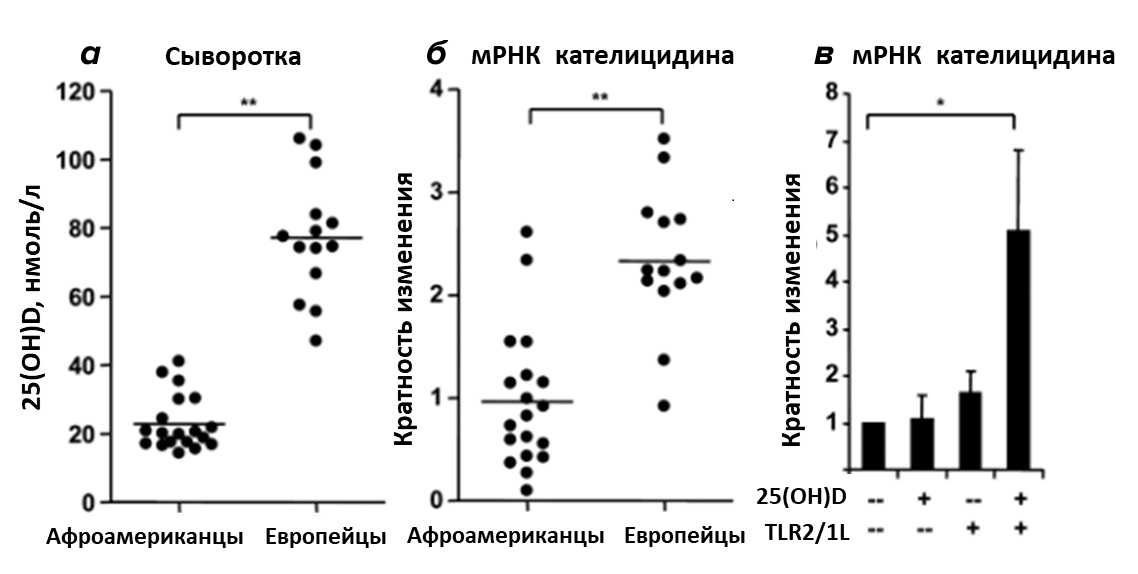
Рисунок 10. Роль витамина D в экспрессии кателицидина.(а) — сывороточная концентрация (нмоль/л) 25(OH)D у афроамериканцев и европейцев. (б) — эффект сыворотки от афроамериканцев или европейцев на экспрессию кателицидина при активации толл-подобных рецепторов TLR2/1L. (в) — влияние на уровень мРНК кателицидина добавления в сыворотку афроамериканцев экзогенного 25(OH)D при активированном и неактивированном TLR2/1L.
адаптировано из [28]
Это были первые результаты, прямо продемонстрировавшие причинно-следственную связь между врождённым иммунитетом и концентрацией витамина D в крови. По-видимому, такой путь иммунной активации ― наше совсем недавнее эволюционное приобретение. Сравнение последовательностей гена кателицидина нескольких млекопитающих выявило, что необходимый для индукции его экспрессии кальцитриолом промотор есть только у человека и шимпанзе и отсутствует в геномах мыши, крысы и собаки [29]. Стоит также отметить, что чувствительность к витамину D ― чрезвычайно гибкий признак в эволюции млекопитающих. Например, летальные дозы в случае передозировки этого витамина для животных разных видов могут отличаться в несколько раз [30].
Также было показано, что в культуре моноцитов и эпителиальных клеток кальцитриол стимулирует экспрессию гена Nod-подобного рецептора типа 2 (nucleotide-binding oligomerization domain containing 2 — другого важного участника обеспечения врождённого иммунитета [31]. NOD2-рецептор связывает бактериальные пептидогликаны, в частности мурамилдипептид, который является составной частью клеточных стенок бактерий. Его активация мурамилдипептидом через транскрипционный фактор NF-kB индуцирует экспрессию гена, кодирующего другой антимикробный пептид β-дефензин 2. Этот пептид, как и кателицидин, нарушает целостность мембраны патогена, приводя к его гибели.
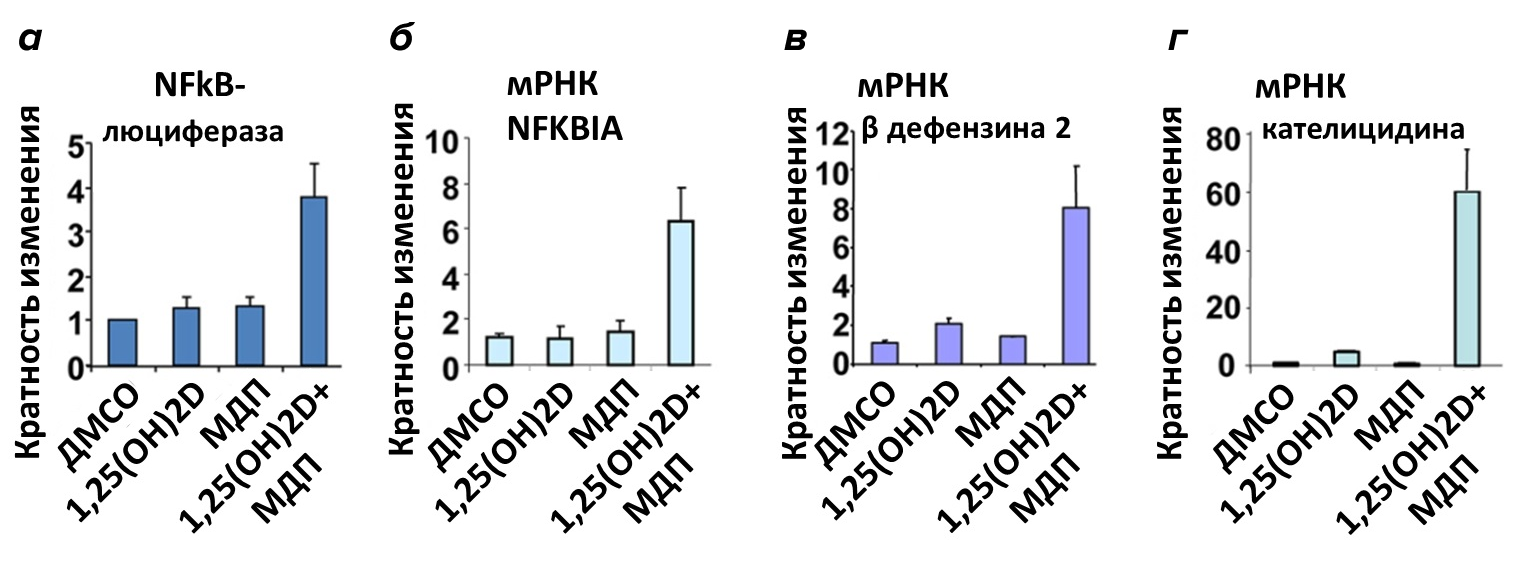
Рисунок 11. Индукция экспрессии антимикробных пептидов кальцитриолом и лигандом NOD2-рецептора мурамилдипептидом в первичной культуре эпителиальных клеток. (а) — индукция экспрессии гена NFkB кальцитриолом (1,25(OH)2D) и мурамилдипептидом (МДП). Клетки трансфицировали плазмидой, несущей гены NFkB и люциферазы, а затем обрабатывали носителем (ДМСО) или кальцитриолом в присутствии МДП или без него. (б) — регуляция экспрессии мишени эндогенного транскрипционного фактора NFkB (NFKBIA) с помощью кальцитриола или МДП отдельно или в комбинации. Индукция экспрессии β-дефензина 2 (в) и кателицидина (г) в культуре эпителиальных клеток человека с помощью кальцитриола или МДП отдельно или в комбинации.
адаптировано из [31]
В 2018 году корейскими исследователями была продемонстрирована способность человеческого β-дефензина 2 стимулировать противовирусный иммунитет при предъявлении S-белка коронавируса, вызывающего ближневосточный респираторный синдром (MERS). Авторы наблюдали увеличение экспрессии в культуре человеческих моноцитов интерферона-β и интерферона-γ, рибонуклеазы L, противовирусных белков MxA и протеинкиназы R, подавляющей трансляцию мРНК в клетке, предотвращая синтез вирусных белков. По их утверждению, β-дефензин 2 может активировать не только врождённый противовирусный иммунный ответ, но и опосредовать индукцию эффективного адаптивного иммунного ответа [32].
Совсем недавно была предложена схема, описывающая влияние витамина D на активацию противовирусной защиты макрофага за счёт стимуляции аутофагии (рис. 12) [33] Аутофагия, буквально самопоедание, ― активный процесс уничтожения крупных молекулярных комплексов и даже целых органелл, вышедших из строя. Этот мусороуборочной механизм также является мощным средством борьбы клетки с проникшими в нее вирусами. Вирусы, взаимодействуя с мембранными толл-подобными рецепторами, усиливают экспрессию уже известных нам гидроксилазы CYP27B1 и рецептора витамина D. Связавшись со своим рецептором, кальцитриол опосредует подавление пути mTOR, мощного ингибитора аутофагии, а также стимулирует ключевых участников её активации. Наряду с этими процессами в клетке возрастают концентрации ионов Ca2+ и и NO, что, в свою очередь, дополнительно стимулирует аутофагию [33]. Помимо непосредственной регуляции путей, связанных с индукцией аутофагии, витамин D также стимулирует экспрессию антимикробных пептидов β-дефензина 2 и кателицидина, о которых говорилось выше.
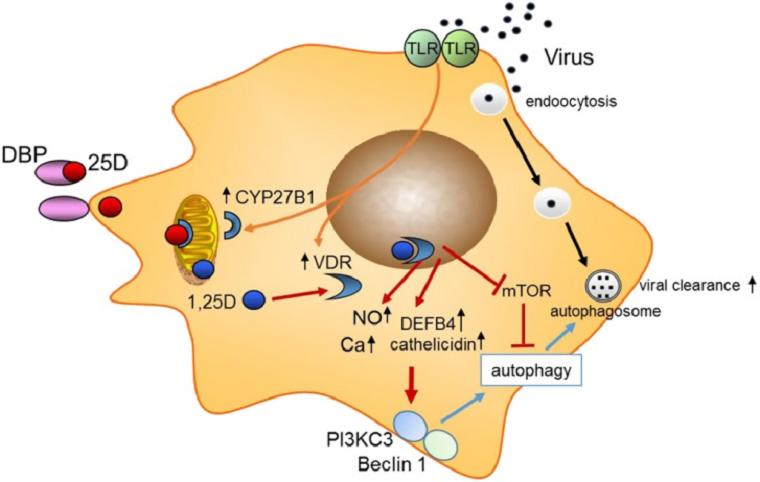
Рисунок 12. Аутофагия и противовирусное действие витамина D. Схема возможных ответов макрофагов на вирусную инфекцию. Активация толл-подобных рецепторов (TLR) индуцирует экспрессию гидроксилазы CYP27B1 и рецептора витамина D (VDR). 25-гидроксивитамин D (25D) в сыворотке крови, связанный с витамин D-связывающим белком (DBP) поступает в макрофаг, где преобразуется в кальцитриол (1,25D), который, в свою очередь, связывается со своим рецептором (VDR). Эффекты кальцитриола (показаны красными стрелками) включают в себя индукцию кателицидина и β-дефензина 2 (DEFB4), увеличение концентрации оксида азота (NO и внутриклеточного кальция (Ca), ингибирование пути mTOR и стимуляцию аутофагии за счёт активации беклина-1 (Beclin 1) и фосфоинозитид-3-киназы классa 3 (PI3KC3).
Была продемонстрирована роль витамина D и в адаптивном иммунитете. Известно, что рецепторы витамина D не экспрессируются в наивных (не имевших контакта с антигеном) Т-клетках человека. Однако они начинали экспрессироваться после стимуляции Т-клеточного рецептора, распознающего антиген. Витамин D, связавшись со своим рецептором, запускал каскад реакций, приводящих в итоге к активации Т-клеток. Исследователи установили, что хронический дефицит витамина D влияет на их пролиферативную способность. Т-клетки, изолированные от людей с его низкими концентрациями в сыворотке крови, имели сниженную способность к пролиферации после знакомства с антигеном, по сравнению с Т-клетками от людей с нормальной его концентрацией. Наблюдаемое нарушение Т-клеточного ответа исчезало при добавлении в культуральную среду витамина D извне [34].
Авторы предположили эволюционное преимущество такого альтернативного витамин D-зависимого пути активации Т-клеток для человека. Она занимает около двух суток после предъявления антигена. Эта задержка может дать врождённому иммунитету возможность быстро справиться с инфекцией. Если это удается, то начало деления Т-клеток происходит в относительно невоспалительной микросреде с небольшим количеством антигена и продолжается в ограниченной степени. Если же врождённая иммунная система не справляется с инфекцией, то деление Т-клеток происходит в провоспалительном микроокружении с большим количеством антигена. Пролиферативный ответ Т-клеток в этом случае будет гораздо сильнее. Известно, что Т-клетки способны к взрывному делению, а эта задержка их созревания, связанная с активацией рецептора витамина D, может снизить риск нежелательной иммунопатологии, «придержав коней иммунитета» [34].
Как мы убедились, витамин D напрямую влияет как на врождённый, так и на адаптивный иммунные ответы. По всей вероятности, эти механизмы и опосредуют возможное влияние его острого дефицита на смертность от инфекционных заболеваний, в частности, у пожилых людей. Следуя этой логике, адекватная концентрация витамина в крови является одним из факторов, определяющим баланс между двумя системами, когда с одной стороны происходит эффективное уничтожение патогена, а с другой — не развивается фатальная гиперактивация иммунной системы, печально известный цитокиновый шторм.
Заключение
В заключении мне хотелось бы ещё раз подчеркнуть, что витамин D, конечно, не панацея. По-видимому, его приём оказывает положительный эффект только в случае его острого дефицита, преимущественно в пожилом возрасте. Необходимы дальнейшие крупномасштабные исследования для установления причинно-следственных отношений дефицита витамина и развития/течения разных заболеваний (исключая детский рахит и остеомаляцию у взрослых людей, где его непосредственная роль доказана). В недалёком будущем, я надеюсь, мы получим однозначный ответ на вопрос: влияет ли дефицит витамина D на заболеваемость, в частности COVID-19? Если он окажется утвердительным, то среди прочих факторов (возраст более 65 лет, избыточная масса тела, сахарный диабет и др.) дефицит витамина будет тем фактором, который легко поддаётся быстрой коррекции. Пока же однозначного ответа у нас нет. Но даже сегодня, если вы входите в группу риска развития острого дефицита витамина D, это существенный повод для коррекции пищевых привычек, включая добавление препаратов витамина D в рацион, а также времени, проводимого на свежем воздухе. Эволюционно наши метаболические пути складывались в совершенно других условиях, нежели нынешние. Древние люди имели другой рацион, уровень инсоляции кожи и другую физическую активность. Наверное, для сохранения собственного здоровья в современном мире с этим нашим эволюционным прошлым необходимо считаться.
Литература
- W. Sneader. (2000). The discovery of aspirin: a reappraisal. BMJ. 321, 1591-1594;
- Jonathan M. Spector, Rosemary S. Harrison, Mark C. Fishman. (2018). Fundamental science behind today’s important medicines. Sci. Transl. Med.. 10, eaaq1787;
- Veronika Piskovatska, Nadiya Stefanyshyn, Kenneth B. Storey, Alexander M. Vaiserman, Oleh Lushchak. (2019). Metformin as a geroprotector: experimental and clinical evidence. Biogerontology. 20, 33-48;
- Youyou Tu. (2016). Artemisinin-A Gift from Traditional Chinese Medicine to the World (Nobel Lecture). Angew. Chem. Int. Ed.. 55, 10210-10226;
- Названы лауреаты Нобелевской премии-2015 по физиологии и медицине;
- Thomas Efferth. (2017). From ancient herb to modern drug: Artemisia annua and artemisinin for cancer therapy. Seminars in Cancer Biology. 46, 65-83;
- Mathieu Gendrot, Isabelle Duflot, Manon Boxberger, Océane Delandre, Priscilla Jardot, et. al.. (2020). Antimalarial artemisinin-based combination therapies (ACT) and COVID-19 in Africa: In vitro inhibition of SARS-CoV-2 replication by mefloquine-artesunate. International Journal of Infectious Diseases. 99, 437-440;
- Ruiyuan Cao, Hengrui Hu, Yufeng Li, Xi Wang, Mingyue Xu, et. al.. (2020). Anti-SARS-CoV-2 Potential of Artemisinins In Vitro. ACS Infect. Dis.. 6, 2524-2531;
- Guoming Li, Mei Yuan, Haihong Li, Changsheng Deng, Qi Wang, et. al.. (2021). Safety and efficacy of artemisinin-piperaquine for treatment of COVID-19: an open-label, non-randomised and controlled trial. International Journal of Antimicrobial Agents. 57, 106216;
- M. F. Holick. (2006). Resurrection of vitamin D deficiency and rickets. Journal of Clinical Investigation. 116, 2062-2072;
- H. M. Macdonald, A. Mavroeidi, W. D. Fraser, A. L. Darling, A. J. Black, et. al.. (2011). Sunlight and dietary contributions to the seasonal vitamin D status of cohorts of healthy postmenopausal women living at northerly latitudes: a major cause for concern?. Osteoporos Int. 22, 2461-2472;
- Choongho Lee. (2020). Controversial Effects of Vitamin D and Related Genes on Viral Infections, Pathogenesis, and Treatment Outcomes. Nutrients. 12, 962;
- Stefan Pilz, Armin Zittermann, Christian Trummer, Verena Theiler-Schwetz, Elisabeth Lerchbaum, et. al.. (2019). Vitamin D testing and treatment: a narrative review of current evidence. Endocrine Connections. 8, R27-R43;
- P. Bergman. (2021). The link between vitamin D and COVID‐19: distinguishing facts from fiction. J. Intern. Med.. 289, 131-133;
- Karin Amrein, Mario Scherkl, Magdalena Hoffmann, Stefan Neuwersch-Sommeregger, Markus Köstenberger, et. al.. (2020). Vitamin D deficiency 2.0: an update on the current status worldwide. Eur J Clin Nutr. 74, 1498-1513;
- Kevin Cashman, Christian Ritz, Mairead Kiely, ODIN Collaborators. (2017). Improved Dietary Guidelines for Vitamin D: Application of Individual Participant Data (IPD)-Level Meta-Regression Analyses. Nutrients. 9, 469;
- Philippe Autier, Mathieu Boniol, Cécile Pizot, Patrick Mullie. (2014). Vitamin D status and ill health: a systematic review. The Lancet Diabetes & Endocrinology. 2, 76-89;
- Goran Bjelakovic, Lise Lotte Gluud, Dimitrinka Nikolova, Kate Whitfield, Jørn Wetterslev, et. al.. (2014). Vitamin D supplementation for prevention of mortality in adults. Cochrane Database of Systematic Reviews;
- Martin Gaksch, Rolf Jorde, Guri Grimnes, Ragnar Joakimsen, Henrik Schirmer, et. al.. (2017). Vitamin D and mortality: Individual participant data meta-analysis of standardized 25-hydroxyvitamin D in 26916 individuals from a European consortium. PLoS ONE. 12, e0170791;
- Thor Aspelund, Martin R. Grübler, Albert V. Smith, Elias F. Gudmundsson, Martin Keppel, et. al.. (2019). Effect of Genetically Low 25-Hydroxyvitamin D on Mortality Risk: Mendelian Randomization Analysis in 3 Large European Cohorts. Nutrients. 11, 74;
- JoAnn E. Manson, Nancy R. Cook, I-Min Lee, William Christen, Shari S. Bassuk, et. al.. (2019). Vitamin D Supplements and Prevention of Cancer and Cardiovascular Disease. N Engl J Med. 380, 33-44;
- Adrian R Martineau, David A Jolliffe, Richard L Hooper, Lauren Greenberg, John F Aloia, et. al.. (2017). Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. i6583;
- Linda L. Benskin. (2020). A Basic Review of the Preliminary Evidence That COVID-19 Risk and Severity Is Increased in Vitamin D Deficiency. Front. Public Health. 8;
- Petre Cristian Ilie, Simina Stefanescu, Lee Smith. (2020). The role of vitamin D in the prevention of coronavirus disease 2019 infection and mortality. Aging Clin Exp Res. 32, 1195-1198;
- David O. Meltzer, Thomas J. Best, Hui Zhang, Tamara Vokes, Vineet Arora, Julian Solway. (2020). Association of Vitamin D Status and Other Clinical Characteristics With COVID-19 Test Results. JAMA Netw Open. 3, e2019722;
- Claire E. Hastie, Daniel F. Mackay, Frederick Ho, Carlos A. Celis-Morales, Srinivasa Vittal Katikireddi, et. al.. (2020). Vitamin D concentrations and COVID-19 infection in UK Biobank. Diabetes & Metabolic Syndrome: Clinical Research & Reviews. 14, 561-565;
- Harvey W. Kaufman, Justin K. Niles, Martin H. Kroll, Caixia Bi, Michael F. Holick. (2020). SARS-CoV-2 positivity rates associated with circulating 25-hydroxyvitamin D levels. PLoS ONE. 15, e0239252;
- P. T. Liu. (2006). Toll-Like Receptor Triggering of a Vitamin D-Mediated Human Antimicrobial Response. Science. 311, 1770-1773;
- Adrian F. Gombart, Niels Borregaard, H. Phillip Koeffler. (2005). Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up‐regulated in myeloid cells by 1,25‐dihydroxyvitamin D 3. FASEB j.. 19, 1067-1077;
- Сколько можно съесть мышиного яду? Очерк о витамине D;
- Tian-Tian Wang, Basel Dabbas, David Laperriere, Ari J. Bitton, Hafid Soualhine, et. al.. (2010). Direct and Indirect Induction by 1,25-Dihydroxyvitamin D3 of the NOD2/CARD15-Defensin β2 Innate Immune Pathway Defective in Crohn Disease. Journal of Biological Chemistry. 285, 2227-2231;
- Ju Kim, Ye Lin Yang, Sun-Hee Jang, Yong-Suk Jang. (2018). Human β-defensin 2 plays a regulatory role in innate antiviral immunity and is capable of potentiating the induction of antigen-specific immunity. Virol J. 15;
- John P Bilezikian, Daniel Bikle, Martin Hewison, Marise Lazaretti-Castro, Anna Maria Formenti, et. al.. (2020). MECHANISMS IN ENDOCRINOLOGY: Vitamin D and COVID-19. European Journal of Endocrinology. 183, R133-R147;
- Marina Rode von Essen, Martin Kongsbak, Peter Schjerling, Klaus Olgaard, Niels Ødum, Carsten Geisler. (2010). Vitamin D controls T cell antigen receptor signaling and activation of human T cells. Nat Immunol. 11, 344-349.







