
Спасайся кто может!
29 октября 2019
Спасайся кто может!
- 1301
- 0
- 2
коллаж автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Мир прокариот жесток и беспощаден. Чтобы выжить, им приходится постоянно адаптироваться к изменяющимся условиям и находить новые способы защиты. Поэтому эволюция этих удивительных созданий представляет собой непрекращающуюся гонку вооружений за мир и процветание против огромнейшего разнообразия генетических врагов. Но, как мы знаем, всё гениальное просто, и зачастую не нужно копать (и капать) глубоко и долго, чтобы найти эффективный метод расправы над врагом.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Сколтех» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Системы РНК/ДНК-интерференции на страже здоровья и благополучия прокариот
Значительная часть генов у бактерий и архей кодирует системы защиты от чужеродного вторжения. Эти механизмы следуют различным алгоритмам, включая стратегии врожденного и адаптивного иммунитета. Одной из таких стратегий является врожденный механизм защиты, основанный на белках-аргонавтах и носящий гордое название «РНК/ДНК-интерференция». Основополагающим принципом этого процесса является комплементарность между молекулами нуклеиновых кислот: направляющие РНК или ДНК в комплексе с белками-аргонавтами распознают геном врага и запускают его инактивацию.
Об РНК-интерференции эукариот подробно написано в статье «Биомолекулы» «Обо всех РНК на свете, больших и малых» [1]. Сам процесс изначально был показан для эукариотических организмов, но не так давно у прокариот также обнаружили аргонавтов, принимающие участие в защите хозяина. Отношения между прокариотическими и эукариотическими защитными механизмами сложны и сочетают гомологию с функциональной аналогией [2]. Так, архейный механизм РНК-интерференции является прямым предком эукариотического, хотя последний и приобрел множество дополнительных компонентов. Однако до сих пор остается открытым вопрос о генетической памяти таких прокариотических систем, то есть передается ли информация о генетических мишенях по наследству аналогично системам CRISPR/Cas?
Аргонавты — ключевые участники игры
Белки Argonaute изначально были идентифицированы как необходимые факторы в развитии Arabisopsis thaliana [3]. Название дали им из-за необычной внешности растения-мутанта арабидопсиса AGO1, свернувшиеся листья которого по форме напоминали щупальца кальмара (рис. 1а). Ген AGO и соответствующий белок получили название в честь моллюска-аргонавта осьминога Argonauta argo (рис. 1б). Это семейство белков действительно «доставило Золотое Руно» современной науке: позже выяснилось, что белок eAgo является ключевым игроком в путях эукариотической интерференции РНК. Первой функцией Ago, охарактеризованной на молекулярном уровне, была роль «слайсера», то есть РНКазы, которая расщепляет основную РНК-мишень в паре с малой интерферирующей РНК (миРНК). Вскоре после этого установили, что Argonaute в комплексе с микроРНК обратимо подавляют трансляцию мРНК-мишеней, не расщепляя их.
Эти белки распространены повсеместно: они кодируются генами большинства эукариот, а также присутствуют у многих бактерий и архей; их последовательности очень схожи у различных таксонов, что говорит об их древнем происхождении и высокой степени консервативности в эволюции [4]. Число генов Argonaute, обнаруженных у различных видов, варьирует. Некоторые эукариоты совсем не имеют аргонавтов (Saccharomyces cerevisiae), что скорее всего объясняется вторичной утратой системы РНК-интерференции, в то время как другие организмы счастливо обладают более чем двумя десятками этих белков (27 у Caenorhabditis elegans). Как правило, гены Argonaute в организме специализированы и имеют непересекающиеся функции.
На основе состава аминокислотных последовательностей, особенностей структуры и механизмов действия эукариотические аргонавты можно разделить на четыре основные группы (табл. 1), основное биохимическое различие между которыми заключается в способах приобретения направляющих РНК [4].
| Семейство Trypanosoma Ago | Типичное для Trypanosoma brucei, у которого направляющие двухцепочечные (дцРНК) синтезируются как с ретротранспозонов, так и с тандемных единиц хромосомы. |
| Семейство WAGO (worm specific AGO, или вторичные аргонавты, так как для своей загрузки они требуют помощи других аргонавтов) | Типичное для нематод, в частности, Caenorhabditis elegans. Эти аргонавты получают направляющие РНК путем опосредованного белком Dicer расщепления экзогенных и эндогенных длинных дцРНК. |
| Семейство PIWI (названное в честь белка дрозофилы PIWI, P-element induced wimpy testis) | Типичные для Drosophila melanogaster аргонавты, которые регулируют активность транспозонов, используя пиРНК (piwi-interacting RNA). Аргонавты семейства PIWI есть только у животных. Считается, что они формируют направляющие РНК по механизму «пинг-понг», при котором целевая РНК одного белка Piwi расщепляется и становится направляющей РНК другого белка Piwi. |
| Семейство Agos | Типичное для Arabidopsis thaliana, является самой многочисленной группой. AGO-белки взаимодействуют с микроРНК или миРНК, которые процессируются ферментами Dicer и Drosha. Именно с работой этих белков и связана классическая РНК-интерференция (направленное подавление активности генов с помощью экзогенной двуцепочечной РНК). |
Несмотря на разнообразие в аминокислотной последовательности и физиологических функциях, эукариотические аргонавты имеют очень консервативную структуру. Она представлена четырьмя доменами: N-концевым, PAZ (PIWI-Argonaute-Zwille), MID (средним) и PIWI [5], [6].
N-концевой домен
Принимает участие в расплетании гидового дуплекса, играет вспомогательную роль в разрезании мишеней и способствует диссоциации расщепленных нитей.
PAZ-домен
Связывает 3′-конец гида путем взаимодействия с основной цепью нуклеотидов. Это взаимодействие не является существенным для стабилизации направляющей нити, но защищает ее от деградации.
MID-домен
Образует специальный карман, в котором происходит связывание 5′-концевого нуклеотида направляющей цепи. Некоторые аргонавты распознают специфические 5′-концевые основания, используя структурный признак, называемый петлей нуклеотидной специфичности.
PIWI-домен
Содержит в себе активный центр, подобный РНКазе H по структуре, благодаря которому происходит разрезание мишени, комплементарной гиду. Каталитический центр содержит необходимую для работы тетраду аминокислот (Asp-Glu-Asp-His/Asp, DEDH/D), которая координирует два иона магния. Аргонавты, имеющие дефектную тетраду, не обладают каталитической активностью и не способны разрезать свои мишени. Тем не менее они могут вызывать «молчание» определенных генов, привлекая дополнительные белки, обладающие нуклеазной активностью (рис. 2).
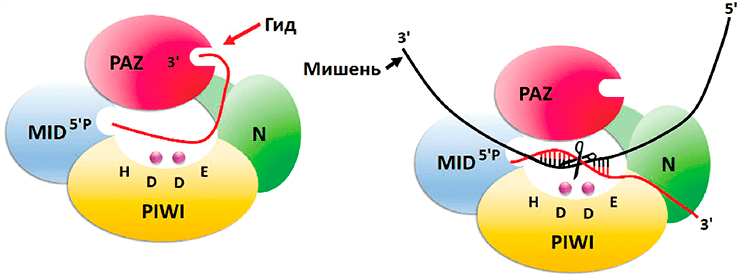
Рисунок 2. Структура и механизм действия белков-аргонавтов. Изображена структура каталитически активного аргонавта, который содержит каталитическую тетраду и два иона магния (показаны сиреневыми сферами) в домене PIWI, в комплексе с гидовой нуклеиновой кислотой (слева) и при связывании с мишенью (справа).
Линкерный участок L1 соединяет домены N и PAZ, а линкер L2 — домены PAZ и MID. Домены N–PAZ и MID–PIWI образуют канал, в котором и происходит связывание нуклеиновых кислот. Аргонавт, загруженный гидовой цепью, может узнавать подходящую мишень и взаимодействовать с ней. Участок между вторым и восьмым нуклеотидами направляющей молекулы называется seed-район и является наиболее важной частью для распознавания и выбора мишени. Комплементарного взаимодействия такой длины достаточно для связывания целевой молекулы с аргонавтом. При последующем формировании протяженных комплементарных взаимодействий между гидом и мишенью происходит высвобождение 3′-конца направляющей цепи из PAZ-домена. Аргонавты могут разрезать целевую молекулу между 10 и 11 нуклеотидами дуплекса, считая от 5′-конца направляющей цепи, а после диссоциируют от мишени [7], [8].
eAgo vs pAgo
Хотя первоначально аргонавты были описаны как специфичные для эукариот (eAgos), вскоре у многих бактерий и архей обнаружили гомологичные белки pAgos. Тем не менее их распространение среди прокариот несколько ограничено: они обнаружены только у трети известных видов архей и лишь у десятой части бактерий. Прокариотические аргонавты обладают значительно бóльшим разнообразием типов и особенностей структуры, а их распределение среди организмов достаточно неравномерно, что свидетельствует о наличии активного горизонтального переноса [4].
Основные функции каждого из четырех доменов эукариотических аргонавтов сохраняются и у прокариот, но сами pAgos часто имеют измененную структуру вследствие потери некоторых доменов. Прокариотические аргонавты делятся на две основные группы в зависимости от наличия или отсутствия домена PAZ: длинные содержат все четыре домена, а короткие — только MID и PIWI — и чаще всего для своей работы требуют ассоциированных нуклеаз [2]. Приблизительно 60% идентифицированных pAgos лишены домена PAZ, при этом меньше трети всех длинных белков содержат в своем активном центре полную каталитическую тетраду, тогда как короткие аргонавты обычно лишены каталитической активности вследствие замены каталитических аминокислотных остатков (рис. 3). Большинство из них образуют единую филогенетическую группу, но часть сформировалась в результате повторных независимых актов потери доменов [9].
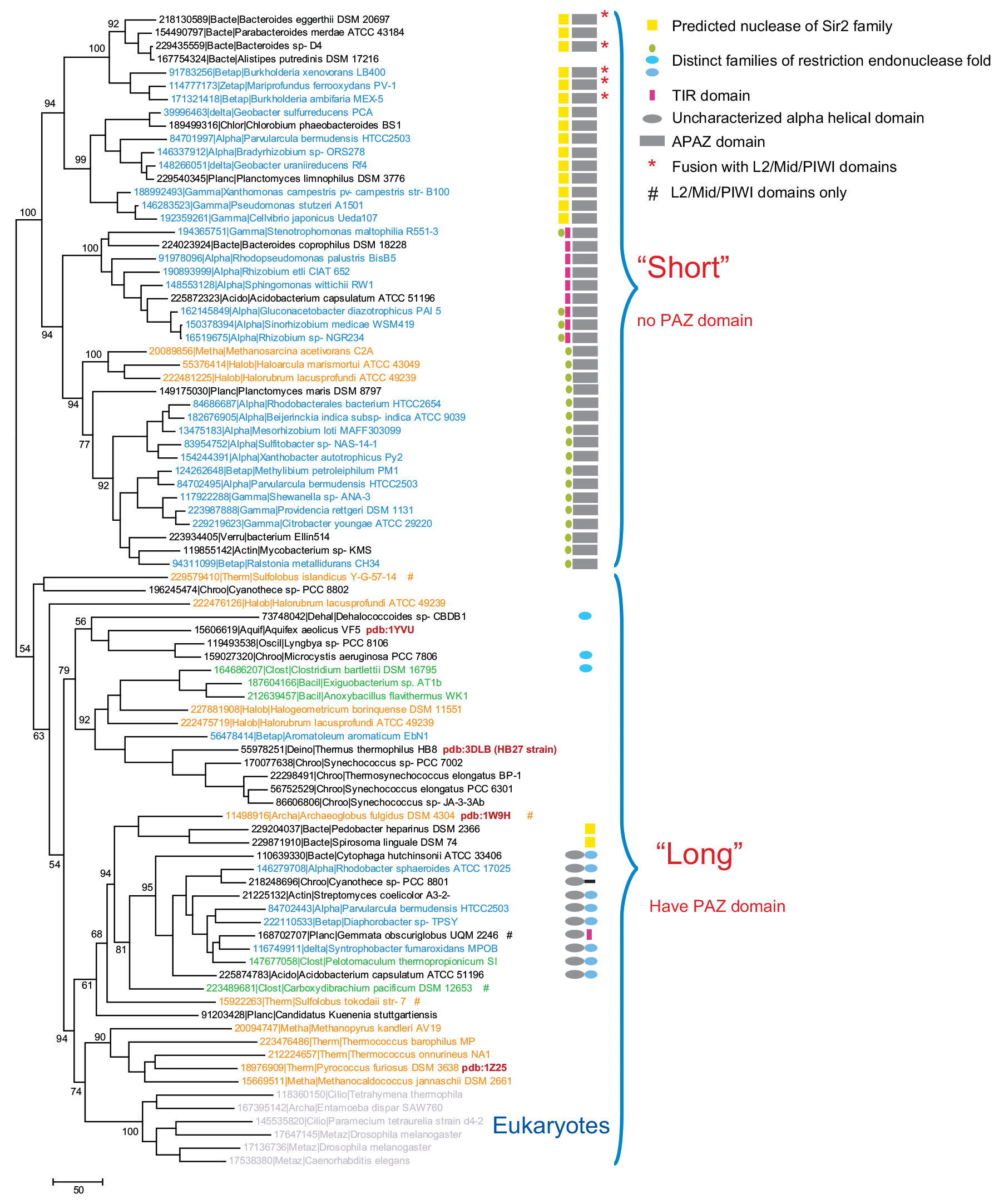
Рисунок 3. Филогенетический анализ PIWI-доменов и организация предсказанных pAgo-оперонов
Помимо этого, прокариотические аргонавты имеют и другие особенности, отличающие их от эукариотических гомологов. Так, целевой молекулой всех охарактеризованных pAgo является ДНК. В то же время генерация коротких производных ДНК путем вырезания их из длинных фрагментов может привести к повреждению геномной ДНК, если этот процесс не будет строго контролироваться и ограничиваться конкретными последовательностями. Отсюда был сделан вывод о существовании дополнительного механизма, который позволяет загруженным комплексам pAgo различать и взаимодействовать именно с чужеродной ДНК, избегая при этом разрезания геномного субстрата самого организма. Внехромосомная природа целевой ДНК, а также высокая скорость ее репликации могут служить особенностями для распознавания правильных мишеней, поскольку реплицирующаяся ДНК обеспечивает легкодоступный одноцепочечный субстрат-мишень для распознавания комплексом аргонавт—гид. Таким образом, для эффективной работы pAgo-центрированной системы защиты требуется как высокий уровень экспрессии генов (для генерации коротких направляющих фрагментов), так и активная репликация ДНК (для обеспечения одноцепочечной ДНК-мишени). Такая комбинация не типична для генов хозяина и позволяет pAgo различать инвазивную ДНК [10].
Многие аргонавты прокариот используют в качестве гида молекулу ДНК, а не РНК, как в классической эукариотической интерференции, за счет того, что их нуклеотидсвязывающий карман MID-домена более гидрофобен. Это свойство характерно, например, для TtpAgo Thermus thermophilus, PfpAgo Pyrococcus furiosus, MjpAgo Methanocalococcus jannaschii. Другие же прокариоты, такие как Rhodobacter sphaeroides (RspAgo) и Marinitoga piezophila (MppAgo), имеют аргонавты, которые, подобно аргонавтам эукариот, используют для своей работы гидовые РНК, но более короткие [10].
Еще одной особенностью прокариотических аргонавтов является участие иона магния в связывании 5′-конца направляющей цепи, тогда как большинство изученных eAgos используют для этого аммониевую группу остатка лизина. Сравнения полученных трехмерных структур аргонавтов говорят о том, что eAgos имеют более широкий канал связывания нуклеиновых кислот. Кроме того, изученные прокариотические аргонавты в отсутствие мишени принимают «выключенную» конформацию, в которой один из остатков каталитической тетрады, находится вне активного центра и попадает туда только после спаривания гида с целевой последовательностью [9], [11].
Анализ геномных окрестностей прокариотических генов AGO выявил, что многие из них встроены в «защитные острова» — районы, обогащенные генами, участвующими в различных защитных механизмах, в том числе нуклеазными и хеликазными. Это свойство особенно характерно для pAgos, утративших каталитическую активность PIWI-домена. Все гены коротких аргонавтов территориально связаны с геном, кодирующим домен APAZ (analog of PAZ, то есть участвующим в связывании направляющей молекулы). Он не имеет сходства последовательности с доменом PAZ и обнаруживается только в контексте с генами, слитыми с нуклеазным доменом [11].
Тяжелая артиллерия
На сегодняшний день изучено не так уж и много прокариотических аргонавтов. Молекулярные механизмы работы большинства из них полностью не охарактеризованы, а физиологические функции многих до конца не определены. Большинство исследований, показывающих роль аргонавтов в защите клеток от чужеродных нуклеиновых кислот, проведены in vitro. К наиболее изученным можно отнести аргонавты pAgos архей Methanocaldococcus jannaschii и Pyrococcus furiosus, бактерий Aquifex aeolicus, а также Rhodobacter sphaeroides и Thermus thermophilus, механизм работы которых исследован in vivo, и определена их роль в защите хозяина.
Thermus thermophilus Argonaute (TtpAgo)
Исследования in vitro белка TtpAgo показали, что в клетках он образует комплекс с короткими фрагментами ДНК длиной 13–25 нуклеотидов, фосфорилированными на 5′-конце, где обычно располагается остаток дезоксицистидина. Эти малые интерферирующие ДНК (миДНК) используются TtpAgo в качестве гида для расщепления мишеней: одноцепочечных (оцДНК) и двуцепочечных ДНК (дцДНК) (причем последних путем независимого надреза двух нитей) и с меньшим успехом — одноцепочечных РНК. Внесение разрывов в двуцепочечную ДНК с наибольшей эффективностью происходит в сайтах, фланкированных АТ-богатыми последовательностями. Первый разрыв приводит к релаксации (и снижению уровня транскрипции), а второй — к линеаризации. В то время как разрезание оцДНК может происходить при температуре ниже 20 °С, расщепление плазмидной дцДНК возможно только при температурах выше 65 °С, что также способствует локальному плавлению дуплекса ДНК. В системе in vivo другие белки, такие как РНК- и ДНК-полимеразы, а также ДНК-хеликазы, могут «оказывать помощь» TtpAgo путем временного разматывания дцДНК [10].
Не так давно описан механизм первоначальной загрузки аргонавта TtpAgo нуклеиновыми кислотами, получивший название chopping [12]. В результате этого процесса и происходит приобретение белком-аргонавтом своего гида путем связывания ДНК и расщепления ее на короткие двуцепочечные фрагменты. Затем эти фрагменты могут снова загружаться в аргонавта, после чего происходит диссоциация пассажирской цепи, и белок остается загружен функциональным гидом. На основании полученных данных был предложен следующий механизм TtpAgo-опосредованной интерференции (рис. 4 слева).
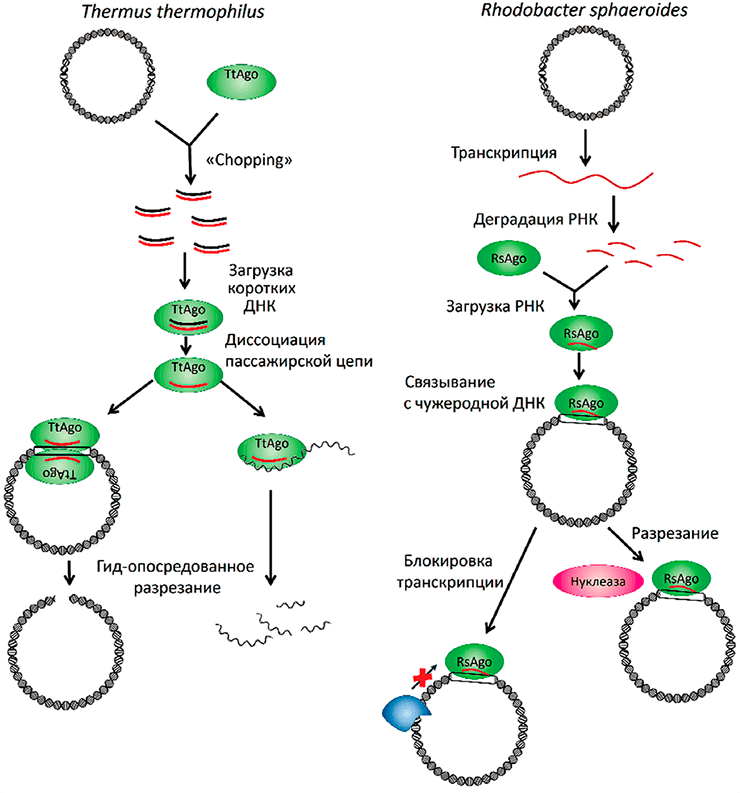
Рисунок 4. Предполагаемые механизмы работы прокариотических аргонавтов: TtAgo (слева) и RsAgo (справа)
Когда в бактериальную клетку проникают чужеродные ДНК (например плазмидная), TtpAgo связывается с ней и вносит разрывы. В результате чего образуются короткие двуцепочечные фрагменты, которые аргонавт может загружать и использовать одну из цепей в качестве гидовой для последующей атаки дц или оцДНК, образующейся, например, при репликации или конъюгации. Таким образом снижается эффективность плазмидной трансформации до четырех раз. В отсутствии же чужеродной ДНК в клетках аргонавт не обладает токсическим действием по отношению к собственному геному из-за способности различать «свою» и «чужую» ДНК благодаря более низкому содержанию GC-последовательностей в инвазивных элементах и разнице в репликационной активности. Кроме того, TtpAgo интересен еще и тем, что его взаимодействие с плазмидной ДНК стимулирует CRISPR-опосредованную адаптацию, поскольку аргонавт неизвестным образом активирует экспрессию локуса CRISPR и ассоциированных с ним генов [13].
Rhodobacter sphaeroides Argonaute (RspAgo)
Argonaute-белок из Rhodobacter sphaeroides (RspAgo) не обладает каталитической активностью вследствие замены аминокислотных остатков DEDH в активном центре на остатки GGHE. Но при выделении его из клеток бактерий он оказывается ассоциирован с короткими нуклеиновыми кислотами, то есть для образования направляющих нуклеотидных молекул и последующего разрезания мишени RspAgo нуждается в содействии дополнительных нуклеаз. В нативной клетке RspAgo способен связываться с гидовыми РНК длиной 15–19 нуклеотидов, предположительно происходящих из деградированных мРНК или ДНК длиной 22–24 нуклеотида. Эти короткие направляющие молекулы взаимно комплементарны друг другу и имеют остаток уридина на 5′-конце РНК и соответствующий ему остаток аденозина недалеко от 3′-конца ДНК. Короткие РНК, как и ДНК, соответствуют большому количеству уникальных последовательностей клетки, но имеют смысловую и антисмысловую ориентацию соответственно. Было показано, что популяция ДНК, связанных с RspAgo, обогащена чужеродными последовательностями — профагами, транспозонами и экзогенными плазмидами, что указывает на роль RspAgo в регуляции активности мобильных генетических элементов и в борьбе с экзогенными нуклеиновыми кислотами. На основании всех полученных данных также был предложен механизм работы RspAgo (рис. 4 справа).
Когда экзогенная плазмидная ДНК проникает в клетку и начинает транскрибироваться, полученные РНК частично деградируют под действием белков организма-хозяина, а получившиеся короткие последовательности РНК загружаются в RspAgo. Затем аргонавт, ассоциированный с направляющей производной, приобретает способность связываться с исходной инвазивной плазмидой. Но из-за отсутствия нуклеазной активности RspAgo не способен самостоятельно разрезать чужеродную плазмидную ДНК, однако может служить фактором привлечения других клеточных нуклеаз, а также препятствовать взаимодействию с плазмидой различных белков (например, РНК- и ДНК-полимераз, блокируя транскрипцию и репликацию). Короткие фрагменты ДНК являются побочными продуктами довольно редкого случая деградации ДНК, после их генерации такая антисмысловая ДНК может загружаться в RspAgo и репрессировать комплементарные плазмидные транскрипты посттранскрипционно [14].
Aquifex aeolicus Argonaute (AapAgo)
In vitro Argonaute-белок AapAgo, точно так же, как и аргонавт AfpAgo археобактерии Archaeoglobus fulgidus, представляет собой сайт-специфическую РНК-эндонуклеазу, опосредованную 5′-фосфорлированной 18–24-нуклеотидной ДНК-направляющей, с наибольшим сродством к ДНК на однонитевом уровне и к ДНК–РНК-гибриду на дуплексном уровне. Расщепление целевой РНК происходит с высокой эффективностью в присутствии Mg2+ для ДНК и Mn2+ как для ДНК, так и для ДНК–РНК-гибрида. ДНК в качестве направляющей нити гораздо более активна, чем РНК, а активность расщепления наиболее выражена при 55 °C, что не удивительно, учитывая, что Aquifex aeolicus является термофильной бактерией [10].
Pyrococcus furiosus Argonaute PfpAgo
Pyrococcus furiosus pAgo (PfpAgo) является первым прокариотическим аргонавтом, для которого определена трехмерная структура, и наиболее филогенетически близким к эукариотическим, но отличается от них механизмом действия. Комбинация анализов in vivo и in vitro демонстрирует его участие в защите хозяина путем ДНК-опосредованной ДНК-интерференции с использованием 5′-фосфорилированных 15–31-нуклеотидных гидов, снижая эффективность трансформации плазмидной ДНК до 2,5 раз [13].
Methanocaldococcus jannaschii Argonaute MjpAgo
Данные анализов in vitro показали, что MjpAgo тоже использует короткие ДНК в качестве направляющих цепей для расщепления ДНК-мишеней, в том числе плазмидной. Он связывает молекулы оцДНК и дцДНК с гораздо более высокой аффинностью, чем молекулы РНК и не способен расщеплять РНК-мишени [15].
Marinitoga piezophile Argonaute MppAgo
Аргонавт MppAgo из термофильной бактерии Marinitoga piezophile, в отличие от других про- и эукариотических аргонавтов, преимущественно связывает 5′-гидроксилирующие гидовые РНК для направленной атаки оцДНК. Это связано с особенностями строения 5′-связывающего кармана в MID-домене. Помимо этого, ген MppAgo ассоциирован с генами CRISPR/Cas-системы, но функциональное значение данного явления неясно [16], [17].
А завершилось ли «плавание»?
Принимая во внимание биохимическую активность и функциональную важность прокариотических аргонавтов, были охарактеризованы две основные функции pAgo: ДНК-управляемая ДНК-интерференция и РНК-управляемая ДНК-интерференция. По сравнению с эукариотическими, об аргонавтах прокариот известно очень мало. В настоящее время целевая специфичность различных аргонавтов не может быть предсказана по их аминокислотной последовательности. Большинство из них, вероятно, функционируют для защиты от вторжения чужеродных ДНК, в результате чего расщепление мишени осуществляется либо доменом PIWI, либо сопутствующими нуклеазами. Подобно системе CRISPR/Cas, pAgos могут быть перспективны в качестве системы геномного редактирования. Более того, функции прокариотических аргонавтов и их белков-партнеров могут выходить за пределы лишь «защиты хозяина» и включать в себя различные регуляторные пути, что делает pAgo интереснейшими объектами для будущих исследований (рис. 5).

Рисунок 5. Поход аргонавтов в Колхиду на корабле «Арго»
Литература
- Обо всех РНК на свете, больших и малых;
- Eugene V. Koonin. (2017). Evolution of RNA- and DNA-guided antivirus defense systems in prokaryotes and eukaryotes: common ancestry vs convergence. Biol Direct. 12;
- K. Bohmert. (1998). AGO1 defines a novel locus of Arabidopsis controlling leaf development. The EMBO Journal. 17, 170-180;
- Daan C Swarts, Kira Makarova, Yanli Wang, Kotaro Nakanishi, René F Ketting, et. al.. (2014). The evolutionary journey of Argonaute proteins. Nat Struct Mol Biol. 21, 743-753;
- Fabiola V Rivas, Niraj H Tolia, Ji-Joon Song, Juan P Aragon, Jidong Liu, et. al.. (2005). Purified Argonaute2 and an siRNA form recombinant human RISC. Nat Struct Mol Biol. 12, 340-349;
- J.-J. Song. (2004). Crystal Structure of Argonaute and Its Implications for RISC Slicer Activity. Science. 305, 1434-1437;
- Y. Tomari. (2005). Perspective: machines for RNAi. Genes & Development. 19, 517-529;
- Ashley J. Pratt, Ian J. MacRae. (2009). The RNA-induced Silencing Complex: A Versatile Gene-silencing Machine. J. Biol. Chem.. 284, 17897-17901;
- Kira S Makarova, Yuri I Wolf, John van der Oost, Eugene V Koonin. (2009). Prokaryotic homologs of Argonaute proteins are predicted to function as key components of a novel system of defense against mobile genetic elements. Biology Direct. 4, 29;
- Daan C. Swarts, Matthijs M. Jore, Edze R. Westra, Yifan Zhu, Jorijn H. Janssen, et. al.. (2014). DNA-guided DNA interference by a prokaryotic Argonaute. Nature. 507, 258-261;
- Eugene V. Koonin, Kira S. Makarova, Yuri I. Wolf. (2017). Evolutionary Genomics of Defense Systems in Archaea and Bacteria. Annu. Rev. Microbiol.. 71, 233-261;
- Daan C. Swarts, Malwina Szczepaniak, Gang Sheng, Stanley D. Chandradoss, Yifan Zhu, et. al.. (2017). Autonomous Generation and Loading of DNA Guides by Bacterial Argonaute. Molecular Cell. 65, 985-998.e6;
- Daan C. Swarts, Jorrit W. Hegge, Ismael Hinojo, Masami Shiimori, Michael A. Ellis, et. al.. (2015). Argonaute of the archaeon Pyrococcus furiosus is a DNA-guided nuclease that targets cognate DNA. Nucleic Acids Research. 43, 5120-5129;
- Ivan Olovnikov, Ken Chan, Ravi Sachidanandam, Dianne K. Newman, Alexei A. Aravin. (2013). Bacterial Argonaute Samples the Transcriptome to Identify Foreign DNA. Molecular Cell. 51, 594-605;
- Adrian Zander, Sarah Willkomm, Sapir Ofer, Marleen van Wolferen, Luisa Egert, et. al.. (2017). Guide-independent DNA cleavage by archaeal Argonaute from Methanocaldococcus jannaschii. Nat Microbiol. 2;
- Emine Kaya, Kevin W. Doxzen, Kilian R. Knoll, Ross C. Wilson, Steven C. Strutt, et. al.. (2016). A bacterial Argonaute with noncanonical guide RNA specificity. Proc Natl Acad Sci USA. 113, 4057-4062;
- Kevin W. Doxzen, Jennifer A. Doudna. (2017). DNA recognition by an RNA-guided bacterial Argonaute. PLoS ONE. 12, e0177097;
- Олина А.В., Кульбачинский А.В., Аравин А.А., Есюнина Д.М. (2018). Белки-аргонавты и механизмы РНК-интерференции у эукариот и прокариот. «Биохимия». 83, 645–661.









