
Спят усталые игрушки: о регуляции сна и роли орексина в этом процессе
20 ноября 2015
Спят усталые игрушки: о регуляции сна и роли орексина в этом процессе
- 10702
- 1
- 12
Избыточная дневная сонливость — признак многих неврологических расстройств, в частности, нарколепсии. Люди с нарколепсией могут погрузиться в сон в любом месте и в любое время.
картина Гюстава Курбе «Спящая пряха» (1853)
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Тонкости механизмов сна можно только восхититься — избыточное преобладание одной фазы сна над другой или отсутствие какой-либо из фаз может кардинально повлиять на качество жизни. Цикл сон–бодрствование и структура сна поддерживаются рядом нейромедиаторов, дисбаланс в работе которых ведет ко множеству функциональных расстройств. Ключевое звено в поддержании бодрствования — пептид латерального гипоталамуса орексин, недостаток которого ведет к расстройству сна, известному как нарколепсия. В этой статье речь пойдет о механизмах сна, регулирующих их трансмиттерных системах, структуре и роли в этом оркестре орексина, а также о патогенезе и лечении нарколепсии.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучший обзор» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Когда от перестановки мест слагаемых сумма меняется: нормальная структура сна
Спать пора! Уснул бычок,
Лег в коробку на бочок.
Сонный мишка лег в кровать,
Только слон не хочет спать.
Головой кивает слон,
Он слонихе шлет поклон.
Агния Барто. Слон
Существуют две фазы сна, последовательно сменяющие друг друга: медленноволновой сон и быстроволновой сон. Название отражает характер волн, которые видны на электроэнцефалограмме (ЭЭГ). Электроэнцефалография — это неинвазивная (в данном случае — не требующая вскрытия черепной коробки) методика записи электрической активности мозга. Под мозговой активностью будем понимать суммарное синхронное возбуждение всех нейронов с подобной пространственной ориентацией в определенном участке мозга в какой-то момент времени [1].
Во время бодрствования активность мозга наивысшая: наши сенсорные системы вовсю работают и доносят информацию о внешнем мире до нейронов сенсорной коры. В соответствующих зонах коры (сенсорных и ассоциативных) полученный паттерн сигналов анализируется. На основе поступившей информации в определенных нервных центрах синтезируется ответное возбуждение, уходящее по проводящим путям на периферию, к нужной структуре-исполнителю. На ЭЭГ (рис. 1) такую работу нервных центров отражает β-ритм — волны низкой амплитуды (около 30 мкВ) и высокой частоты (14–26 Гц).
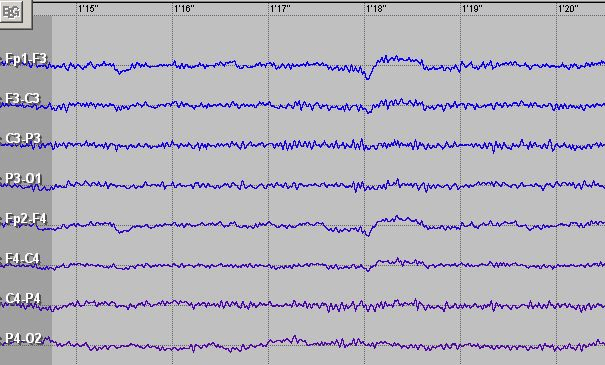
Рисунок 1. ЭЭГ, снятая во время бодрствования. Во всех отведениях регистрируется β-ритм.
«Википедия»
Засыпая, мы входим в фазу медленноволнового сна (он же — ортодоксальный или синхронизированный сон). Функциональный покой сенсорных систем, который мы создаем — закрытые глаза, тишина в комнате и другие условия, — значительно сокращает восходящие (поступающие в мозг) потоки чувствительной информации. Вследствие этого мозговая активность начинает снижаться, создавая предпосылки для развертывания полноценного процесса сна. На ЭЭГ фаза медленноволнового сна отражается в виде снижения частоты волн и увеличения их амплитуды, что объясняется их ритмичным, согласованным и одновременным возбуждением: нейроны, до этого выполняющие каждый свою функцию и работающие вразнобой, теперь синхронизируют свою активность. Такая слаженность обусловлена ритмичной восходящей активностью стволовых синхронизирующих центров сна, о которых речь пойдет ниже. Этот процесс постепенный, поэтому в пределах медленноволнового сна выделяют четыре стадии, последовательно сменяющие друг друга. В итоге к четвертой фазе на ЭЭГ преобладает δ-ритм частотой 0,5–2 Гц и амплитудой 75–150 мкВ, значительно снижены тонус мышц, артериальное давление, температура тела, частота сердечных сокращений и дыхания.
По прошествии четырех стадий медленноволнового сна наступает фаза быстроволнового (парадоксального, десинхронизированного) сна. На ЭЭГ появляются β-волны, характерные для состояния активного бодрствования, а электроокулография регистрирует быстрые периодические движения глаз под закрытыми веками. Эта отличительная особенность фазы дала повод называть быстроволновой сон REM-сном (англ. rapid eye movements — быстрые движения глаз), а медленноволновой — nonREM-сном. Для REM-сна характерны полное отсутствие мышечного тонуса, гипорефлексия, повышение порога возбуждения для всех стимулов, а также «вегетативная буря» — нестабильность функциональных показателей внутренних органов, таких как частота дыхания и сердечных сокращений (рис. 2). Именно в эту фазу человек видит сновидения. Активность нейронов различных нервных центров снова, как и во время бодрствования, десинхронизируется — благодаря активности десинхронизирующих нервных центров, подавляющих возбуждение от центров-синхронизаторов [2], [3].
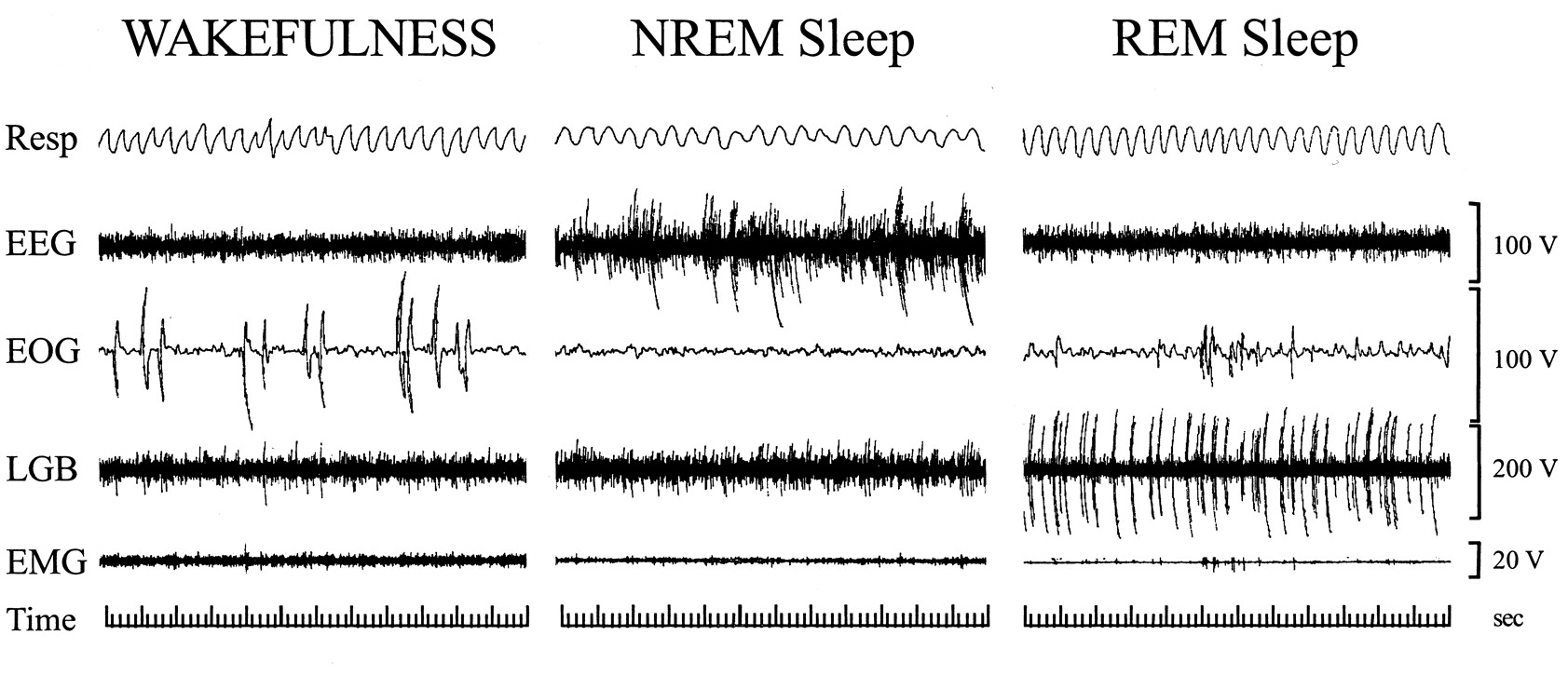
Рисунок 2. Фрагменты полисомнографий, отражающие состояние различных систем организма во время бодрствования (wakefulness), медленноволнового (NREM) и быстроволнового (REM) сна. Для REM-сна характерны учащение дыхания, десинхронизация мозговой активности, быстрые движения глаз и минимальный мышечный тонус. EEG — электроэнцефалограмма, EOG — электроокулограмма, LGB — латеральное коленчатое тело, EMG — электромиограмма.
Таким образом, мозговая активность десинхронизирована и при бодрствовании, и при REM-сне. В чем же подвох? Дело в том, что десинхронизация в первом случае обеспечивается моноаминергической системой ствола мозга, в то время как REM-сон возникает вследствие холинергической активности, а нейроны моноаминергических центров при этом ингибированы (на работе трансмиттерных систем остановимся чуть позже).
Разделение труда в нейрофизиологии сна: синхронизирующие и десинхронизирующие нервные центры
Нейроны каждого нервного центра контроля состояний сон/бодрствование имеют свой особенный характер импульсации. Одни нейроны, к примеру, активны только во время медленноволнового сна, другие — во время бодрствования. Возможны следующие варианты паттернов активности (рис. 3):
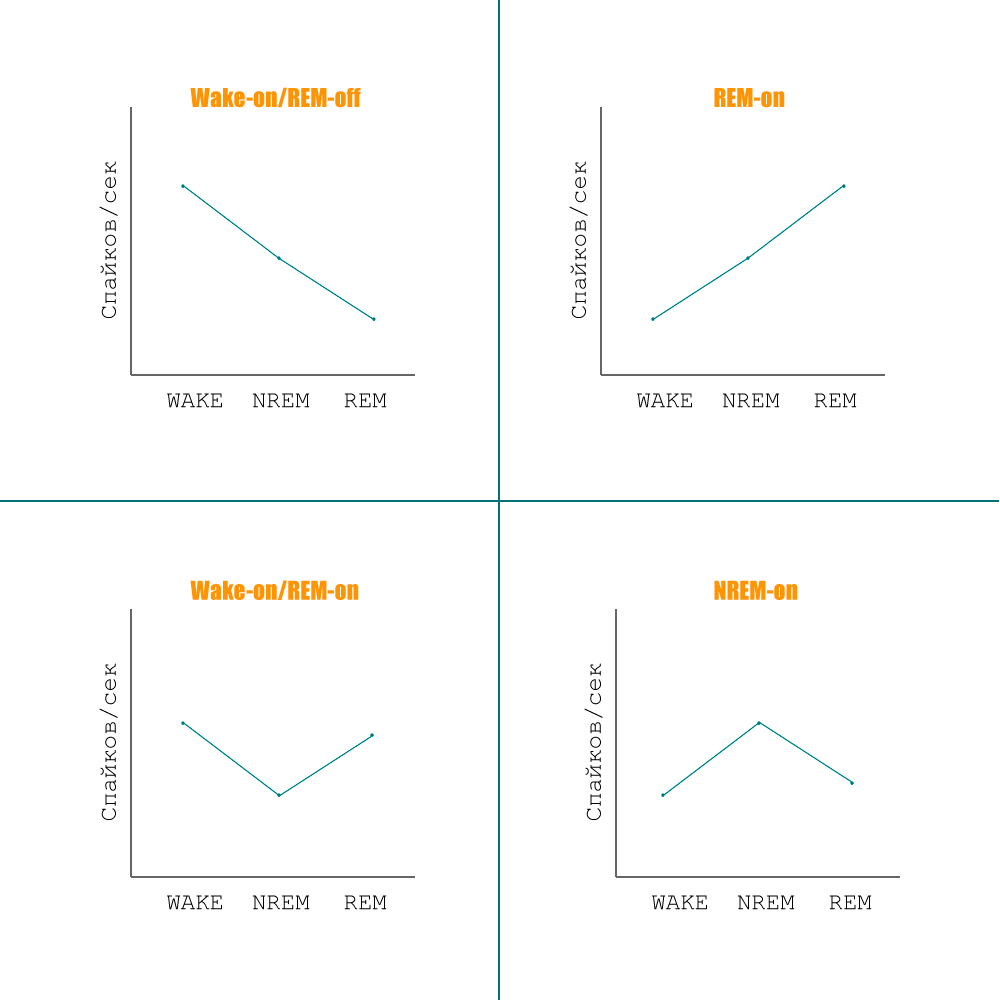
Рисунок 3. Варианты паттернов активности нервных центров, регулирующих цикл сон—бодрствование.
рисунок автора
- Wake-on/REM-off — паттерн нейронов десинхронизирующих центров, индуцирующих и поддерживающих состояние бодрствования;
- REM-on — характерен для центров-десинхронизаторов, запускающих и поддерживающих фазу быстроволнового сна;
- NREM-on — свойственен нейронам синхронизирующих центров, под влиянием импульсации которых возникает медленноволновой сон;
- Wake-on/REM-on — паттерн нейронов, активных как во время быстроволнового сна, так и во время бодрствования.
Каждый центр представляет собой скопление нейронов, имеющих многочисленные связи с другими отделами головного мозга и использующих определенный нейромедиатор для передачи возбуждения (подробности на рис. 4) [4].
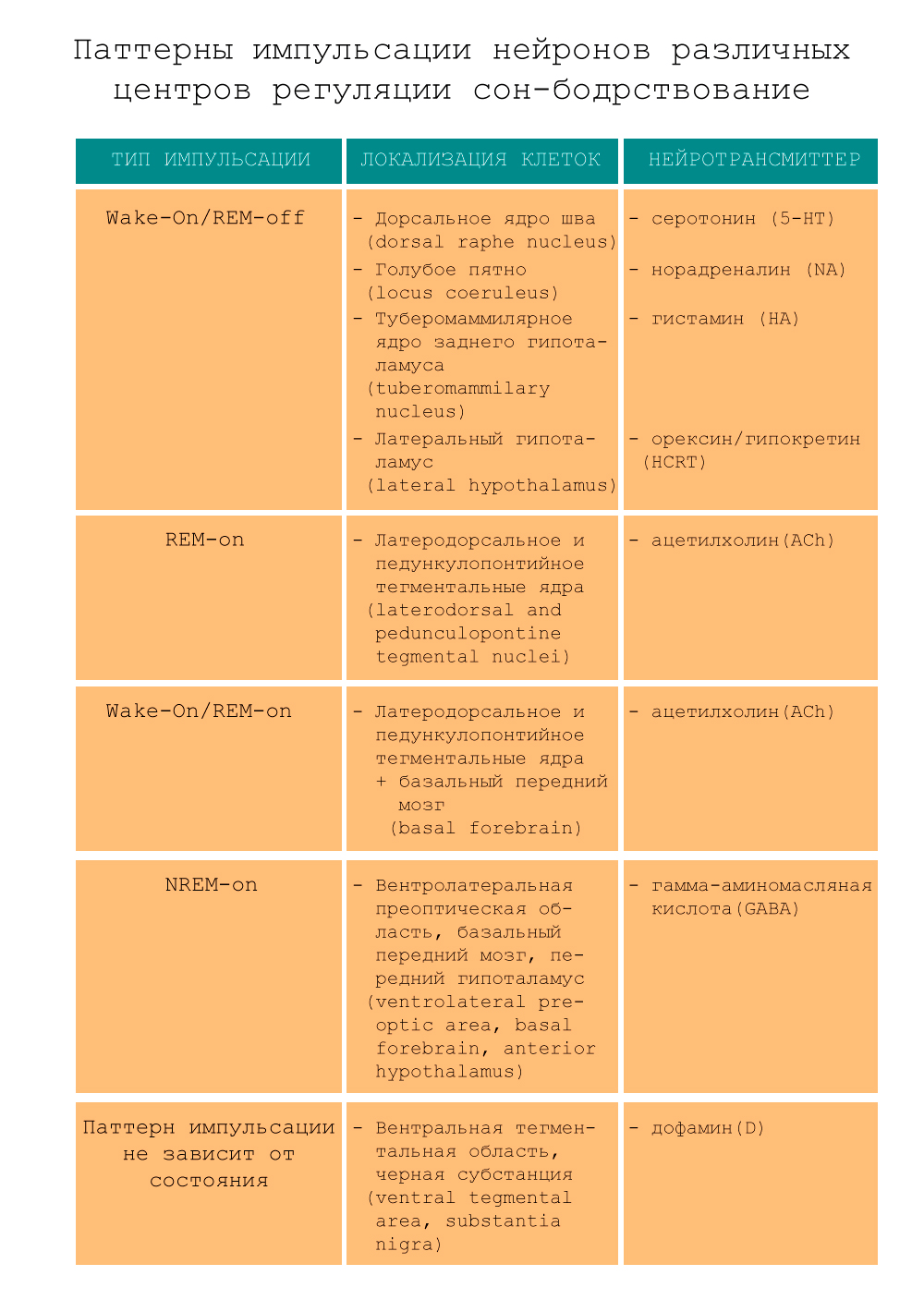
Рисунок 4. Локализация и паттерны импульсации нейронов нервных центров регуляции цикла сон—бодрствование.
рисунок составлен на основе [4]
Совокупность центров, обеспечивающих состояние бодрствования, называют восходящей возбуждающей системой (англ. ascendingarousalsystem, AAS). AAS состоит из моноаминергических, ацетилхолинергических нейронов и центров в латеральном гипоталамусе, секретирующих орексин (рис. 5) [5].
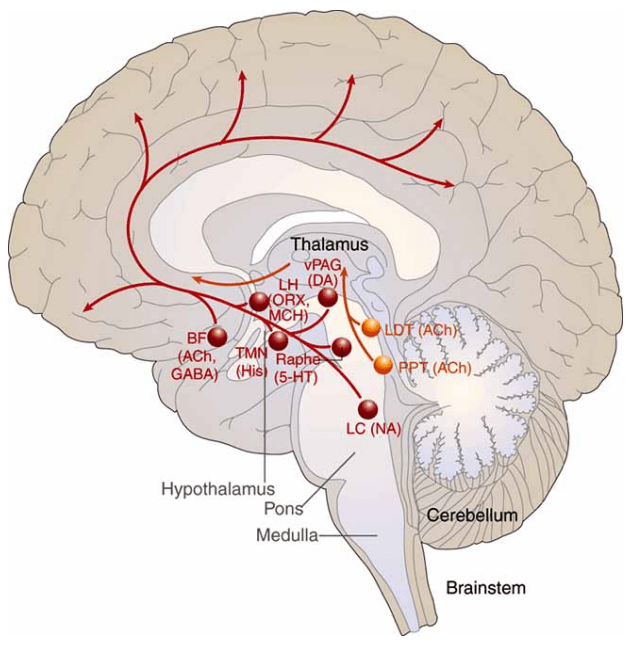
Рисунок 5. Расположение центров AAS. LC — locus coeruleus (голубое пятно), LDT — laterodorsal tegmental nucleus (заднелатеральное ядро покрышки), PPT — pedunculopontine nucleus (педункулопонтийное ядро покрышки), vPAG — ventral periaqueductal gray (передняя область центрального серого вещества), LH — lateral hypothalamus (латеральный гипоталамус), TMN — tuberomamillary nucleus (туберомамиллярное ядро гипоталамуса), BF — basal forebrain (базальный передний мозг).
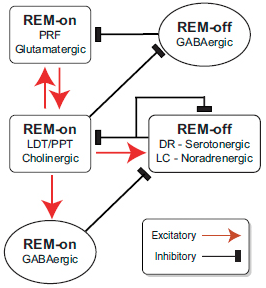
Рисунок 6. Реципрокные связи и самоингибирование моноаминергических нейронов в модели перехода от бодрствования и медленноволнового сна к быстроволновому сну. Стрелки на концах связующих линий обозначают возбуждение, «кирпичики» — торможение.
Согласно принятой модели, смена состояний сон/бодрствование и фаз сна обусловлена двумя свойствами ответственных за это нервных центров (рис. 6):
- реципрокным торможением конкурирующих центров (например, моноаминергические тормозят ГАМК-ергические во время бодрствования);
- способностью к самоингибированию (активность нервного центра сама себя ограничивает и постепенно угасает, давая центру-конкуренту проявить себя) [6].
Упрощенная схема перехода от состояния бодрствования ко сну выглядит так: во время бодрствования моноаминергическая система тормозит ГАМК-ергические нейроны вентролатеральной преоптической области (ВЛПО), а нейроны ВЛПО, становясь активными во время сна, в свою очередь ингибируют моноаминергические нейроны.
Моноаминергические центры активируются возбуждающими импульсами из латерального гипоталамуса от нейронов, использующих орексин. Последние получают возбуждающие сигналы от нейронов лимбической системы, супрахиазмального ядра (СХЯ), гипоталамических структур, анализирующих и регулирующих энергетический баланс. Отсюда следует, что бодрствование зависит от эмоционального состояния (лимбическая система), циркадных ритмов (СХЯ) и энергетической обеспеченности организма.
Активированные моноаминергические нейроны посылают тормозящие обратные импульсы к орексиновым центрам. Такая обратная связь служит для поддержания бодрствования: как только падает активность орексиновых нейронов, снижается и активность моноаминергических. Тогда орексиновые нейроны возобновляют прежний поток возбуждающих залпов к моноаминергическим партнерам [7].
Таким образом сохраняется баланс, предотвращающий чрезмерное возбуждение моноаминергических нейронов и отдающий первенство в индуцировании бодрствования циркадным ритмам, эмоциям, энергетическому балансу организма и другим факторам (рис. 7).
Орексиновые нейроны в данной модели служат для стабилизации цикла сон—бодрствование: они не дают одному состоянию резко перейти в другое. Если убрать из модели орексиновые нейроны и оставить лишь ингибирующие друг друга ГАМК-ергические и моноаминергические, то переход от одного состояния к другому будет непредсказуемым и всецело зависящим от преобладающей активности той или иной системы. В экспериментах мыши с недостаточностью орексина не страдали избытком сна, однако могли внезапно перейти из состояния бодрствования в состояние сна. Подобные внезапные переходы ко сну характерны и для людей, страдающих нарколепсией [5], [7].

Рисунок 7. Схематическое изображение связей между латеральным гипоталамусом (орексин), моноаминергическими нейронами и ВЛПО (ГАМК). а — Бодрствование. Орексиновые нейроны получают возбуждающие импульсы из лимбической системы, супрахиазмального ядра и других областей гипоталамуса. Аксоны этих нейронов образуют с моноаминергическими клетками возбуждающие синапсы. Моноаминергические нейроны ингибируют активность нейронов ВЛПО и орексиновых нейронов. Снижение активности орексиновых нейронов ведет к снижению активности моноаминергических нейронов; тормозящее влияние последних ослабляется, и орексиновые клетки возобновляют прежний ритм импульсации к моноаминергическим нейронам. б — Сон. Нейроны ВЛПО активны и ингибируют как орексиновые, так и моноаминергические нейроны. в — Нарколепсия. Орексиновые нейроны отсутствуют, и состояние сна или бодрствования определяется преобладающей активностью моноаминергических или ГАМК-ергических нейронов. Переход между состояниями внезапен.
В главных ролях: орексин/гипокретин...
Орексин, он же гипокретин, был открыт в 1998 году двумя группами ученых независимо друг от друга.
Луис де Лесеа (Luis de Lecea) в своей лаборатории в Стэнфордском университете сначала выделил из гипоталамуса мышей ряд последовательностей мРНК — всего 38. Внимание исследователей привлек образец под номером 35: эта мРНК кодировала предшественника двух пептидов, сходных по аминокислотным последовательностям с гормоном желудочно-кишечного тракта секретином. Используя для точной локализации в гипоталамусе и выделения этого белка-предшественника поликлональную сыворотку к его С-концевой последовательности из 17 аминокислотных остатков (далее — АК), ученые описали два пептида. Они назвали эти пептиды гипокретинами, так как они секретируются нейронами заднего гипоталамуса и гомологичны секретину. Участники исследования также высказали ряд предположений относительно функций открытых ими веществ [8].
Такэси Сакураи (Takeshi Sakurai) со своей командой из Техасского университета открыл эти два пептида, проводя скрининг в поисках лиганда для двух орфанных рецепторов (от англ. orphan — сирота; рецептор без известного лиганда), связанных с G-белком. Ученые определили расположение секретирующих эти пептиды нейронов в заднем и латеральном гипоталамусе, а также обозначили одну из их функций: внутрижелудочковое введение этих веществ крысам стимулировало поглощение животными пищи. Из-за такого эффекта эти пептиды и окрестили орексинами (от греческого ορεξις, которое авторы расценили как «аппетит», хотя на самом деле более близкое значение — «желание») [9].
Позже при сравнении АК-последовательностей оказалось, что гипокретины и орексины — это одни и те же пептиды, а потому эти термины синонимичны.
Итак, в 1998 году мировому научному сообществу открылись два пептида нового семейства: орексин А и орексин Б (рис. 8). Эти молекулы образуются из общего предшественника — препроорексина (ППО). ППО вырабатывается нейронами заднего и латерального гипоталамуса. Отсечение типичной для секретируемых пептидов N-терминальной сигнальной последовательности приводит к образованию проорексина, который разрубается протеазами на 2 части — орексин А длиной 33 АК, имеющий 2 дисульфидные связи, и орексин Б длиной 28 АК, не имеющий дисульфидных связей.
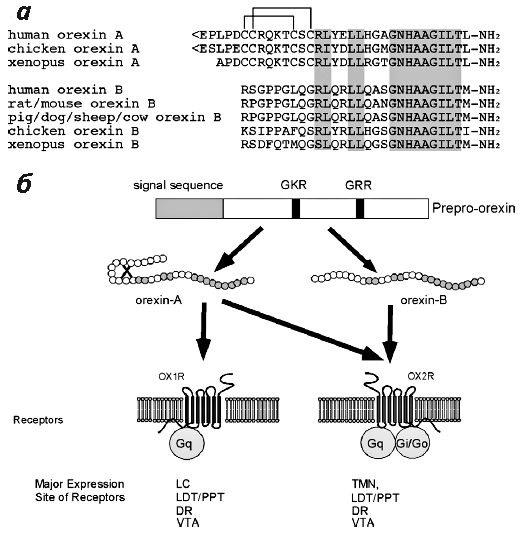
Рисунок 8. Орексины и зоны их действия. а — Сравнение аминокислотных последовательностей зрелых орексина А и орексина Б человека и некоторых млекопитающих. Идентичные последовательности обозначены серым цветом. б — «Сфера влияния» орексинов. Орексин А и орексин Б образуются из одного и того же предшественника — препроорексина. Для них существует два рецептора, связанных с G-белком: рецептор орексина-1, OX1R, и рецептор орексина-2, OX2R. Орексин А неселективен по отношению к этим двум рецепторам, в то время как орексин Б действует лишь через OX2R. Оба рецептора экспрессируются нейронами заднелатерального и педункулопонтийного тегментальных ядер (LDT/PPT), дорсального ядра шва (DR) и вентральной тегментальной области (VTA). OX1R также в обилии экспрессируется нейронами голубого пятна (LC), а OX2R — нейронами туберомамиллярного ядра (TMN).
Рецепторов орексина тоже два: ОХ1 и ОХ2 (рис. 9). Они принадлежат к семейству рецепторов, сопряженных с G-белком (англ. G protein-coupled receptors, GPCRs). Последовательность их АК совпадает на 64%. Активация этих рецепторов приводит к повышению уровня внутриклеточного кальция, который является элементом очень многих клеточных сигнальных путей. Афинность орексина А и орексина Б к этим рецепторам разнится. Орексин А в равной степени активирует ОХ1 и ОХ2, тогда как орексин Б реагирует с ОХ2 в несколько крат сильнее, чем с ОХ1 [7].
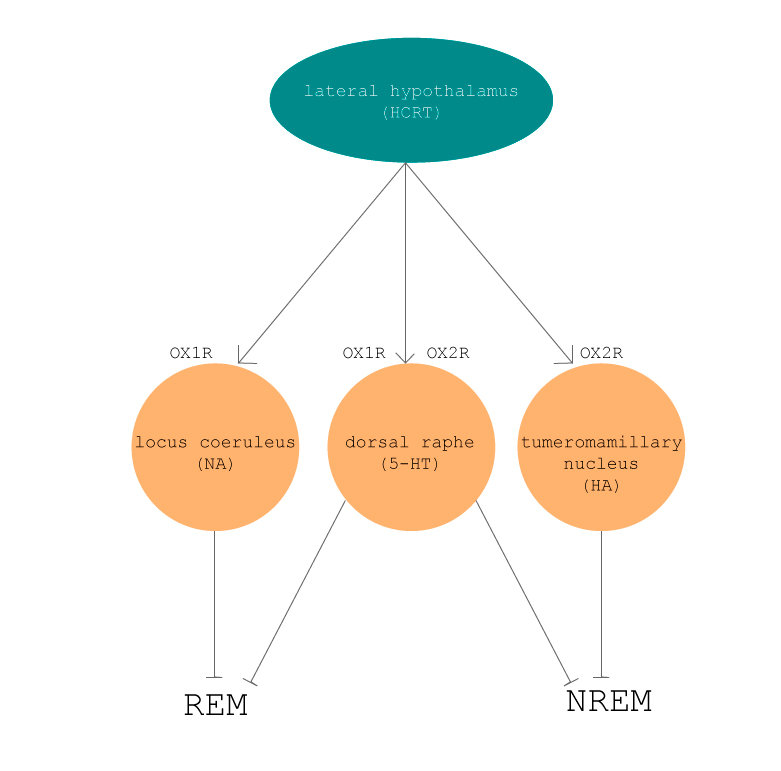
Рисунок 9. Связь орексиногенных нейронов латерального гипоталамуса с моноаминергическими нейронами и рецепторы, посредством которых орексин возбуждает нейроны каждого из центров.
Актер одной роли? Это не об орексине!
Индукция и поддержание бодрствования — не единственная функция орексина. Так уж повелось, что у всего, что выделяется в гипоталамусе, сложные и переплетенные с большим количеством процессов функции. Помимо регуляции цикла сон—бодрствование, орексин играет роль в:
- Пищевом поведении и энергетическом гомеостазе. Орексины индуцируют поиск и потребление пищи, одновременно с этим активируя метаболизм. В эксперименте трансгенные мыши с недостатком орексина страдали ожирением, несмотря на гипофагию. В дополнение к этому орексины активируют термогенез в бурой жировой ткани [10].
- Водном гомеостазе. Внутрижелудочковая инъекция орексина в эксперименте увеличивала потребление воды. Кроме того, антидиуретический гормон активирует орексиновые нейроны через V1a-рецепторы [10].
- Получении удовольствия и становлении наркотической зависимости. В связи с этим было сделано любопытное наблюдение: несмотря на то, что страдающие нарколепсией люди в качестве лечения получали психостимуляторы типа амфетамина, зависимость у них практически не развивалась [10].
Люди с нарколепсией на своем примере испытывают все многообразие проявлений «молчания» орексина.
Что же есть нарколепсия?
Cон и бессонница, то и другое сверх
меры проявляющиеся, — худой знак.
Гиппократ
Нарколепсия (от др.-греч. ναρκη — оцепенение, сон — и ληψις — приступ) — это хроническое неврологическое расстройство, характеризующееся следующей тетрадой симптомов [16]:
- избыточной дневной сонливостью;
- катаплексией (внезапной потерей мышечного тонуса при ясном сознании);
- гипнагогическими (при засыпании) и гипнапомпическими (при пробуждении) галлюцинациями;
- сонным параличом.
Катаплексия наблюдается не у всех пациентов с нарколепсией, однако в случаях сочетания нарколепсии с катаплексией наблюдается явная недостаточность орексиновой системы: в спинномозговой жидкости 90% пациентов с этой патологией орексин не обнаруживается, а гистологические исследования выявляют селективную потерю орексиновых нейронов. При нарколепсии без катаплексии лишь у 10–20% пациентов выявляется значительное снижение содержания орексина в ликворе. Не исключено, что при нарколепсии без катаплексии потеря нейронов, продуцирующих орексин, не так велика; вместе с тем, нарколепсии без и с катаплексией имеют один и тот же механизм развития, заключающийся в недостатке орексина [16].
Структура сна у нарколептиков имеет одну неприятнейшую особенность: REM-сон у них наступает сразу же после засыпания, вместо фазы NREM-сна, которая может так и не наступить. Отсюда — фрагментированный ночной сон и дневная сонливость: нарколептики фактически живут в состоянии хронического недосыпания. Днем они способны заснуть в самый неподходящий момент времени, к примеру, на ответственной деловой встрече, и при этом такой кратковременный сон слабо восполняет потребность во сне. И толком не поспал, и выговор от шефа получил — нарколепсия, таким образом, отрицательно влияет на все аспекты жизни, и социальные среди них не последние в списке.
Помимо этого, REM-сон время от времени «вторгается» в состояние бодрствования: катаплексия соответствует атонии REM-сна, галлюцинации — сновидениям, обычно возникающим во время REM-сна, но продолжающимся в данном случае после пробуждения [17].
Превалирование REM-сна предположительно связано с потерей ингибирующего влияния моноаминергических центров на ацетилхолинергические REM-on нейроны, в связи с чем в определенные моменты времени их тоническая импульсация выходит на передний план.
Давай, давай лечиться!
Психостимуляторы были первыми препаратами для облегчения участи страдающих нарколепсией. Бензедрин — рацемическая смесь лево- и правовращающего амфетамина — начал использоваться с этой целью в 1933 году. Амфетамин и другие производные метилфениламина (дексамфетамин, метамфетамин, метилфенидат) и по сей день назначаются нарколептикам в странах, где медицинский оборот психостимуляторов разрешен законодательством. Модафинил и армодафинил — более новые препараты этой группы [15].
Кроме психостимуляторов, в арсенале сомнологов присутствуют и другие фармакологические препараты: антидепрессанты (трициклические и селективные ингибиторы обратного захвата серотонина), ингибиторы моноаминоксидазы (селегилин), оксибат натрия.
Наиболее перспективное направление в разработке препаратов для лечения нарколепсии — создание агонистов рецепторов ОХ1 и ОХ2. Для собственно орексина, являющегося пептидом, гематоэнцефалический барьер практически непроницаем. Альтернативный путь — разработка непептидных агонистов орексиновых рецепторов. Подходящих агентов на эту роль пока нет.
Надо отметить, что создание антагонистов орексиновых рецепторов (первый антагонист — суворексант — был одобрен FDA в августе 2014 года) продвигается активнее. Очевидно, больший энтузиазм обусловлен большей востребованностью на фармацевтическом рынке именно антагонистов — в отличие от нарколепсии, которой страдают 0,02% людей земного шара [17], бессонница (при которой и показаны антагонисты орексиновых рецепторов) встречается гораздо чаще. С учетом такой ситуации шансы у завсегдатаев Гипноса на получение эффективной заместительной терапии целиком зависят от спонсоров, которые согласятся вложить средства в разработку препаратов против орфанных заболеваний.
Судьбе сирот редко можно позавидовать, а больным заболеваниями-«сиротами» — тем более. Однако возрастающий интерес к нейрофизиологии сна — и в частности к физиологии орексина — обнадеживает и дает предвкушение новых открытий, которые позволят лучше понять патогенез расстройств сна и разработать эффективные средства борьбы с ними.
Литература
- Niedermeyer E., Schomer D.L., Da Silva L.F.H. Niedermeyer’s electroencephalography: basic principles, clinical applications, and related fields. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins Health, 2011. — 1296 p.;
- Ткаченко Б.И. Нормальная физиология человека (2-е изд.). М.: Медицина, 2005. — 928 с.;
- Vazquez J., Lydic R., Baghdoyan H.A. (2002). The nitric oxide synthase inhibitor NG-nitro-L-arginine increases basal forebrain acetylcholine release during sleep and wakefulness. J. Neurosci. 22, 5597–5605;
- Watson C.J., Baghdoyan H.A., Lydic R. (2012). Neuropharmacology of sleep and wakefulness. Sleep Med.Clin. 7, 469–486;
- Schwartz J.R. and Roth T. (2008). Neurophysiology of sleep and wakefulness: basic science and clinical implications. Curr. Neuropharmacol. 6, 367–378;
- Brown R.E., Basheer R., McKenna J.T., Strecker R.E., McCarley R.W. (2012). Control of sleep and wakefulness. Physiol. Rev. 92, 1087–1187;
- Ohno K. and Sakurai T. (2008). Orexin neuronal circuitry: role in the regulation of sleep and wakefulness. Front. Neuroendocrinol. 29, 70–87;
- de Lecea L., Kilduff T.S., Peyron C., Gao X., Foye P.E., Danielson P.E. et al. (1998). The hypocretins: hypothalamus-specific peptides with neuroexcitatory activity. Proc. Natl. Acad. Sci. USA. 95, 322–327;
- Sakurai T., Amemiya A., Ishii M., Matsuzaki I., Chemelli R.M., Tanaka H. et al. (1998). Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior. Cell. 92, 573–585;
- Inutsuka A. and Yamanaka A. (2013). The physiological role of orexin/hypocretin neurons in the regulation of sleep/wakefulness and neuroendocrine functions. Front. Endocrinol. (Lausanne). 4, 18;
- Спокоен как GABA;
- Молекула здравого ума;
- Тайны голубого пятна;
- Серотониновые сети;
- Passani M.B. and Blandina P. (2011). Histamine receptors in the CNS as targets for therapeutic intervention. Trends Pharmacol. Sci. 32, 242–249;
- Kumar S. and Sagili H. (2014). Etiopathogenesis and neurobiology of narcolepsy: a review. J. Clin. Diagn. Res. 8, 190–195;
- Bozorg A.M. and Selim R.B. (2015). Narcolepsy: practice essentials, background, pathophysiology. Medscape;
- Liblau R.S., Vassalli A., Seifinejad A., Tafti M. (2015). Hypocretin (orexin) biology and the pathophysiology of narcolepsy with cataplexy. Lancet Neurol. 14, 318–328..






