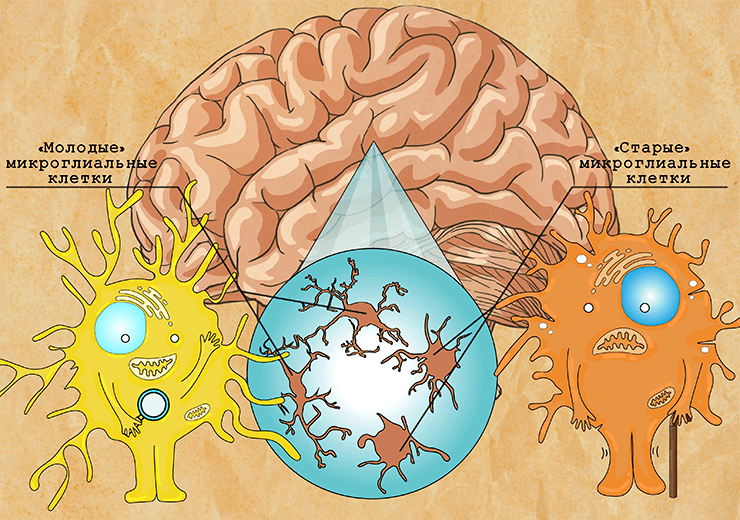
Старение «иммунитета» головного мозга
09 марта 2023
Старение «иммунитета» головного мозга
- 1643
- 0
- 14
Старение иммунных клеток головного мозга. Рисунок в полном размере.
создано в приложении Adobe Illustrator Мариной Варочкиной по мотивам Cartoon Neuron by Jimmy Smith
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Долгое время считалось, что мозг — иммунопривилегированный орган, в котором развитие воспалительных реакций не представляется возможным. Вот только за последние 50 лет вопрос о наличии иммунной защиты в центральной нервной системе был в корне пересмотрен. Сегодня ни для кого не секрет, что функции иммунитета (и не только) выполняет сообщество резидентных профессиональных фагоцитов — микроглия. К сожалению, с возрастом микроглиальные клетки теряют интерес к своим рутинным обязанностям и отправляются на поиски себя, что сказывается на работе всей центральной нервной системы. Именно об этих малых по размеру, но не менее важных по значению клетках и пойдет речь.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания «Сесана».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
С возрастом наш мозг испытывает различные изменения, приводящие к прогрессирующему снижению его функциональных возможностей: усилению окислительного стресса, нарушению биоэнергетики клеток и повышению уровня провоспалительных факторов. В первую очередь, данные процессы происходят в микроглиальных клетках, старение которых приводит к повышенному риску развития различных нейродегенеративных заболеваний. Но перед тем как говорить о влиянии старения на микроглию, ознакомимся с ее «жизнью».
У истоков открытия
Открытие микроглиальных клеток связано с работами двух испанских ученых (рис. 1).

Рисунок 1. Работы Сантьяго Рамона-и-Кахаля и Пио дель Рио-Ортеги. Ссылки на пртрет Сантьяго Рамона-и-Кахаля и его работы по окрашиванию срезов. Ссылки на портрет Пио дель Рио-Ортеги и его работы по окрашиванию срезов.
создано в приложении Biorender Мариной Варочкиной
Первый из них, Сантьяго Рамон-и-Кахаль [1], разработал метод окрашивания гистологических срезов коры головного мозга, благодаря чему смог подробно описать структуру и организацию нейронов и астроцитов в различных ее областях. За это он впоследствии получил Нобелевскую премию. Также в срезах он наблюдал аполярные клетки, названные им «третьим элементом», но описать особенности и характеристики этих клеток он не смог [2], [3].
Работу Сантьяго Рамон-и-Кахаля продолжил его ученик Пио дель Рио-Ортега, который в 1919 году придумал метод окрашивания срезов коры головного мозга аммиачным карбонатом серебра. Это позволило ему разделить «третий элемент» Кахаля на два типа клеток: микроглию и олигодендроциты [2], [3].
Вот что сам Пио дель Рио-Ортега говорил о микроглии: «В результате нашего первого наблюдения мы убедились, что этот новый тип клеток является глиальной клеткой, и мы называем его микроглией из-за крошечного размера их сомы, которая значительно меньше, чем у волокнистых и протоплазматических астроцитов. Микроглия происходит из мезодермы и способна фагоцитировать мусор». С этими словами 100 лет назад родилась научная область исследований микроглии [2], [3].
Колонизация головного мозга
После открытия микроглиальных клеток перед научным сообществом встал вопрос об их происхождении. Мнения ученых разделились на три основные версии: мезодермальное происхождение, нейроэктодермальное происхождение и миелоидное происхождение. Долгое время главенствовала вторая теория. Считалось, что клетки микроглии, глии и нейроны происходят от общего предшественника. Однако в начале 2000-х годов ряд исследований показал, что микроглия имеет миелоидное происхождение, то есть происходят из клеток миелобластов — унипотентных стволовых клеток [4]. Рассмотрим его подробнее.
Эксперименты с использованием мышиной модели с картированием судьбы (то есть мышей, у которых микроглия и периферические макрофаги производят флуоресцентный белок) показали, что микроглия происходит из пула примитивных макрофагов желточного мешка. Желточный мешок у мышей образуется на седьмой день эмбрионального развития и выполняет роль кроветворного органа. На данном сроке развития он представляет собой островки кровяных клеток двух типов: бипотентные предшественники эритроцитов и мегакариоциты. Эти клетки созревают в островках и выходят в кровоток на восьмой день эмбрионального развития. После этого они мигрируют и проникают в рудимент мозга через его оболочки и боковые стенки желудочков на десятый день эмбрионального развития. Там они распределяются по всей кортикальной области с обеих сторон и полностью колонизируют головной мозг к одиннадцатому дню эмбрионального развития до появления гематоэнцефалического барьера (рис. 2). Человеческая амебоидная микроглия проникает в развивающуюся кору головного мозга на 4,5 неделе беременности, и уже на 21-й неделе приобретает разветвленную морфологию [5], [6].
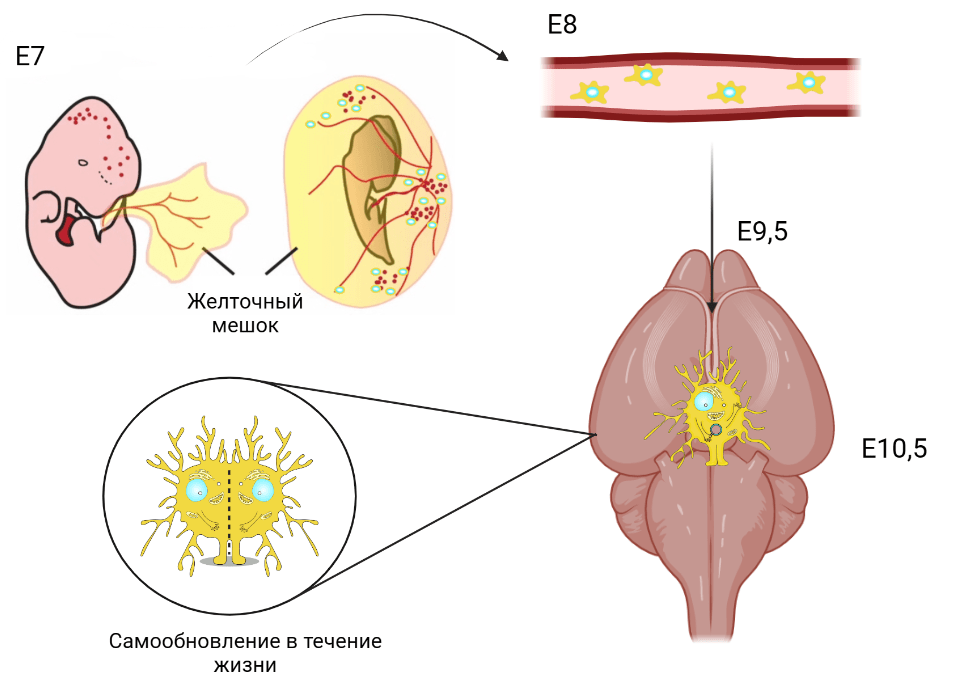
Рисунок 2. Схема развития микроглии в течение жизни
создано в приложении Biorender Мариной Варочкиной c использованием статьи [23]
Клетки микроглии пребывают в мозге на протяжении всей жизни и поддерживают численность посредством самообновления, а не повторной миграции. В первые две недели постнатального развития мышей количество клеток микроглии увеличивается, а затем постепенно снижается на 50% с 3 по 6 неделю. Затем плотность микроглии стабилизируется. По оценкам ученых, на долю микроглиальных клеток приходится от 5% до 15% клеток головного мозга.
Физиология микроглиальных клеток
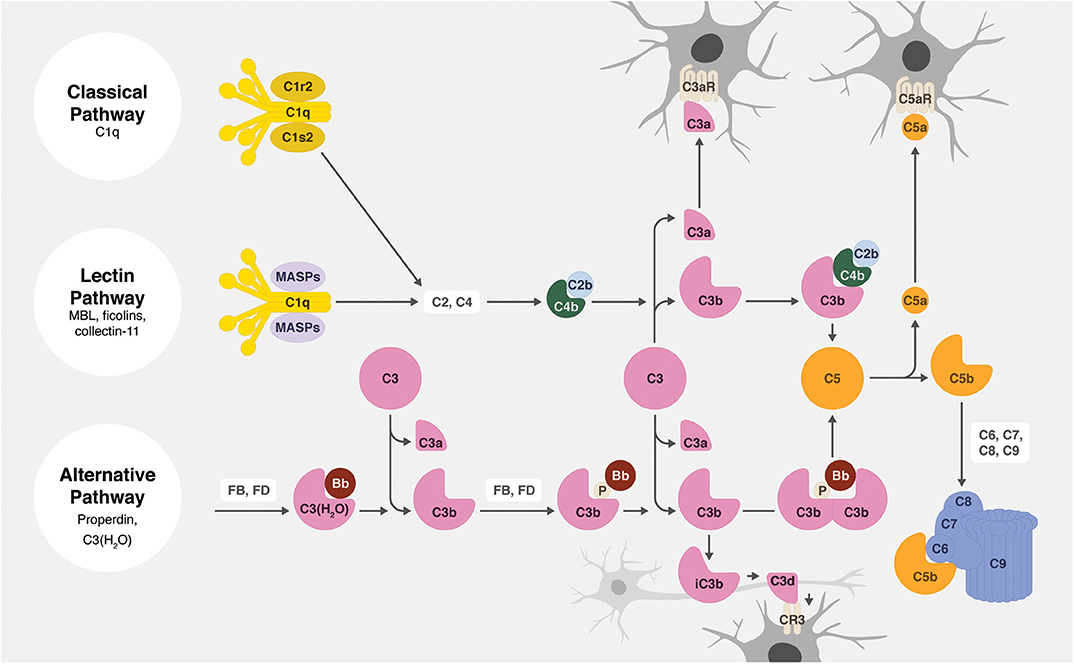
В связи с отличающимся от других клеток головного мозга происхождением, микроглия имеет уникальные функции, направленные на поддержание гомеостаза центральной нервной системы. Например, она контролирует и поддерживает оптимальное количество синаптических контактов посредством фагоцитоза пресинаптических элементов, используя компоненты системы комплемента (рис. 3). Для избегания уничтожения синапса, нейроны используют сигнал «не ешь меня», в основе которого лежит взаимодействие микроглиального белка SIRPα и мембранного гликопротеина нейронов CD47. Синаптическое ремоделирование (перестройка нейронных сетей) играет решающую роль в созревании нейронных цепей, а нарушение данного процесса приводит к различным неврологическим расстройствам [7], [8].
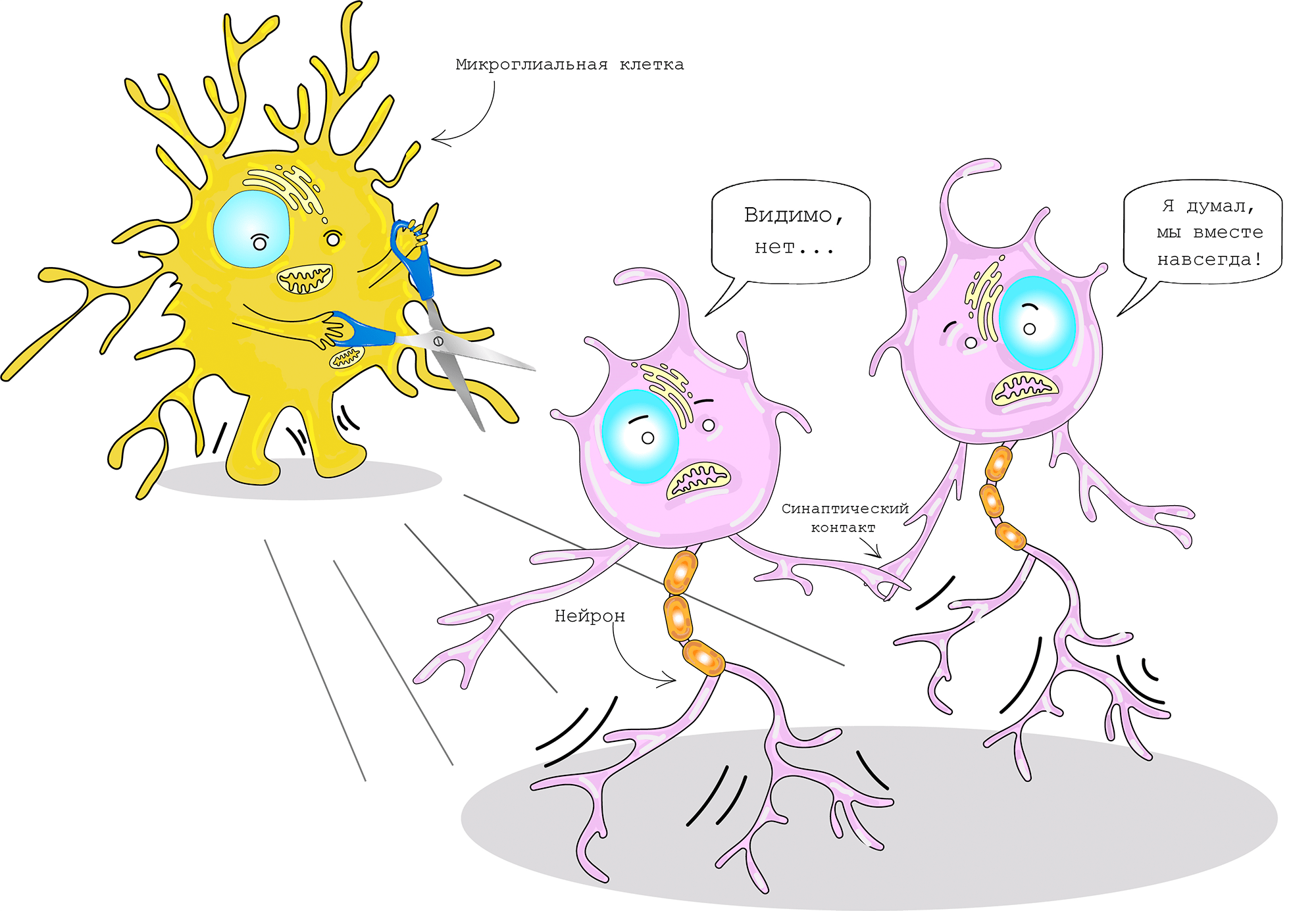
Рисунок 3. Ремоделирование синаптического контакта микроглиальной клеткой
создано в приложении Adobe Illustrator Мариной Варочкиной по мотивам Cartoon Neuron by Jimmy Smith
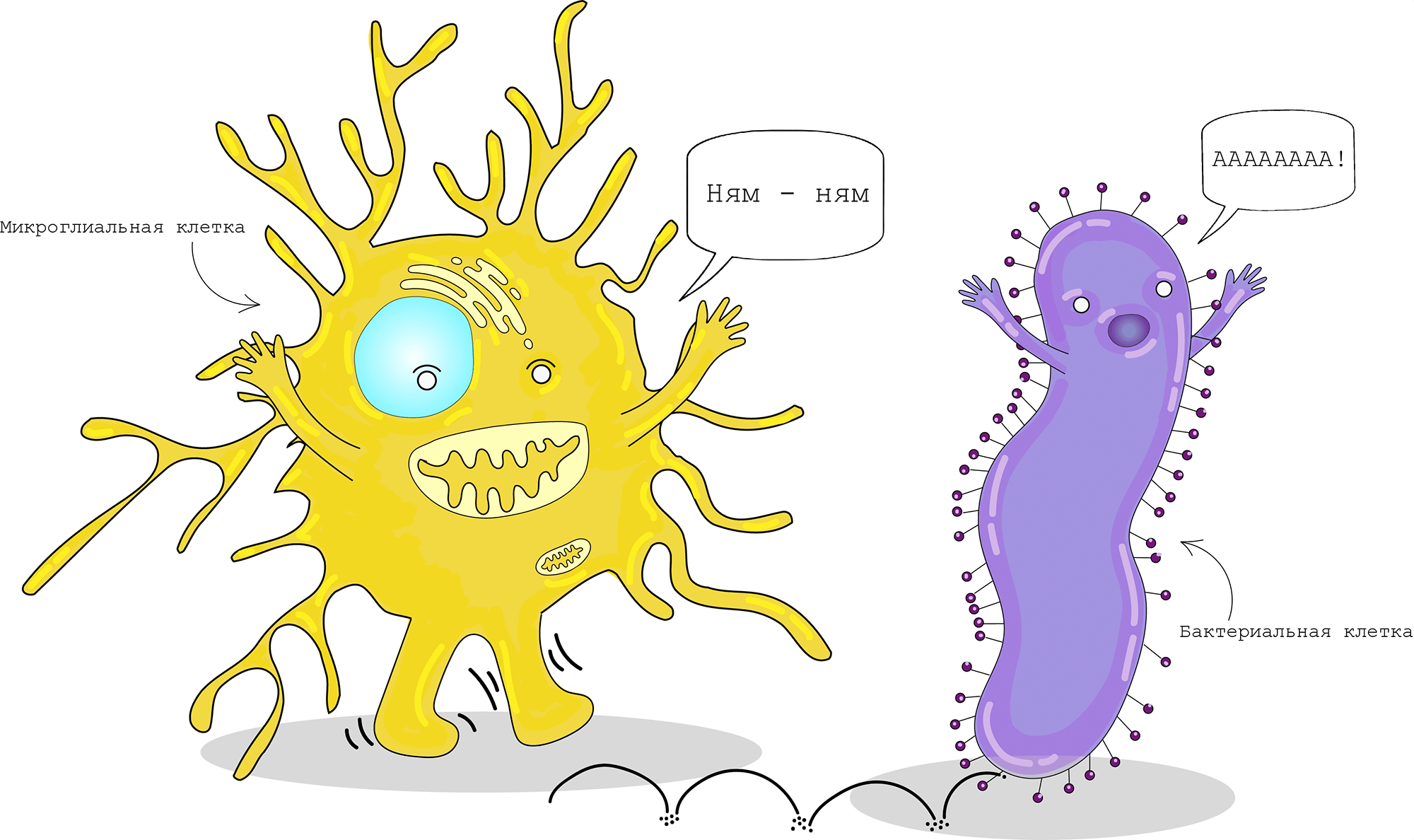
Во время повреждения головного мозга микроглия отвечает за устранение микробов, мертвых клеток и белковых агрегатов, а также других твердых частиц и растворимых антигенов, используя все тот же механизм фагоцитоза с помощью системы комплемента (рис. 4) [9]. Однако для элиминации некоторых молекул на поверхности микроглиальных клеток существуют специальные рецепторы (например, микроглиальный рецептор TREM2 участвует в фагоцитирвоании бета-амилоида при болезни Альцгеймера). Быстрое удаление отмирающих клеток и предотвращение агрегации белков — необходимый процесс тканевого гомеостаза, так как это предотвращает высвобождение токсических компонентов, вызывающих повреждение тканей [10].
Микроглиальные клетки — это динамические структуры, которые способны к изменению своей морфологии и профиля экспрессии генов. В «покоящемся состоянии» микроглия имеет длинные и разветвленные отростки, с помощью которых она исследует микроокружение и проверяет клетки на наличие признаков повреждения [11].
Помимо этого, микроглия содержит на своей поверхности множество рецепторов, участвующих в распознавании различных сигнальных молекул. При обнаружении сигналов повреждения микроглиальные клетки претерпевают морфологические изменения, приобретая амебоидную форму, и мигрируют в место повреждения для устранения проблемы (рис. 5) [12].
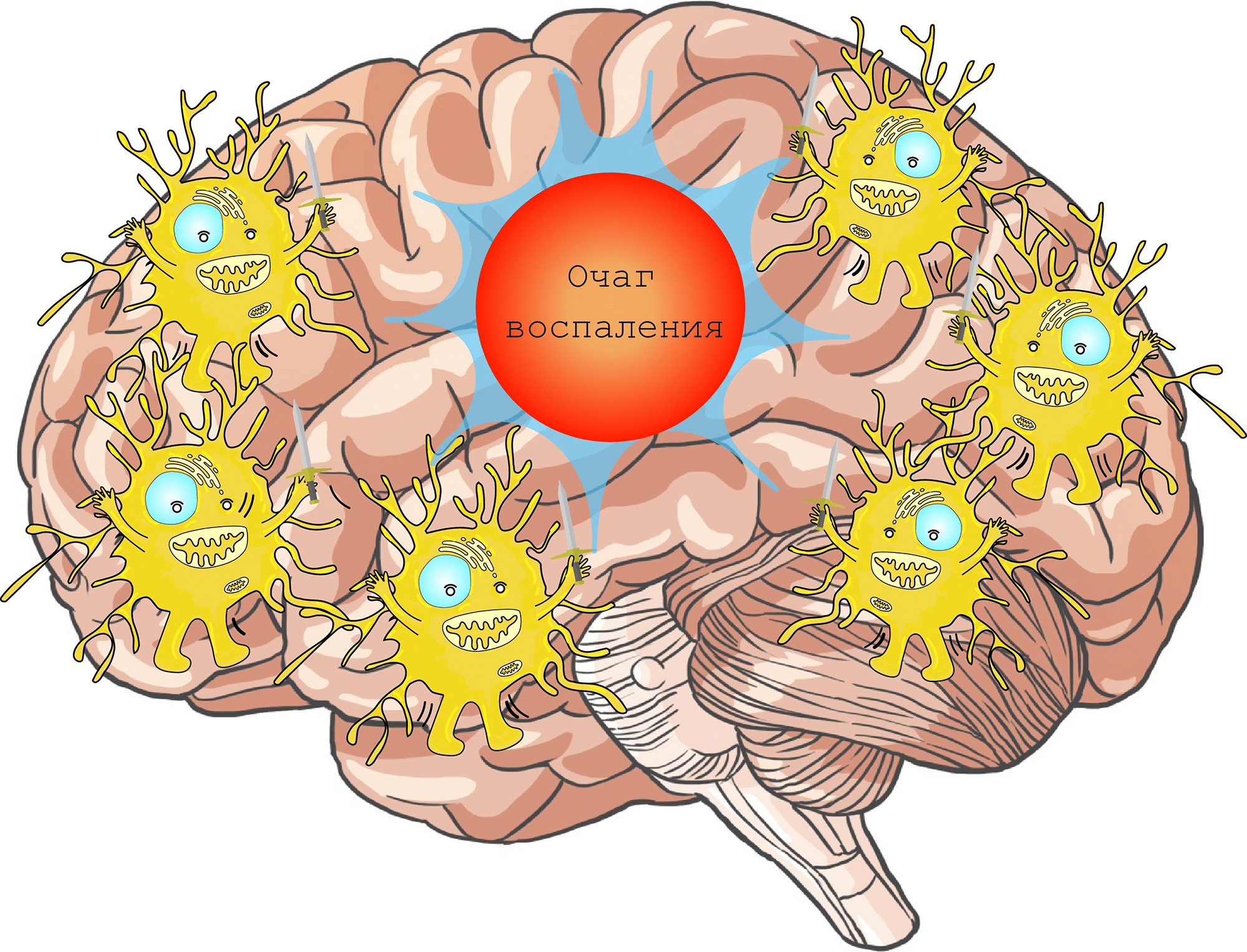
Рисунок 5. Миграция микроглиальных клеток в очаг воспаления
создано в приложении Adobe Illustrator Мариной Варочкиной по мотивам Cartoon Neuron by Jimmy Smith
Кроме этого, микроглия может секретировать многие растворимые факторы, такие как хемоаттрактанты, цитокины и нейротропные факторы. Их набор зависит от способа активации микроглии (рис. 6).

Рисунок 6. Секреция молекул в зависимости от типа активации. Подробности в тексте.
создано в приложении Adobe Illustrator Мариной Варочкиной по мотивам Cartoon Neuron by Jimmy Smith
Активировать микроглию могут многие факторы. Помимо вирусной и бактериальной инфекций, микроглиальные клетки способны реагировать на хронический стресс и нарушение циркадного ритма «день–ночь». Также они способны активироваться в ответ на черепно-мозговые травмы.
При обнаружении молекул, сигнализирующих о повреждении, микроглия переходит в активированное по классическому пути состояние M1. Классическая активация связана с выработкой провоспалительных цитокинов и хемокинов, таких как TNF-α, IL-6, IL-12, CCL2, IL-1β, активных форм кислорода и протеаз. Кроме того, M1-микроглия синтезирует MHC-II, интегрины (CD11b, CD11c), костимулирующие молекулы (CD36, CD45, CD47) и Fc-рецепторы. Данные цитокины активируют покоящуюся микроглию, способствуя ее пролиферации и активной миграции в очаг воспаления, где она устраняет его причину [13].
Одновременно с классической активацией, микроглия активируется по альтернативному пути и переходит в состояние М2. Данный переход инициируется за счет действия IL-4 или IL-13 и тесно связан с генами М2, которые способствуют противовоспалению, фагоцитозу клеточного мусора, восстановлению тканей и реконструкции внеклеточного матрикса. Такая микроглия активно производит аргиназу 1, противовоспалительные цитокины IL-13, IL-10, IL-4 и различные факторы роста (например BDNF и TGF-β), тем самым снижая провоспалительные иммунные реакции и поддерживая нормальное развитие головного мозга [13].
Возрастные изменения микроглии
Как говорилось выше, старение является одним из факторов риска развития нейродегенеративных заболеваний. Также оно приводит к снижению когнитивных способностей даже в непатологических состояниях [14]. Хотя микроглиальные клетки способны к самообновлению, а их продолжительность жизни может достигать 29 месяцев, они также подвержены процессам старения [15].
До сих пор нет однозначного ответа, что конкретно вызывает возрастные изменения в микроглии, но, как показывают эксперименты, с возрастом в ней увеличивается количество поврежденной ДНК, особенно в митохондриях, уменьшается длина теломер и накапливается железо (рис. 7). Все это влияет на ее профиль экспрессии и морфологию. У стареющих микроглиальных клеток снижается динамика отростков: уменьшается их ветвление и длина, а также способность к патрулированию окружающей среды. Во внутриклеточном пространстве происходит уплотнение цитоплазмы и нуклеоплазмы, ремоделирование ядерного хроматина, нарушения в работе митохондрий и системы лизосом [16].
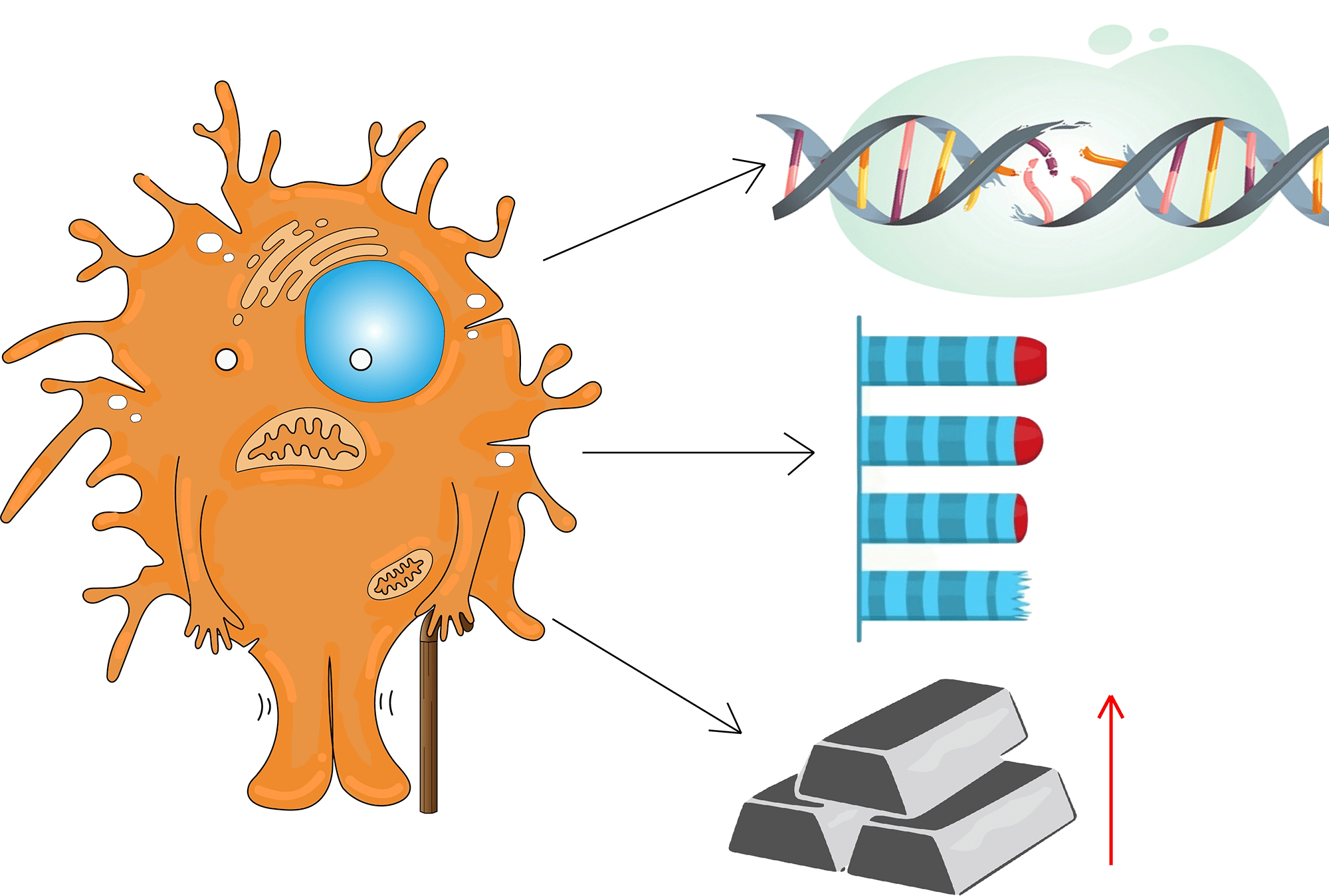
Рисунок 7. Основные клеточные дефекты в микроглиальных клетках при старении
создано в приложении Adobe Illustrator Мариной Варочкиной по мотивам Cartoon Neuron by Jimmy Smith
В «старых» микроглиальных клетках происходят изменения в энергетическом обмене и сдвиг в сторону гликолиза, который менее эффективен с точки зрения производства энергии, чем окислительное фосфорилирование. Тем не менее такие клетки по-прежнему метаболически активны и способны секретировать различные молекулы. Однако пропорции и виды секретируемых веществ сильно отличаются от нормального состояния, поэтому связанный со старением секреторный фенотип клеток называют SASP (senescence-associated secretory phenotype). В составе микроглиального SASP преобладают провоспалительные молекулы, в первую очередь TNFα, IL -1β, IL-6 и IL-8, и, помимо этого, увеличивается выработка активных форм кислорода (рис. 8). Длительное воздейсвие этих молекул на микроглиальное окружение приводит к возникновению хронического воспаления [17], [18].
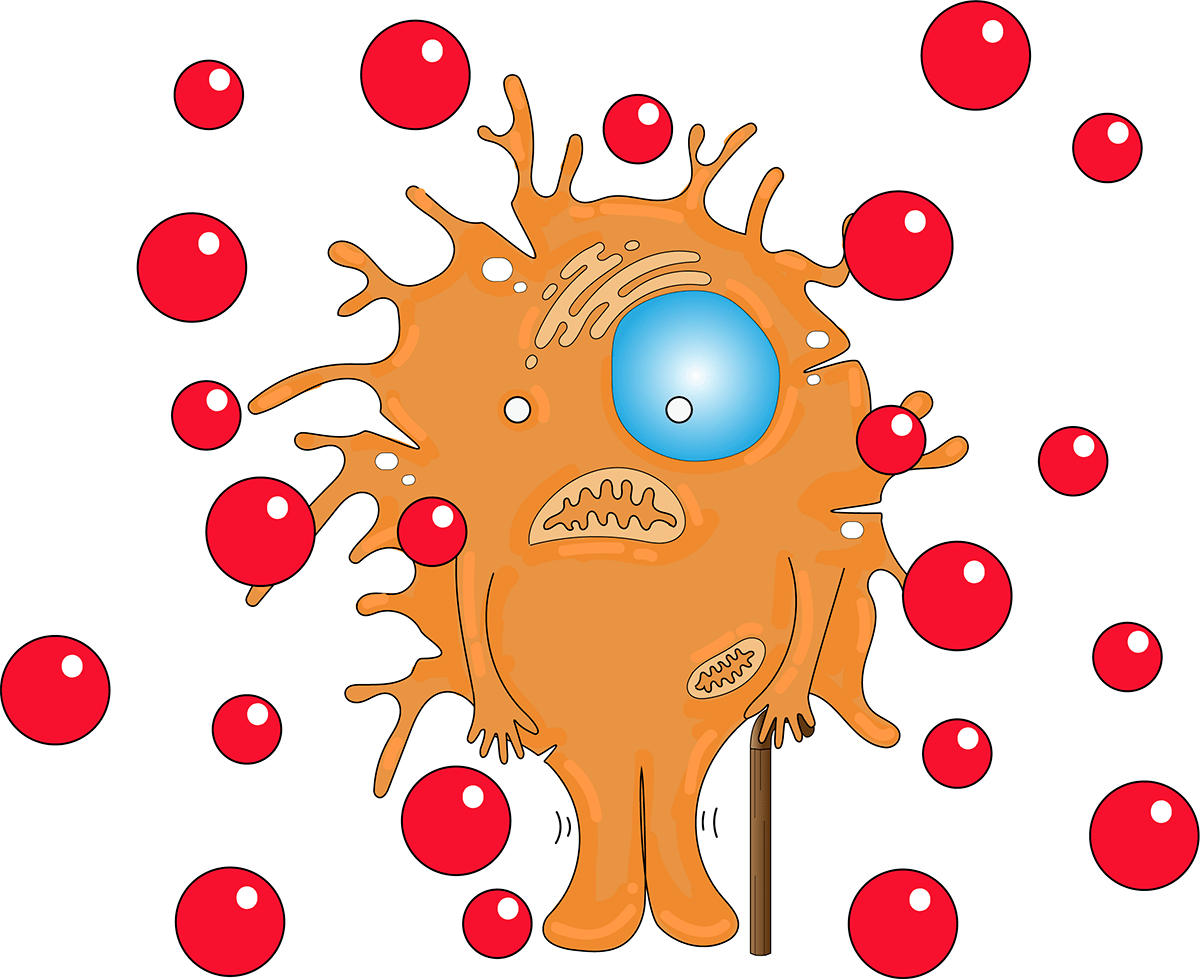
Рисунок 8. Микроглия, секретирующая факторы SASP (TNFα, IL -1β, IL-6 и IL-8)
создано в приложении Adobe Illustrator Мариной Варочкиной по мотивам Cartoon Neuron by Jimmy Smith
Такие изменения приводят к тому, что микроглия не только перестает поддерживать нормальную функциональность нейронов, но и ухудшает их работу (рис. 9). В первую очередь в нейронах снижается уровень SIRT1 (сиртуина 1). Данная молекула отвечает за деацетилирование факторов транскрипции, нарушение данного процесса вызывает геномную нестабильность в нейронах.
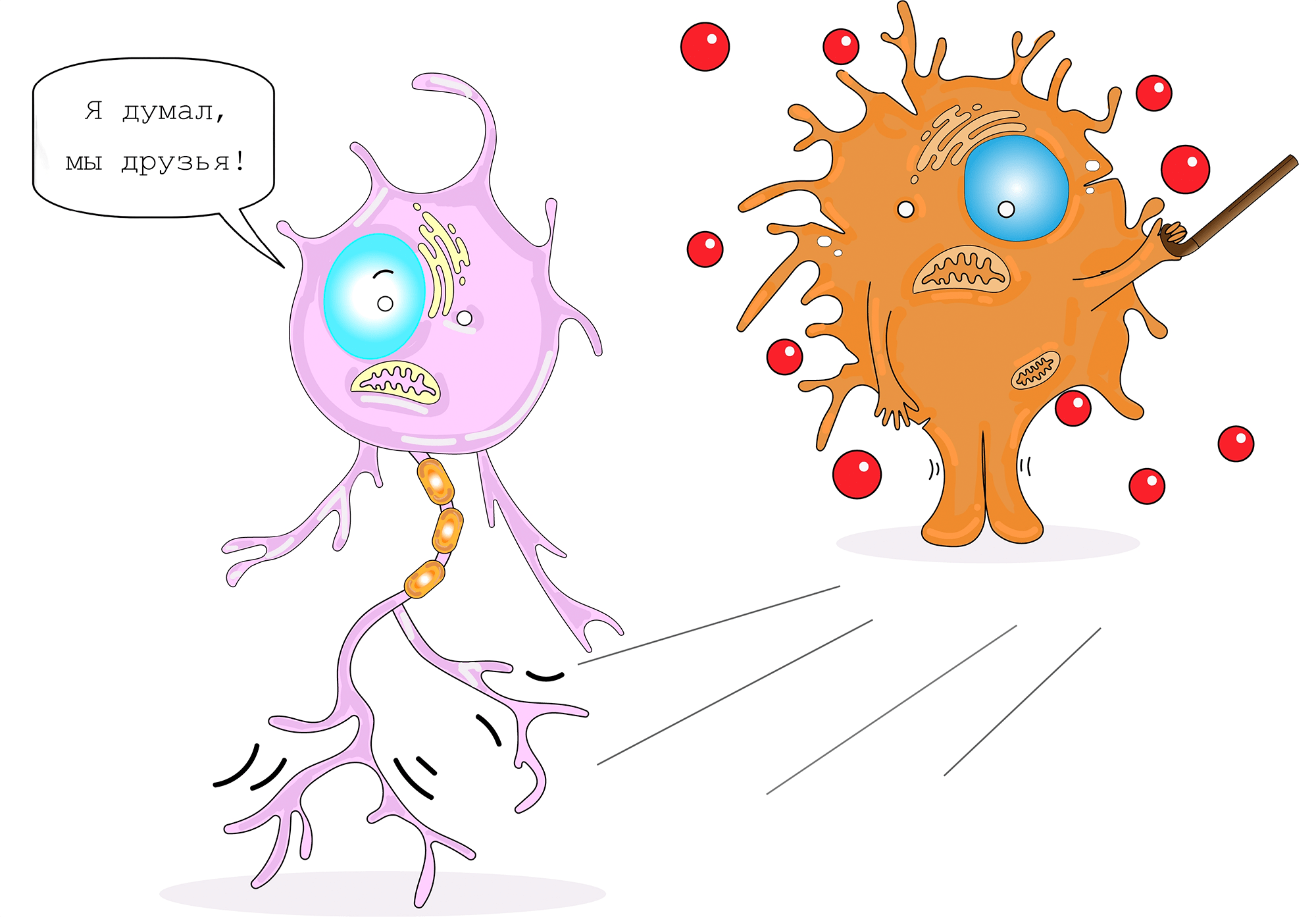
Рисунок 9. Отрицательное влияние микроглии на нейроны при старении
создано в приложении Adobe Illustrator Мариной Варочкиной по мотивам Cartoon Neuron by Jimmy Smith
Также с возрастом микроглия снижает скорость миграции, усиливает фагоцитоз, но при этом уменьшает способность переваривать поглощенные частицы, а также снижает процессы аутофагии [19]. Это имеет решающее значение при развитии нейродегенеративных заболеваний, таких как болезни Альцгеймера и Паркинсона [17], [18], [20–22], которые характеризуются внутри- и внеклеточным накоплением β-амилоида и α-синуклеина.
Старение микроглиальных клеток коррелирует со снижением когнитивных функций в возрасте, а также рассматривается как одна из причин развития нейродегенеративных заболеваний. На сегодня нет описания точных механизмов изменений функций микроглии с возрастом, поэтому исследования в данной области активно развиваются.
Заключение
Таким образом, старение микроглиальных клеток все больше рассматривается в качестве фактора развития патологий нервной системы. Потеря полезных микроглиальных функций и усиленная секреция провоспалительных молекул приводит к возникновению хронического воспаления и нарушению работы ЦНС. Поиск возможностей предотвращения негативного аспекта микроглиального старения является актуальной задачей, что делает микроглию одной из перспективных мишеней для лечений нейродегенеративных заболеваний.
Литература
- Сотворивший нейробиологию: Сантьяго Рамон-и-Кахаль;
- Amanda Sierra, Rosa C. Paolicelli, Helmut Kettenmann. (2019). Cien Años de Microglía: Milestones in a Century of Microglial Research. Trends in Neurosciences. 42, 778-792;
- Amanda Sierra, Fernando de Castro, Juan del Río-Hortega, José Rafael Iglesias-Rozas, Manuel Garrosa, Helmut Kettenmann. (2016). The “Big-Bang” for modern glial biology: Translation and comments on Pío del Río-Hortega 1919 series of papers on microglia. Glia. 64, 1801-1840;
- Ismé De Kleer, Fabienne Willems, Bart Lambrecht, Stanislas Goriely. (2014). Ontogeny of Myeloid Cells. Front. Immunol.. 5;
- Marco Prinz, Steffen Jung, Josef Priller. (2019). Microglia Biology: One Century of Evolving Concepts. Cell. 179, 292-311;
- Lijuan Zhang, Yue Cao, Xin Zhang, Xinyang Gu, Ying Mao, Bo Peng. (2022). The origin and repopulation of microglia. Developmental Neurobiology. 82, 112-124;
- Elizabeth C. Wright-Jin, David H. Gutmann. (2019). Microglia as Dynamic Cellular Mediators of Brain Function. Trends in Molecular Medicine. 25, 967-979;
- Alexei Verkhratsky, Dandan Sun, Junya Tanaka. (2021). Snapshot of microglial physiological functions. Neurochemistry International. 144, 104960;
- Davis M. Borucki, Amer Toutonji, Christine Couch, Khalil Mallah, Baerbel Rohrer, Stephen Tomlinson. (2020). Complement-Mediated Microglial Phagocytosis and Pathological Changes in the Development and Degeneration of the Visual System. Front. Immunol.. 11;
- Lijuan Zhang, Yue Cao, Xin Zhang, Xinyang Gu, Ying Mao, Bo Peng. (2022). The origin and repopulation of microglia. Developmental Neurobiology. 82, 112-124;
- Eleanor K. Greenwood, David R. Brown. (2021). Senescent Microglia: The Key to the Ageing Brain?. IJMS. 22, 4402;
- Dafina M. Angelova, David R. Brown. (2019). Microglia and the aging brain: are senescent microglia the key to neurodegeneration?. J. Neurochem.. 151, 676-688;
- Ze-Yong Yang, Wei-Lin Jin, Yu Xu, Ming-Zhu Jin. (2021). Microglia in neurodegenerative diseases. Neural Regen Res. 16, 270;
- Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни;
- Petra Füger, Jasmin K Hefendehl, Karthik Veeraraghavalu, Ann-Christin Wendeln, Christine Schlosser, et. al.. (2017). Microglia turnover with aging and in an Alzheimer's model via long-term in vivo single-cell imaging. Nat Neurosci. 20, 1371-1376;
- Eleanor K. Greenwood, David R. Brown. (2021). Senescent Microglia: The Key to the Ageing Brain?. IJMS. 22, 4402;
- Dafina M. Angelova, David R. Brown. (2019). Microglia and the aging brain: are senescent microglia the key to neurodegeneration?. J. Neurochem.. 151, 676-688;
- Elizabeth C. Wright-Jin, David H. Gutmann. (2019). Microglia as Dynamic Cellular Mediators of Brain Function. Trends in Molecular Medicine. 25, 967-979;
- Аутофагия, протофагия и остальные;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Болезнь Паркинсона: что изучать? как изучать?;
- Jéssica Costa, Solange Martins, Pedro A. Ferreira, Ana M.S. Cardoso, Joana R. Guedes, et. al.. (2021). The old guard: Age-related changes in microglia and their consequences. Mechanisms of Ageing and Development. 197, 111512;
- Tom Arnold, Christer Betsholtz. (2013). The importance of microglia in the development of the vasculature in the central nervous system. Vasc Cell. 5, 4.