Структура бактериальной стерол-редуктазы поможет разобраться с нарушениями биосинтеза стеролов у человека
03 февраля 2015
Структура бактериальной стерол-редуктазы поможет разобраться с нарушениями биосинтеза стеролов у человека
- 1789
- 0
- 1
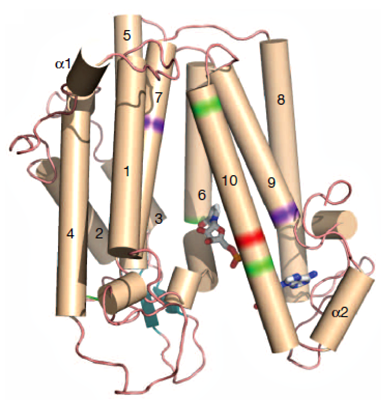
Модель рецептора ламина B человека и картирование мутаций, приводящих к развитию аномалии лейкоцитов Пельгера-Хьюета (показано зеленым) и дисплазии Гринберга (показано фиолетовым). Красным показана мутация, приводящая к развитию обоих нарушений.
Рисунок в полном размере.
-
Автор
-
Редактор
Стеролы — неотъемлемые компоненты большинства клеточных мембран. Нарушения биосинтеза стеролов у человека приводят к развитию широкого спектра заболеваний. Знание трехмерной структуры ключевых ферментов этого пути необходимо для разработки эффективных методов лечения. Большинство ферментов, участвующих в биосинтезе стеролов, заякорены в мембране, и их структуру выяснить непросто. Однако недавно удалось получить трехмерную структуру стерол-редуктазы MaSR1 метанотрофной бактерии Methylomicrobium alcaliphilum 20Z. Оказалось, этот бактериальный белок принципиально очень похож на стерол-редуктазы человека, а данные о его пространственной структуре смогут пролить свет на патогенез заболеваний, связанных с нарушением биосинтеза стеролов у человека.
Стеролы (еще известные как «стероидные спирты») — это класс амфипатических органических соединений. Один из концов их молекулы обладает гидрофобными свойствами, а другой — гидрофильными. Благодаря такой двойственности стеролы выступают неотъемлемым компонентом клеточных мембран [1]. У каждого царства эукариот, как гимн или государственная валюта, есть свой особенный, преобладающий, стерол. У грибов — это эргостерол, у растений — фитостерол, а у животных — холестерин.
Холестерин повышает плотность упаковки фосфолипидных головок липидного бислоя, стабилизируя мембраны в широком интервале температур, тем самым влияет на их проницаемость [2]. Также холестерин является метаболическим предшественником стероидных гормонов и необходим для синтеза витамина D. Нарушение регуляции обмена холестерина может привести к развитию атеросклероза и сопутствующих заболеваний. Но сейчас история не об этом.
Труженики холестеринового производства
У человека холестерин вырабатывается эндогенно из ацетил-КoА и ряда простых водорастворимых предшественников. Многие из ферментов этого пути заякорены в мембране за счет трансмембранных доменов. Хотя общая последовательность реакций биосинтеза холестерина известна довольно давно, данных о пространственной структуре многих ключевых ферментов пока нет.
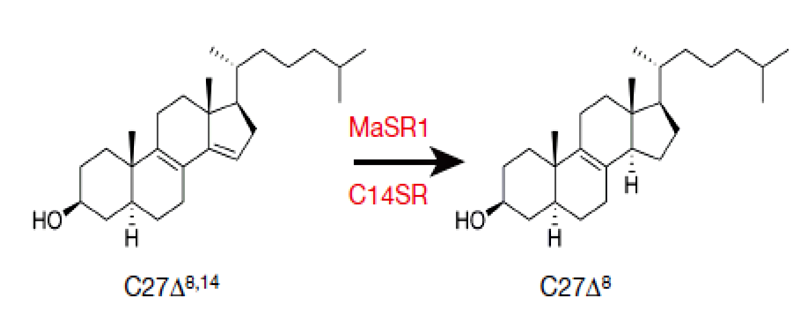
Рисунок 1. Реакция восстановления стерола, катализируемая стерол-редуктазами C14SR (у человека) и MaSR1 (у Methylomicrobium alcaliphilum).
В частности, долгое время не удавалось выяснить структуру стерол-редуктаз — ферментов, восстанавливающих двойные углеродные связи стеролов за счет протонов кофактора (NADH или NADPH) (рис. 1). У человека известно несколько стерол-редуктаз: Δ14-стерол-редуктаза (C14SR), 7-дегидрохолестерол-редуктаза (DHCR7) и 24-дегидрохолестерол-редуктаза (DHCR24). Кроме того, оказалось, что многофункциональный рецептор ламина B (LBR), расположенный во внутренней ядерной мембране, также содержит
Мутации в генах стерол-редуктаз приводят к аномалии лейкоцитов Пельгера-Xьюета (изменению формы их ядер), скелетной дисплазии Гринберга (несовместимому с жизнью нарушению развития скелета у эмбрионов) и синдрому Смита-Лемли-Опица (инвалидизирующим метаболическим нарушениям). Структура мембранных стерол-редуктаз до сих пор не была установлена, что затрудняло понимание молекулярного механизма их действия и причины патологий. И вот наконец, группа ученых из Нью-Йорка и Перуджи опубликовала работу с долгожданным описанием этих ферментов [3].
Отдельно нужно подчеркнуть, что выяснение структуры мембранных белков — это, как правило, сложная задача [4]. Большая площадь гидрофобной поверхности, гибкая структура и низкий уровень экспрессии — все это затрудняет получение нужного количества белка для выращивания кристаллов. Несмотря на огромную биологическую значимость, известно гораздо меньше структур трансмембранных белков по сравнению с технически более удобными водорастворимыми и глобулярными белками.
Один из наиболее эффективных подходов для выяснения структуры мембранных белков — гомологичное моделирование [5]. Основная идея здесь — найти похожий, но легко кристаллизующийся, белок и построить его структуру. На эту модель можно «натянуть» ваш любимый, но некристаллизующийся белок. Этот трюк позволит оценить расположение активного центра и получить хотя бы грубый набросок структуры.
Так и поступили Li и коллеги [3]. Хорошо кристаллизующимся гомологом стерол-редуктаз человека оказался, как ни странно, интегральный мембранный белок MaSR1 аэробной метанотрофной бактерии Methylomicrobium alcaliphilum 20Z. Эта бактерия живет в очень соленых озерах и использует метан в качестве источника углерода и энергии, а ее мембрана содержит большое количество стеролов и гопаноидов (пентациклических тритерпенов) [6]. Хотя филогенетически это довольно далекий организм, сходство последовательности MaSR1 со стерол-редуктазами человека C14SR, DHCR7 и
Структура и работа MaSR1
MaSR1 кристаллизовали вместе с кофактором (NADPH) и получили структуру с разрешением в 2,74 ангстрема (рис. 2). Две молекулы MaSR1 образуют немного асимметричный димер размером 50×45×58 Å. Фермент содержит 10 трансмембранных спиралей (TM1–10). Руководствуясь правилом «положительные остатки внутри»,
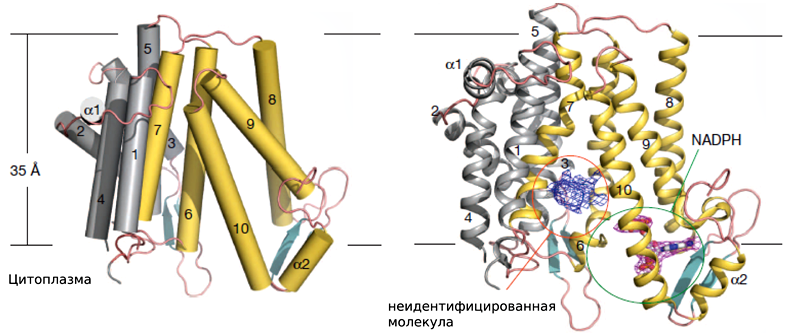
Рисунок 2. Общая архитектура MaSR1, ориентированного в мембране.
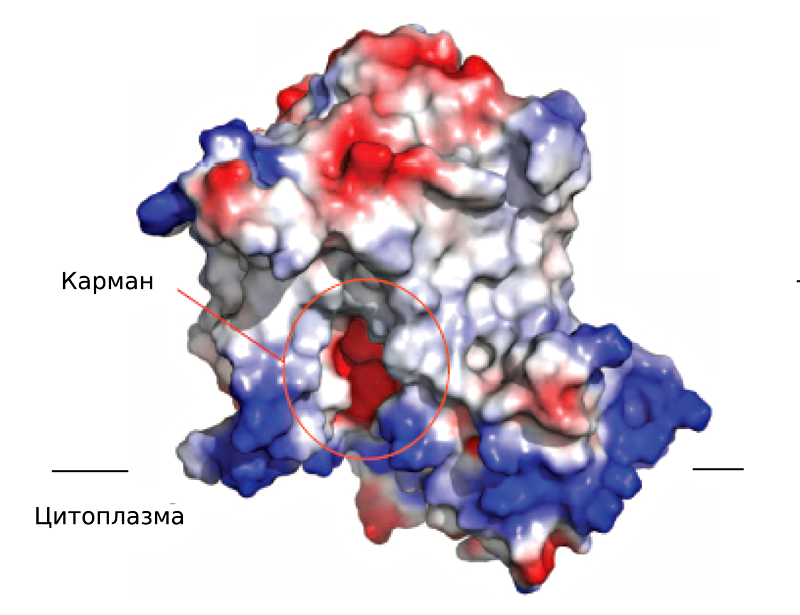
Рисунок 3. Электростатическая поверхность MaSR1.
За исключением никотинамид-рибозной части, молекула NADPH отчетливо видна на структуре. Никотинамидное кольцо NADPH служит донором протонов водорода при реакции взаимодействия с субстратом. Однако рассматриваемая структура получена без субстрата (стерола). Возможно, поэтому NADPH и не сориентирован нужным образом, а точное положение никотинамидного кольца определить нельзя. Другая половина молекулы NADPH стабилизирована за счет водородной связи с одним из остатков (Tyr414) второй α-спирали (α2) и хорошо видна на карте электронной плотности. Остальная полость кармана для NADPH выстлана тремя трансмембранными спиралями (TM8–10). Если мутировать аминокислотные остатки, формирующие NADPH-связывающий карман, MaSR1 немедленно теряет каталитическую активность.
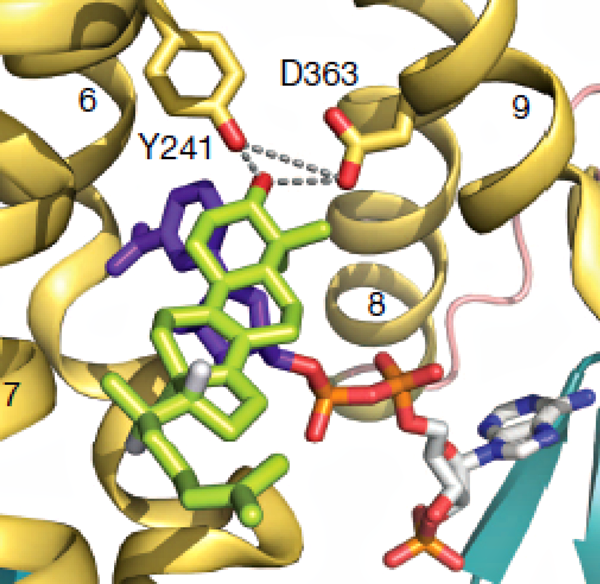
Рисунок 4. Карман для связывания субстрата в структуре MaSR1.
Основной принцип работы редуктаз — пространственное сближение кофактора с субстратом. Это приводит к восстановлению двойной углеродной связи в структуре субстрата за счет протонов никотинамидного кольца кофактора. NADPH-связывающий карман MaSR1 стабилизирован в пространстве за счет особенного аминокислотного мотива, между членами которого образуется треугольник водородных связей (рис. 4). Именно они удерживают β3-гидроксил стерола или стероида. Этот треугольник построен на остатках Tyr241 и Asp363, расстояние между которыми составляет 3,9 Å. Белок MaSR1 с двойной мутацией (Y241F/D363A) совершенно теряет стерол-редуктазную активность. Исходя из полученной структуры, предположили, что гидрофобные контакты между высококонсервативными Trp274 и Tyr387 обеспечивают взаимодействие между трансмембранными доменами 7 и 10 (TM7, TM10). Согласно результатам моделирования, структура кармана ориентирует NADPH таким образом, что восстанавливающий хвост молекулы прижимается к двойной связи стеролов (стероидов), которая затем восстанавливается. Аналогичный механизм характерен для семейства альдо-кето-редуктаз, участвующих в биосинтезе стероидов у человека.
Модель одна — прозрений много
На основании модели фермента MaSR1 построены гомологичные модели для стерол-редуктаз человека LBR и DHCR7. Модели использовали для картирования известных мутаций. Практически все мутации, приводящие к развитию скелетной дисплазии Гринберга, аномалии лейкоцитов Пельгера и синдрому Смита-Лемли-Опица, приходятся на каталитический домен и домены, обеспечивающие связывание с кофактором и субстратом. Сходство патогенеза указанных заболеваний обусловлено сходными нарушениями в процессе восстановления стеролов. Примечательно, что стерол-редуктазы узнают свой невосстановленный субстрат достаточно неспецифично. Так, MaSR1 может восстанавливать двойные связи и C27Δ, и эргоста-8,14-диенола (субстрат стерол-редуктазы дрожжей). Столь же неспецифична и LBR: может катализировать восстановление C27Δ, компенсировать функцию C14SR, а также катализировать восстановление различных стерольных субстратов дрожжей.
И, наконец, структура MaSR1 проливает свет на функцию LBR. Поиск полных структурных гомологов MaSR1 среди известных структурных белков не увенчался успехом, однако обнаружилось сходство между трансмембранными доменами TM6–10 MaSR1 и изопренилцистеин-метилтрансферазой (ICMT). ICMT распознает, а затем карбоксиметилирует фарнезилированный цитозин субстрата. Возможно, C14SR-домен LBR занимается примерно тем же самым: распознает фарнезилированный цитозин преламина А или ламина B и тем самым регулирует их транспорт в ядро.
Литература
- Липидный фундамент жизни;
- Холестериновая страшилка, которая правит миром;
- Xiaochun Li, Rita Roberti, Günter Blobel. (2015). Structure of an integral membrane sterol reductase from Methylomicrobium alcaliphilum. Nature. 517, 104-107;
- Chen C.P., Rost B. (2002). State-of-the-art in membrane protein prediction. Appl. Bioinf. 1,
21–35; https://pubmed.ncbi.nlm.nih.gov/15130854/; - Торжество компьютерных методов: предсказание строения белков;
- В генетическом контакте.