
Липидный фундамент жизни
22 января 2012
Липидный фундамент жизни
- 28375
- 4
- 23
Возникшая в 1970-е годы концепция жидкостно-мозаичной модели биологической мембраны, где липидам отводится пассивная роль «океана», в котором «айсберги» белковых комплексов разыгрывают предназначенные им биологические роли, немного устарела. Согласно современным представлениям, тщательно подобранный эволюцией липидный состав мембран играет роль не менее важную, а, возможно, даже более фундаментальную.
картинка в мраморе: Singer & Nicholson, 1972 [3]
-
Авторы
-
Редакторы
Темы
Жизнь в том виде, в каком мы ее знаем, невозможно представить без биомембраны, разделяющей «внутренний мир» клетки и всё остальное пространство. Мембрана обеспечивает взаимодействие клетки с внешней средой, избирательно пропуская многие вещества, а также является средой протекания множества биохимических процессов. И хотя большую часть полезной работы выполняют белки, которыми мембрана буквально «нашпигована», роль липидного матрикса не стоит недооценивать. Липиды — это не просто «океан», в котором плавают белки. Это «умный» океан, чьи физико-химические свойства были тщательно подобраны в ходе эволюции так, чтобы создать эффективную платформу для функционирования и взаимодействия мембранных белков.
Вопрос зарождения жизни на Земле вряд ли когда-нибудь получит окончательный ответ, но мало кто сомневается в том, что само ее появление стало возможным лишь в тот момент, когда в «первичном бульоне» (так в биологии принято называть растворенные в доисторическом мировом океане простые органические вещества) стали появляться маленькие изолированные области пространства, ставшие основной ареной для эволюции. В этих «первичных клетках» биохимические процессы могли протекать существенно быстрее, нежели на безбрежных просторах океана, и такое разделение является одной из предпосылок для первых, добиологических, шагов эволюции. Один из теоретиков абиотического происхождения жизни на Земле — академик А.И. Опарин — представлял себе эти «первичные клетки» в виде коацерватов (свободно плавающих липидных пузырьков, внутри которых протекала химическая эволюция). Согласно некоторым современным воззрениям, жизнь могла зародиться в гидротермальных источниках, где «первичная клетка» была образована минеральными отложениями [1]. Так или иначе, именно компартментализация (этим сложным словом обозначают обособленность содержимого клетки от внешней среды, а также подразделение самих клеток на внутренние «отсеки») является одним из непреложных признаков жизни.
Краткая история исследования липидов и биомембран
Структурообразующую функцию биологических мембран выполняют липиды — амфифильные молекулы, имеющие полярную головку и неполярный (гидрофобный) хвост. Они малорастворимы в воде и склонны к образованию моно- и бимолекулярных слоев благодаря своей амфифильной природе. Еще из школьного курса биологии известно, что мембрана состоит из двойного слоя (бислоя) липидов, «прячущих» от воды внутрь гидрофобные и выставляющих на поверхность полярные (гидрофильные) части [2].
Любопытно, что одним из первых исследователей свойств липидов стал один из «отцов-основателей» США Бенджамин Франклин, который в 1773 году провел серию экспериментов по измерению площади масляных пятен на поверхности пруда, остающихся от ложки (5 мл) растекающегося оливкового масла: пятна неизменно оказывались размером ≈2000 м2. Если бы любознательный сэр имел в то время представление о молекулярном строении вещества, он легко мог бы вычислить площадь, приходящуюся на одну молекулу (!) триглицерида олеиновой кислоты (основного компонента оливкового масла) в этом мономолекулярном пятне, и, причем, довольно точно:
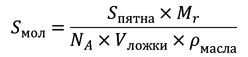
где Mr — масcа 1 моля триолеина, NA — число Аводгадро, Sпятна — площадь пятна, Vложки — объем ложки, ρмасла — плотность масла. В результате мы получим значение площади Sмол ≈ 1 нм2 (на молекулу). Несложно оценить и толщину мономолекулярного слоя, равную размеру одной молекулы триолеина, разделив Vложки на Sпятна — 2,5 нм.
Более ста лет спустя, Чарльз Овертон заметил, что через биомембраны сравнительно легко проникают вещества, хорошо растворимые в липидах, из чего он сделал заключение, что мембрана должна быть образована тонким липидным слоем. Так эксперименты Франклина оказались впереди современных биофизических изысканий. 1925-м годом датируется идея бислойности мембраны: Гортер и Грендель обнаружили, что монослой липидов, выделенных из мембран эритроцитов, ровно вдвое превосходит площадь поверхности самих клеток.
Однако тогда же было замечено, что мембрана содержит значительное количество белков, которые сильно влияют на ее свойства (в частности, поверхностное натяжение). Это открытие повлекло появление концепции мембраны-«сендвича» (Доусон и Доннелли, 1935), согласно которой липидный бислой, как слой масла в бутерброде, заключен между двумя слоями белка. Прошло не одно десятилетие, пока точные данные по соотношению белков и липидов в мембранах различных клеток и современные методы исследования (такие как рентгеноструктурный анализ и электронная микроскопия) не доказали ошибочности этого представления: на самом деле, белки не окружают бислой, — они в него «встроены», подобно элементам мозаики.
Эта метафора дала название последней «классической» теории строения мембраны: «жидкостно-мозаичная мембрана» [3]. Согласно этой теории, мембрана представляет собой липидный «океан», в котором, подобно айсбергам, плавают молекулы мембранных белков. Сравнение с океаном появилось из-за того, что агрегатное состояние липидов в мембране жидкое, а точнее — жидкокристаллическое. Мембрана сравнительно свободно «течет» в плоскости, в то время как вне нее — строго упорядочена геометрией двойного молекулярного слоя.
«Последней классической» эта теория здесь названа потому, что, с одной стороны, она явно устарела, а с другой — современные представления не достигли еще той лаконичной изящности, чтобы их начала запросто можно было изложить в школьном учебнике [4].
В настоящее время стало понятно, что липидный компонент мембраны — это не просто пассивный носитель белков, которые и выполняют всю работу, но равноправный участник большинства биохимических процессов. На поверку оказывается, что липидный состав мембраны (а она состоит отнюдь не из одного типа молекул липидов!) тщательно оптимизирован эволюцией и позволяет создать необходимые условия для корректной и эффективной работы мембранных белков. Например, частичное взаимное несмешивание липидных компонентов мембраны эукариотической клетки приводит к появлению микроскопических (строго говоря, даже наноскопических) неоднородностей, называемых также мембранными рафтами (от англ. raft — «плот»). Такое сложное фазовое поведение липидного матрикса мембраны активно используется клеткой: упомянутые рафты, предположительно, образуют функциональные платформы, в которых комплексы мембранных белков выполняют все разнообразие своих функций, причем определенные белки предпочитают находиться в рафтовых областях, тогда как другие — в областях между ними.
В данной статье мы постарались осветить современные представления о биофизике липидных компонентов биологических мембран, и в первую очередь, подробнее остановиться на способности липидов к самоорганизации, которая широко используется клетками в своих нуждах.
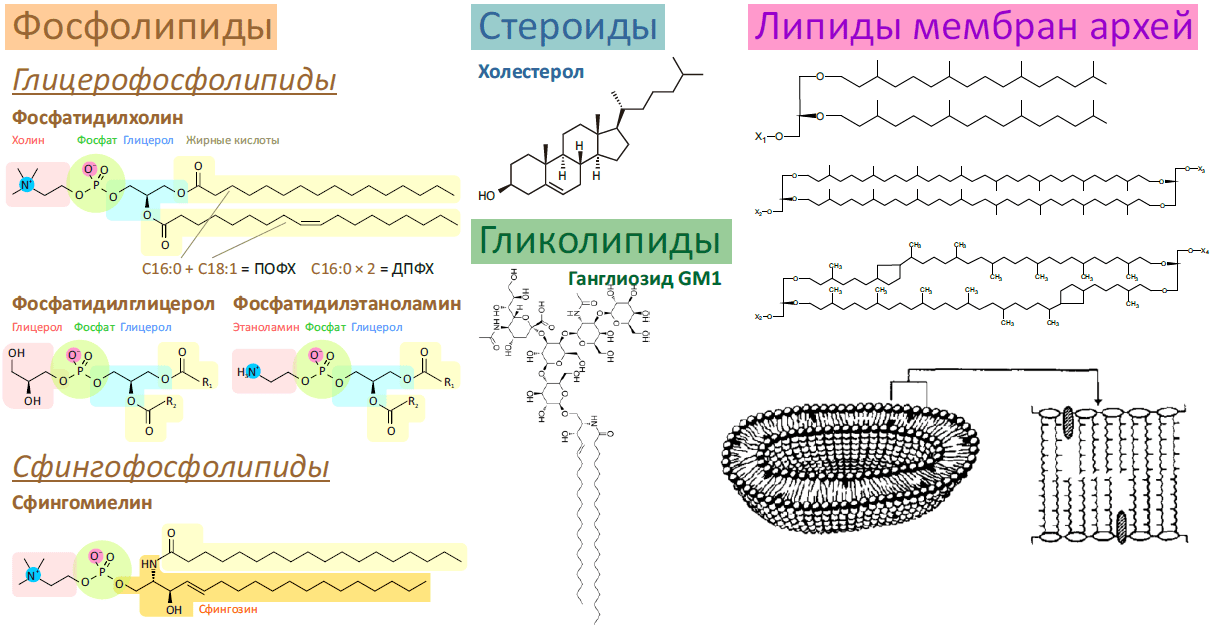
Рисунок 1. Разнообразие липидов — компонентов клеточных мембран. «Комбинаторное» построение большинства липидов (то есть, сочетание разных гидрофобных, гидрофильных и «адапторных» фрагментов) приводит к тому, что в клетке обнаруживается до 1000 разновидностей липидных молекул. Подавляющее большинство из них играет регуляторную роль, либо их роль не изучена. На рисунке показаны только некоторые основные типы липидов, встречающихся в биологических мембранах.
- Фосфолипиды — один из основных компонентов плазматической мембраны эукариот и бактерий. Являются сложными эфирами жирных кислот («хвосты») и многоатомных спиртов (преимущественно глицерола, сфингозина и инозитола), соединенных через остаток фосфорной кислоты с добавочной группой («головкой»). Глицерофосфолипидов в мембранах по массе больше всего, и это наиболее пластичный и текучий их компонент. В зависимости от типа головки эти липиды делят на классы: фосфатидилхолины (головка — холин), фосфатидилглицеролы, фосфатидилэтаноламины и т.д. Полное название липида включает также наименование жирных кислот, образующих хвосты, например олеиновая (одна двойная связь — C18:1 [9]) и пальмитиновая (все связи насыщены — С16:0) кислоты образуют пальмитоилолеилфосфатидилхолин (ПОФХ), а две молекулы пальмитиновой кислоты — дипальмитоил фосфатидилхолин (ДПФХ).
Сфингофосфолипиды также имеют два ацильных хвоста, но только один из них принадлежит жирной кислоте: второй относится к сфингозину. Один из таких липидов — сфингомиелин (в обилии встречается в миелиновой оболочке аксонов) — является важным компонентом клеточной мембраны, придавая ей жесткость и уникальные физико-химические свойства. Самые простые сфингофосфолипиды называются церамидами. - Холестерол (он же холестерин) — другой важный липид клеточной мембраны, стабилизирующий ее текучесть, — является отличительной чертой мембран эукариот (его нет ни у бактерий, ни у архей). Кроме стабилизации мембран (обычно «в паре» со сфингомиелином), холестерол является предшественником половых гормонов и витамина D. О свойствах холестерола и сфингомиелина подробнее рассказано дальше.
- Гликолипиды, имеющие в качестве полярной головки один или несколько остатков сахаров, также являются компонентами мембран (преимущественно внешнего монослоя). Основной их формой являются гликосфинголипиды, благодаря чему эти липиды, как правило, колокализованы со сфинголипидами (а именно, расположены в жидкой упорядоченной фазе). Основная их роль — межклеточное распознавание, и кроме пользы (например, определения групп крови) эта их функция может быть и вредна: многие ганглиозиды (например, GM1) являются рецепторами бактериальных токсинов и вирусов.
- Липиды мембран архебактерий существенно отличаются от таковых у бактерий и эукариот, — видимо, вследствие эволюционной адаптации к термофильности, галофильности, ацидофильности и прочей экстремофильности, которой знамениты археи. Отличий от фосфолипидов несколько:
- Используется другой стереоизомер глицерола.
- Жирными хвостами служат изопреноидные спирты, а не жирные кислоты.
- Соединяются они с помощью простой, а не сложной эфирной связи.
- Липиды могут быть биполярными (сшиваются концами хвостов), пронизывая при этом всю мембрану насквозь.
- Вместо двойных связей липидные хвосты могут содержать циклопентановые кольца, играющие ту же роль.
Многообразие биомембран
Не удивительно, что мембраны клеток разных организмов отличаются между собой. Подробное сравнение липидной составляющей различных мембран наводит на мысль, что эти различия носят принципиальный характер, и что «липидный портрет» той или иной мембраны во многом определяет ее функции (помимо «населяющих» эту мембрану белков) [5]. Так, мембраны бактерий отличаются от мембран эукариот тем, что в состав первых входит большое количество отрицательно заряженных фосфолипидов (например, фосфатидилглицеролы), тогда как вторые в основном содержат липиды цвиттерионной природы (то есть, обладая как отрицательным, так и положительным зарядом, в целом они электронейтральны), — например, фосфатидилхолины. Это фундаментальное отличие используется системой врожденного иммунитета многих эукариот, — например, антимикробные пептиды селективно разрушают мембраны бактерий именно благодаря наличию отрицательного заряда на их поверхности [6], [7], а Toll-подобные рецепторы распознают бактериальные патогены благодаря компонентам их клеточной стенки (липиополисахаридам) [8], [9]. (Химическая структура упоминаемых липидов приведена на рис. 1.)
Другая важная особенность эукариот — холестерол (известный также как холестерин), отсутствующий в прокариотических мембранах. Вопреки своей дурной славе у обывателей [12], холестерол играет важнейшую и еще, видимо, не до конца осознанную роль в работе мембран наших клеток (не говоря уже о том, что он является предшественником половых гормонов). Вместе со сфинголипидами (такими как сфингомиелин) холестерол образует рафтовые структуры, придающую эукариотическим мембранам прочность и особую функциональную гетерогенность, о чем подробнее будет сказано ниже.
Интересно, что липидный состав разных органелл существенно отличается (рис. 2). Например, липидный состав митохондрий и пластид гораздо больше напоминает бактериальный, нежели эукариотический, подтверждая тем самым химерную гипотезу становления эукариот (эукариогенеза), согласно которой эти органеллы — бывшие бактерии, захваченные во «внутриклеточный плен» путем фагоцитоза какими-то ранними формами эукариот [13]. В эндоплазматическом ретикулуме, являющемся «стартовой точкой» метаболизма большинства липидов, состав обоих листков мембраны примерно одинаковый, однако в аппарате Гольджи, плазматической мембране и эндосомах различия уже весьма существенны, что говорит о наличии активных процессов, создающих эту асимметрию. В частности, фосфатидилсерины (ФС) и фосфатидилэтаноламины (ФЭ) в норме присутствуют только в цитоплазматическом листке плазматической мембраны. Наличие ФС на поверхности клетки может говорить о злокачественном перерождении и запускает программы фагоцитоза и сворачивания крови.
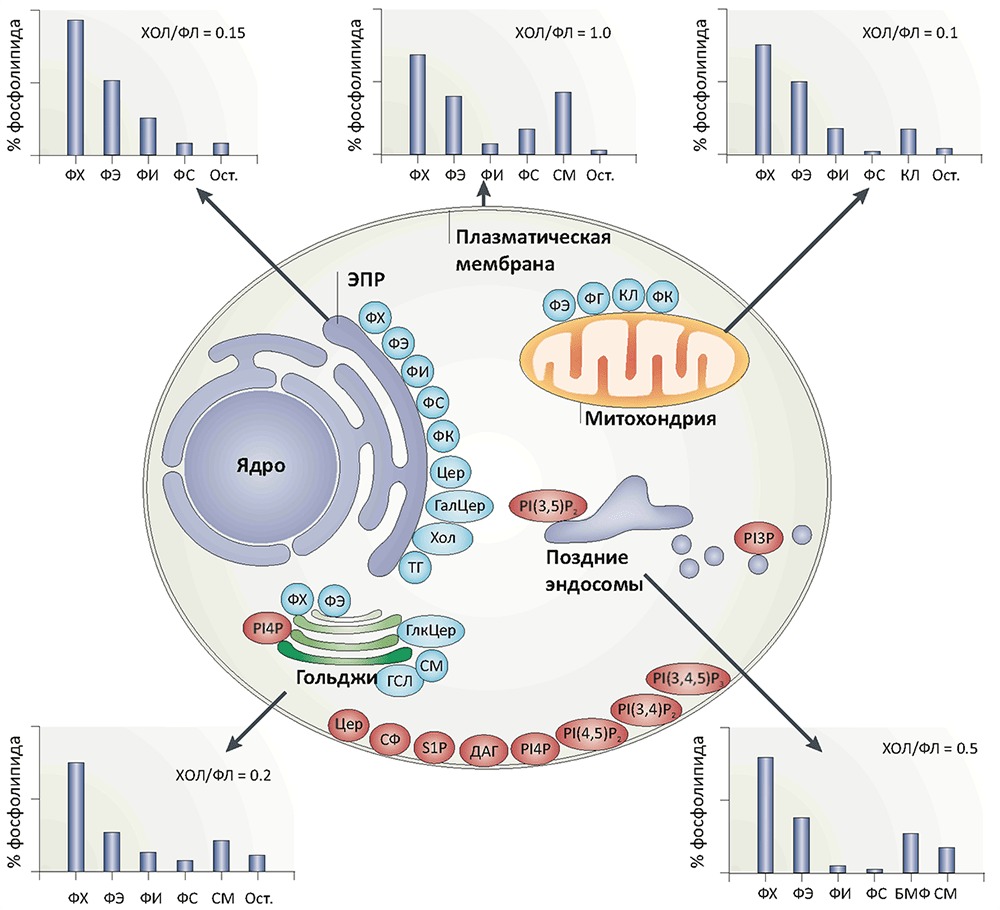
Рисунок 2. Липидный состав различных мембранных структур клеток млекопитающих. Диаграммы показывают липидный состав некоторых клеточных мембран; содержание холестерола (ХОЛ) дано в отношении к суммарному количеству фосфолипидов (ФЛ). Внутри клетки обозначены места синтеза основных фосфолипидов (голубые овалы) и сигнальных липидов (красные овалы) (последних по массе не более 1% от фосфолипидов, за исключением церамидов (Цер)). В эндоплазматическом ретикулуме (ЭПР) синтезируются в основном глицерофосфолипиды, жиры, холестерол и церамиды. Аппарат Гольджи является «поставщиком» сфингомиелина и сложных гликосфинголипидов. Около половины липидов митохондрий (в основном, фосфатидилэтаноламина (ФЭ), фосфатидной кислоты (ФК) и кардиолипина (КЛ)) синтезируется этими органеллами автономно, что, вместе с типично «бактериальным» липидным составом их мембран, говорит в пользу химерной теории эукариогенеза.
Условные обозначения: БМФ — бисмоноацилглицерофосфат; ГалЦер — галактозилцерамид; ГСЛ — гликосфинголипиды; ДАГ — диацилглицерол; КЛ — кардиолипин; СМ — сфингомиелин; ТГ — триацилглицеролы (жиры); ФГ — фосфатидилглицерол; ФИ — фосфатидилинозитол; ФК — фосфатидная кислота; ФС — фосфатидилсерин; ФХ — фосфатидилхолин; ФЭ — фосфатидилэтаноламин; Хол — холестерол; Цер — церамид; PI(?)P — фосфатидилинозитолфосфаты; S1P — сфингозин-1-фосфат; Ост. — остальные липиды.
Совершенно уникальной организацией мембран обладают архебактерии — третий «домен» жизни [10], [11], наряду с бактериями и эукариотами. Эволюционно они считаются более близкими родственниками эукариот, нежели бактерий, хотя по строению липидов мембраны этого не скажешь [14]. Видимо, как адаптация к экстремофильности (способности обитать при высокой температуре и/или солености и/или кислотности), мембраны архей содержат липиды с нетипичным химическим строением (см. рис. 1):
- используется другая конфигурация остатка глицерола;
- неполярные «хвосты» крепятся к этому остатку не сложными, а простыми эфирными связями;
- хвосты имеют не линейную структуру, а состоят из изопреновых звеньев, и, что самое интересное, архейные липиды могут быть биполярными («сшитыми» кончиками и пронизывающими всю мембрану насквозь) и содержать для большей прочности циклопентановые кольца, предположительно выполняющие функцию двойных связей в «обычных» фосфолипидах (регулирование температуры плавления).
Из всего сказанного следует, что липидный состав мембран отнюдь не является чем-то выбранным раз и навсегда [15]: он претерпел существенные изменения в процессе эволюции. Даже в разные периоды жизни одного и того же организма состав мембран может существенно варьировать. По всей видимости, липидную организацию мембран эукариот можно считать эволюционно наиболее прогрессивной, поскольку она обеспечивает максимально гибкую адаптацию микроскопического окружения под нужды белковых молекул, создавая частично изолированные области в пределах одной, казалось бы, жидкой фазы. Далее мы остановимся на этих аспектах функционирования гетерогенной эукариотической мембраны подробнее.
Латеральная гетерогенность эукариотических мембран
Что же заставило исследователей обратить внимание на то, что мембрана — это нечто более сложно устроенное, нежели липидный «океан», в котором плавают «айсберги» белков, согласно модели Сингера-Николсона? Можно сформулировать три основных аргумента, почему клеточная мембрана должна быть устроена более сложно и организованно, чем это было принято считать в те годы:
- В каждой эукариотической клетке присутствует более 1000 разновидностей липидов — такое разнообразие обеспечивается возможностью комбинации различных полярных «головок» и гидрофобных «хвостов» [5], [16]. Из этого следует многообразие ролей липидов в организме, — хотя структурные свойства мембран определяются, видимо, основными тремя–четырьмя компонентами (если не считать белков, конечно).
- Распределение липидов и белков в плоскости мембраны неоднородно, а, напротив, обладает характерной структурой, — это принято называть латеральной гетерогенностью. Гетерогенная организация наблюдается и для сравнительно простых (например, трехкомпонентных) смесей липидов, используемых в качестве моделей биомембран: в пределах единой жидкокристаллической фазы появляются микрофазы, не смешивающиеся между собой (см. далее). В мембранах клеток подобная самоорганизация обеспечивает сортировку мембранных белков в различные компартменты в пределах одной и той же поверхности, повышая эффективность взаимодействия белков между собой.
- Функциональное состояние мембраны существенно неравновесно. Оно может быть стационарным (когда концентрации разных липидов сохраняются примерно на том же уровне), но обязательно включает непрерывный обмен веществом (регенерация и «отпочковывание» участков мембраны). Таким образом, неравновесные диссипативные процессы играют важную роль не только в биохимии, но даже и в биофизике мембраны.
В практическом смысле вышеперечисленное обозначает, что липидная компонента, будучи жидкой, тем не менее, способна образовывать частично изолированные области бислоя, обладающие особыми структурными свойствами. Эти участки представляют собой кластеры («островки») молекул липидов, сравнительно более упорядоченные и «твердые», чем окружающая их более «жидкая» фаза. В конце 1990-х такие кластеры получили уже упомянутое название рафтов [17], и то же самое название было дано новой теории организации биологических мембран.
Сосуществование двух жидких липидных фаз — относительно более и менее упорядоченной — оказывается возможным, если липидная смесь содержит как минимум три компоненты: «легкоплавкий» липид (низкая температура плавления, ненасыщенные хвосты), «тугоплавкий» липид (температура плавления выше физиологической, насыщенные хвосты и/или высокая склонность образовывать водородные связи с соседями), а также холестерол. «Тугоплавких» липидов в эукариотической мембране немного, потому что иначе она была бы гелеобразной массой вроде маргарина: основным является сфингомиелин (производное церамида, рис. 1).
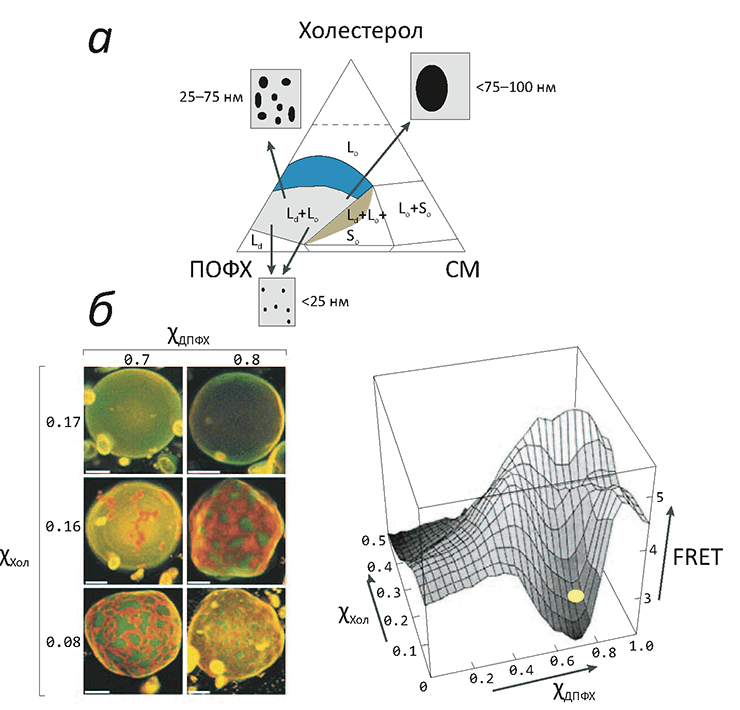
Рисунок 3. «Жидкое упорядоченное» состояние липидов в модельных мембранах. а — Фазовая диаграмма тройной смеси холестерола (Хол), сфингомиелина (СМ) и пальмитоилолеилфосфатидилхолина (ПОФХ) (при 23 °C). Цветные области соответствуют составам, при которых мембрана пребывает в жидком состоянии. Сосуществование жидкой упорядоченной (Lo) и жидкой неупорядоченной (Ld) фаз показано синим цветом: здесь при увеличении концентрации холестерола в диапазоне 10–35% размеры доменов «жидкой упорядоченной» фазы постепенно увеличиваются. б — Образование макроскопических мембранных доменов в гигантских везикулах, состоящих из насыщенного (ДПФХ) и ненасыщенного (ДОФХ) фосфолипидов, а также холестерола. Домены окрашиваются флуоресцентными красителями, «предпочитающими» упорядоченную (Lo) или неупорядоченную (Ld) фазы. При увеличении концентрации холестерола сверх 16% макроскопических доменов уже не заметно, но разделение Lo/Ld продолжает существовать, о чем говорит низкий сигнал резонансного переноса энергии между молекулами красителя разных типов, находящихся в разных доменах (примерное положение двух верхних микрофотографий везикул обозначено справа желтым кругом).
Такая тройная смесь «туго-» и «легкоплавкого» липидов с холестеролом демонстрирует сложное фазовое поведение (рис. 3). По всей видимости, молекулы холестерола играют роль «центров кристаллизации» для доменов из «тугоплавких» липидов, однако его присутствие в то же время не позволяет им образовать твердую (гелевую) фазу. Чтобы точнее понять возможные фазовые состояния в мембране и сложных липидных смесях, ее изображающих, введем следующие обозначения:
- Твердая фаза (гель) — So (от solid ordered). Характерна высоко упорядоченным состоянием липидных «хвостов», приблизительно параллельных друг другу. Толщина бислоя, состоящего из липидов в этом состоянии, будет максимальной, а площадь, приходящаяся на молекулу, — минимальной. Проще всего гелевую фазу себе представить, вспомнив маргарин.
- Жидкая (жидкокристаллическая) фаза — L (от liquid). В биологических мембранах и сложных смесях существует две разные (и взаимно несмешивающиеся) жидкие фазы:
- Жидкая упорядоченная фаза — Lo (от liquid ordered). Эту фазу можно считать синонимом рафтов и липидных доменов в мембране. Отличается достаточно высокой упорядоченностью липидных «хвостов» (что напрямую подтверждается такими экспериментальными методиками, как рентгеновская дифракция, рассеяние нейтронов или спектроскопия ядерного магнитного резонанса), а значит, и большей толщиной состоящих из нее липидных доменов (и меньшей площадью, приходящейся на одну молекулу липида). При всем при том, Lo-фаза обладает высокой латеральной подвижностью (за счет малого размера рафтов в мембране), что помещает ее примерно посередине между жидкостью и твердой фазой (так называемая «мезофаза»).
- Жидкая неупорядоченная фаза — Ld (от liquid disordered). Это настоящая, свободно перемешивающаяся, жидкость, — только в двух измерениях (поскольку в бислое третье измерение фактически отсутствует). Липидные «хвосты» в этой фазе максимально неупорядочены, и площадь на одну молекулу липида в связи с этим максимальна. Проще всего жидкую фазу Ld себе представить, посмотрев на масляное пятно, на поверхности которого переливаются радужные узоры.
Равновесие между Lo/Ld фазами было давно показано на искусственных мембраноподобных системах (например, гигантских везикулах, изготовленных из липидов легочного сурфактанта) (рис. 3б), однако непосредственно в биологической мембране такого разделения (а, значит, и рафтов) пронаблюдать долгое время не удавалось. В чем же дело, если липидный состав искусственных мембран был подобран максимально похожим на мембраны настоящие?
Проблема заключается в том, что в биологических мембранах жидкая упорядоченная фаза сильно «раздроблена», и максимальный размер рафтов не превышает 100 нм, что недоступно для непосредственного наблюдения в оптический микроскоп. (Даже флуоресцентная конфокальная микроскопия, делающая «видимыми» отдельные светящиеся молекулы, в данном случае не сможет сказать, находятся ли определенные белки и пептиды в пределах одного кластера или нет.) Причины, в силу которых в живой клетке рафты не сливаются в крупные домены, видимые в оптический микроскоп (а именно это и происходит в искусственных мембранах), мы обсудим чуть дальше.
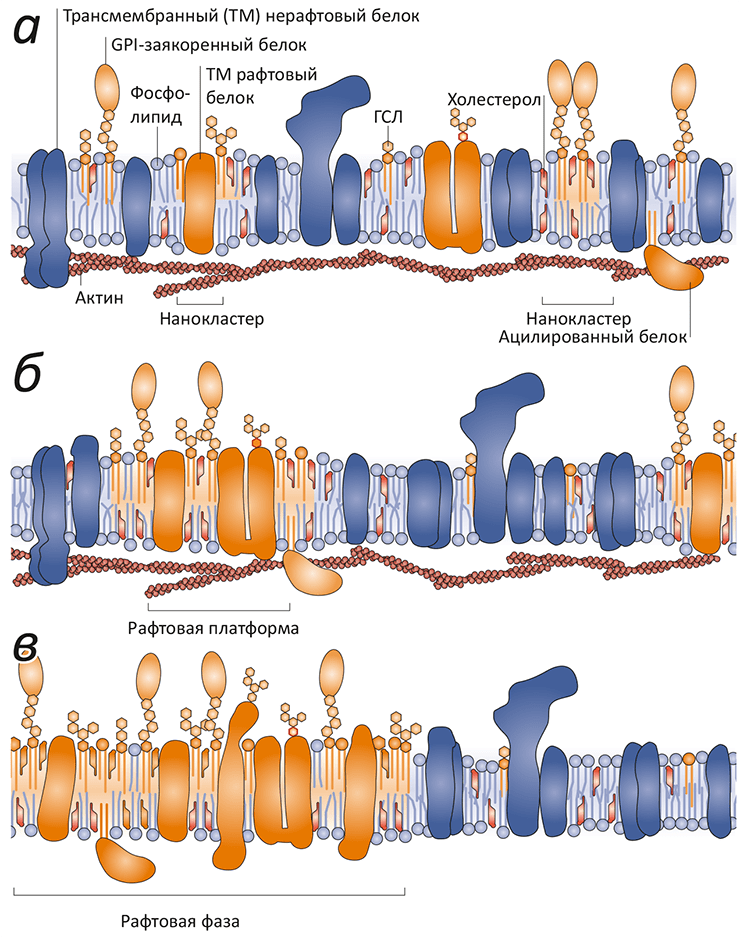
Рисунок 4. Рафтовые неоднородности в мембране различного масштаба. а — Нанокластеры холестерола, сфингомиелина, гликосфинголипидов и белков плазматической мембраны различаются по составу. Считается, что в эти кластеры входят ГФИ-заякоренные белки, трансмембранные (ТМ) белки, специфичные для рафтов, и цитоплазматические белки, связанные с актиновыми филаментами. «Обычные» ТМ-белки не входят в состав рафтов. б — В ответ на внешние сигналы нанокластеры могут сливаться с образованием рафтовой платформы, важной для ТМ передачи сигналов и мембранного транспорта. в — Рафтовая фаза, видимая в микроскоп (ø ≈1 мкм), наблюдается исключительно в равновесных мембранных системах, таких как гигантские синтетические или мембранные везикулы. В «нативных» мембранах постоянный обмен веществом и энергией «дробит» рафтовую фазу до субдифракционных размеров.
На маленьком липидном плоту
Гипотеза рафтов восходит к наблюдению, что гликосфинголипиды в комплексе Гольджи распределены не равномерно, а кластеризуются вместе перед тем, как направляться к полюсам поляризованных эпителиальных клеток. Лабораторное изучение этих кластеров показало, что, в отличие от «обычных» участков мембран, эти кластеры не растворяются в детергенте тритон X-100: они более прочные и устойчивые. Согласно химическому анализу, эти кластеры состоят преимущественно из холестерола и сфингомиелина (рис. 1), а основные белки, неизменно попадающие в эти кластеры — это гликозилфосфатидилинозитол (ГФИ)-заякоренные белки (GPI-anchored proteins). Было сделано предположение, что эти плотные кластеры образуют стабильные «плоты» (размером примерно 50 нм), в которые встроены определенные типы белков. Дополнительно в пользу этой концепции говорил тот факт, что синтетические мембраны, содержащие холестерол и гликосфинголипиды, демонстрируют примерно те же свойства: липиды разделяются на две несмешивающиеся фазы, которые даже можно разглядеть в микроскоп (рис. 3б).
Однако с течением времени стало понятно, что такое представление — противоположная крайность по сравнению с жидкостно-мозаичной моделью Сингера и Николсона: рафты далеко не столь стабильны, как это было постулировано первоначально. По всей видимости, это динамические структуры, постоянно обменивающиеся молекулами липидов и белков с остальной частью мембраны. При этом липиды в рафтах упакованы гораздо более плотно и структурированно, нежели в окружающей «жидкой» мембране. Сравнительно современное определение рафтов звучит так:
Однако, несмотря на то, что определение рафтам дано, само их существование представлялось до недавнего времени довольно-таки спорным, то есть — не подтвержденным в прямом эксперименте. Как же понимать этот парадокс?
Дело в том, что существование мембранной фракции, не растворимой в детергентах — это еще не повод считать эту фракцию рафтами (функциональными неоднородностями). Непосредственное же изучение этих доменов затруднено в связи с тем, что рафты очень сложно наблюдать «напрямую» из-за их малого размера: типичный их предполагаемый диаметр меньше дифракционного предела оптической микроскопии (≈200 нм). (Здесь речь идет именно об оптическом, а не рентгеновском или электронном излучении, потому что только оно позволяет наблюдать за клеткой неинвазивно, то есть — не разрушая ее.) Правда, в последние годы уже появились экспериментальные методики непосредственного наблюдения рафтовых кластеров (см. таблицу). В частности, одна из разновидностей оптической микроскопии сверхвысокого разрешения — наноскопия индуцировано-истощенного излучения (stimulated emission depletion, STED) — позволила установить, что ГФИ-заякоренные белки в течение достаточно длительного времени (10–20 мс) захватываются в сфинголипидно-холестерольные домены размером <20 нм в мембранах живых клеток, — то есть, в рафты [21]. (Кстати, ГФИ-заякоренные белки — один из основных компонентов рафтов в биомембранах, и попадают они туда самопроизвольно. Подробнее об этом будет рассказано далее.)
Но даже с помощью этих точнейших наблюдений невозможно проникнуть в детали межмолекулярных взаимодействий, заставляющих липиды собираться в кластеры, а также «захватывать» с собой белки. С другой стороны, подобная информация может быть получена с привлечением методов компьютерного моделирования.
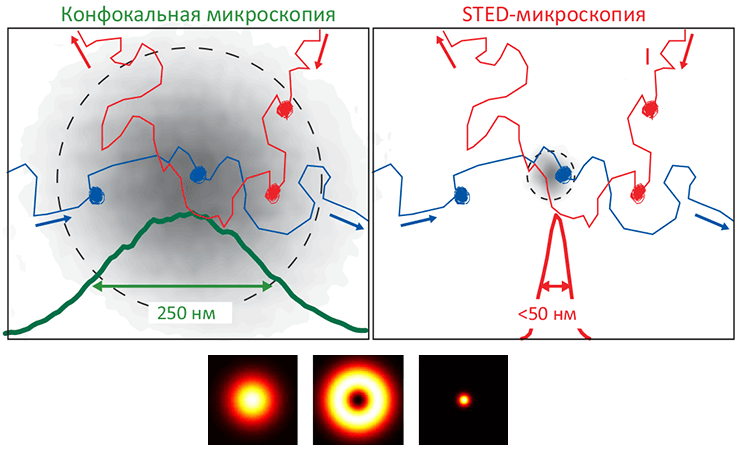
Рисунок 5. Микроскопия подавления индуцированного излучения (STED) — инновационный способ неинвазивного наблюдения липидной динамики мембран в наномасштабе. STED-микроскопия — один из ультрасовременных оптических методов сверхвысокого разрешения, позволяющих «заглянуть за» дифракционный барьер (то есть, различать объекты, меньшие ≈200 нм). Образование «упорядоченной жидкой» фазы (Lo) связано с образованием доменов, обогащенных холестеролом и сфингомиелином, что можно установить при помощи метода флуоресцентно-резонансного переноса энергии (FRET). Однако размер зоны, в пределах которой «обычный» конфокальный микроскоп (слева) позволяет различать детали (≈250 нм), оказывается слишком велик, чтобы точно определить, движутся ли две молекулы совместно (то есть, образуют домен) или независимо. STED-микроскопия с размером «зоны наблюдения» всего 50 нм (справа) позволила установить существование холестерольно-сфингомиелиновых доменов на живых клетках, положив конец спору о существовании рафтов в живых клетках.
Внизу. Принцип STED-методики сходен с конфокальной флуоресцентной микроскопией, но здесь, кроме возбуждающего лазерного импульса (слева), запускающего свечение молекул-флуорофоров, используется также кольцевой формы гасящий импульс (в центре), уменьшающий эффективный радиус зоны возбуждения флуорофоров до ≈50 нм (справа; это в 4–5 раз меньше пресловутого «дифракционного барьера»).
| Метод | Что наблюдает | Пространственное / временное разрешение | Пояснение |
|---|---|---|---|
| Спектроскопия скоррелированной флуоресценции (FCS) | Подвижность флуорофора и латеральная гетерогенность | ~250 нм / ~1 мкс | Чувствителен к кластеризации; использование нескольких цветов |
| Флуоресцентно-резонансный перенос энергии (FRET) | Сближенность донора и акцептора | ~5–10 нм (расстояние между флуорофорами) / <1 с | Идентификация кластеров в нанометровом диапазоне |
| Отслеживание одиночных частиц (SPT) | Траектории наночастиц (золото, квантовые точки) | ~ 250 (10а) нм / <25 мкс | Чувствительность для одиночных молекул, идентификация кластеров |
| Флуоресцентная микроскопия одиночных молекул (SMFI) | Флуоресценция отдельных молекул | ~ 250 (20а) нм / <30 мс | Различает, входят ли в обесцвеченный лазером участок одиночные молекулы или димеры |
| Картирование тепловых движений (TNI) | Частица, прикрепленная к компоненту мембраны, «захватывается» лазером | ~10 нм / ~1 мкс | Исследуется движение частицы, «захваченной» лучом лазера |
| Микроскопия подавления индуцированного излучения (STED) | Флуоресцентный или FRET-сигнал | ~50 нм / 1 мс | «Область обзора» эффективно сужается за счет гасящего импульса |
| a — Точность в определении центра изображения | |||
Кластеризация липидов in silico
Современные методы молекулярного моделирования позволяют изучить процесс самоорганизации липидных смесей с разной степенью детализации. Расчеты молекулярной динамики (МД; [7], [22]) модельных мембран, в которых все атомы липидов и окружающего растворителя представлены в явном виде, дают наиболее полную информацию. И хотя при таком подробном рассмотрении системы, доступные для моделирования даже на современных суперкомпьютерах, ограниченны в своих размерах (102–103 молекул липида) и длительности наблюдения за их динамическим поведением (<10−6 c), получаемые результаты дают атомарную картину возникновения мембранных неоднородностей в наномаштабе. Даже в случае однокомпонентной липидной мембраны ее поверхность не является однородно полярной, как это можно предположить из схематического представления липидов в виде «шариков с хвостиками» — часть этих «хвостиков» всплывает на границу вода—мембрана и формирует гидрофобные участки (рис. 6). В итоге мы имеем мозаично организованную поверхность, на которой в полярном «море» рассредоточены гидрофобные «островки» размером до нескольких нм2 [23].
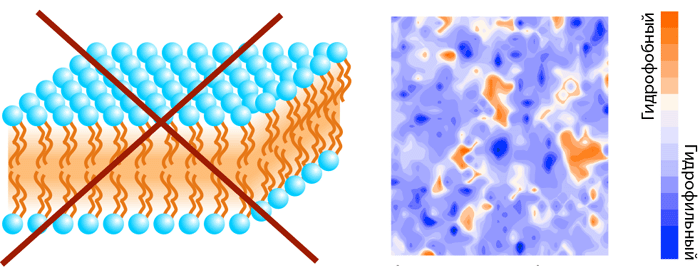
Рисунок 6. Мозаичная организация поверхности простейшей однокомпонентной мембраны. Слева представлена идеальная модель мембраны, справа — поверхность полноатомной мембраны (ДОФС), раскрашенной по гидрофобности.

Рисунок 7. Предпочтительная локализация трансмембранных пептидов WALP23 в Ld-фазе. Модельная мембрана состоит из липидов ДЛФХ, ДПФХ и холестерола.
При смешивании двух компонентов, например насыщенного (дипальмитоил-) и ненасыщенного (диолеил-) фосфатидилхолинов (ДПФХ и ДОФХ, соответственно), картина усложняется, и наблюдается обособление более «твердой» фазы (ДПФХ) в стабильные нанокластеры, распределенные диффузно в плоскости мембраны [24]. При моделировании трехкомпонентных мембран, в состав которых входят холестерол, сфингомелиеин и ДОФХ даже на небольших временах МД (2×10−7 с) наблюдается настоящее фазовое разделение, при котором «тугоплавкий» сфингомелеин формирует островок, по границе которого располагается холестерол, обращенный своей «щетинистой» стороной во внешнюю фазу «легкоплавкого» ДОФХ [25].
Увеличить время наблюдения за поведением многокомпонентных мембран in silico, а также размер моделей, позволяет упрощенное («крупнозернистое») описание молекул. Атомы объединяют в обособленные группы — «зерна» (обычно 3–4 атома), — для которых производят расчет МД. Такая методика позволила впервые «увидеть» разделение Lo/Ld фаз в мембране из нескольких тысяч молекул, содержащей 40% насыщенного ДПФХ, 30% ненасыщенного дилинолеилфосфатидилхолина (ДЛФХ) и 30% холестерола, моделируемых в течение 20 мкс [26]. Более того, если к такой модельной мембране добавить трансмембранные спиральные пептиды (минимальные «строительные блоки» большинства мембранных белков), то можно наблюдать, как происходит их сортировка между фазами — моделируемые фрагменты белка предпочитают находиться в более жидкой Ld-фазе (ДЛФХ) и избегают упорядоченной Lo-фазы ДПФХ (рис. 7) [27].
Стоит отметить, что возникновение латеральной гетерогенной структуры в мембране наблюдается не только при смешивании «тугоплавких» и «легкоплавких» липидов, но также любых других отличающихся по своим физико-химическим свойствам — например, заряду полярной головки и склонности образовывать водородные связи с соседями. В частности, в модельной бактериальной мембране, содержащей 70% фосфатидилэтаноламина (ФЭ) и 30% отрицательно зараженного фосфатидилглицерола (ФГ) также наблюдается формирование нанодоменов, — за счет того, что молекулы ФЭ эффективно взаимодействуют друг с другом и вытесняют «невыгодного» партнера ФГ. На «крупнозернистых» моделях была показано, что такая латеральная организация мембран бактерий используется в процессе связывания антимикробными пептидами, которые при этом вызывают рост доменов ФГ и возникновение фазового разделения [28].
Что ограничивает размер рафтов в биомембранах
В реальных экспериментальных системах наблюдается достаточно парадоксальный контраст с искусственными мембранами, разделение фаз Lo/Ld в которых наблюдали неоднократно и при разных условиях. В живой клетке это удалось сделать непосредственно лишь недавно, да и то — используя самые современные технологии субдифракционного наблюдения [21]. В чем же причина такого разительного отличия?
Ведь на границе рафтовой фазы создается поверхностное (линейное) натяжение, а значит, присутствует избыточная свободная энергия, снизить которую можно путем слияния отдельных «плотиков» в одну большую макрофазу. Примерно то же самое наблюдается в супе, мелкие капли жира на поверхности которого постепенно объединяются в более крупные пятна. Фактически, это самое и происходит в искусственных мембранах (например, в мембранных везикулах) — самопроизвольный термодинамический процесс толкает к глобальному разделению Lo и Ld фазы. Но это обозначает, что отсутствие в живой клетке крупных Lo-кластеров — следствие активных процессов, протекающих с затратой энергии. (Возвращаясь к аналогии с супом, мы никогда не увидим одного большого пятна жира в кипящей кастрюле.) С одной стороны, это может происходить «само», поскольку мембрана, как и сама жизнь, — система, далекая от термодинамического равновесия. С другой стороны, эволюция физико-химических свойств мембраны могла направленно выработать такое приспособление, поскольку оно позволяет мембранам выполнять свои функции более эффективно.
Так или иначе, в мембранах протекает ряд процессов, постоянно «дробящих» рафты, — именно поэтому их так долго и не могли с достаточной степенью уверенности «нащупать». Это постоянный обмен веществом и энергией — ведь мембраны представляют собой открытые системы: помимо многочисленных разновидностей везикулярного транспорта, отдельные фрагменты мембраны постоянно «заглатываются» внутрь клетки и после какой-то переработки возвращаются обратно. Кроме этого, специальные белки делят мембрану, подобно «заборчикам», на отдельные участки. С одной стороны, это способствует компартментализации, с другой — также препятствует росту рафтов.
Анализ огромного массива биохимических и биофизических данных относительно липидных доменов в биомембранах, накопившихся за последние 15 лет, привел ученых к выводу, что состав липидного матрикса мембран эволюционно подобран, чтобы при физиологических условиях всегда находиться вблизи фазового перехода (рис. 8). Это способствует образованию в мембранах мезофазы (рафтов), которые, несмотря на свой малый размер и динамическую природу, играют важную (хотя не до конца еще изученную) роль. Какую? Читайте в заключительной части статьи.
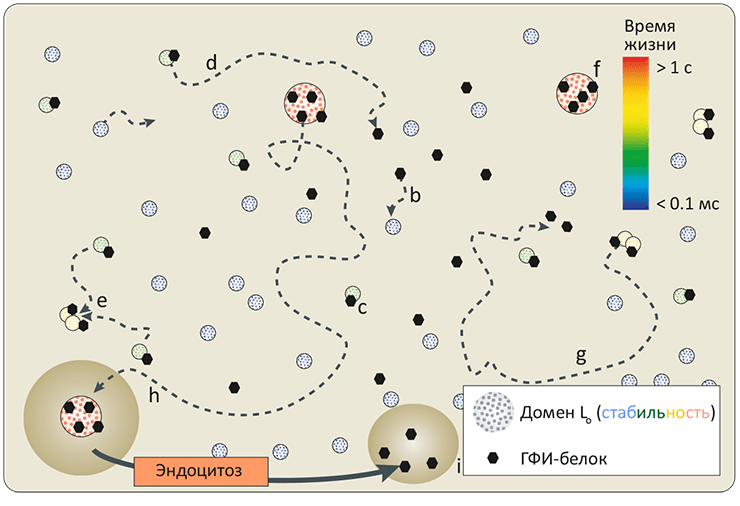
Рисунок 8. Динамическая модель рафтов. Домены «жидкой упорядоченной» фазы (Lo) в мембране гетерогенны как по размеру, так и по времени существования (0,1 мс — 1 с, показано цветом): это зависит от размера, липидного состава и «захваченных» белков, способных стабилизировать рафт. (Длина пунктирных стрелок, изображающих латеральную подвижность доменов, пропорциональна времени жизни.) Маленькие Lo-домены формируются спонтанно и диффундируют в плоскости мембраны (a). Захватив ГФИ-заякоренный или другой рафтовый белок (b), такой домен становится стабильнее и образует комплекс (c), способный или просто распасться (d), или, слившись с другим, увеличить размер (e). Такие столкновения могут привести к формированию более крупного и стабильного Lo-белкового комплекса (f), либо через какое-то время распадающегося самостоятельно, либо захватываемого в эндоцитозный пузырек (h) и «разбираемого» на исходные составляющие (i). Таким образом, рафтовые платформы в биомембранах, хотя и выполняют важные функции, являются динамическими структурами, постоянно возникающими и пропадающими вновь.
Биологическая роль наноразмерных неоднородностей в мембране
Роль такого сложного фазового поведения липидного матрикса мембран еще только предстоит понять в полной мере. Впрочем, сегодня ясно главное — такие свойства позволяют группировать (сортировать) разные белки в частично изолированные области, что позволяет им выполнять предназначенные функции. Также эти свойства определяют то, каким образом мембраны делятся и сливаются, — а это и деление самих клеток, и везикулярный транспорт, и жизненный цикл вирусов, и способность многих токсинов проникать внутрь клеток. Рассмотрим несколько примеров биологической роли рафтов немного более подробно [20]:
- Передача сигналов при дифференциации Т-лимфоцитов. В основе приобретенного иммунитета лежит процесс «обучения» Т-лимфоцитов распознавать определенные антигены и уничтожать их. Это происходит при непосредственном контакте антиген-презентирующей клетки (АПК) с «наивным» лимфоцитом, который, «обучившись», многократно делится и дает начало целой колонии идентичных Т-лимфоцитов, способных распознавать именно этот антиген.
Что интересно, рецепторы Т-клеток, которые распознают «заряженный» антигеном главный комплекс гистосовместимости на поверхности АПК, кластеризуются именно в рафтовой фазе, и дополнительно скрепляются актиновыми нитями со стороны цитоплазмы. Это скопление рецепторов обеих клеток формирует иммунологический синапс (область плотного контакта) между Т-лимфоцитом и АПК.
В лабораторных экспериментах подтверждено, что участие рафтовой фазы в формировании иммунологического синапса принципиально: изъятие из мембран холестерола или модификация некоторых участвующих в процессе белков, чтобы они теряли сродство к рафтам, приводит к тому, что презентирования антигена не происходит, и иммунитет не образуется. - «Почкование» вирусных частиц. Многие вирусы, покидая зараженную ранее клетку, облачаются в липидную оболочку — часть мембраны клетки-хозяина. Некоторые из них, в частности ВИЧ и вирус гриппа, «отпочковываются» от рафтовых участков мембраны, что приводит к тому, что вокруг их собственного нуклеокапсида образуется липидная «скорлупа», состоящая целиком из рафтовых липидов. Делается это, видимо, затем, чтобы в оболочку попали вирусные гликопротеины и не попадали ненужные вирусу мембранные белки клетки-хозяина.
Опять же, эксперименты показывают, что «почкование» — процесс, зависящий от наличия холестерола и сфинголипидов, что подтверждает участие рафтовой фазы. - Участие рафтов в мембранном транспорте. Секреция секретируемых и доставка мембранных белков начинаются с эндоплазматического ретикулума (ЭР) с «промежуточной остановкой» в комплексе Гольджи. В этом транспорте на основе все тех же принципов разделения фаз в липидных системах играет роль жидкая упорядоченная фаза (рафты). На примере ЭР дрожжей установлено, что существует три различных сайта выхода везикул с белковым «грузом» из ЭР: два из них отвечают за транспорт растворимых секретируемых и мембранных белков, а третий является «портом отправления» ГФИ-заякоренных белков, в мембране клетки расположенных внутри рафтов. Так вот уже на стадии ЭР эти белки транспортируются в везикулах, по составу близких к рафтам (насыщенных холестеролом и церамидами).
Аналогичная ситуация наблюдается и с комплексом Гольджи, откуда к мембране идут везикулы, либо покрытые клатриноподобной белковой оболочкой, либо состоящие из рафтовых липидов. Кстати, сама гипотеза рафтов была выдвинута в связи с наблюдением процесса сортировки белков и липидов в комплексе Гольджи: оказалось, что к апикальным поверхностям эпителиальных клеток отправляются пузырьки, несущие строго определенные белки.
Дополнительно подтверждая роль жидкой упорядоченной фазы в мембранном транспорте, было установлено, что некоторые ферменты, участвующие в синтезе холестерола и сфинголипидов, необходимы для доставки рафтовых белков в мембрану клетки. - Некоторые рафтовые липиды — «троянские кони» для бактериальных токсинов и вирусов. В частности, шигатоксин (токсин бактерий, вызывающих дизентерию [30]) и холерный токсин, формируя пентамерный «бублик», захватывают рафтовые гликосфинголипиды под названием ганглиозиды Gb3 и GM1, что провоцирует образование «впячиваний» мембраны в виде трубочек, что лежит в основе токсического действия этих микроорганизмов. Аналогичным образом в клетку проникает вирус SV40: он связывается с ганглиозидом GM1 и кластеризует его; это приводит к образованию мембранного «впячивания» и захвата вируса в эндосому, направляющуюся в сторону ЭР.
«Троянская» роль ганглиозидов подтверждается отсутствием токсичности и способности вируса проникать внутрь клетки при действии на синтетические аналоги этих ганглиозидов, имеющие более короткий жирный «хвост» и сортирующиеся не в рафтовую, а в жидкую неупорядоченную фазу (Ld, или, проще говоря, «обычную» мембрану).
Интересно, что у бактерий тоже есть липид мембраны (называемый липидом-II), действующий в роли троянского коня для некоторых антибиотиков, однако этот липид не имеет отношения к рафтам, а является предшественником клеточной стенки, без которой бактерии погибают.
Перспективы биофизического изучения мембран
Кажущаяся простота липидного «океана» осталась в прошлом, и сейчас исследователи лишь приблизительно представляют все молекулярные тонкости образования кластеров в липидах. Точно так же далек от понимания и механизм «сортировки» одних белков в рафтовую фазу, а других — в более жидкую область мембраны. Между тем, это понимание дало бы возможность создать стратегию рафт-селективной доставки в клетку различных веществ, — в том числе, лекарств.
Все рассказанное в этой статье относится в первую очередь к мембранам эукариот, — но это еще не обозначает, что у бактерий нет ничего подобного (раз нет и холестерола). Изучение латеральной неоднородности бактериальных мембран может привести к созданию новых поколений антибиотиков, избирательно уничтожающих патогенные микроорганизмы, и свободных от проклятия резистентности, давно уже нависшего над «традиционными» антибактериальными средствами.
История с изучением липидного матрикса мембран в очередной раз показывает, что живая материя устроена значительно сложнее, чем представлялось ранее, и изобретение новых высокоточных методик наблюдения лишь усугубляет эту сложность.
Статья написана в соавторстве с Антоном Полянским и при поддержке РФФИ (конкурс на написание научно-популярных статей), № проекта: 11-04-11516-с. В сокращенном виде она опубликована в «Природе» [31].
Литература
- К вопросу о происхождении жизни;
- Антонов В.Ф. (1996). Биофизика мембран. Соросовский образовательный журнал. 6;
- S. J. Singer, G. L. Nicolson. (1972). The Fluid Mosaic Model of the Structure of Cell Membranes. Science. 175, 720-731;
- Luis A. Bagatolli, John H. Ipsen, Adam C. Simonsen, Ole G. Mouritsen. (2010). An outlook on organization of lipids in membranes: Searching for a realistic connection with the organization of biological membranes. Progress in Lipid Research. 49, 378-389;
- Gerrit van Meer, Dennis R. Voelker, Gerald W. Feigenson. (2008). Membrane lipids: where they are and how they behave. Nat Rev Mol Cell Biol. 9, 112-124;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Компьютерные игры в молекулярную биофизику биологических мембран;
- Иммунологическая Нобелевская премия (2011);
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Эволюция между молотом и наковальней, или Как микробиология спасла эволюцию от поглощения молекулярной биологией;
- Гигантские вирусы: 4-й домен жизни?;
- Наночастицами — по «плохому» холестерину!;
- T. Cavalier-Smith. (2009). Predation and eukaryote cell origins: A coevolutionary perspective. The International Journal of Biochemistry & Cell Biology. 41, 307-322;
- Y.H. Itoh, A. Sugai, I. Uda, T. Itoh. (2001). The evolution of lipids. Advances in Space Research. 28, 719-724;
- Mari Gotoh, Ayae Sugawara, Kazunari Akiyoshi, Isamu Matsumoto, Guy Ourisson, Yoichi Nakatani. (2007). Possible Molecular Evolution of Biomembranes: from Single-Chain to Double-Chain Lipids. C&B. 4, 837-848;
- Daniele Piomelli, Giuseppe Astarita, Rao Rapaka. (2007). A neuroscientist's guide to lipidomics. Nat Rev Neurosci. 8, 743-754;
- Kai Simons, Elina Ikonen. (1997). Functional rafts in cell membranes. Nature. 387, 569-572;
- John F. Hancock. (2006). Lipid rafts: contentious only from simplistic standpoints. Nat Rev Mol Cell Biol. 7, 456-462;
- Ken Jacobson, Ole G. Mouritsen, Richard G. W. Anderson. (2007). Lipid rafts: at a crossroad between cell biology and physics. Nat Cell Biol. 9, 7-14;
- Kai Simons, Mathias J. Gerl. (2010). Revitalizing membrane rafts: new tools and insights. Nat Rev Mol Cell Biol. 11, 688-699;
- Christian Eggeling, Christian Ringemann, Rebecca Medda, Günter Schwarzmann, Konrad Sandhoff, et. al.. (2009). Direct observation of the nanoscale dynamics of membrane lipids in a living cell. Nature. 457, 1159-1162;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности;
- Anton A. Polyansky, Pavel E. Volynsky, Alexander S. Arseniev, Roman G. Efremov. (2009). Adaptation of a Membrane-active Peptide to Heterogeneous Environment. II. The Role of Mosaic Nature of the Membrane Surface. J. Phys. Chem. B. 113, 1120-1126;
- Darya V. Pyrkova, Natalya K. Tarasova, Timothy V. Pyrkov, Nikolay A. Krylov, Roman G. Efremov. (2011). Atomic-scale lateral heterogeneity and dynamics of two-component lipid bilayers composed of saturated and unsaturated phosphatidylcholines. Soft Matter. 7, 2569;
- Sagar A. Pandit, Eric Jakobsson, H.L. Scott. (2004). Simulation of the Early Stages of Nano-Domain Formation in Mixed Bilayers of Sphingomyelin, Cholesterol, and Dioleylphosphatidylcholine. Biophysical Journal. 87, 3312-3322;
- H. J. Risselada, S. J. Marrink. (2008). The molecular face of lipid rafts in model membranes. Proceedings of the National Academy of Sciences. 105, 17367-17372;
- L. V. Schafer, D. H. de Jong, A. Holt, A. J. Rzepiela, A. H. de Vries, et. al.. (2011). Lipid packing drives the segregation of transmembrane helices into disordered lipid domains in model membranes. Proceedings of the National Academy of Sciences. 108, 1343-1348;
- Anton A. Polyansky, Rajesh Ramaswamy, Pavel E. Volynsky, Ivo F. Sbalzarini, Siewert J. Marrink, Roman G. Efremov. (2010). Antimicrobial Peptides Induce Growth of Phosphatidylglycerol Domains in a Model Bacterial Membrane. J. Phys. Chem. Lett.. 1, 3108-3111;
- Jan Domański, Siewert J. Marrink, Lars V. Schäfer. (2012). Transmembrane helices can induce domain formation in crowded model membranes. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1818, 984-994;
- Огурцы-убийцы, или Как встретились Джим Уотсон и Гордон Мур;
- Чугунов А.О., Полянский А.А., Ефремов Р.Г. Липидный фундамент жизни. «Природа». 3, 3–12.






