
SUMO: японская борьба или уникальная посттрансляционная модификация?
26 августа 2013
SUMO: японская борьба или уникальная посттрансляционная модификация?
- 4080
- 5
- 4
Японский борец сумо и кристаллическая структура его маленького конкурента — белка SUMO
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Все знают, что сумо — это вид единоборства родом из Японии, сильной страны с сильными людьми. Спортсмены-тяжеловесы, совершающие поединок, сопровождающийся многочисленными ритуалами, — вот первая и до недавних пор единственная ассоциация со словом «сумо», пока в 1990-х годах не появилось слово-омоним — SUMO, совпадающее в своем звучании при полном несоответствии значений. Кто же это, и о ком пойдет речь в данной статье? SUMO — это маленький белок, главный участник посттрансляционной модификации (под названием сумоилирование) разных белков в клетке от дрожжей до человека. Процесс сумоилирования является необходимым для регуляции широкого спектра клеточных процессов, включая экспрессию генов, клеточный цикл, локализацию белков и состояние хроматина.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Посттрансляционные модификации и функциональное разнообразие белков
Каждая клетка любого организма содержит набор генетической информации, реализация которой в природе подчиняется центральной догме молекулярной биологии: информация передаётся от нуклеиновых кислот к белку, но не в обратном направлении. Правило было сформулировано Френсисом Криком еще в 1958 году [1]. Переход генетической информации от ДНК к РНК и от РНК к белку является универсальным для всех без исключения клеточных организмов, и лежит в основе биосинтеза макромолекул. Процесс перехода ДНК → РНК называется транскрипцией, а процесс перехода РНК → белок — трансляцией (рис. 1).
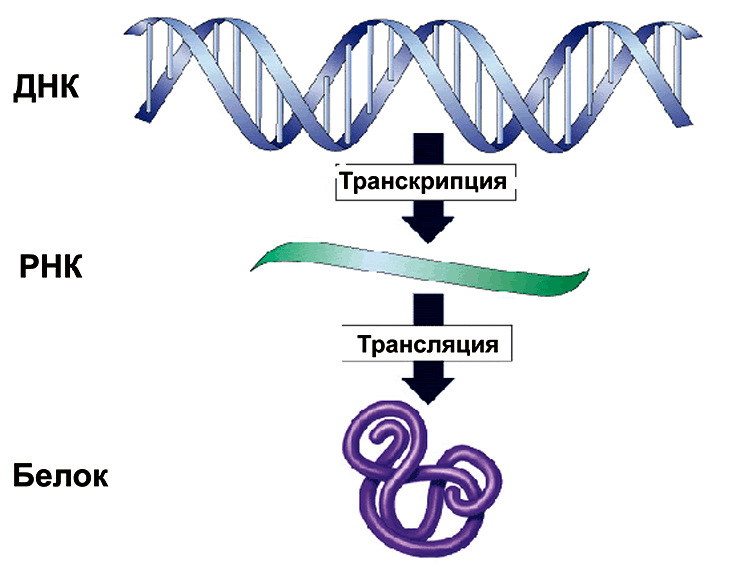
Рисунок 1. Центральная догма молекулярной биологии
Исходя из этих малых знаний можно предположить, что посттрансляционные модификации — это процесс регуляции на уровне белка. Зачем же они нужны клетке? Разве не достаточно перехода от ДНК к РНК и от РНК к белкам? Оказывается, что нет — этого недостаточно. В клетке любого организма присутствует огромное количество функционально различающихся белков: структурные белки (необходимы для строения клеточной стенки и мембран), ферменты (необходимы для каталитических процессов), регуляторные белки (исполняют роль регуляторов экспрессии генов, транскрипционные факторы) и т.д. Иногда один белок может выполнять разные функции в клетке одного и того же организма, и этому способствуют как раз посттрансляционные модификации (ПТМ).
ПТМ заключаются в ковалентной модификации белков, транслированных с РНК. Они играют ключевую роль в гетерогенности белков, в исключении идентичных белков, их деградации, тканеспецифичности, регуляции активности. Например, ПТМ осуществляемые на N-конце* полипептидной цепи, способствуют транспорту белков через биологические мембраны. N-гликозилирование белков происходит по карбоксамидному атому азота остатка аспарагина в последовательности Asn-X-Ser/Thr. Многие белки, а именно относящиеся к секреторным белкам прокариот и эукариот, а также белки, транспортируемые в клеточные органеллы — лизосомы, хлоропласты, митохондрии, — содержат моносахаридный остаток N-ацетилглюкозамина [2].
Звёздочками в верхнем индексе помечены термины, разъясненные в «Словарике» в конце статьи.
Благодаря ПТМ в клетках эукариот может достигаться большое разнообразие функционально активных белков и транскрипционных факторов. Так, 20 с небольшим тысяч генов, содержащихся в ДНК человека [3], транскрибируемых в РНК и транслируемых в белки, в результате ПТМ дают от 300 000 до миллиона функционально различных белков в клетке. Например, известный транскрипционный фактор р53, выполняющий роль опухолевого супрессора и принимающий участие в регуляции клеточного цикла, подвергается нескольким ПТМ, а именно — фосфорилированию, ацетилированию и гликозилированию. Данные ПТМ помогают белку р53 увеличить количество участков связывания с ДНК.
Таким образом, ПТМ необходимы для изменения конформации, клеточной локализации, активности ферментов и транскрипционных факторов, регуляции белок-белковых взаимодействий и контроля продолжительности «жизни» белков. ПТМ белков могут осуществляться несколькими способами. На сегодняшний день известно более 100 ПТМ. Наиболее распространенными и изученными являются:
- гликозилирование — присоединение дополнительного углеводного фрагмента обычно к аспарагину, гидроксилизину, серину или треонину;
- ацетилирование — добавление дополнительной ацетильной группы к N-концу полипептидной цепи;
- метилирование — присоединение дополнительной метильной группы к лизину или аргинину;
- фосфорилирование — присоединение дополнительной фосфатной группы обычно на серин, треонин или тирозин.
Каждый тип ПТМ осуществляется специальными ферментами: известно 500 протеинкиназ (фосфорилирование), 150 фосфатаз, 500 протеаз, небольшое количество гистоновых* ацетилаз (ацетилирование) и деацетилаз (деацетилирование) [4].
Одной из самых распространенных ПТМ белков является фосфорилирование. Анализ белков в клеточной линии человека HeLa [5] показал, что фосфорилируется более чем 20 000 белков по более чем 6000 позициям (сайтам). Фосфорилирование важно для рецепторов, осуществляющих передачу сигнала извне клетки в цитоплазму и ядро. Интересно, что белки могут подвергаться нескольким ПТМ одновременно, и в этом случае одна ПТМ может как усиливать, так и ослаблять эффект другой модификации.
Вы можете спросить: «А как долго существуют белки в клетке, бесконечно ли их время жизни?». Белки в клетке не только все время синтезируются, но и расщепляются. (Аналогичная динамика наблюдается и для РНК [6].) Данный процесс осуществляется при участии белка убиквитина [7], а соответствующая ПТМ называется убиквитинилирование — ацилирование белков активированной С-концевой карбоксильной группой остатка глицина убиквитина. Убиквитинилирование приводит к деградации «меченого» белка с направлением его в протеасому.
В 1990-х годах в процессе изучения ядерного белка RanGAP1* была открыта новая убиквитин-подобная ПТМ — сумоилирование. Сумоилирование осуществляется с участием небольшого белка, названого SUMO (Small Ubiquitin-related MOdifier), который ковалентно присоединяется к аминокислоте лизину белковых субстратов за счет серии ферментативных реакций, подобных процессу убиквитинилирования. Правда, в отличие от убиквитинилирования, сумоилирование не приводит к деградации белков [8].
Сумоилирование — уникальная посттрансляционная модификация
Итак, что же это за уникальная посттрансляционная модификация? Какую роль выполняет в сумоилировании белок SUMO? Как было описано выше, сумоилирование осуществляется с участием небольшого убиквитин-подобного модифицирующиего белка SUMO, состоящего всего из ~100 аминокислотных остатков (молекулярный вес ≈11–12 кДа) (рис. 2).
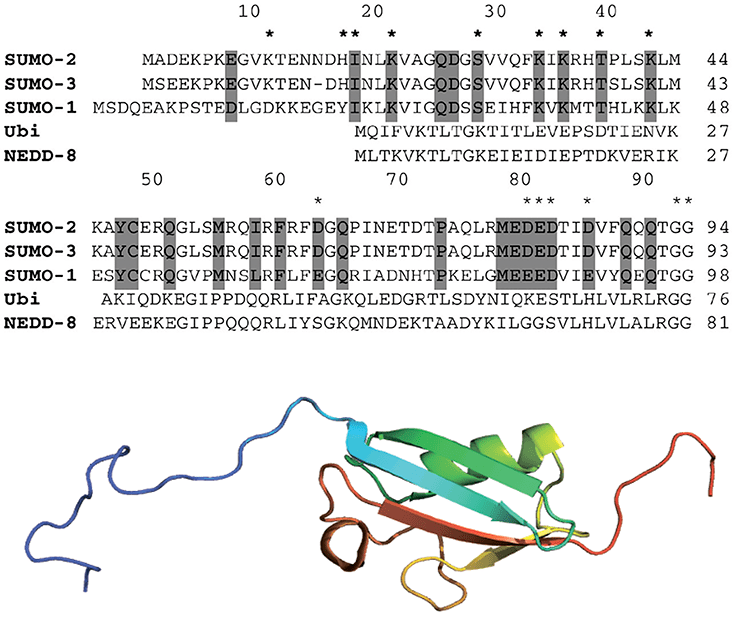
Рисунок 2. Строение белка SUMO. На верхнем рисунке представлена аминокислотная последовательность белков SUMO, а также показано выравнивание аминокислотных последовательностей с убиквитином. Серым цветом выделены гомологичные аминокислоты. На нижнем рисунке представлена пространственная структура белка SUMO1 человека. Синий конец — N-конец белка, красный — С-конец.
Сумоилирование является эволюционно высококонсервативным процессом от дрожжей до человека. SUMO экспрессируется во всех эукариотических организмах (дрожжи, растения, животные), но отсутствует у бактерий (однако присутствует у архей). У дрожжей, червей и насекомых экспрессируется одна изоформа* SUMO. У позвоночных животных определено несколько изоформ — SUMO1, SUMO2, SUMO3 (рис. 2), которые встречаются во всех тканях, и SUMO4, который является псевдогеном*. Несмотря на то, что механизм конъюгации SUMO идентичен для всех трех изоформ, разные формы белка характеризуются разными функциональными особенностями. Так, мышиные эмбрионы, лишенные SUMO1, погибают: это говорит о том, что SUMO2/3 не могут компенсировать отсутствие SUMO1 в клетках млекопитающих [8–10].
Давайте вместе рассмотрим процесс сумоилирования, насколько «силен» такой маленький белок, и можно ли его сравнить с тяжеловесными борцами сумо.
Вспомним центральную догму молекулярной биологии: ДНК → РНК → белок. Белок SUMO синтезируется по такому же принципу (ДНК → РНК → SUMO). Но только что синтезированный белок SUMO не может запустить процесс сумоилирования и осуществить конъюгацию белков-субстратов. Чтобы стать активным, ему сначала приходится подвергнуться протеолизу*.
Помимо сумоилирования, бывает и десумоилирование. В данном случае SUMO высвобождается из субстрата в реакции, катализируемой семейством изопептидаз, названных SENP — SUMO-специфические протеолитические ферменты (рис. 3).
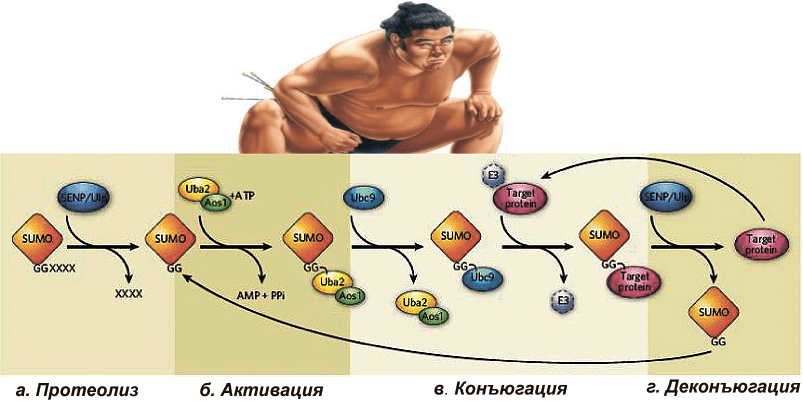
Рисунок 3. SUMO: ковалентная модификация белков. a — Протеолиз или «созревание» — SUMO подвергается протеолизу SENP/Ulp протеазами. б — «Активация» SUMO ферментами Uba/Aos1. в — «Конъюгация» SUMO с белком-субстратом. г — «SUMO-деконъюгация».
Таким, образом, маленький белок SUMO прибегает к помощи многих дополнительных белков-ферментов, а иногда даже «зазывает напарников», как в случае полисумоилирования. В такой ситуации можно сказать, что наш SUMO уступает профессиональным борцам сумо. Но так ли это на самом деле, мы можем оценить, только рассмотрев функциональную значимость данной посттрансляционной модификации.
Функциональная значимость SUMO и сумоилирования
Как было уже отмечено ранее, первой найденной мишенью для сумоилирования оказался белок RanGAP1, изучение которого впервые показало связь между ядерным транспортом и SUMO. Конъюгация SUMO с RanGAP1 осуществляется через RanBP2 — ядерный белок: такая модификация важна для ядерного транспорта и локализации RanGAP1. Потеря сумоилирования может привести к нарушению ядерного транспорта RanGAP1 для осуществления его нормальной функции. Кроме этого, сумоилирование RanGAP1 важно для митотической функции Ran [11].
Интересен тот факт, что сумоилирование может быть вовлечено в патогенез многих нейродегенеративных заболеваний. Показано, что сумоилирование необходимо для ядерного транспорта фактора DJ-1, который подавляет транскрипционную активность апоптотического белка р53, и мутации в котором зачастую связаны с развитием ранней аутосомно-рецессивной формы болезни Паркинсона [12].
Функциональная значимость полисумоилирования остается еще малоизученной. Тем не менее, была показана структурная роль SUMO-2/3 цепей в клетках млекопитающих. Был найден белок CENP-E, который подвергается полисумоилированию SUMO-2/3 и локализуется к кинетохорам*, что является важным для выравнивания хромосом в стадии метафазы во время митоза [9]. Существуют версии, что полисумоилирование может, как и убиквитинилирование, приводить к деградации белков. Так, например, показано, что опухолевый супрессор PML может подвергаться полисумоилированию и деградации 26S-протеасомой. Полисумоилирование может влиять на другие ПТМ за счет экранирования сайтов связывания белка-субстрата с ферментами, принимающими участие в ПТМ [9].
Подводя итоги знакомства с новым маленьким конкурентом борьбы сумо, можно смело говорить о его огромной значимости и необходимости для регуляции широкого спектра клеточных процессов во всех живых организмах от дрожжей до человека. Полученные знания о белке SUMO могут быть интересны не только для любителей японского искусства, но и для почитателей биологии.
Литература
- Crick F.H.C. (1958). On Protein Synthesis. Symp. Soc. Exp. Biol. XII, 139–163;
- Кнорре Д.Г., Кудряшова Н.В., Годовикова Т.С. (2009). Химические и функциональные аспекты посттрансляционной модификации белков. Acta Naturae. 3, 32–56;
- В полку генов убыло;
- Bérénice A. Benayoun, Reiner A. Veitia. (2009). A post-translational modification code for transcription factors: sorting through a sea of signals. Trends in Cell Biology. 19, 189-197;
- Бессмертные клетки Генриетты Лакс;
- Как избавиться от РНК за несколько минут;
- Вездесущий убиквитин;
- Erik Meulmeester, Marion Kunze, He Hsuan Hsiao, Henning Urlaub, Frauke Melchior. (2008). Mechanism and Consequences for Paralog-Specific Sumoylation of Ubiquitin-Specific Protease 25. Molecular Cell. 30, 610-619;
- Xiang-Dong Zhang, Jacqueline Goeres, Hong Zhang, Tim J. Yen, Andrew C.G. Porter, Michael J. Matunis. (2008). SUMO-2/3 Modification and Binding Regulate the Association of CENP-E with Kinetochores and Progression through Mitosis. Molecular Cell. 29, 729-741;
- Helle D. Ulrich. (2008). The Fast-Growing Business of SUMO Chains. Molecular Cell. 32, 301-305;
- M. J. Matunis. (1996). A novel ubiquitin-like modification modulates the partitioning of the Ran-GTPase-activating protein RanGAP1 between the cytosol and the nuclear pore complex. The Journal of Cell Biology. 135, 1457-1470;
- Jun Fan, Haigang Ren, Erkang Fei, Nali Jia, Zheng Ying, et. al.. (2008). Sumoylation is critical for DJ-1 to repress p53 transcriptional activity. FEBS Letters. 582, 1151-1156;
- Shen-Hsi Yang, Andrew D Sharrocks. (2004). SUMO Promotes HDAC-Mediated Transcriptional Repression. Molecular Cell. 13, 611-617;
- N. Stankovic-Valentin, S. Deltour, J. Seeler, S. Pinte, G. Vergoten, et. al.. (2007). An Acetylation/Deacetylation-SUMOylation Switch through a Phylogenetically Conserved KXEP Motif in the Tumor Suppressor HIC1 Regulates Transcriptional Repression Activity. Molecular and Cellular Biology. 27, 2661-2675;
- Yasuhiro Uchimura, Takaya Ichimura, Junsuke Uwada, Taro Tachibana, Satoko Sugahara, et. al.. (2006). Involvement of SUMO Modification in MBD1- and MCAF1-mediated Heterochromatin Formation. J. Biol. Chem.. 281, 23180-23190.







