Тайны периферической иммунной регуляции — за что вручили Нобелевскую премию по физиологии и медицине (2025)?
07 октября 2025
Тайны периферической иммунной регуляции — за что вручили Нобелевскую премию по физиологии и медицине (2025)?
- 2041
- 0
- 9
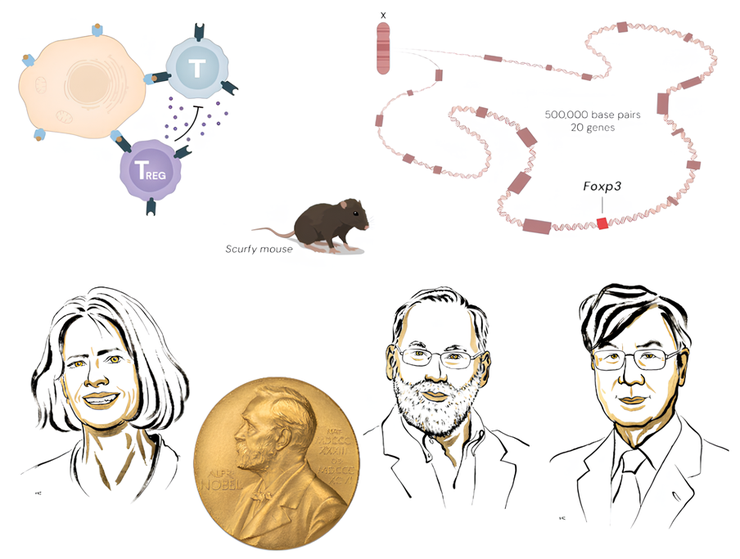
Мэри Бранкоу, Фред Рамсделл и Симон Сакагути — три лауреата Нобелевской премии по физиологии и медицине 2025 года. Премия присуждена «за открытия, касающиеся периферической иммунной толерантности». На рисунке также изображены основные вехи их открытий: мыши scurfy, которые помогли открыть ген Foxp3, необходимый для развития и функции регуляторных Т лимфоцитов; а также сами регуляторные Т-клетки (Тreg) в работе.
Рисунок в полном размере.
коллаж автора статьи по изображениям Нобелевского комитета
-
Автор
-
Редакторы
Иммунная система — это сложный механизм сдержек и противовесов, балансирующий между уверенным отпором внешним угрозам и безопасностью внутренних органов и тканей. Как же организму удается соблюсти этот баланс и не устроить террор своим собственным клеткам? Благодаря серии хорошо спланированных экспериментов и проницательных наблюдений Мэри Бранкоу, Фреду Рамсделлу и Симону Сакагути удалось пролить свет на этот вопрос. Они смогли разобраться, как работает периферическая иммунная толерантность и в чем заключается роль регуляторных Т-клеток. Их исследование приблизило понимание того, как раковые клетки уходят из поля зрения иммунитета и стимулировало разработку новых методов лечения аутоиммунных заболеваний.
Наша иммунная система — это биохимический шедевр эволюции. Каждый день она защищает нас от миллионов вирусов, бактерий и патогенов, которые мы даже не замечаем. Это противостояние не знает конца — иммунная система жестко подавляет инфекции, ну а они, в свою очередь, из кожи вон лезут, чтобы иммунитет обойти. Поэтому главный контур нашей системы безопасности — система опознавания «свой—чужой», причем под второе определение должны попадать также и свои собственные клетки, перешедшие на «темную сторону» — например, раковые или безнадежно пораженные вирусами. В общем, враг поджидает как снаружи, так и изнутри — как же в итоге иммунная система определяет, кого казнить, а кого помиловать? И почему в норме она не нападает на собственный организм?
Долгое время ученые думали, что знают ответ на этот вопрос. Им казалось, что всё определяет центральная иммунологическая толерантность — способность не реагировать на собственные антигены организма, — вырабатываемая в первичных (центральных) органах иммунитета: тимусе для Т-клеток и костном мозге для В-клеток (рис. 1). В недрах этих органов выявляются и уничтожаются аутореактивные лимфоциты — «предатели», распознающие и связывающиеся со здоровыми клетками организма. Кроме того, в этих же органах происходит аннергия — перевод лимфоцитов в неактивное состояние из-за недостатка сигналов для их активации.
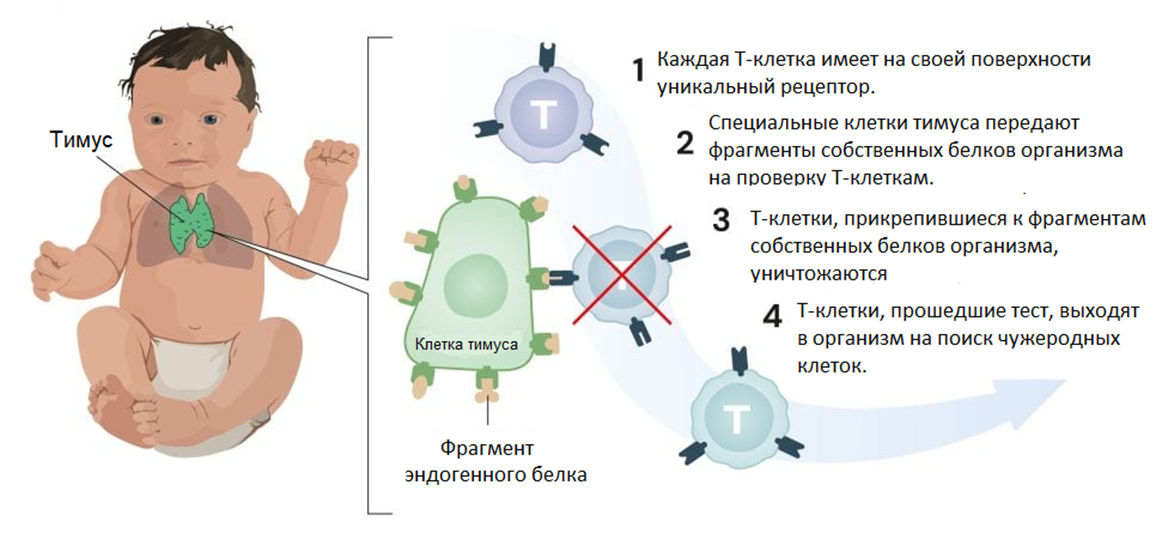
Рисунок 1. Истребление вредоносных Т-клеток в тимусе. В недрах этого органа Т-клетки учатся маршировать и ходить строем, а те из них, которые непокорно распознают собственные клетки организма, будут безжалостно уничтожены. Этот процесс называется центральной толерантностью.
Однако на деле всё оказалось сложнее. Центральная иммунологическая толерантность — лишь первый уровень самоконтроля иммунной системы. Дальше в ход идет уже периферическая иммунная толерантность, подключающаяся во вторичных лимфоидных органах (лимфатические узлы, селезенка) и затем в остальных тканях организма. Использует эта система совершенно иные механизмы — такие как регуляторные Т-клетки и секвестрация (изоляция) антигенов. И именно за открытие этих механизмов были удостоены премии Нобелевские лауреаты этого года .
Надо сказать, что эта Нобелевка — далеко не первая иммунологическая премия: например, в 2011 году уже отметили открытия в области как врожденного, так и приобретенного иммунитета: «Иммунологическая Нобелевская премия (2011)» [1]. Впрочем, тогда основное внимание досталось врожденным системам распознавания патогенов, таким как Toll-подобные рецепторы; в этот же раз мы глубже окунемся в мир приобретенного, или адаптивного иммунитета, рассмотрев нюансы его регуляции. Читателям, знакомым со всем этим лишь понаслышке, мы настоятельно рекомендуем насладиться нашей небольшой, но вполне энциклопедической статьей: «Иммунитет: борьба с чужими и... своими» [2]. — Ред.
Как Т-клетки распознают врага?
Поскольку Т-клетки занимают центральное место в нашей истории, давайте вначале выясним, что о них было известно еще с давних пор — далеких 1990-х годов. В первую очередь, что существует две их главные разновидности:
- Т-хелперы постоянно патрулируют организм. Обнаружив вторгшийся патоген, они предупреждают другие иммунные клетки, которые затем начинают атаку.
- Т-киллеры уничтожают клетки, инфицированные вирусом или другими патогенами. Они также могут атаковать опухолевые клетки.
На поверхности Т-клеток имеются особые белковые датчики, способные отделять свои клетки от чужеродных, — Т-клеточные рецепторы. Все они имеют разную форму своих распознающих частей благодаря механизму генетической рекомбинации — подробнее об этом см. во врезке. Теоретически организм способен выдавать астрономические 1015 различных генных комбинаций для сборки Т-клеточных рецепторов, уникальных для каждого человека: «Анализ индивидуальных репертуаров Т-клеточных рецепторов» [3]. А нужны они для того, чтобы безошибочно распознавать инфекцию, сколь бы многоликой она не была (рис. 2Б).
Благодаря огромному разнообразию репертуаров T-клеточных рецепторов, организм подберет ключик даже к новейшему и ранее неопознанному микробу — на этом изобретении держится весь приобретенный иммунитет. Однако при этом организм создает также большое количество рецепторов, способных распознать и собственные клетки организма. Почему же в таком случае иммунные клетки не атакуют — по большей части — наш организм изнутри?
Иммунная система должна иметь своего надзирателя — мнение лауреата Симона Сакагути

Рисунок 3. Симон Сакагути (р. 1951), M.D. (1976), Ph.D (1983). Заслуженный профессор Центра передовых исследований иммунологии Осакского университета, Япония.
Разобраться в вопросе предстояло японскому исследователю Симону Сакагути (рис. 3), который работал в Научно-исследовательском институте онкологического центра Айти в Нагое, Япония. В 1970-х годах возникла концепция «супрессорных Т-клеток», согласно которой некоторые T-клетки могут подавлять иммунитет [5]. Однако эта область страдала от непоследовательных методик, отсутствия специфических маркеров и невозможности окончательно отличить супрессорные и все прочие Т-клетки.
Чтобы понять, что же еще контролирует иммунную систему, кроме центральной иммунологической толерантности, японские ученые Ясуаки Нисидзука и Тэруё Сакакура в 1969 году провели ряд экспериментов на новорожденных мышах, хирургическим путем удаляя им тимус. Ученые предположили, что в таком случае Т-клеток будет вырабатываться меньше, а иммунная система ослабнет. Однако, если операция проводилась через три дня после рождения мышей, иммунная система начинала работать с перегрузкой и выходила из-под контроля, что приводило к развитию у мышей ряда аутоиммунных заболеваний [6].
В 1973 году Уильям Пенхейл расширил эти наблюдения, показав, что удаление тимуса у крысят приводит к аутоиммунному тиреоидиту с развитием аутоантител к клетки щитовидной железы [7]. Позже он продемонстрировал, что тиреоидит можно предотвратить, если ввести таким крысам лимфоциты от здоровых животных [8].
Чтобы разобраться в этом феномене, за дело взялся наш будущий лауреат — молодой японский исследователь Симон Сакагути. В начале 1980-х годов он повторил эксперименты коллег и выделил Т-клетки, созревшие у генетически идентичных мышей (фактически однояйцевых близнецов), и ввел их мышам с хирургически удаленным тимусом (рис. 4). Эта процедура привела к интересному эффекту — развитие аутоиммунных реакций у мышей без тимуса подавлялось введением лишь некоторых фракций Т-клеток [9].
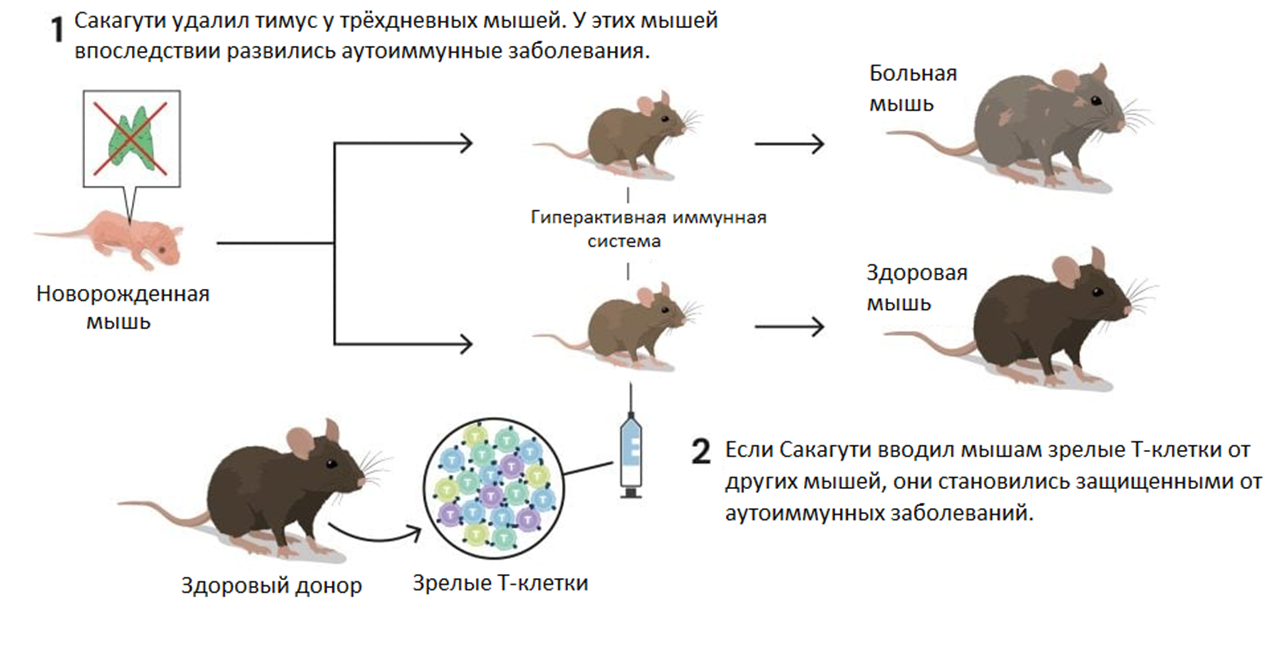
Рисунок 4. Эксперимент, вдохновивший Сакагути на открытие. Если новорожденным мышам удалить тимус, это приводит к развитию аутоиммунных заболеваний. Введение зрелых Т-лимфоцитов определенной фракции от генетически идентичных мышей решает эту проблему.
Этот и другие подобные результаты убедили Сакагути в том, что у иммунной системы должен быть механизм защиты, «успокаивающий» и держащий Т-клетки под контролем. Причем развитие аутоиммунных реакций сдерживали лишь некоторые фракции выделенных Т-клеток — но какие?
Сакагути открывает новый класс Т-клеток
Иммунологи описывают T-клетки по набору белков, расположенных на их поверхности — в частности, Т-хелперы распознаются благодаря белку CD4, а Т-киллеры — по CD8. Вскоре выяснилось, что в эксперименте, в котором Сакагути защищал мышей от аутоиммунных заболеваний, он использовал клетки с CD4 на поверхности — Т-хелперы. Обычно они пробуждают и активируют иммунную систему, но в эксперименте Сакагути всё было наоборот. Он пришел к выводу, что должны существовать различные формы CD4-Т-клеток. Чтобы проверить свою гипотезу, Сакагути необходимо было научиться отличать одни T-клетки от других.
Направление, заданное Сакагути, подхватили Фиона Поури и Дон Мейсон из Оксфордского университета, которые при помощи моноклональных антител показали, что CD4±Т-хелперы, экспрессирующие много белка CD45RB, при введении бестимусным мышам вызывали тяжелое изнуряющее заболевание, характеризующееся системным воспалением внутренних органов. При этом инъекция других CD4+ лимфоцитов — с низким уровнем CD45RB — защищала животных от заболевания [10]. Они пришли к выводу, что функциональная гетерогенность и специализация в популяции периферических CD4+Т-клеток смогут объяснить механизмы иммунной регуляции. Однако понять, чем же отличаются эти клеточные популяции, ученые всё же не смогли.
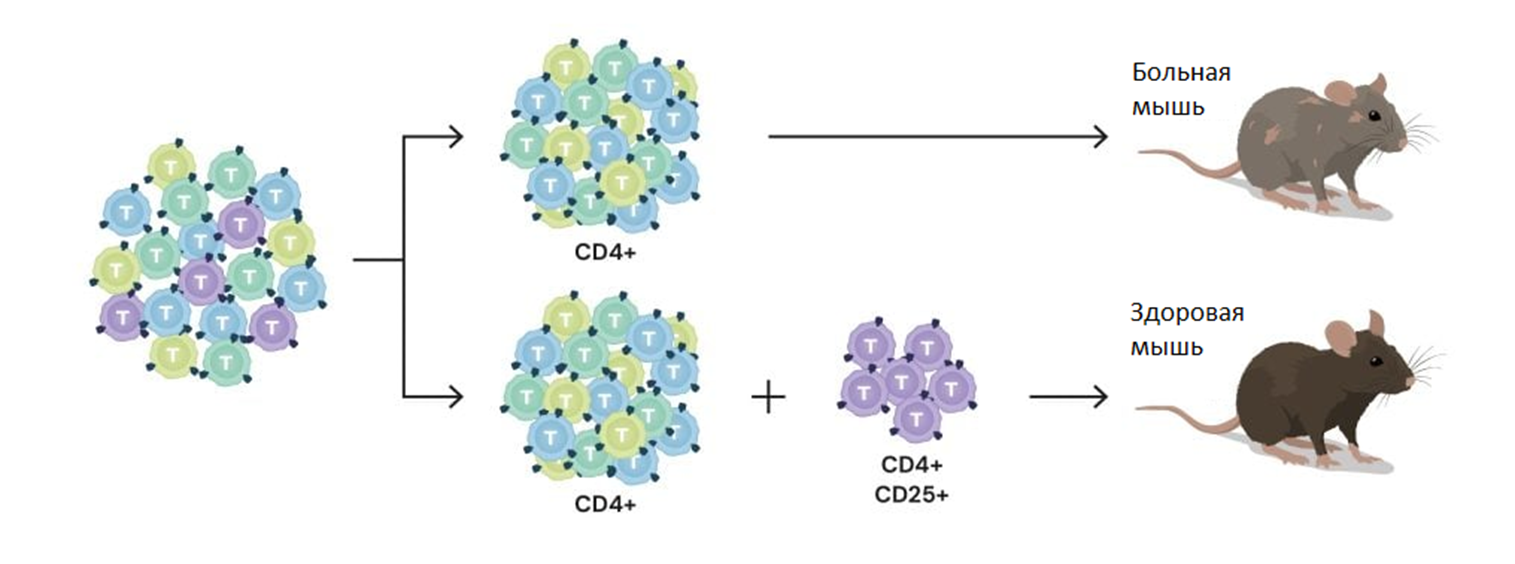
Рисунок 5. Сакагути определяет новый класс Т-клеток и показывает, что лимфоциты с CD25 на поверхности защищают мышей без собственных T-клеток от аутоиммунных заболеваний. Если мышам вводили Т-клетки, несущие CD4, но не CD25, развивались серьезные аутоиммунные заболевания; если же маркер CD25 также присутствовал, мыши оставались здоровыми.
После того, как Сакагути определил подгруппу CD4+CD25+ как совершенно новый тип Т-клеток, термин «регуляторные Т-клетки» получил широкое признание в научном сообществе [12]. Кроме того, Сакагути и его коллеги продемонстрировали, что большинство регуляторных Т-клеток вырабатывается именно в тимусе [13]. Они также идентифицировали рецепторный белок CTLA-4 как дополнительный маркер этих клеток [14].
Однако многие исследователи все еще скептически отнеслись к открытию; им требовались дополнительные доказательства участия регуляторных Т-клеток в подавлении аутоиммунных расстройств. Ключевую информацию смогли предоставить два других лауреата — Мэри Бранкоу и Фред Рамсделл. Настало время для второго акта Нобелевских открытий — а начинается он с рождения больных самцов мышей в секретной американской лаборатории в 1940-х годах.
Мутация, нарушающая иммунную систему, и Манхэттенский проект
В этой лаборатории, расположенной в городе Оук-Ридж, штат Теннесси, исследователи изучали последствия радиации — их работа была частью Манхэттенского проекта по разработке атомной бомбы. Ключевая для Нобелевки этого года линия мышей стала эволюционной случайностью: некоторые самцы, подвергшиеся в утробе действию радиации, родились с чешуйчатой и шелушащейся кожей, чрезвычайно увеличенной селезенкой и лимфатическими узлами и прожили всего несколько недель [15].
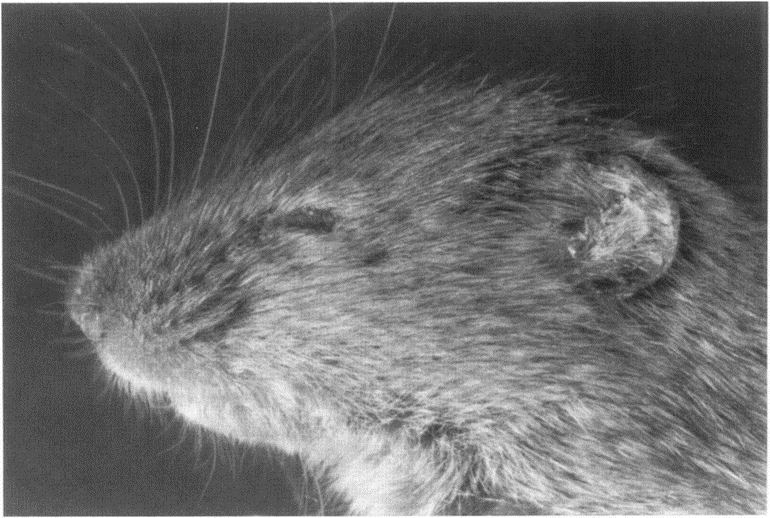
Рисунок 6. Мыши линии scurfy (sf/Y). На фото видны типичные признаки: прищуренные глаза и маленькие, покрытыми шелушащейся коркой, уши.
Линия мышей, получившая название scurfy, привлекла внимание исследователей. Молекулярная генетика тогда только зарождалась, но при дальнейшем скрещивании потомков этих мышей исследователи поняли, что мутация, вызывающая это заболевание, должна быть локализована в X-хромосоме. Половина всех самцов мышей были больны, но самки могли жить нормально, поскольку у них две X-хромосомы, одна из которых имеет здоровую ДНК. Таким образом, самки передают мутацию scurfy в Х-хромосоме следующим поколениям.
В 1990-х годах, когда молекулярные инструменты значительно усовершенствовались, исследователи начали изучать причины такого заболевания у самцов мышей, страдающих от множественных аутоиммунных реакций. Оказалось, что их органы подвергались атаке Т-клеток, разрушающих ткани. По какой-то причине мутация, вызывающая шелушение кожи, по-видимому, поднимала «восстание» иммунной системы.
Бранкоу и Рамсделл ищут объяснения аутоиммунных заболеваний
Двое исследователей, заинтересовавшихся мутацией, вызывающей шелушение и мультиорганную недостаточность, были Мэри Бранкоу и Фредом Рамсделлом (рис. 7). Они работали в биотехнологической компании Celltech Chiroscience в Ботхелле, штат Вашингтон, США. Компания разрабатывала фармацевтические препараты для лечения аутоиммунных заболеваний. Изучая линию мышей sf/Y, Бранкоу и Рамсделл поняли, что эти мыши, пораженные шелушением, являются ключом к сути их работы. Если бы они смогли понять молекулярный механизм, лежащий в основе заболевания мышей, секрет аутоиммунных заболеваний вышел бы наружу. Исследователи приняли важное решение: они будут искать тот самый мутантный ген, приводящий к шелушению кожи у несчастных мышей.

Рисунок 7. Нобелевские лауреаты 2025. Слева: Мэри Э. Бранкоу (р. 1961), Ph.D. Принстонского университета (США). Старший руководитель программ Института системной биологии (Сиэттл, США). Справа: Фред Рамсделл (р. 1960), Ph.D. Калифорнийского университета (Лос-Анджелес, США). Научный консультант в компании Sonoma Biotherapeutics (Сан-Франциско, США).
Сегодня можно картировать весь геном мыши и найти мутировавший ген за несколько дней. В 1990-х годах это было похоже на поиск иголки в гигантском стоге сена. Цепочка ДНК, образующая Х-хромосому мышей, состоит примерно из 170 миллионов пар оснований нуклеотидов. Обнаружение мутации в этой массе ДНК было возможно, но требовало времени, терпения и творческого использования инструментов молекулярной биологии той эпохи.
— Полагаю, дело в том, что вы, конечно, выдающийся генетик, и клонирование гена, его обнаружение в 1998 году — это было совсем не то же самое, что поиск генов сейчас. Вам пришлось провести целый комплекс сложных исследований.
— Да, поразительно, насколько изменилась наука. И то, как мы это делаем сегодня, совершенно отличается от того, как нам приходилось делать это тогда.
Иголка в стоге ДНК-сена
Картирование показало, что мутация scurfy должна находиться где-то в середине X-хромосомы. Бранкоу и Рамсделлу удалось сузить потенциальную область до примерно 500 000 нуклеотидов; затем они приступили к кропотливой работе по детальному картированию этой области X-хромосомы.
Это заняло много времени. Когда Бранкоу и Рамсделл закончили, они установили, что эта область содержит 20 потенциальных генов. Следующей задачей было сравнить эти гены у здоровых и больных мышей, перебрав их один за другим. Только с двадцатым — последним! — геном они смогли сказать: «бинго!». После многих лет упорной работы мутация, отвечающая за шелушение кожи, наконец-то была найдена (рис. 8).
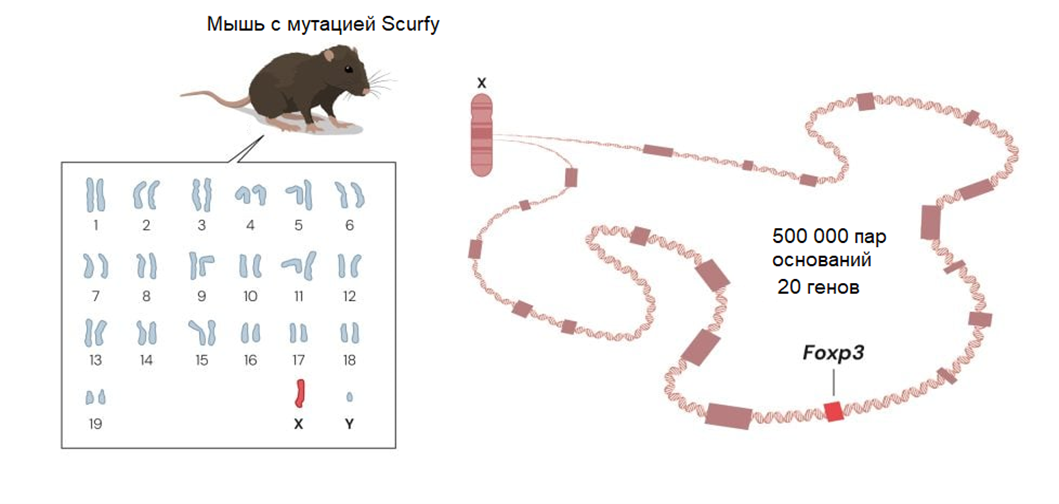
Рисунок 8. Бранкоу и Рамсделл обнаруживают мутацию у мышей с мутацией scurfy. Эта мутация вызывает сбой в регуляции иммунной системы, и локализовать ее удалось внутри гена Foxp3, оказавшегося решающим в развитии регуляторных Т-клеток.
Дефектный ген ранее не был известен, но имел много общего с группой генов, называемых forkhead box или FOX. Они кодируют белки, регулирующие активность других генов (транскрипционные факторы), что может влиять на развитие иммунных клеток. Поэтому Мэри Бранкоу и Фред Рамсделл назвали новый ген Foxp3.
Открытие поломанного гена выявило причину серьезного аутоиммунного заболевания у людей
В ходе своей работы Бранков и Рамсделл начали подозревать, что редкое аутоиммунное генетическое заболевание IPEX, также связанное с Х-хромосомой, может быть человеческим вариантом расстройства, от которого страдают мыши sf/Y. Синдром IPEX также приводит к экземам на коже, полиорганной недостаточности и эндокринным нарушениям вроде диабета первого типа.
В базе данных, где исследователи хранят информацию о недавно открытых генах, они нашли человеческий эквивалент поломанного мышиного гена Foxp3. С помощью педиатров со всего мира они собрали образцы геномов у мальчиков, страдающих IPEX. При картировании образцов они действительно обнаружили опасные мутации в гене FOXP3.
В 2001 году в журнале Nature Genetics Мэри Бранкоу и Фред Рамсделл выпустили работу, в которой описали, что мутации в гене FOXP3 вызывают как заболевание человека, называемое синдромом IPEX, так и проблемы со здоровьем у мышей линии sf/Y [16]. Эти ключевые открытия привели к научному переполоху в нескольких ведущих иммунологических лабораториях мира. Собрав воедино фрагменты головоломки, исследователи поняли, что ген FOXP3 может быть важен для экспрессии регуляторных Т-клеток, открытых Сакагути.
Регуляторные Т-клетки — стражи организма
Два года спустя Симон Сакагути, а вскоре и другие исследователи смогли убедительно доказать, что ген FOXP3 контролирует развитие регуляторных Т-клеток. Эти клетки предотвращают ошибочную атаку других Т-клеток на собственные ткани организма (рис. 9), что важно для процесса, называемого периферической иммунной толерантностью. Регуляторные Т-клетки также обеспечивают торможение иммунной системы после устранения патогенной угрозы для организма, как бы завершая аврал.
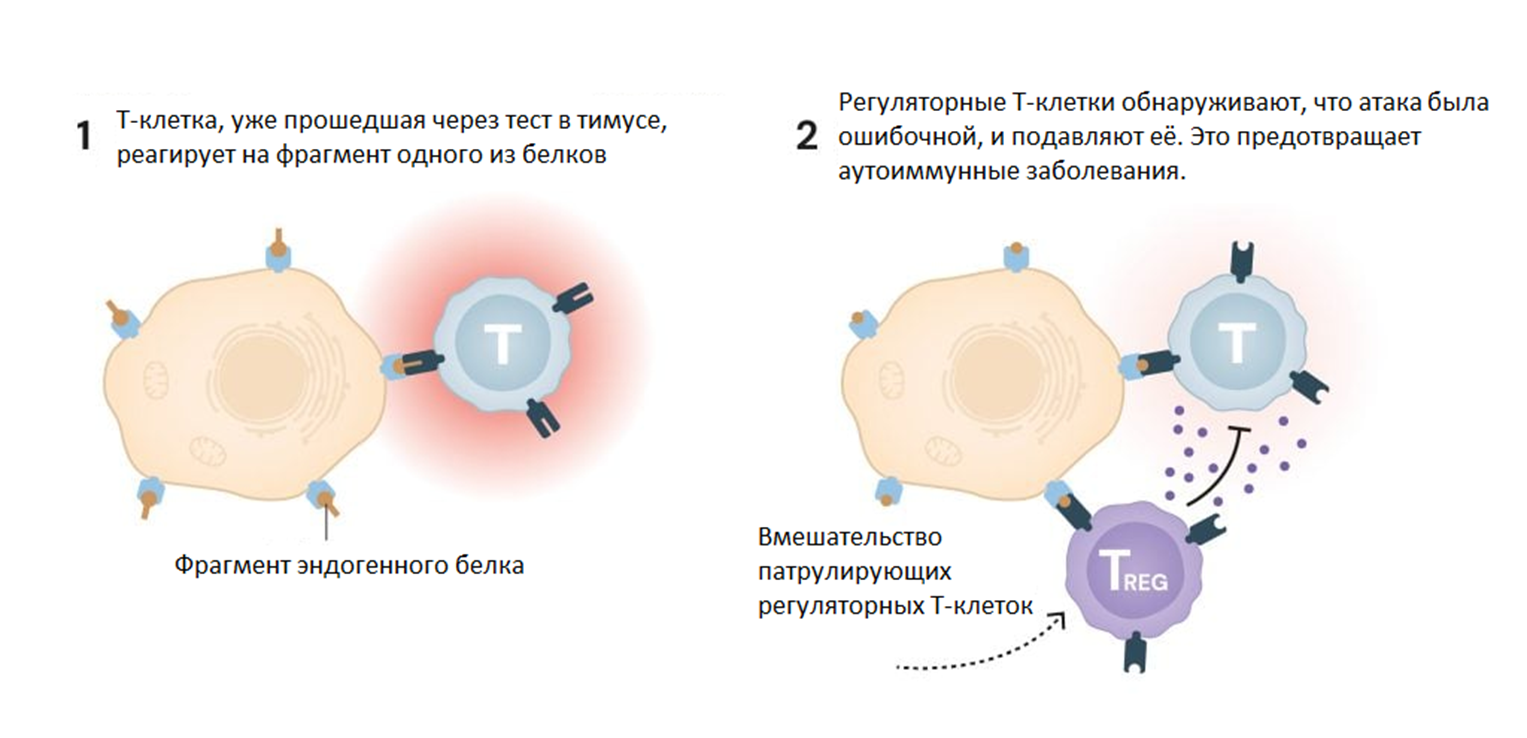
Рисунок 9. Как регуляторные Т-клетки защищают нас. Даже Т-клетки, уже прошедшие через отбор центральной иммунной толерантности в тимусе, могут атаковать собственные здоровые клетки организма. Регуляторные Т-клетки постоянно патрулируют ткани и предотвращают нежелательные атаки иммунной системы.
Фундаментальные знания, полученные исследователями благодаря открытию регуляторных Т-клеток и их роли в периферической иммунной толерантности, стимулировали разработку потенциальных новых методов лечения. Картирование опухолей показывает, что они могут привлекать большое количество регуляторных Т-клеток, защищающих их от иммунной системы . Поэтому исследователи пытаются найти способы разрушить этот барьер из регуляторных Т-клеток, чтобы иммунная система могла получить доступ к опухолям [19].
Опять-таки, среди «нобелевских» тем мы не впервые видим раковые клетки, обманывающие иммунитет: «Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018)» [20]. — Ред.
При аутоиммунных заболеваниях исследователи вместо этого пытаются стимулировать образование большего количества регуляторных Т-клеток. В пилотных исследованиях пациентам вводят специально мутированный интерлейкин-2 — вещество, на которое больше не реагируют обычные Т-клетки, но которые «интересны» Treg [21]. Исследователи также изучают, можно ли использовать интерлейкин-2 для предотвращения отторжения органов после трансплантации.
Другая стратегия, которую исследователи тестируют для замедления гиперактивности иммунной системы, заключается в выделении регуляторных Т-клеток пациента и их размножении в лабораторных условиях. Затем их возвращают пациенту, что приводит к увеличению количества регуляторных Т-клеток в его организме. В некоторых случаях исследователи также модифицируют Т-клетки, добавляя на их поверхность антитела, которые выполняют функцию адресной метки. Это позволяет исследователям, например, отправлять этих защитников клеток в трансплантированную печень или почку и защищать орган от атак иммунной системы.
Существует еще и третье направление — CAR-Treg. Так, ген FOXP3 могут модифицировать, чтобы его было больше и/или чтобы он был стабильным. Это делают по аналогии с CAR-T-клетками (chimeric antigen receptor T cells), так как у этих клеток тоже модифицируется Т-клеточный рецептор [22].
Сейчас существует множество примеров исследований, в которых ученые проверяют возможности использования регуляторных Т-клеток для борьбы с заболеваниями. Благодаря своим революционным открытиям Мэри Бранкоу, Фред Рамсделл и Симон Сакагути предоставили фундаментальные знания о регуляции и контроле иммунной системы. Тем самым они принесли человечеству величайшую пользу.
На основе пресс-релиза Нобелевского комитета.
Литература
- Иммунологическая Нобелевская премия (2011);
- Иммунитет: борьба с чужими и… своими;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Susumu Tonegawa. (1983). Somatic generation of antibody diversity. Nature. 302, 575-581;
- Gershon R. K., Kondo K. (1970). Cell interactions in the induction of tolerance: the role of thymic lymphocytes. Immunology. 18, 723;
- Yasuaki Nishizuka, Teruyo Sakakura. (1969). Thymus and Reproduction: Sex-Linked Dysgenesia of the Gonad after Neonatal Thymectomy in Mice. Science. 166, 753-755;
- Penhale W. J. (1973). Spontaneous thyroiditis in thymectomized and irradiated Wistar rats. Clinical and experimental immunology. 15, 225;
- Penhale W. J. (1976). Thyroiditis in T cell-depleted rats: suppression of the autoallergic response by reconstitution with normal lymphoid cells. Clinical and experimental immunology. 25, 6;
- S Sakaguchi, T Takahashi, Y Nishizuka. (1982). Study on cellular events in post-thymectomy autoimmune oophoritis in mice. II. Requirement of Lyt-1 cells in normal female mice for the prevention of oophoritis.. The Journal of experimental medicine. 156, 1577-1586;
- F Powrie, D Mason. (1990). OX-22high CD4+ T cells induce wasting disease with multiple organ pathology: prevention by the OX-22low subset.. The Journal of experimental medicine. 172, 1701-1708;
- Sakaguchi S. (1995). Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. Journal of immunology. 155, 1151–1164;
- Takeshi Takahashi, Tomoyuki Tagami, Sayuri Yamazaki, Toshimitsu Uede, Jun Shimizu, et. al.. (2000). Immunologic Self-Tolerance Maintained by Cd25+Cd4+Regulatory T Cells Constitutively Expressing Cytotoxic T Lymphocyte–Associated Antigen 4. The Journal of Experimental Medicine. 192, 303-310;
- Itoh M. (1999). Thymus and autoimmunity: production of CD25+ CD4+ naturally anergic and suppressive T cells as a key function of the thymus in maintaining immunologic self-tolerance. The Journal of Immunology. 162, 5317–5326;
- Simon Read, Vivianne Malmström, Fiona Powrie. (2000). Cytotoxic T Lymphocyte–Associated Antigen 4 Plays an Essential Role in the Function of Cd25+Cd4+ Regulatory Cells That Control Intestinal Inflammation. The Journal of Experimental Medicine. 192, 295-302;
- Godfrey V. L., Wilkinson J. E., Russell L. B. (1991). X-linked lymphoreticular disease in the scurfy (sf) mutant mouse. The American journal of pathology. 138, 1379;
- Robert S. Wildin, Fred Ramsdell, Jane Peake, Francesca Faravelli, Jean-Laurent Casanova, et. al.. (2001). X-linked neonatal diabetes mellitus, enteropathy and endocrinopathy syndrome is the human equivalent of mouse scurfy. Nat Genet. 27, 18-20;
- S Sakaguchi, K Fukuma, K Kuribayashi, T Masuda. (1985). Organ-specific autoimmune diseases induced in mice by elimination of T cell subset. I. Evidence for the active participation of T cells in natural self-tolerance; deficit of a T cell subset as a possible cause of autoimmune disease.. The Journal of experimental medicine. 161, 72-87;
- S Sakaguchi, N Sakaguchi. (1988). Thymus and autoimmunity. Transplantation of the thymus from cyclosporin A-treated mice causes organ-specific autoimmune disease in athymic nude mice.. The Journal of experimental medicine. 167, 1479-1485;
- Tatiana Akimova, Liqing Wang, Zhanna Bartosh, Lanette M. Christensen, Evgeniy Eruslanov, et. al.. (2024). Antisense targeting of FOXP3+ Tregs to boost anti-tumor immunity. Front. Immunol.. 15;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Liliane Khoryati, Minh Nguyet Pham, McKenna Sherve, Swarnima Kumari, Kevin Cook, et. al.. (2020). An IL-2 mutein engineered to promote expansion of regulatory T cells arrests ongoing autoimmunity in mice. Sci. Immunol.. 5;
- Sebastian Bittner, Thomas Hehlgans, Markus Feuerer. (2023). Engineered Treg cells as putative therapeutics against inflammatory diseases and beyond. Trends in Immunology. 44, 468-483.