
Тетродотоксин — история элегантного убийцы
01 ноября 2016
Тетродотоксин — история элегантного убийцы
- 25605
- 0
- 13
Подобно агенту 47, тетродотоксин является превосходным убийцей, который, однако, не лишен благородных черт и может использоваться даже во благо общества.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Среди всего многообразия молекулярного вооружения, которое эволюция подарила живым организмам, наиболее эффективным и смертоносным оружием являются нейротоксины — вещества, специфично воздействующие на нервную систему атакуемой жертвы. Один из наиболее интересных и загадочных нейротоксинов — тетродотоксин (ТТХ), обнаруженный у многих морских и наземных животных. Это один из сильнейших нейропаралитических ядов, в 100 раз более эффективный, чем цианид калия. Ученые до сих пор пристально присматриваются к самому элегантному низкомолекулярному убийце и пытаются разгадать все его тайны.
«Био/мол/текст»-2016
 Эта работа заняла первое место в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Эта работа заняла первое место в номинации «Свободная тема» конкурса «био/мол/текст»-2016.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Подобная активность тетродотоксина обусловлена его уникальным свойством прочно блокировать ионные каналы в мембранах нервных и мышечных клеток, тем самым «запрещая» передачу нервного сигнала и вызывая паралич мышц. Несмотря на более чем вековую историю изучения тетродотоксина, некоторые ее страницы до сих пор полны белых пятен, а некоторые — окутаны мистикой и давно стали почвой для мифов: например, о жрецах Вуду, якобы умеющих превращать людей в зомби. Конечно же, ученые не могли мириться с таким положением дел и попытались окончательно разобраться в свойствах этого таинственного убийцы — а вдруг смертоносные молекулы можно заставить работать в мирных целях? В конце концов, даже опаснейший ботулотоксин где теперь только не используют! Так что же мы знаем о тетродотоксине сейчас?
Краткое досье
Как и многие известные нейротоксины, тетродотоксин (ТТХ) был впервые выделен в ХХ веке, однако знакомство человечества со столь сильным ядом произошло намного раньше. Существуют упоминания о том, что потрясающая ядовитость рыб фугу (рис. 1) — самых известных источников токсина — была знакома древнеегипетским любителям морепродуктов еще за 2500 лет до н.э. [1]! Жители Страны восходящего солнца, активно употребляющие в пищу этих рыб, также давно знают о том, что поедание подобных деликатесов представляет собой своеобразную «игру в рулетку». Даже европейцам токсин рыбы фугу был известен за несколько веков до выделения его в чистом виде: в своих бортовых журналах знаменитый мореплаватель Джеймс Кук описывает интересный случай, когда он и его команда едва не умерли, приготовив свежевыловленную рыбу. Кук с моряками отделались отравлением, в то время как животные, которых они держали на борту и которым скормили рыбьи внутренности, не пережили этой трапезы. Задолго до открытия самогό токсина путешественник первым смог сделать вывод о том, какие органы рыбы наиболее ядовиты [2].

Рисунок 1. Рыба фугу и популярное японское национальное блюдо — сашими, приготовленное из ее филе. Для приготовления опасного деликатеса повара должны пройти специальный двухгодичный (!) курс обучения и получить особую лицензию. Затраты на обучение оправдываются стократно: работа повара, имеющего такую лицензию, — одна из самых высокооплачиваемых в ресторанах Японии.
левая фотография — с сайта clotheshorse.com, правая — из поездки Антона Чугунова на конференцию в Японию
Однако, несмотря на широкую известность фугу, яд был выделен из рыб только в 1906 году японским доктором Ёсизуми Тахарой и назван тетродотоксином — в соответствии с названием семейства рыб Tetraodontidae [3]. Но открытие Тахары осталось почти незамеченным, и до середины ХХ века ТТХ избегал пристального внимания ученых, продолжая травить незадачливых японских гурманов. Повышение интереса к токсину наметилось только спустя несколько десятилетий, когда в 1950 году его впервые выделили в кристаллическом виде [4], а затем спустя еще десятилетие три независимых исследовательских группы установили его химическую структуру (одну из этих групп возглавлял легендарный Роберт Вудворд) [2], [5]. Структура токсина оказалась уникальной: циклический гуанидиновый фрагмент, сшитый с объемным диоксоадамантановым углеродным скелетом, образовывал полярную молекулу, напоминающую железную клеть с торчащими во все стороны прутьями — гидроксильными группами (рис. 2).
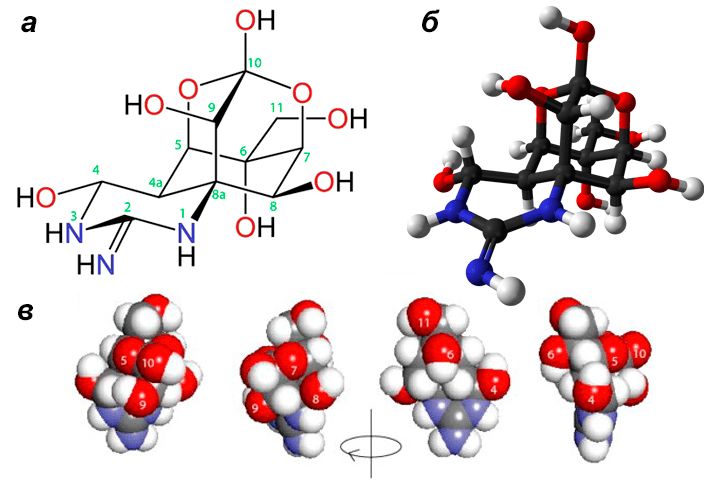
Рисунок 2. Химическая структура тетродотоксина. а — Стереохимическая проекция молекулы с нумерацией атомов и с сохранением конформаций гуанидинового (с атомами азота) и диоксоадамантановых (с атомами углерода и кислорода) циклов. б — Модельная проекция ТТХ. Атомы углерода, азота, кислорода и водорода отмечены черным, синим, красным и белым цветами соответственно. в — Пространственное представление молекулы ТТХ. Модель составлена по четырем последовательным изображениям, полученным при вращении молекулы вокруг вертикальной оси по часовой стрелке. Атомы кислорода пронумерованы в соответствии с атомами углерода, с которыми они связаны.
Примерно в это же время токсин впервые нашел практическое применение — вместе со своим структурным гомологом, сакситоксином, ТТХ стал ценным инструментом в руках нейрофизиологов и привел к открытию ионных каналов в мембранах нервных клеток, а также позволил выяснить природу потенциалов действия, лежащих в основе нервного импульса [6], [7]. Было установлено, что молекулярной мишенью токсина являются потенциал-чувствительные натриевые каналы (ПЧНК) , присутствующие в мембранах нервных клеток и ответственные за проведение сигналов между ними. Иронично, что именно ТТХ, вызывающий паралич и летальный исход за счет блокировки тока ионов натрия через эти каналы, и позволил досконально изучить строение этих самых каналов. Средневековая мудрость «Всё есть яд и всё есть лекарство — важна лишь доза» оказалась здесь как нельзя кстати и позволила превратить опасный нейротоксин в удобный инструмент для исследований.
О пространственной структуре простейшей (бактериальной) версии такого канала рассказывает статья «О чем не знал Гальвани: пространственная структура натриевого канала» [8], а о природных токсинах, манипулирующих ПЧНК, компьютерном анализе «молекулярной гонки вооружений» и его прикладных задачах — материал «Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов» [9]. — Ред.
Как действует лицензия на убийство?
В рассказе о механизме, на основании которого животные, продуцирующие или аккумулирующие ТТХ, используют «лицензию на убийство», сложно обойтись без образных сравнений. Главное из них касается особенностей взаимодействия токсина с ПЧНК: благодаря уникальной химической структуре токсин выступает в качестве «молекулярной пробки», физически закупоривающей натриевые каналы. Для этого его гуанидиновая группа на правах небольшого органического катиона проникает внутрь поры канала, однако ее дальнейшее продвижение оказывается невозможным. Виной тому — массивная «задняя» часть молекулы, которая застревает внутри поры, очень прочно связываясь с ее аминокислотными остатками посредством множества собственных функциональных групп. В таком закупоренном состоянии ток ионов натрия через канал становится невозможным, и клетки теряют способность проводить нервные импульсы. Надежность подобной молекулярной пробки настолько высока, что летальная доза токсина крайне мала — всего 10 мкг/кг для человека [10]. Для сравнения: цианистого калия — самого популярного «детективного» яда — требуется в 100 с лишним раз больше для достижения его летальной дозы — 1,7 мг/кг [11].
Справедливости ради стόит заметить, что не все ПЧНК одинаково чувствительны к ТТХ и не все из них становятся его непосредственными молекулярными «жертвами» при отравлении. Только семь из девяти установленных подтипов ПЧНК обладают достаточной чувствительностью к ТТХ, чтобы взаимодействовать с ним при его наномолярных концентрациях. Остальные два типа каналов также способны к связыванию ТТХ, однако для этого им необходимы в 1000 раз большие концентрации токсина [12]. Подобная неоднородность в чувствительности обусловлена различиями в аминокислотной последовательности разных типов ПЧНК, а точнее — различиями в конкретных их сайтах, необходимых для связывания токсина. Соответственно, «идеальными» участками связывания обладают подтипы ПЧНК, для взаимодействия с которыми требуются крайне малые количества ТТХ. Такие подтипы широко представлены как в центральной (ЦНС), так и в периферической нервной системе (ПНС), а также в скелетных мышцах [12]. Тем не менее чувствительность к ТТХ — не единственный фактор, ограничивающий круг его «клиентов», которых он стремится «убрать» при отравлении организма.
Ограничения на распространение ТТХ накладывает и способность самой молекулы добираться из кровеносной системы до тех или иных молекулярных мишеней. Например, токсин не способен преодолевать гематоэнцефалический барьер — особый физиологический фильтр между ЦНС и кровеносной системой — и взаимодействовать с ТТХ-чувствительными каналами в ЦНС [12]. Принимая во внимание все эти факторы, удалось установить, что главными мишенями ТТХ при отравлениях служат ТТХ-чувствительные каналы в ПНС и скелетных мышцах. Физическое блокирование именно этих каналов является причиной всех тяжелых симптомов, которыми сопровождается интоксикация ТТХ.
Обычно встреча человека со столь эффективным низкомолекулярным киллером происходит при поедании морепродуктов, по тем или иным причинам содержащих токсин. ТТХ встречается не только в неправильно приготовленной фугу (при создании деликатеса из нее избегают использования наиболее токсичных частей тела — печени и яичников), но и в моллюсках, аккумулирующих токсин благодаря деятельности ТТХ-продуцирующих микроорганизмов.
Симптомы отравления ТТХ обычно проявляются в течение первых шести часов после приема пищи и на начальном этапе включают в себя тошноту, недомогание и онемение конечностей. В более тяжелых случаях уже в течение 40 минут токсин способен вызвать параличи, дыхательную недостаточность и кому с последующим летальным исходом [13]. Именно с возникновением дыхательной недостаточности вследствие паралича дыхательных мышц и связаны смертельные случаи отравления токсином. И наконец последний штрих к портрету идеального убийцы — отсутствие к нему антидота, который можно было бы вводить пациентам при отравлениях ТТХ. В таком случае уберечь человека от печального исхода может только скорейшая госпитализация и подключение к аппарату искусственной вентиляции легких. К счастью, в большинстве случаев это удается сделать вовремя, и с 2006 по 2009 год из 183 зафиксированных случаев отравления в Японии только семь закончились плачевно [14]. Тем не менее ТТХ по-прежнему остается опасным нейротоксином, и встреча с ним в каком-нибудь японском ресторане не сулит ничего хорошего.
Как заставить плохого парня работать на благо общества?
Как мы выяснили, еще в 50-х годах прошлого века исследователи смогли превратить опасный тетродотоксин в ценнейший молекулярный инструмент, позволивший сделать несколько важных открытий в нейрофизиологии. Однако на этом полезный потенциал «плохого парня» не заканчивается, и токсин обладает еще целым рядом особенностей, благодаря которым его можно плодотворно использовать, например, в медицине. Чтобы понять, каким образом можно направить тетродотоксин на «праведный путь», стόит вспомнить, что ПЧНК являются непосредственными участниками формирования и передачи болевых сигналов [15]. Потому логичным терапевтическим предназначением ТТХ может стать купирование болевых состояний (рис. 3). А именно — нейропатических болей, которые обусловлены патологическим возбуждением нейронов, ответственных за реакцию на различные физические повреждения. Именно для этого типа боли лучше всего установили роль ТТХ-чувствительных ПЧНК в ЦНС и ПНС и показали максимальную эффективность ТТХ в экспериментах с мышами [16], [17].
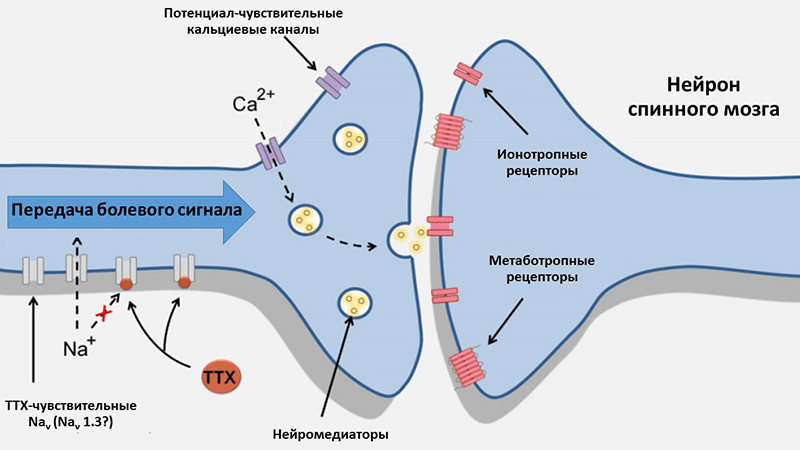
Рисунок 3. Возможный механизм действия ТТХ при нейропатических болях. При таком типе болей чувствительные нейроны могут создавать внезапный очаг потенциалов действия — предположительно, путем повторной экспрессии Nav1.3, одного из подтипов ТТХ-чувствительных ПЧНК. Потенциал действия распространяется вдоль аксона и активирует потенциал-чувствительные кальциевые каналы, что приводит к высвобождению нейромедиаторов в синаптическую щель. Нейромедиаторы, в свою очередь, активируют рецепторы постсинаптической мембраны нейронов задних рогов спинного мозга и таким образом осуществляют передачу болевого сигнала. Токсин за счет блокирования Nav1.3 может препятствовать возникновению очага потенциалов действия и предотвращать появление и распространение боли.
Среди людей, страдающих от нейропатических болей, целевой группой для ТТХ-терапии являются онкобольные, проходящие длительный курс химиотерапии. Это связано с тем, что противоопухолевые препараты способны провоцировать сильные устойчивые боли, проявляющиеся аллодинией (ощущением боли после стимуляции, обычно не вызывающей боль, например температурной или тактильной) и гипералгезией (аномально высокой чувствительностью к болевым стимулам).
Доклинические испытания ТТХ в качестве анальгетика показали, что характерные боли (например, механическая аллодиния и тепловая гипералгезия), появляющиеся у мышей при введении им противоопухолевого (цитостатического) препарата паклитаксела, сильно ослабевают при использовании малых количеств ТТХ (1–6 мкг/кг). Кроме того, некоторые болевые состояния могут исчезать полностью, если ТТХ вводится за три часа до инъекции цитостатика [18].
Клинические испытания, в которых участвовали онкопациенты, также показали обнадеживающие результаты: после четырехдневного курса инъекций ТТХ (дозировка в пределах 15–90 мкг тщательно подбиралась врачом) боли значительно уменьшались на срок до двух и более недель. Несмотря на то, что у некоторых пациентов наблюдались побочные эффекты, такие как слабость и тошнота, они проявлялись в легкой форме и недолго [19]. Дополнительно обезболивающий эффект ТТХ сравнили с эффектом морфия, уже давно используемого в качестве анальгетика для онкобольных. У мышей токсин уменьшал нейропатические боли так же эффективно, однако, в отличие от морфия, не вызывал при этом седацию (легкое подавление сознания) и двигательные и дыхательные нарушения [20].
Похожий вариант использования ТТХ в медицине — это местная анестезия. Местные анестетики понижают или полностью подавляют возбудимость чувствительных нервных окончаний в слизистых оболочках, коже и других тканях при непосредственном контакте. Одной из первых моделей, на которой удалось проверить действие ТТХ как анестетика длительного действия, послужила деэпителизация роговицы кролика. Исследователи механически удаляли центральный эпителий роговицы, затем закапывали в нижний конъюнктивальный мешок ТТХ в различной концентрации и в течение 24 часов тщательно отслеживали реакцию глаза на раздражение (мигание, сужение зрачка). Было отмечено, что в концентрации 10 ммоль/л ТТХ давал сильный обезболивающий эффект, длящийся до восьми часов, и при этом не вызывал раздражение глаз, утолщение роговицы и системную токсичность. Для сравнения: эффект пропаракаина — популярного в офтальмологии местного анестетика — держался всего в течение часа. Таким образом, эти исследования демонстрируют возможность применения ТТХ в фоторефракционной кератэктомии (одном из основных видов лазерной коррекции зрения) [21].
Еще одной интересной особенностью ТТХ является его способность продлять действие ряда других местных анестетиков, иными словами — обеспечивать длительную аналгезию после завершения действия анестетика. Например, в сочетании с одним из сильнейших препаратов, бупивакаином, ТТХ способен обеспечивать блокировку тепловой болевой чувствительности у крыс в течение почти 15 часов, в отличие от трех часов при использовании только бупивакаина. Применение ТТХ в комбинации с бупивакаином также позволило снизить довольно ощутимую токсичность последнего [22].
Пара белых пятен в истории очаровательного убийцы
Завершая многогранную историю ТТХ, нельзя не упомянуть, что, несмотря на более чем столетнее изучение свойств смертельного нейротоксина с потенциально благородными намерениями, некоторые страницы его биографии до сих пор остаются недописанными.
Например, доподлинно неизвестно его биологическое происхождение — на статус первичного звена в тетродотоксинном производстве претендует одновременно несколько кандидатов (рис. 4). И главные из них — микроорганизмы, продуцирующие ТТХ и обнаруженные у различных ТТХ-содержащих животных. Прокариотические ТТХ-продуценты чрезвычайно разнообразны — они относятся более чем к 10 различным родам [23]. Считается, что эти микробы попадают в животных-хозяев по пищевым цепям либо состоят с ними в симбиотических отношениях. Тем не менее стройную и красивую теорию о микробиологическом происхождении токсина крайне некрасиво нарушает калифорнийский тритон, в котором, несмотря на его чрезвычайную ядовитость, подобные бактерии так и не были найдены [24]. Тритон умудряется водить за нос исследователей еще и потому, что в экспериментах, призванных показать, что синтез токсина происходит в организме животного de novo (то есть осуществляется самим животным), тоже был получен отрицательный результат [25]. Каким образом самый ядовитый наземный носитель ТТХ получает этот нейротоксин, остается загадкой.
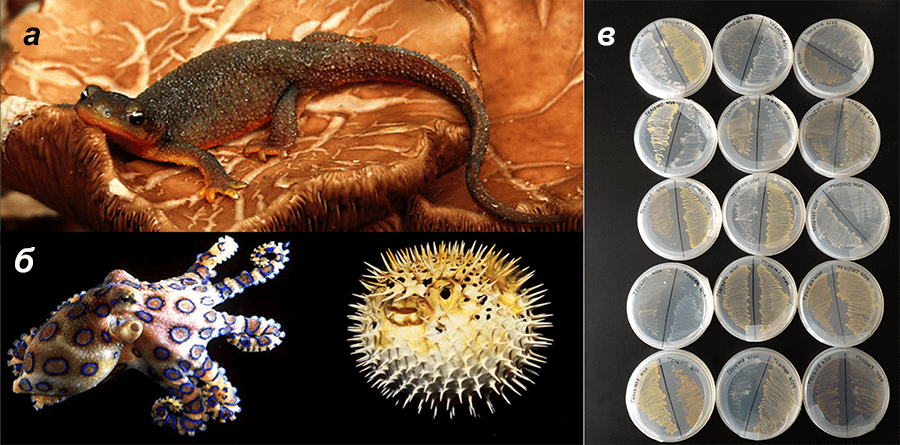
Рисунок 4. Возможные первичные и вторичные источники тетродотоксина. а — Калифорнийский тритон — самое ядовитое наземное животное, содержащее ТТХ. Чтобы доказать, что токсин способен синтезироваться в организме животного de novo, в ряде экспериментов тритонов сажали на специальную диету, содержащую радиоактивно меченные предполагаемые предшественники ТТХ. К глубокому сожалению исследователей, радиометки в итоге находили во многих вторичных метаболитах тритона, но только не в ТТХ [23]. Нельзя исключить, что в организме животного токсин синтезируется каким-то альтернативным образом с участием других прекурсоров, однако такие пути биосинтеза ученым неизвестны. б — Голубой кольчатый осьминог и рыба фугу — известнейшие морские «аккумуляторы» ТТХ, в которых токсин вырабатывают бактерии-симбионты. в — Штаммы микроорганизмов, обнаруженные в коже калифорнийского тритона. Удивительно, но в эксперименте ни один из них не синтезировал ТТХ тритона
Другим белым пятном в истории изучения токсина является почти полное отсутствие данных о генах ферментов, участвующих в его биосинтезе. Да и вообще этот биохимический каскад пока только гипотетический (и не лишенный альтернатив): белки, принимающие в нём участие, вычислены на основе данных о структуре самого токсина (рис. 5). Предполагается, что в сборке молекулы ТТХ могут быть задействованы две группы ферментов, каждая из которых отдельно формирует один из двух фрагментов токсина. Первая группа собирает гуанидиновый цикл ТТХ, используя в качестве предшественника аргинин — аминокислоту, служащую типичным донором гуанидиновой группы в биосинтезе различных метаболитов. Другая группа ферментов трудится над созданием уникального клеткообразного углеродного скелета молекулы, складывая его из разных предполагаемых «кирпичиков» — изопентенилпирофосфата (классического прекурсора, участвующего в биосинтезе огромного количества соединений, включая холестерин) или апиозы (типичного восстанавливающего сахара, обладающего, как и ТТХ, большим количеством асимметрических центров). Но несмотря на все теоретические построения, реальные ферменты, участвующие в биосинтезе токсина, до сих пор неизвестны [2].
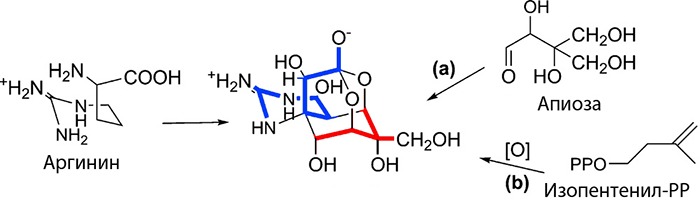
Рисунок 5. Один из предполагаемых путей биосинтеза ТТХ. Синим отмечен фрагмент, состоящий из гуанидиновой группы и небольшого углеродного «хвоста», который образует часть адамантановой структуры. Универсальным донором фрагмента является аргинин. Красным выделен другой участок адамантанового фрагмента, который может иметь несколько возможных предшественников. а — Апиоза — типичный восстанавливающий моносахарид. б — Изопентенилпирофосфат (РР) — классический прекурсор в синтезе ряда природных соединений.
И наконец, тетродотоксин замешан в совершенно фантастических историях типа мифов о гаитянских зомби, в которых жрецы Вуду с помощью специальных отваров якобы превращают обычных островитян. В 80-х годах прошлого века этноботаник и путешественник Вэйд Дэвис выдвинул гипотезу о том, что именно ТТХ, который попадает в отвар из печени приготовляемой рыбы фугу, ответственен за превращение людей в «живых мертвецов» — он вызывает у них некоторые характерные для фольклорных зомби проявления: нарушение двигательной и рефлекторной активности, частичный паралич конечностей, трупный запах и т.д. (рис. 6) [26]. В своей гипотезе Дэвис опирался на то, что часть этих проявлений была очень похожа на симптомы отравления ядом рыбы фугу. Однако ряд скептически настроенных исследователей в конце 1980-х — начале 2000-х годов развенчал эту гипотезу, показав присутствие в «магическом зелье» лишь очень незначительных количеств ТТХ, недостаточных для проявления каких-либо серьезных физиологических эффектов [27], [28]. Вышедшие работы так и не пролили свет на популярный миф о зомби, создаваемых магией Вуду, однако показали непричастность токсина ко всей этой странной истории.
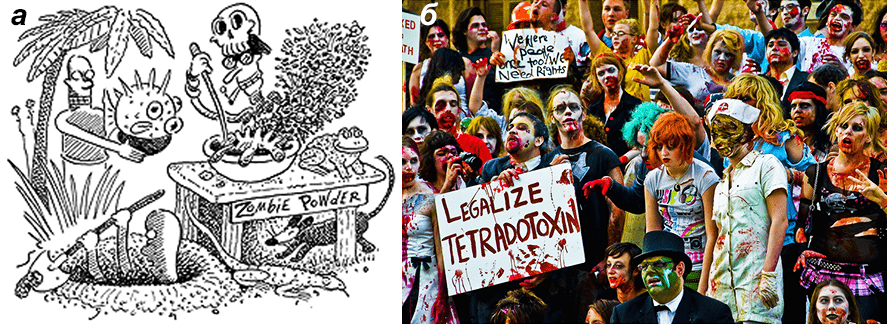
Рисунок 6. Городская легенда о причастности тетродотоксина к фольклору о гаитянских зомби. Книга Вэйда Дэвиса «Passage of darkness: the ethnobiology of the Haitian zombie», вышедшая в 1985 году и впервые приписавшая тетродотоксину роль в создании «живых мертвецов», имела большой успех. Даже несмотря на последующие статьи, остро критикующие выводы Дэвиса, легенда о тетродотоксине, превращающем темнокожих гаитянцев в зомби, прочно закрепилась в массовой культуре и до сих пор популярна. а — Карикатура на книгу Дэвиса в американской интернет-газете The Straight Dope. б — «Марш зомби», проходивший в Техасе (США) в октябре 2009 года в рамках акции, организованной Zombie Rights Campaign — пародийным движением активистов, занимающихся защитой прав зомби в США.
Литература
- Fuhrman F.A. (1986). Tetrodotoxin, tarichatoxin, and chiriquitoxin: historical perspectives. Ann. NY Acad. Sci. 479, 1–14;
- Chau R., Kalaitzis J.A., Neilan B.A. (2011). On the origins and biosynthesis of tetrodotoxin. Aquat. Toxicol. 104, 61–72;
- Bane V., Lehane M., Dikshit M., O’Riordan A., Furey A. (2014). Tetrodotoxin: chemistry, toxicity, source, distribution and detection. Toxins. 6, 693–736;
- Yokoo A. (1950). Study on chemical purification of tetrodotoxin (3) — purification of spheroidine. J. Chem. Soc. Japan. 71, 590–592;
- Роберт Вудворд: евангелист органической химии;
- Hodgkin A. (1952). A quantitative description of membrane current and its application to conduction and excitation in nerve. J.&nbsnbsp;Physiol. 117, 500–544;
- Dettbarn W., Higman H., Rosenberg P., Nachmansohn D. (1960). Rapid and reversible block of electrical activity by powerful marine biotoxins. Science. 132, 300–301;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Яды — высокоточное оружие: компьютерное исследование природных нейротоксинов;
- Moczydlowski E.G. (2013). The molecular mystique of tetrodotoxin. Toxicon. 63, 165–183;
- Agency for Toxic Substances and Disease Registry (ATSDR);
- Goldin A.L. (2003). Mechanisms of sodium channel inactivation. Curr. Opin. Neurobiol. 13, 284–290;
- Saoudi M., Abdelmouleh A., Feki A. (2010). Tetrodotoxin: a potent marine toxin. Toxin Rev. 29, 60–70;
- Википедия: «Тетродотоксин» (en.);
- Dib-Hajj S.D., Cummins T.R., Black J.A., Waxman S.G. (2010). Sodium channels in normal and pathological pain. Annu. Rev. Neurosci. 33, 325–347;
- Lyu Y.S., Park S.K., Chung K., Chung J.M. (2000). Low dose of tetrodotoxin reduces neuropathic pain behaviors in an animal model. Brain Res. 871, 98–103;
- Kayser V., Viguier F., Ioannidi M., Bernard J.F., Latrémolière A., Michot B. et al. (2010). Differential anti-neuropathic pain effects of tetrodotoxin in sciatic nerve- versus infraorbital nerve-ligated rats-behavioral, pharmacological and immunohistochemical investigations. Neuropharmacology. 58, 474–487;
- Nieto F.R., Entrena J.M., Cendán C.M., Pozo E.D., Vela J.M., Baeyens J.M. (2008). Tetrodotoxin inhibits the development and expression of neuropathic pain induced by paclitaxel in mice. Pain. 137, 520–531;
- Hagen N.A., Fisher K.M., Lapointe B., du Souich P., Chary S., Moulin D. et al. (2007). An open-label, multi-dose efficacy and safety study of intramuscular tetrodotoxin in patients with severe cancer-related pain. J. Pain Symptom. Manag. 34, 171–182;
- Marcil J., Walczak J.S., Guindon J., Ngoc A.H., Lu S., Beaulieu P. (2006). Antinociceptive effects of tetrodotoxin (TTX) in rodents. Br. J. Anaesth. 96, 761–768;
- Schwartz D.M., Fields H.L., Duncan K.G., Duncan J.L., Jones M.R. (1998). Experimental study of tetrodotoxin, a long-acting topical anesthetic. Am. J. Ophthalmol. 125, 481–497;
- Padera R.F., Tse J.Y., Bellas E., Kohane D.S. (2006). Tetrodotoxin for prolonged local anesthesia with minimal myotoxicity. Muscle Nerve. 34, 747–753;
- Pratheepa V. and Vasconcelosa V. (2013). Microbial diversity associated with tetrodotoxin production in marine organisms. Environ. Toxicol. Pharmacol. 36, 1046–1054;
- Cardall B.L., Brodie E.D. Jr., Brodie E.D. 3rd, Hanifin C.T. (2004). Secretion and regeneration of tetrodotoxin in the rough-skin newt (Taricha granulosa). Toxicon. 44, 933–938;
- Shimizu Y. and Kobayashi M. (1983). Apparent lack of tetrodotoxin biosynthesis in captured Taricha torosa and Taricha granulosa. Chem. Pharm. Bull. 31, 3625–3631;
- Davis W. (1988). Zombification. Science. 240, 1715–1716;
- Yasumoto T. and Kao C.Y. (2004). Tetrodotoxin and the Haitian zombie. Toxicon. 24, 747–749;
- Kao C.Y. and Yasumoto T. (1990). Tetrodotoxin in «zombie powder». Toxicon. 28, 129–132;
- Nieto F.R., Cobos E.J., Tejada M.Á., Sánchez-Fernández C., González-Cano R., Cendán C.M. (2012). Tetrodotoxin (TTX) as a therapeutic agent for pain. Mar. Drugs. 10, 281–305.







