Тимоцитов ведут в зоопарк. Что такое эктопическая экспрессия и как она защищает нас от аутоиммунитета
30 июля 2021
Тимоцитов ведут в зоопарк. Что такое эктопическая экспрессия и как она защищает нас от аутоиммунитета
- 1758
- 0
- 14
Т-клетки, несущие различные антигенспецифические рецепторы
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Иммунная система весьма разнообразна и состоит из клеток, осваивающих разные «профессии». Есть среди них профессиональные антиген-презентёры, такие как дендритные клетки, которые замечают врага и мобилизуют других иммунных участников, есть В-клетки — фабриканты и производители антител, или еще уборщики-макрофаги, одна из обязанностей которых — поглощать и переваривать мертвые клетки, павшие на полях сражения. Почетной службой является и само военное искусство, которое освоили Т-лимфоциты. Но поскольку работа эта высококвалифицированная, Т-лимфоцитом нельзя просто родиться. Им нужно стать, пройдя огонь, воду и медные трубы. Иными словами, пережить три уровня селекции в специальном органе — тимусе. О том, как протекает взросление Т-самураев, какие выпускные испытания им предстоит пройти, прежде чем покинуть свою тимусную «альма-матер», и какие гены играют в этом особую роль и дирижируют процессом — читайте в этой статье.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
«Не навреди!» — если бы иммунитет давал клятву верности организму, обещая защищать его от разнообразных врагов, то пришлось бы также заверять, что в пылу боя он не пришибет своих же. Ведь как патогены, так и собственные клетки, ставшие опухолевыми, стремятся спрятаться от иммунного ответа или замаскироваться. Поэтому разобрать, где «свой», а где «чужой», порой весьма непросто, и требует от иммунной системы чуткого баланса и тонкой отладки. К счастью, механизмы для этого у нее есть.
Неотъемлемым их элементом являются живущие на поверхности клеток белки главного комплекса гистосовместимости (major histocompatibility complex, MHC). MHC класса I «захватывают» внутри клетки различные пептиды (антигены), которые являются продуктом непрерывной деградации белков в специальных «шредерах», протеасомах, и отправляются с ними на поверхность, демонстрируя свою ношу патрулирующим лимфоцитам. То же самое делают MHC класса II, только связываются они с пептидами, попавшими в клетку извне путем эндоцитоза (рис. 1).
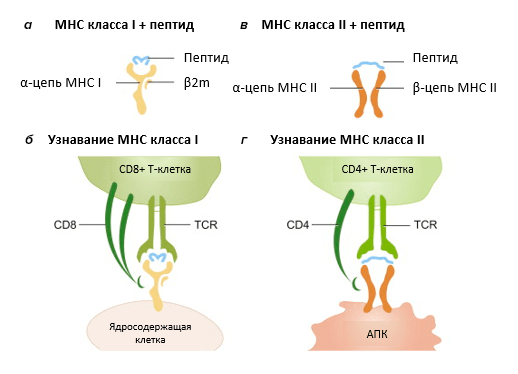
Рисунок 1. Как устроен главный комплекс гистосовместимости (MHC). а — MHC I класса состоит из α-цепи и маленького β2-микроглобулина. Сверху домены α1 и α2 образуют кармашек, или антигенсвязывающую бороздку, в которую укладывается пептид длиной в среднем 8–11 аминокислот. б — MHC I есть на поверхности всех ядросодержащих клеток, и они взаимодействуют с CD8+ (цитотоксическими) Т-лимфоцитами, то есть несущими корецептор CD8. в — MHC II образован α- и β-цепями и связывает 13–25-аминокислотные пептиды, краешки которых даже немного высовываются за пределы бороздки. г — MHC II экспонируются преимущественно на поверхности антигенпрезентирующих клеток (АПК) и узнаются CD4+ Т-клетками (хелперами).
Если «заложником» MHC I оказался фрагмент собственного организма — значит, все спокойно, свои. Однако если там что-то новенькое — иммунные клетки активируются, в результате чего система переходит на «военные рельсы». MHC — это самые полиморфные белки организма (на сегодняшний день суммарно для классов I и II насчитывается более 30 тыс. аллелей!) [1], потому что различные по аминокислотному составу антигены могут быть захвачены не любым, а лишь определенным, подходящим вариантом MHC. В комплексе пептид и MHC составляют уникальную структуру, которая называется эпитопом.
«Снайперским прицелом» Т-лимфоцитов, узнающих свой эпитоп, является Т-клеточный рецептор (T-cell receptor, TCR). В сопровождении корецептора CD8 либо CD4 (в зависимости от «отряда» T-клетки) именно TCR отвечает за скрининг пептидов, презентируемых на MHC. Поскольку каждый TCR узнает свой эпитоп, необходим механизм, который сможет обеспечить колоссальное разнообразие TCR на любой случай, то есть на любой эпитоп. Такой механизм называется V(D)J-рекомбинацией. Если вкратце, то в ходе нее ген вариабельного фрагмента TCR случайным образом склеивается из множества генных сегментов с добавлением или удалением нескольких нуклеотидов на «стыках», чтобы усилить разнообразие.
Неудивительно, что в результате такой игры в комбинаторику среди примерно 1013 теоретически возможных вариантов TCR обязательно найдутся такие, которые будут узнавать эпитопы с хозяйскими антигенами. Поэтому удачное решение — изымать такие Т-клетки из оборота контролируемо, еще до их окончательного созревания и выхода в кровоток. Иначе говоря, нужен некий фильтр, который называется негативной селекцией. Благодаря ей обеспечивается центральная толерантность иммунитета, в противоположность толерантности периферической, когда селекция «недобитых» в тимусе аутоспецифичных лимфоцитов продолжается за его пределами при помощи, например, Т-регуляторных клеток. Без механизмов центральной толерантности организм уже на ранних стадиях разрушал бы себя изнутри, и вряд ли периферическая толерантность успевала бы эффективно элиминировать все свободно мигрирующие аутореактивные клетки.
Но давайте обо всем по порядку .
А чтобы было совсем по порядку, лучше сначала прочитать статью о том, какие иммунные клетки бывают в целом — «Иммунитет: борьба с чужими и… своими» [2]. — Ред.
Селекционер внутри нас
Колыбелью будущих Т-лимфоцитов является костный мозг. Там часть гемопоэтических стволовых клеток развивается в лимфоидных предшественников, дающих начало Т-, В- и NK-клеткам. В какой-то момент такие предшественники получают от своего микроокружения в гемопоэтической нише определенную совокупность сигналов, в результате чего «осознают» свою тягу к Т-клану лимфоидной семьи и «обзаводятся» рецепторами (CXCR4, CCR7 и CCR9) к ряду хемокинов, выделяемых кузницей Т-клеток, тимусом [3]. Затем они выходят в кровоток и продвигаются в его сторону, ориентируясь на цитокиновый градиент .
О том, как кроветворные клетки находят призвание, можно почитать в статье «Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию» [4], а о том, как они находят до него дорогу — «Т-лимфоциты: путешественники и домоседы» [5]. — Ред.
Тимус, или вилочковая железа — орган морфологически гетерогенный. Он состоит из двух функционально различных компартментов (рис. 2). Корковое вещество, или кортекс, который расположен ближе к периферии и образован кортикальными эпителиальными клетками тимуса (cTEC), и мозговое вещество, по-другому медулла, располагающаяся ближе к центру органа и образованная, соответственно, медуллярным эпителием (mTEC).
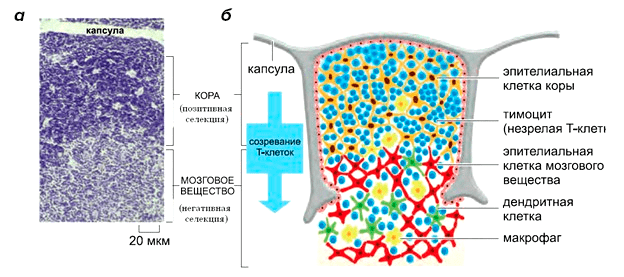
Рисунок 2. Клеточная организация тимуса человека. а — На световом микрофотоснимке окрашенного среза одного сегмента тимуса видна внешняя кора (кортикальная область) и внутренняя мозговая область (медуллярная область). б — Схематический рисунок сегмента, показывающий его клеточный состав. В коре находятся незрелые тимоциты, а в мозговом веществе — почти зрелые. Тимоциты, макрофаги и дендритные клетки развиваются из клеток, мигрировавших в тимус из костного мозга. Процессы селекции — причина апоптотической гибели более 95% тимоцитов, произведенных в тимусе. Мертвые клетки быстро фагоцитируются и перевариваются макрофагами.
[26], рисунок адаптирован
Проводя аналогию со школой, можно сказать, что кортекс — это младшие и средние классы, где происходит β- и позитивная селекция, о которых будет сказано чуть дальше, в то время как медулла — для тимоцитов-старшеклассников, которым необходимо пройти через отрицательный отбор. (Про своих выпускников расскажет сам Тимус в статье «Будем знакомы, меня зовут Тимус!» [6].) То есть за счет такой компартментализации позитивная и негативная селекции разнесены во времени и пространстве, что дополняет принятую на сегодняшний день модель аффинности, согласно которой судьба Т-лимфоцита определяется силой взаимодействия с комплексом «пептид+MHC», которая должна быть в пределах некоторого окна (рис. 3).
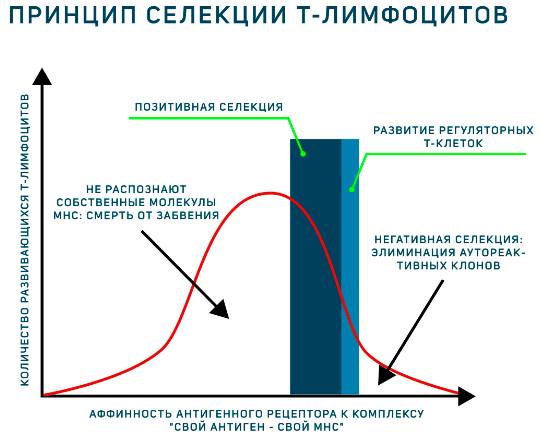
Рисунок 3. График, иллюстрирующий модель аффинности
Итак, добравшись до тимуса, а точнее до кортекса, предшественник получает звание тимоцита и приступает к формированию своего уникального TCR.
Т-клеточный рецептор состоит из двух цепей — α и β (рис. 4а). Сначала клетка предпринимает попытку сформировать β-цепь. Почему лишь «предпринимает попытку»? Поскольку V(D)J-рекомбинация (рис. 4б) включает в себя процесс случайных вставок и делеций, выпадение одной или нескольких «букв» полностью меняет «слово» рецептора, иными словами, сбивается рамка считывания гена или может не в том месте образоваться стоп-кодон. В таком случае β-цепь получается нерабочей. Чтобы это проверить, у Т-клетки заготовлена инвариантная суррогатная α-цепь для «примерки». Если новоиспеченной β-цепи удалось образовать с ней стабильный гетеродимер и показаться на поверхности клетки, то она получит сигнал к выживанию и приступит к формированию уже настоящей, вариабельной α-цепи. Если нет — ей дается вторая попытка собрать более удачный ген на второй хромосоме. Если же и на этот раз не получилось, такая клетка погибает. Этот этап и называется β-селекцией.
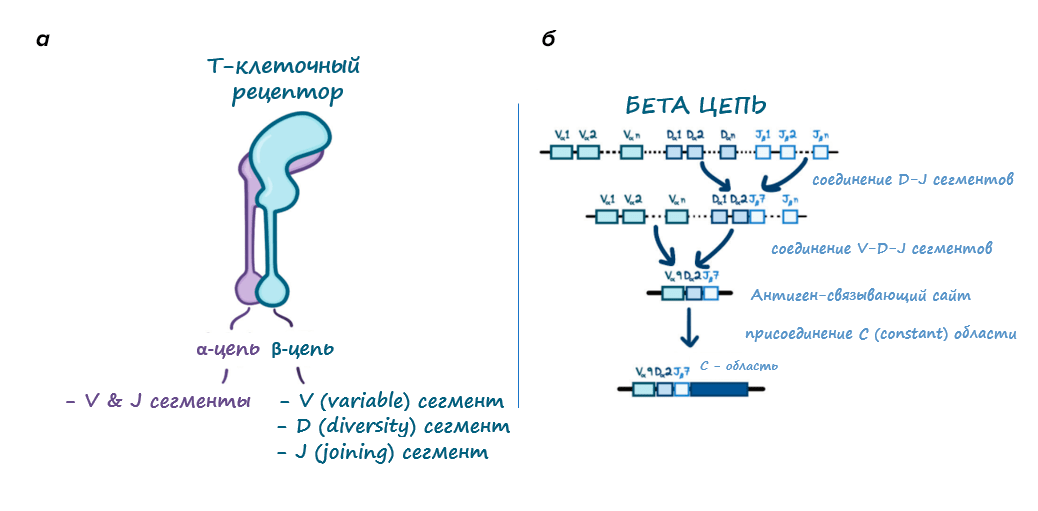
Рисунок 4. а — Т-клеточный рецептор состоит из α- и β-цепей. В свою очередь, первая образована из сегментов V (Variable) и J (Joining), а у второй посередине дополнительно есть сегмент D (Diversity). б — Последовательность V(D)J-рекомбинации на примере β-цепи. Сначала специальные белки, RAG-1 и RAG-2, вносят в ДНК двунитевые разрывы, чтобы соединить сначала один из D с одним из J-сегментов, а затем V — с DJ. Параллельно с этим белки-репараторы убирают, а трансфераза TdT добавляет на стыках несколько нуклеотидов. В завершение к VDJ добавляется инвариантный (C, Constant) участок. Наконец, нити ДНК сшиваются лигазой. Таким образом у каждой отдельно взятой Т-клетки формируются свои уникальные рекомбинантные гены TCR-цепей.
Если испытание с жизнеспособным TCR было пройдено, тимоцит начинает блуждать по кортексу, периодически натыкаясь на cTEC, которые экспонируют свои комплексы «антиген—MHC». Как уже было сказано ранее, лишь умеренно связывающиеся с ними Т-клетки вознаграждаются сигналом к выживанию, а остальные умирают, что называется, от «нехватки внимания» со стороны cTEC (death by neglect). Также известно, что в кортексе в принципе может частично осуществляться и негативная селекция, если тимоцит слишком сильно «вцепится» в приглянувшийся ему cTEC или даже просто антигенпрезентирующую клетку [7]. Вот так вот, шаг вправо, шаг влево — расстрел (то есть апоптоз).
Потихоньку выжившие клетки бредут от края к центру, к медулле, где в игру вступают mTEC. В их обязанности также входит презентация антигенов на своих MHC, однако если на предыдущем этапе акцент был на взаимодействие с самими MHC, а в качестве антигенов годились более-менее любые пептиды, которые нарубила протеасома cTEC, то сейчас задача mTEC — познакомить тимоцитов с как можно большим разнообразием хозяйских антигенов, которые в организме присущи лишь определенным тканям, в том числе тем, которые расположены совсем далеко от тимуса. Такие антигены называются тканеспецифическими антигенами (tissue-restricted antigens, TRA). Критерием отнесения антигена к TRA является его синтез не более, чем в 5 из 60 исследованных типов тканей [8]. В качестве примера можно привести гормон инсулин, экскретируемый клетками поджелудочной железы, или пептид альфа-дефензин, вырабатываемый эпителиальными клетками ЖКТ. Противоположное понятие — ubiquitous antigens, то есть «повсеместные, вездесущие антигены», на предмет которых, как уже было сказано, осуществлять негативную селекцию могут и клетки кортекса.
Но в таком случае возникает вопрос, откуда специализированные клетки тимуса могут достать антигены, скажем, того же инсулина? Ведь это противоречит теории эпигентического ландшафта (рис. 5), сформулированной Конрадом Уоддингтоном, согласно которой в процессе онтогенеза клетка дифференцируется и обретает специализацию, что на молекулярно-генетическом уровне означает экспрессию лишь генов специализации и «домашнего хозяйства» (то есть абсолютно необходимых для выживания любой клетки), на фоне «замолкания» остальных. Так, если брать мышиный геном, в периферических органах экспрессируется в среднем 60% генов, в то время как оставшиеся гены плотно упакованы в гетерохроматин, будучи подавлены различными эпигенетическими механизмами. Уникальность же mTEC в том, что их «репертуар» намного шире и доходит до 85% [9].
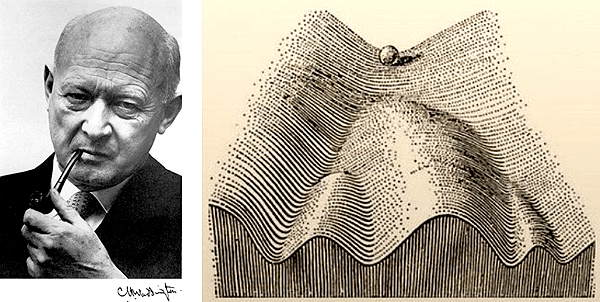
Рисунок 5. К.Х. Уоддингтон и его рисунок «эпигенетического ландшафта». Шарик вверху обозначает первоначальные неспециализированные клетки зародыша. Под воздействием генетических и эпигенетических сигналов клетке будет задана траектория онтогенеза (развития), и она станет специализированной — клеткой сердца, печени и т.д.
Для решения этой задачи клетки тимуса обладают удивительной способностью воссоздавать на своей поверхности своего рода антигенную мини-модель остального организма благодаря удивительному механизму эктопической экспрессии генов (promiscuous gene expression, PGE). Суть ее заключается в том, что mTEC умеют как раз нарушать теорию эпигенетического ландшафта (рис. 5), чтобы синтезировать и презентировать на своей поверхности фрагменты тех самых TRA, ну или по крайней мере какую-то их часть. Это можно сравнить с зоопарком, где на малюсенькой территории можно увидеть по соседству слона и пингвина, жирафа и белого медведя, — в общем всех животных, которые в обычной жизни обитают по всему земному шару, и которые в норме никогда не оказались бы вместе, скажем, в вольере в Москве.
Главный спонсор нашей программы — AIRE
Молекулярно-биологически PGE объясняется тем, что mTEC — одна из немногих известных на сегодня популяций клеток, синтезирующая необычный транскрипционный фактор, называемый аутоиммунным регулятором (AIRE). Еще в 80-х гг. XX века ученые обнаружили в тимусе транскрипты несвойственных для данной ткани белков, такие как гормоны гипоталамо-гипофизарной системы или инсулиноподобный фактор роста. Позже, в 1998 г., было замечено, что PGE у разных людей проявляется с разной степенью интенсивности, что объясняется важной ролью генетического фона. А в 2001 г. в своей статье Дербински с соавторами продемонстрировал корреляцию между экспрессией гена транскрипционного фактора AIRE и мРНК тканеспецифичных антигенов в медуллярном эпителии тимуса, что подвигло иммунологов приглядеться к AIRE повнимательнее [10].
Эксперименты с трансгенными мышами, нокаутированными по гену AIRE, подтвердили его роль в установлении центральной толерантности (рис. 6). Ученые использовали линию мышей, производящих в тимусе одновременно генномодифицированный TCR против лизоцима из куриного яйца (hen egg lysozyme, HEL) и сам HEL с гена под контролем промотора крысиного инсулина, имитируя таким образом один из TRA. В норме у таких мышей Т-клетки против HEL не обнаруживались в кровотоке, поскольку устранялись негативной селекцией. Однако такие аутореактивные Т-лимфоциты прослеживались в крови у линии мышей с нокаутом AIRE [11].
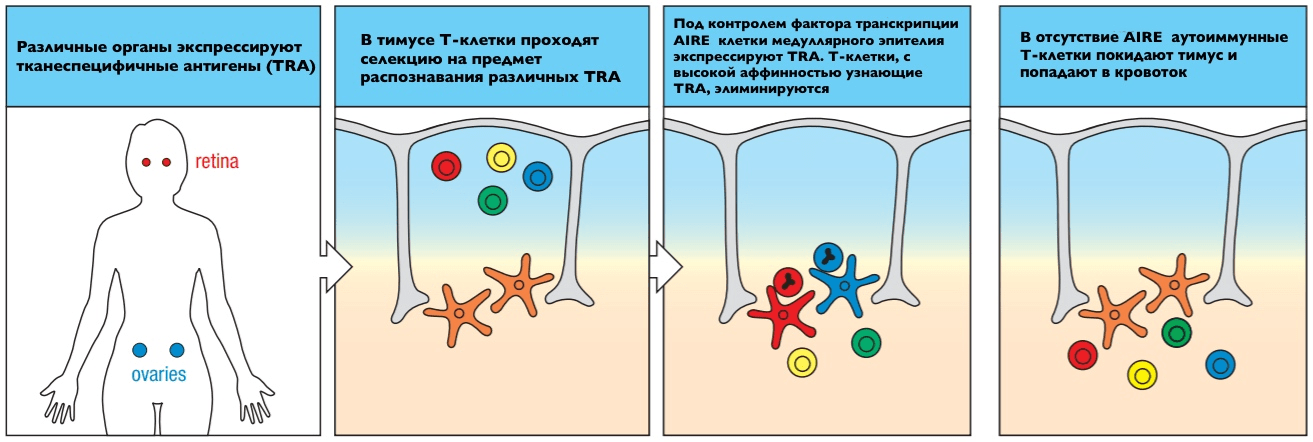
Рисунок 6. Схема, демонстрирующая роль AIRE в установлении центральной толерантности
[7], рисунок адаптирован
У человека мутация в гене AIRE, расположенном на коротком плече 13 хромосомы, приводит к аутоиммунному полиэндокринному синдрому 1-го типа. В различных литературных источниках можно встретить множество синонимов данного рецессивного наследственного заболевания: APECED (autoimmune polyendocrinopathy, candidosis, ectodermal dystrophy), MEDAС (multiple endocrine deficiency autoimmune candidiasis), синдром Уитакера и прочие варианты. Так или иначе, проявляется это в форме сильнейшего системного аутоиммунного ответа одновременно на несколько эндокринных желез. Самыми частыми симптомами APECED являются кандидоз полости рта, гипопаратиреоз и надпочечниковая недостаточность, что коррелирует с TRA, аутоантигены к которым находят у пациентов с мутацией AIRE: белок слюны [12], NALP5 (тканеспецифичный антиген паращитовидной железы) [13] и адренокортикоидный энзим 21-гидроксилаза [14]. Что интересно, на проявление APECED влияет еще и этнический фактор. Так, у финнов данный синдром чаще проявляется в форме диабета, в то время как у жителей южной Италии чаще страдает щитовидная железа [10]. Вероятно, в это замешан тот факт, что MHC также являются этнозависимыми, а ведь именно от их генотипа зависит, какие антигены «уместятся» в их антигенпрезентирующую бороздку и смогут быть представлены на поверхности.
Эктопическая экспрессия похожа на мозаику. Это значит, что каждая отдельная mTEC-клетка производит своей небольшой кластер TRA, но в сумме они дают несколько сотен затрагиваемых генов. Дополнительное их разнообразие расширяется за счет поощряемого AIRE альтернативного сплайсинга транскриптов. А вообще AIRE — хулиган. Мало того, что с его легкой руки транскрибируется то, что ни одной другой клетке и в голову бы не пришло, так еще все делается наперекор геномному импринтингу (когда некоторые гены читаются только с отцовской или материнской хромосомы): гены, которые ему обычно подвергаются, такие как инсулиноподобный фактор роста, в mTEC начинают экспрессироваться биаллельно, а гены, которые в норме импринтингом не затрагиваются, наоборот — считываются здесь предпочтительно с какой-то одной хромосомы [10].
Но за такую игру в обход правил mTEC приходится платить: недолго AIRE сможет переворачивать их эпигенетический ландшафт с ног на голову. Довольно быстро такие mTEC прекращают пролиферировать и умирают. Однако не все так печально: у mTEC есть продолжатели их дела, медуллярные дендритные клетки, которые являются профессиональными антиген-презентёрами. Довольно быстро и с огромным удовольствием они подбирают все пептиды, которые оставила после себя отмершая mTEC, и сами начинают представлять их тимоцитам [15]. Такой процесс называется кросс-презентацией. Причем дендритная клетка умеет «общаться» с Т-лимфоцитами даже более эффективно, чем TEC, так что ее помощь при негативной селекции весьма ощутима.
Существуют данные, что некоторые антигенпрезентирующие клетки за пределами тимуса также синтезируют AIRE в рамках периферической толерантности, правда, в данном случае перечень TRA отличается от тимусного [10]. И Т-клетки на периферии чаще просто переходят в неактивное состояние (анергия), чем подвергаются апоптозу.
Молекулярная биология AIRE
AIRE — неканонический транскрипционный фактор. Вместо того чтобы узнавать определенную консенсусную последовательность ДНК, AIRE реагирует на эпигенетические маркеры, такие как отсутствие гистоновых меток H3K4me3 и наличие H3K27me3 (тройное метилирование четвертого и двадцать седьмого лизина по третьему гистону соответственно), а также узнавая белковый комплекс ATF7ip-MBD, связывающий метилцитозины [10]. В совокупности такой паттерн гистоновых меток свидетельствует о неактивном хроматине в данной области. Это-то и нужно AIRE, ведь его задача — заставить такие молчащие гены «говорить». Но в одиночку с такой задачей не справиться: чтобы провернуть это дело, AIRE рекрутирует к своему сайту связывания около 50 белков-партнеров. Часть из них, например, ДНК-топоизомеразы, расплетают ДНК и тем самым вносят временные двуцепочечные разрывы. Другие ферменты (DNK-PK-киназа, PARP1) тотчас пребывают на место разрывов, чтобы произвести их репарацию, для чего требуется предварительно ослабить конденсацию хроматина в этом районе. По последним данным, одним из возможных участников нуклеосомной деконденсации считается ацетилаза KAT7, которая ацетилирует H3K14, из-за чего этот лизин приобретает больший отрицательный заряд и слегка отталкивает так же отрицательно заряженную ДНК от гистона [20]. В результате этой суматохи на ДНК оголяется участок старта транскрипции, на который AIRE привлекает положительный фактор транскрипции pTEF-b, помогающий РНК-полимеразе II войти в стадию элонгации. Собственно, тем самым инициируя PGE (рис. 7).
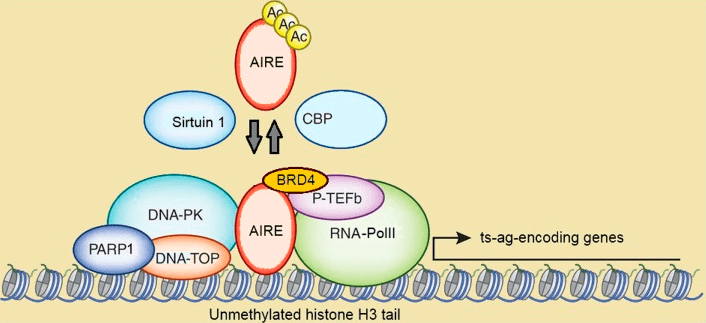
Рисунок 7. AIRE и его белки-партнеры
Но и сам AIRE подвергается регуляции: когда Sirt1 его деацетилирует, он деактивируется. Чтобы AIRE снова заработал, он должен быть ацетилирован CPB (CREB-binding protein). Поскольку у AIRE так много коллег, для более эффективной работы им желательно держаться поближе друг к другу. Поэтому все действо сконцентрировано в AIRE-тельцах, ассоциированных с ядерным матриксом [21].
Видео 1. Зачем нужен AIRE и как он функционирует
Структурно AIRE состоит из нескольких доменов, которые обусловливают его функции (рис. 8). Ближе к N-хвосту находится домен активации и рекрутирования каспаз (CARD), далее располагаются домены сигнала ядерной локализации (NLS) и SAND и, наконец, домены двух PHD-пальцев (PHD1 и PHD2) [10].
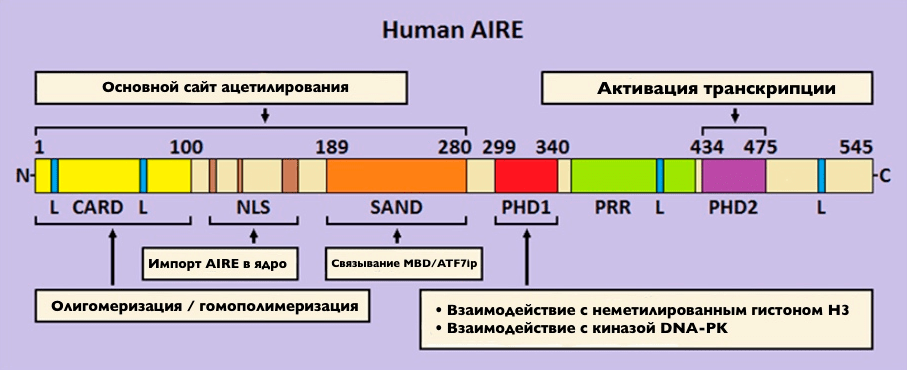
Рисунок 8. Важнейшие домены AIRE
[10], рисунок адаптирован
Благодаря CARD-домену AIRE способен образовывать гомодимеры, гомотетрамеры или даже целые филаменты, которые различимы в электронном микроскопе [22]. Олигомеризация критично важна, поскольку без этого AIRE теряет способность связываться с хроматином и с рядом ключевых белков-партеров.
NLS является сайтом узнавания специальных белков транспортеров, кариоферинов, и необходим для транспортировки белка из цитозоля в ядро.
С SAND посложнее: с одной стороны, он относится к семейству ДНК-связывающих белков, с другой, у него отсутствует необходимый для этого мотив, состоящий из четырех аминокислот (KDWK), зато структурно наличие β-плиссированного листа подсказывает роль белок-белковых взаимодействий. Действительно, одно исследование продемонстрировало участие SAND во взаимодействии AIRE с комплексом ATF7ip-MBD, сидящем на метилированных CpG-динуклеотидах, что является меткой неактивного хроматина [23].
Что касается двух PHD, несмотря на свое структурное сходство, они выполняют немного разные задачи. Полагают, что за счет отрицательно заряженных мотивов PHD1 предпочитает связываться с неметилированными положительно заряженными (благодаря лизинам и аргининам) участками гистона H3, в то время как метилирование понижает разницу в зарядах. Положительно же заряженному PHD2 неинтересно взаимодействовать с гистонами, он участвует, скорее, в активации транскрипции.
Возвращаясь к эктопической экспрессии в целом, напомним, что посредством AIRE транскрибируется лишь часть (может даже меньше половины) тканеспецифичных антигенов в медуллярном эпителии. Следовательно, помимо AIRE-зависимой PGE-экспрессии должны существовать параллельные, AIRE-независимые механизмы. И действительно, не так давно обнаружили второй транскрипционный фактор, Fezf2, синтезируемый приблизительно в 80% mTEC [24]. В отличие от AIRE, за пределами тимуса Fezf2 участвует и в других важных процессах в организме, таких как нормальное развитие аксонов. Важно, что репертуар TRA, регулируемый Fezf2, не пересекается с AIRE-опосредованными транскриптами. Например, через него AIRE-независимо производится Fabp9 (из группы белков, связывающих жирные кислоты), который встречается в яичках в клетках Лейдига [25]. Кроме того, мыши, нокаутированные по Fezf2, также проявляют признаки глобальной аутоиммунной реакции, однако при этом оказываются вовлеченными другие органы и ткани, чем в случае с APECED. Но несмотря на новые данные, ряд тканеспецифичных антигенов по-прежнему синтезируется в медуллярных клетках тимуса посредством AIRE- и Fezf2-независимого механизма, но какого именно — пока до конца не понятно.
Хорошо, а как насчет В-клеток?
Подобно тому, как это происходит у Т-коллег, иммуноглобулиновые рецепторы В-клеток тоже генерируются за счет случайной V(D)J-рекомбинации, а значит, им тоже нужен отбор функционирующих и аутотолерантных клонов! При этом большая часть созревания B-лимфоцитов проходит в костном мозге, и вроде никакой там эктопической экспрессии особо не наблюдается.
Действительно, В-клетки в этом плане пошли немного своим путем. Сначала они подвергаются базовой негативной селекции в костном мозге, где тестируются на агрессию к ubiquitous-антигенам, то есть ко всему тому, что можно в большом количестве найти в циркулирующем через их микроокружение кровотоке. Чаще всего такими антигенами служат те же MHC или, например, какие-то растворимые молекулы. Но вот TRA остаются за пределами внимания В-лимфоцитов на данном этапе. Однако если из тимуса Т-лимфоциты выходят уже окончательно созревшими и готовыми к исполнению своих прямых обязанностей, то В-лимфоциты должны дозреть в селезенке, а до тех пор они не могут активироваться. Поэтому их первое путешествие по кровотоку из костного мозга до селезенки — отличный шанс выяснить, кто из них все еще аутореактивен [26]. Таким образом, роль периферической толерантности для В-клеток выше, чем в случае с их Т-товарищами. Но впрочем, В-клетки — это уже совсем другая история.
Надеемся, нам удалось проиллюстрировать, какая нетривиальная это задача для иммунной системы: различать, где свой, а где чужой. Чтобы опознать врага и при этом не трогать собственное мирное население клеток, организму приходится идти на огромные, казалось бы даже иррациональные с точки зрения энергозатрат жертвы: он тратит ресурсы на лотерейные билеты в виде Т-клеток и устраивает им жесткий конкурс в тимусе, чтобы более 95% из них погибло, что называется, в зародыше. И это лишний раз подчеркивает, какую бесценную роль играет баланс иммунной системы, где с одной стороны угрожают инфекции и онкологические заболевания, а с другой — аутоиммунные.
Литература
- James Robinson, Dominic J Barker, Xenia Georgiou, Michael A Cooper, Paul Flicek, Steven G E Marsh. (2019). IPD-IMGT/HLA Database. Nucleic Acids Research;
- Иммунитет: борьба с чужими и… своими;
- L. Calderon, T. Boehm. (2011). Three chemokine receptors cooperatively regulate homing of hematopoietic progenitors to the embryonic mouse thymus. Proceedings of the National Academy of Sciences. 108, 7517-7522;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Т-лимфоциты: путешественники и домоседы;
- Будем знакомы, меня зовут Тимус!;
- Murphy K. and Weaver C. Janeway's Immunobiology (9th Edition). Garland Science, 2016. — 924 p.;
- Ludger Klein, Bruno Kyewski, Paul M. Allen, Kristin A. Hogquist. (2014). Positive and negative selection of the T cell repertoire: what thymocytes see (and don't see). Nat Rev Immunol. 14, 377-391;
- Miri Danan-Gotthold, Clotilde Guyon, Matthieu Giraud, Erez Y. Levanon, Jakub Abramson. (2016). Extensive RNA editing and splicing increase immune self-representation diversity in medullary thymic epithelial cells. Genome Biol. 17;
- Roberto Perniola. (2018). Twenty Years of AIRE. Front. Immunol.. 9;
- Kirsty Minton. (2003). There's something in the Aire. Nat Rev Immunol. 3, 264-264;
- Jens Derbinski, Jana Gäbler, Benedikt Brors, Sascha Tierling, Sunitha Jonnakuty, et. al.. (2005). Promiscuous gene expression in thymic epithelial cells is regulated at multiple levels. Journal of Experimental Medicine. 202, 33-45;
- Mohammad Alimohammadi, Peyman Björklund, Åsa Hallgren, Nora Pöntynen, Gabor Szinnai, et. al.. (2008). Autoimmune Polyendocrine Syndrome Type 1 and NALP5, a Parathyroid Autoantigen. N Engl J Med. 358, 1018-1028;
- Daniel Eriksson, The Norwegian Addison Registry Study Group, Ellen Christine Røyrvik, Maribel Aranda-Guillén, Amund Holte Berger, et. al.. (2021). GWAS for autoimmune Addison’s disease identifies multiple risk loci and highlights AIRE in disease susceptibility. Nat Commun. 12;
- Olivier P. Joffre, Elodie Segura, Ariel Savina, Sebastian Amigorena. (2012). Cross-presentation by dendritic cells. Nat Rev Immunol. 12, 557-569;
- Asiel A. Benitez, Sara Khalil-Agüero, Anjali Nandakumar, Namita T. Gupta, Wen Zhang, et. al.. (2020). Absence of central tolerance in Aire-deficient mice synergizes with immune-checkpoint inhibition to enhance antitumor responses. Commun Biol. 3;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018);
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Heinlein M. Molecular mechanisms of thymic tolerance induction and recovery from involution. PhD thesis, 2019;
- Pärt Peterson, Tõnis Org, Ana Rebane. (2008). Transcriptional regulation by AIRE: molecular mechanisms of central tolerance. Nat Rev Immunol. 8, 948-957;
- Yu-San Huoh, Bin Wu, Sehoon Park, Darren Yang, Kushagra Bansal, et. al.. (2020). Dual functions of Aire CARD multimerization in the transcriptional regulation of T cell tolerance. Nat Commun. 11;
- Michael Waterfield, Imran S Khan, Jessica T Cortez, Una Fan, Todd Metzger, et. al.. (2014). The transcriptional regulator Aire coopts the repressive ATF7ip-MBD1 complex for the induction of immunotolerance. Nat Immunol. 15, 258-265;
- Hiroyuki Takaba, Yasuyuki Morishita, Yoshihiko Tomofuji, Lynett Danks, Takeshi Nitta, et. al.. (2015). Fezf2 Orchestrates a Thymic Program of Self-Antigen Expression for Immune Tolerance. Cell. 163, 975-987;
- Afshin Moradi, Farzad S. Forootan, Masoumeh Hosseini, Farkhondeh Pouresmaeili. (2019). Leydig cells express the FABP9 in human testis. HAB. 27, 275-278;
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки: в 3-х томах. Т. III. Москва–Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — 720 с.;
- The Major Histocompatibility Complex. In: Primer to the Immune Response / ed. by T.W. Mak, M.E. Saunders, B.D. Jett. Academic Cell, 2014. P. 143–159;
- Эпигенетика: невидимый командир генома.