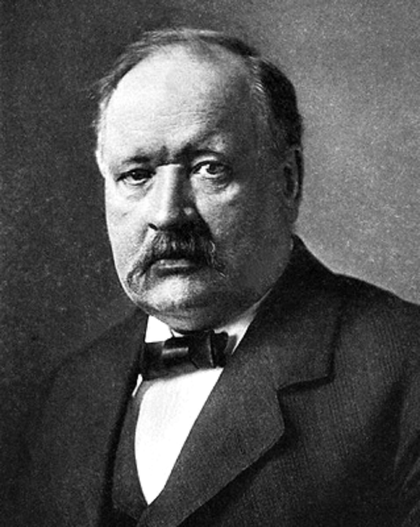Тот, кто придумал ионы
24 мая 2015
Тот, кто придумал ионы
- 901
- 0
- 0
Сванте Август Аррениус. Родился 18 февраля 1859 г. в замке Вик недалеко от Уппсалы, Швеция. Умер 2 октября 1927 г. в Стокгольме, Швеция. Лауреат Нобелевской премии по химии 1903 года.
Рисунок в полном размере.
-
Автор
-
Редакторы
Нашего героя принято считать соперником и ненавистником Менделеева. Однако в этой истории не всё до конца ясно. Что точно можно сказать — это был один из разностороннейших химиков мира. Он «придумал» ионы и получил «нобеля» за свою диссертацию, которую с трудом пропустил диссертационный совет. Он применил законы физики и химии к биологии, он занимался парниковым эффектом и шаровыми молниями... В общем, встречайте — Сванте Аррениус, третий нобелевский лауреат по химии. Формулировка Нобелевского комитета: «в знак признания особого значения его теории электролитической диссоциации для развития химии».
Герой нашего сегодняшнего рассказа, судя по всему, был очень непростым человеком. Впрочем, кто из нобелевских лауреатов прост? С другой стороны, этот человек не просто получил Нобелевскую премию по химии 1903 года за свою докторскую (по-нашему — кандидатскую) диссертацию; без ссылок на него не обходится ни один школьный или университетский курс химии. Он — один из основоположников химической науки ХХ века, даже несмотря на конфликты с великим Менделеевым. Считается, что впоследствии именно он помешал Дмитрию Ивановичу получить Нобелевскую премию. Хотя с точки зрения современной химии они оба были неправы и правы одновременно. Речь сегодня пойдет о первом в истории нобелиате — земляке Нобеля, Сванте Августе Аррениусе.

Рисунок 1. Эрик Эдлунд (1819–1888). Шведский физик, известный трудами по теории электричества. Иностранный член-корреспондент Петербургской академии наук. Занимался индукцией, телеграфией, дуговыми лампами; разработал теорию атмосферного электричества для объяснения феномена полярного сияния.
Будущий лауреат родился в достаточно богатой и образованной семье. Его дядя, Иоанн (Юхан) Аррениус, — известный ботаник, деятель сельского хозяйства и агроном. Отец был управляющим имением и вскорости стал членом совета инспекторов Уппсальского университета. Так что ребенку было в кого рано развиваться: пишут, что он уже в младенчестве любил складывать циферки из папиных отчетов (правда, не сообщается, делал ли он что-либо с самими листами: я как отец не по годам развитой девочки подозреваю, что за интерес к цифрам Сванте иногда влетало). Достаточно легко Сванте окончил Уппсальский университет (физика и химия), в 1878 году получил степень бакалавра, а в 1881 уехал в столицу, в Шведскую королевскую академию наук, заниматься изучением электричества под руководством Эрика Эдлунда (который, кроме того, организовал систему метеорологических наблюдений в Швеции).
Своему докторанту Эдлунд (рис. 1) предложил заняться изучением электролитов. К тому времени сам по себе электрический ток был, конечно, хорошо известен, хотя электрон еще не открыли, и природа этого явления была до конца не ясна. С другой стороны, физики и химики уже прекрасно знали, что, к примеру, кристаллы поваренной соли ток не проводят, дистиллированная вода — тоже. А вот раствор NaCl — прекрасный проводник. В чем тут дело? По мнению Аррениуса, изложенному в его докторской диссертации (увидевшей свет в 1884 году), в растворе некоторые вещества, нейтральные сами по себе, распадаются, взаимодействуя с растворителем, на положительно и отрицательно заряженные ионы. Та же соль NaСl распадается на ион Na+ и ион Cl−.

Рисунок 2. Вильгельм Фридрих Оствальд (1853–1932). Немецкий химик и философ, лауреат Нобелевской премии по химии 1909 года — за изучение природы катализа и основополагающие исследования скоростей химических реакций. Его имя носит закон разбавления. Основал первый в мире физико-химический институт (при Лейпцигском университете), активно содействовал международному обмену научной информацией. Считал материю формой проявления энергии.
Мнение оказалось настолько революционным, что диссертация, к которой формально придраться было нельзя, была защищена с самой низкой оценкой — она прошла по четвертому классу, без права преподавания в университете [1]. Кстати, именно поэтому существовал вариант, при котором Аррениус мог бы стать первым российским нобелевским лауреатом по химии: его старший коллега, которому Аррениус прислал свою статью, пригласил его работать к себе, в Лифляндскую губернию Российской империи, в Рижское политехническое училище. Аррениус отказал (да и потом, в 1909 году, уже будучи нобелиатом и работая в Нобелевском комитете, сомневался, принимать ли номинацию своего тогдашнего «благодетеля»). Правда, в 1909 году Вильгельм Фридрих Оствальд (рис. 2) уже давно жил и работал в Лейпциге.
Кстати, сам Оствальд вначале не мог принять теорию электролитической диссоциации. «Я провел лихорадочную ночь со скверными снами», — писал он про лето 1884 года. — «У меня одновременно появились жестокая зубная боль, новорожденная дочка и статья Аррениуса “Исследования по проводимости электролитов”. То, что было написано в работе, настолько отличалось от привычного и известного, что я сначала был склонен всё в целом принять за бессмыслицу».
Но останься Аррениус в России, ему бы тоже пришлось несладко: яростным противником его теории электролитической диссоциации оказался сам Дмитрий Иванович Менделеев (рис. 3).

Рисунок 3. Дмитрий Иванович Менделеев (1834 1927). Семнадцатый (!) ребёнок в семье директора Тобольской гимназии. Русский «универсальный мозг»: химик, физик, экономист, геолог и ещё много кто. Самое известное открытие — периодический закон химических элементов. На вопрос журналиста о «кухне» открытия периодической системы Менделеев ответил: «...Не пятак за строчку! Не так, как вы! Я над ней, может, двадцать пять лет думал...». Создал точную теорию весов, впервые обобщил информацию по неорганической химии в труде «Основы химии». Ярый борец с модным в то время спиритизмом. Педагог, который старался экспериментировать во всём, вплоть до совершения самостоятельного полета на воздушном шаре — с научными целями. Считал, что «профессор, который только читает курс, а сам не работает в науке и не двигается вперед, — не только бесполезен, но прямо вреден». Менделеев подвел итог своей научной жизни так: «Всего более четыре предмета составили моё имя: периодический закон, исследование упругости газов, понимание растворов как ассоциации и „Основы химии“. Тут моё богатство. Оно не отнято у кого-нибудь, а произведено мною...» Иностранные (а не отечественные!) ученые выдвигали Менделеева на Нобелевскую премию три раза. Считается, что в 1906-м Нобелевский комитет уже присудил ее Менделееву, но Шведская королевская Академия наук не утвердила решение под влиянием С. Аррениуса. В следующем году ½ премии русскому гению всё же готовились отдать, но до сего события он не дожил...

Рисунок 4. Якоб Хенрик Вант-Гофф (1852–1911). Голландский химик, один из основателей стереохимии и физической химии. Удостоился первой «химической» Нобелевской премии — за открытие законов химической динамики и осмотического давления в растворах.
Создатель периодической системы был автором собственной теории растворов и протестовал против того, что Аррениус не учитывал ни сольватации — взаимодействия ионов с молекулами растворителя, — ни электростатического взаимодействия между ионами в случае концентрированных растворов. Любопытнее всего, что созданная после смерти и Менделеева, и Аррениуса протонная теория кислот и оснований в итоге примирила «врагов», вобрав в себя положения как Аррениуса, так и Менделеева. Нобелевская премия Аррениуса, кстати, оказалась «чистой победой»: из 23 номинаций на премию 1903 года Аррениус занял чистое первое место 11 раз. Другими претендентами были: англичанин сэр Уильям Рамзай (премия 1904 года), француз Анри Муассан (1906), немец Адольф фон Байер (1905), американский химик Хармон Морзе и француз Марселен Бертло (тоже получил бы своего «нобеля», если бы не умер в 1907 году — Бертло номинировали общим количеством 11 раз).
Нужно обязательно отметить и еще два момента, связанные с Аррениусом и Нобелевскими премиями. Начнем в хронологическом порядке, с 1901 года. А точнее, еще раньше. В конце XIX века Аррениус, наряду с доработками своей теории, занимается и осмотическим давлением. «Классиком» работ по осмосу был голландец Якоб Вант-Гофф (рис. 4) с его классической формулой PV=iRT. (Тут P — осмотическое давление вещества в растворе, Т — температура, R — универсальная газовая постоянная, а i — эмпирический коэффициент, сейчас называемый коэффициентом Вант-Гоффа, или изотоническим коэффициентом.) Однако Вант-Гофф никак не мог объяснить, почему для растворенных газов, к примеру, i равен единице, а вот для солей коэффициент становится больше. Работы Аррениуса помогли Вант-Гоффу понять, что i связан с количеством частиц в растворе, а поскольку соли распадаются (диссоциируют) на ионы, коэффициент возрастает. В итоге Вант-Гофф стал самым первым нобелевским лауреатом в истории (1901 год).

Рисунок 5. Анри Муассан (1852–1907). Лауреат Нобелевской премии по химии 1906 года — в основном за исследование и выделение фтора. Получил свободный фтор и различные его соединения, обнаружил в аризонском метеорите и описал новый минерал (муассанит), состоящий из карбида кремния.
Второй момент относится к 1906 году. К тому времени Аррениус уже вышел в отставку с поста ректора Стокгольмского университета и стал директором физико-химического Нобелевского института. Пишут, что в 1906 году Нобелевский комитет предварительно вынес решение в пользу Менделеева, однако ненавидевший соперника Аррениус запротестовал и заставил поменять решение в пользу молодого Анри Муассана (рис. 5).
Справедливости ради отметим, что я слышал и другое объяснение этой истории: комитет решил, что Менделееву можно дать премию и в следующем году, а Муассан — парень «молодой», изувеченный фтором, и ему премия нужнее. Что я могу утверждать совершенно точно, так это то, что Менделеев и Аррениус друг друга действительно не любили, а счет по номинациям в 1906 году у нашего соотечественника и Анри Муассана был 4:8, а также то, что в 1907 году не стало и Менделеева, и Муассана. И еще одно могу сказать точно: на первом конгрессе памяти Менделеева в 1907 году в Петербурге Аррениус был почетным гостем (рис. 6).

Рисунок 6. Аррениус на I Менделеевском съезде (первый ряд, третий слева). Съезд проходил с 20 по 30 декабря 1907 г. в Санкт-Петербурге. Работали отделения химии (рассматривались вопросы общей и прикладной науки), агрохимии, физики, биологии и гигиены.
Как бы то ни было, нельзя не отметить энциклопедичность и прозорливость Аррениуса. Ведь именно он впервые увязал рост температуры на планете с содержанием углекислого газа в атмосфере (к этому выводу он пришел, изучая ледниковые периоды) [2]. Аррениус оформил в стройную научную гипотезу и дополнил расчетами предположения других ученых о панспермии — переносе зародышей живых организмов через космос. Он пытался объяснить природу полярных сияний, солнечной короны и шаровой молнии, изучить вулканы методами физической химии. И давайте уже ответим на вопрос, что делает кондовый физхимик на биомолекуле?
Даже если опустить тот факт, что именно Аррениусом были введены такие замечательные понятия, как ионы — а какую роль играют ионы в нашей с вами биохимии, мне объяснять не надо — и энергетический барьер реакции, если забыть о роли осмоса в биологических процессах, останется тот факт, что Аррениус был одним из пионеров иммунохимии и посвятил этой теме целую монографию, затронув в ней и физико-химию токсинов и антитоксинов [3]. Именно Аррениус показал, что нет никакой принципиальной разницы между реакциями, над которыми химики работают в своих колбах, и теми, которые идут внутри живых организмов. И в предисловии к книге Quantitative laws in biological chemistry он написал: «Физики и химики пришли к заключению, что те биологические теории, которые еще пользуются признанием в медицинских кругах, основаны на совершенно неправильных взглядах и должны быть заменены другими представлениями, согласующимися с основными законами общей химии» [4].
А вот со здоровьем Сванте Аррениусу не повезло. Он рано начал набирать вес, страдал одышкой; однажды на входе на какую-то конференцию или конгресс швейцар сказал ему, что мясники заседают в соседнем здании. Как итог — 67 лет жизни (большинство нобелиатов прожили намного дольше), короткая болезнь и смерть. Печально, но тем не менее успел Аррениус очень много. В конце концов, не каждый химик и даже не каждый нобелевский лауреат может похвастаться тем, что его открытия изучают в школе — даже сейчас, когда прошло более века с того дня, когда они были сделаны.
Первый вариант статьи был опубликован в блоге автора на сайте Политехнического музея [5].
Литература
- Arrhenius S. Recherches sur la conductivité galvanique des électrolytes. Doctoral dissertation. Royal publishing house, P.A. Norstedt & söner, Stockholm, 1884;
- Arrhenius S. (1896). On the influence of carbonic acid in the air upon the temperature of the ground. Philos. Mag. J. Sci. 41, 237–276;
- Arrhenius S. Immunochemistry. New York: Macmillan, 1907;
- Arrhenius S. Quantitative laws in biological chemistry. London: G. Bell, 1915;
- Паевский А. «Соперник Менделеева». Сайт политехнического музея..