Трансплантация островков поджелудочной железы: как, кому и почему не всем?
24 января 2024
Трансплантация островков поджелудочной железы: как, кому и почему не всем?
- 5139
- 1
- 2
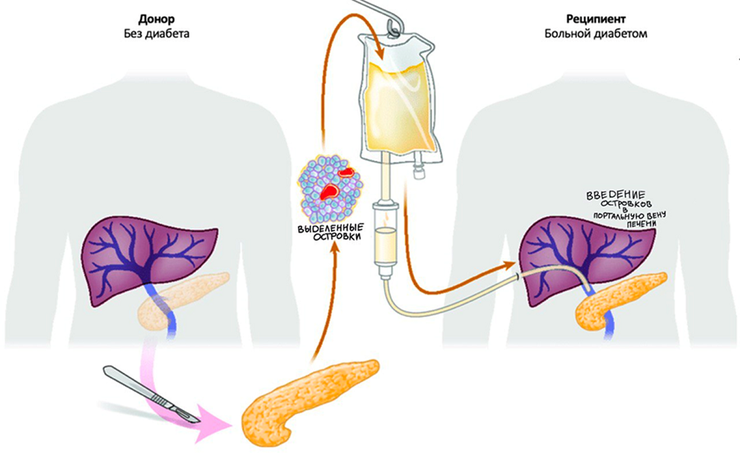
Упрощенная схема трансплантации островковых клеток поджелудочной железы.
Рисунок в полном размере.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Многие слышали о «пересадке» почки и даже о трансплантации сердца. А вот про трансплантацию поджелудочной железы мало кому известно. Все потому, что эта процедура редко выполняется из-за сложности оперативной техники. Но существуют пациенты, которым она жизненно необходима. Это люди с плохо контролируемым сахарным диабетом. Что, если попробовать пересадить не весь орган, а только ту часть, которая функционально утеряна — островковые клетки? Как проводится их трансплантация и почему не всем данная процедура может быть рекомендована? На эти вопросы мы ответим в нашей статье.
Оценка «Биомолекулы»
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Инсулин — гормон, который обеспечивает захват глюкозы клетками нашего организма
Сахарный диабет (СД) 1 типа — это аутоиммунное заболевание, развивающееся при разрушении β-клеток поджелудочной железы, продуцирующих инсулин [1]. В 2022 году всего было зарегистрировано около 8,7 миллиона случаев СД 1 типа, причем распространенность продолжает существенно увеличиваться. Прогнозируется, что к 2040 году будет зарегистрировано уже 17,4 млн случаев [2]. Несмотря на все технологические достижения большинство пациентов с этим заболеванием так и не достигают целевых показателей глюкозы крови (этот параметр принципиально важен в эндокринологической практике, так как чем больше уровень глюкозы у человека, тем выше риск различных осложнений и последствий). Некоторые люди и вовсе испытывают повторяющиеся эпизоды пониженного уровня сахара крови [3]. В настоящий момент единственным лечением данного заболевания является регулярное введение инсулина.
Раз поджелудочная железа перестает работать, то довольно логично предложить заменить ее на новую. Трансплантация органов развивается просто с невероятной скоростью, но есть определенные сложности, которые необходимо преодолевать. Иммунитет реципиента (человека, которому предоставляется орган) активно реагирует на донорский орган (трансплантат). После такого взаимодействия донорский орган даже может погибнуть. Нехватка доноров ткани поджелудочной железы и проблемы с преодолением отторжения и гибели трансплантата серьезно ограничивают широкую доступность данного метода лечения.
Но что, если попробовать пересадить не сам орган, а только клетки, которые синтезируют жизненно необходимый инсулин? Трансплантация β-клеток, входящих в состав островков поджелудочной железы, является многообещающим терапевтическим подходом в лечении СД 1 типа.
Для начала необходимо понять, что из себя представляют островки. Это скопления клеток (рис. 1), которые продуцируют все гормоны поджелудочной железы. Было подсчитано, что здоровая железа содержит примерно миллион разбросанных островков. Но это составляет лишь 1% от общего объема ткани. Каждый островок включает в себя несколько тысяч эндокринных клеток, которые тесно связаны с кровеносными сосудами и друг с другом. Сложные межклеточные взаимодействия способствуют правильному контролю гомеостаза глюкозы.
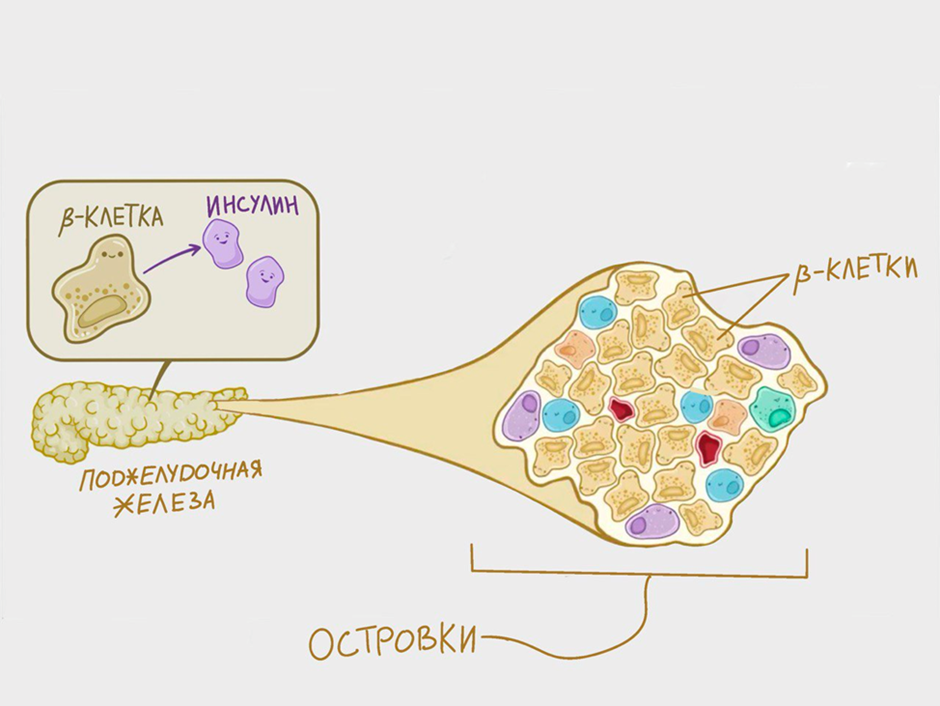
Рисунок 1. В поджелудочной железе есть эндокринная часть, которая представлена отдельными островками. Островки — это мелкие скопления клеток, преимущественно в хвосте железы. Они состоят из разных типов клеток: альфа, дельта, бета. Сегодня мы бы хотели уделить внимание последним, так как они производят очень важный гормон — инсулин. Он выделяется непосредственно в кровь, чтобы регулировать уровень глюкозы.
адаптировано из osmosis.org
Но кому, когда и стоит ли вообще в современных реалиях рекомендовать трансплантацию островковых клеток? Попробуем разобраться с вами в нашем обзоре.
Краткий экскурс в историю метода
Проблема восстановления функции поджелудочной̆ железы интересовала ученых начиная с конца 19 века. В 1888 г. Ж. Меринг и О. Минковский впервые доказали связь поджелудочной железы с инсулином и диабетом. В качестве эксперимента они удаляли поджелудочную железу или перевязывали ее протоки [4].
Попытки трансплантировать поджелудочную железу человеку начались еще за 23 года до открытия инсулина.
Первые эксперименты по трансплантации всегда заканчивались неудачно, поскольку тогда было мало известно о проблемах несовместимости и клеточного иммунитета, ведь открытия, посвященные данной проблеме, появились только в XX веке. В течение XX века продолжались попытки трансплантировать поджелудочную железу как орган, но даже терапия препаратами, подавляющими иммунитет, приводила к тому, что через год происходило неизбежное отторжение органа.
В связи с такими необнадеживающими результатами была выдвинута теория о возможности трансплантации только части ткани поджелудочной железы. Однако надежды не оправдались из-за того, что пересаживаемые фрагменты содержали не только островковую, но и ацинозную ткань поджелудочной железы, которая отвечает за образование пищеварительных ферментов. Определенным прорывом в трансплантации островков поджелудочной железы оказались разработка и получение фермента коллагеназы, которая «очищала» островки от ненужной ацинозной ткани, что позволяло получать из одной железы до 800 000 островков, доводя чистоту конечного материала до 90% [5].
C этого времени стало возможным получать и трансплантировать больным СД такое количество островков поджелудочной железы, которое необходимо для восстановления нарушенного обмена глюкозы при полном отказе от введения инсулина. Одновременно было показано, что островковые клетки, трансплантированные в печень, способны к выживанию и функционированию в течение нескольких лет без признаков отторжения. В некоторых случаях трансплантированные пациентам с СД 1 типа островки поджелудочной железы функционировали в течение нескольких лет, способствуя нормализации углеводного обмена [6].
В 2000 году А. Шапиро и соавторы разработали Эдмонтонский протокол, который сделал трансплантацию островковых клеток реальной клинической процедурой. Он предполагает выделение большого количества островков из поджелудочных желез двух-трех доноров с использованием ферментов. Островки вводятся в портальную вену печени реципиента. Во время и после трансплантации пациент начинает принимать иммунносупрессивную терапию, которая защищает островки от разрушения [7].
Последующее пятилетнее наблюдение за пациентами, которым была выполнена трансплантация островков по Эдмонтонскому протоколу, показало, что большинству из них требовалось возобновить введение инсулина только через 3–5 лет. Около 10% остались полностью инсулинонезависимыми к пятому году [8]. За последние 20 лет процедура трансплантации островковых клеток поджелудочной железы значительно улучшились благодаря многочисленным усовершенствованиям, включая более оптимальную подготовку ткани, более безопасные методы трансплантации и более эффективную противовоспалительную и иммуносупрессивную терапию.
Описание современных технологий и имеющихся методик
Подведем промежуточный итог вышесказанному: трансплантация островковых клеток поджелудочной железы — один из перспективных экспериментальных методов лечения пациентов с СД 1 типа, который позволяет снизить потребность в постоянных инъекциях инсулина, улучшить контроль уровня глюкозы крови. А еще благодаря данной процедуре возможно снижение риска развития осложнений со стороны других органов и систем, что крайне важно для пациентов с длительным течением диабета. Казалось бы, сплошные преимущества данной процедуры. Но, как и любой экспериментальный метод, он имеет свои минусы, ряд проблем, которые не решены к настоящему времени.
Что же из себя представляет методика и каким образом осуществляется трансплантация?
Процесс трансплантации требует последовательных шагов, включая получение и закупку донорской поджелудочной железы, выделение островков, их очистку, культивирование, а затем уже непосредственное введение нуждающимся людям. Необходимо уделять внимание деталям на всех этапах этого процесса, так как это повышает выживание трансплантируемых островков.
Как отмечалось ранее, ключевым моментом процедуры трансплантации является подготовка источника островковых клеток — самой поджелудочной железы. В настоящее время используется донорская поджелудочная железа. И здесь важно отметить, что это одна из проблем, требующая определенных решений, так как имеющегося количества донорских органов и тканей недостаточно для удовлетворения потенциального спроса. После того, как поджелудочную железу хирургическим путем удаляют у донора, ее промывают, охлаждают специальным консервирующим раствором и упаковывают для транспортировки в центр, где будет происходить выделение островковых клеток.
Процедура, используемая в настоящее время для извлечения островков из поджелудочной железы человека, представляет собой автоматизированный метод (рис. 2) [9]. К. Рикорди в 1987 году разработал специальную камеру, которая и сегодня применяется для выделения островковых клеток из поджелудочной железы [10].
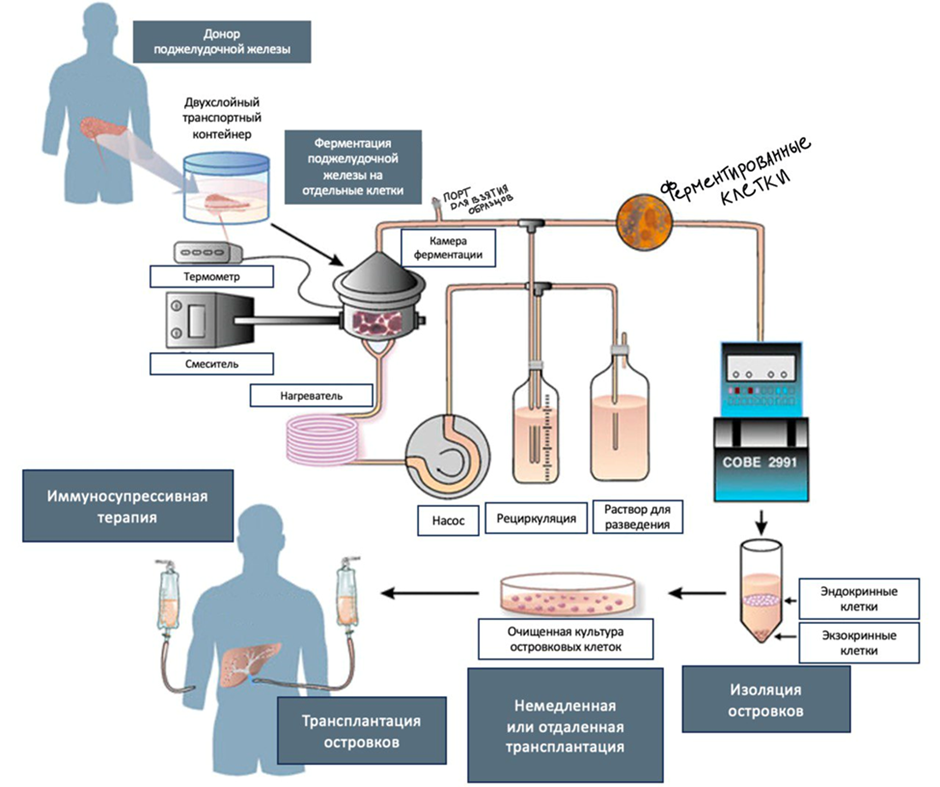
Рисунок 2. Процедура извлечения и пересадки островковых клеток. Извлечение островковых клеток из поджелудочных желез нескольких доноров происходит с помощью камеры Рикорди. Камера служит как для механического, так и для химического переваривания островков. Ферментация происходит в замкнутом контуре, где теплый раствор Хэнкса перекачивается в нижнюю камеру, а ткань, выделившаяся в растворе, проходит через фильтр в верхнюю камеру. Между камерами также рециркулирует коллагеназа. Как только большая часть островков высвобождается из окружающей ацинарной ткани, контур нагрева отключается. Температуру постепенно снижают до 10 oC, а активность коллагеназы подавляют добавлением альбумина. Затем происходит дополнительная очистка островковых клеток от ацинарной ткани на клеточном сепараторе «COBE 2991». После этого очищенные островки культивируют в течение 24–72 часов при температуре 20 oC или 37 oC в среде с добавлением инсулина, трансферрина и селена. После этой сложной процедуры островки готовы для трансплантации.
адаптировано из [9]
Процессы производства островков контролируются с помощью различных анализов, а продукт партии проверяется и характеризуется. Затем проводят проверку безопасности на чистоту (чтобы не было других «ненужных» участков тканей), количество клеток (подсчет островков), жизнеспособность, эффективность (содержание инсулина) и, наконец, стабильность (хранение в культуре).
Инфузию островков можно проводить только через несколько часов после окончания процесса выделения и до 72 часов после него. Их введение в портальную вену печени на сегодняшний день является золотым стандартом такой трансплантации.
Процедура введения островковых клеток выполняется хирургом-радиологом под местным обезболиванием по следующей схеме: в воротную вену печени через кожу вводят сосудистый катетер диаметром несколько миллиметров (рис. 3) [11]. Далее производят контроль правильности его установки с помощью рентгена. Затем островковые клетки поступают в катетер и попадают в сосуды. После катетер удаляют и вводят биосовместимый материал (спирали и желатиновые губки) для закупорки места пункции с целью предотвращения кровотечения.
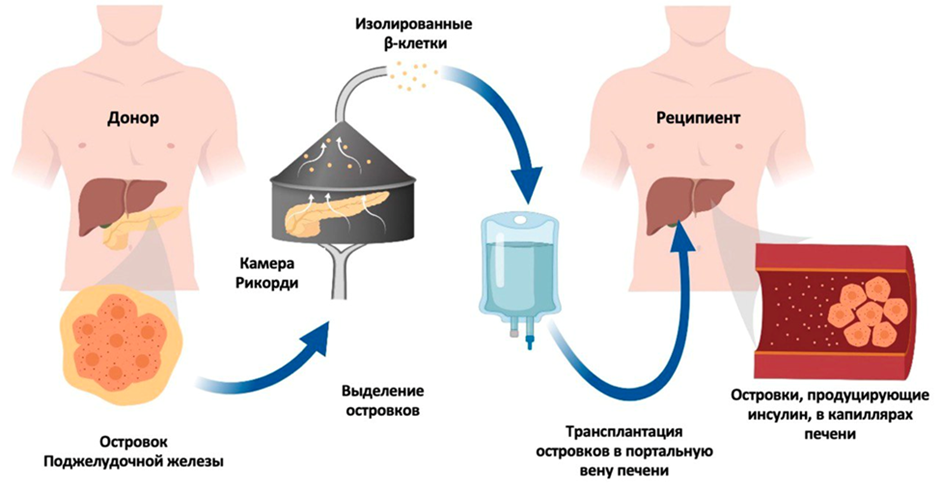
Рисунок 3. Выделение островков поджелудочной железы с их последующей трансплантацией в портальную вену печени пациента. Островковые клетки отделяются от остальных тканей поджелудочной железы с помощью камеры Рикорди. Затем очищенные островковые клетки вводятся в портальную вену реципиента с помощью специального сосудистого катетера. Островки оседают в капиллярах печени, где приживаются и начинают секретировать инсулин.
адаптировано из [11]
Рекомендации пациентам на современном этапе
Особенность трансплантации островковых клеток в настоящий момент состоит в том, что она трудновыполнима: очень трудоемок процесс производства β-клеток и мало мировых центров, которые берутся за выполнение такой операции. Именно поэтому пересадка островковых клеток поджелудочной железы показана не всем. Наиболее широко она применяется в области лечения СД 1 типа, который не контролируется инсулином, и панкреатитов [12–14].
После трансплантации островковых клеток пациентам с плохо контролируемым СД 1 типа повышается вероятность стабилизации их показателей глюкозы и даже возможности отмены инъекционного инсулина (20–90% наблюдений). Кроме того, данная процедура является менее травматичной, чем, например, пересадка целой поджелудочной железы.
Но, к сожалению, примерно трети пациентов требуется повторная трансплантация (ретрансплантация), так как функция островковых клеток довольно быстро утрачивается. Кроме того, для пересадки используются клетки доноров, поэтому такие пациенты должны постоянно принимать препараты, подавляющие иммунитет, чтобы продлить срок службы пересаженных клеток и не вызвать серьезных иммунологических реакций [15].
Рассмотрим еще одно неочевидное показание для применения островковых клеток — панкреатит. В первую очередь поражается преимущественно та часть поджелудочной железы, которая отвечает за производство пищеварительных ферментов. При тяжелом течении болезни с частыми обострениями также поражается эндокринная часть железы. Это может привести к развитию так называемого сахарного диабета типа 3с вследствие того, что исчезают β-клетки, которые вырабатывают инсулин [16]. У людей с тяжелым панкреатитом в качестве лечения рассматривается удаление всей поджелудочной, выделение из нее островковых клеток и последующее их обратное введение с целью контроля возникшего диабета.
Что можно ожидать от данной операции? Полное удаление тканей железы приводит к уменьшению выраженности боли и увеличению качества жизни (это один из ключевых параметров в медицине и отражает он то, как сам человек оценивает свое состояние после проведенного лечения). Обратное введение собственных островковых клеток позволяет примерно у трети пациентов восстановить физиологическую секрецию инсулина и избежать пожизненной инсулинотерапии. Кроме того, происходит трансплантация не чужеродной, а собственной ткани, поэтому подавление иммунитета с помощью препаратов не требуется. Главный минус — это то, что пока сложно сказать, какое время прослужат трансплантированные клетки в печени и в какой момент потребуется возвращение к инсулинотерапии [17–19].
Инновационные подходы в трансплантации островковых клеток
Предыдущие три части могли вызвать у вас недопонимание: а все-таки стоит ли проводить трансплантацию островковых клеток или нет? Наш ответ такой: мы с коллегами уверены, что за этим методом — будущее лечения СД 1 типа, но, к сожалению, сейчас данная процедура не может быть рекомендована всем. Имеются три основные проблемы, в области которых в настоящий момент ведутся активные исследования:
- недостаточное количество материала, из которого возможно получение островковых клеток;
- довольно быстрое снижение количества островковых клеток после процедуры трансплантации вследствие чрезмерного иммунного ответа хозяина;
- осложнения и нежелательные эффекты препаратов, подавляющих иммунитет, которые необходимы для поддержания жизнеспособности трансплантированных островков.
Создаем островковые клетки сами!
Имеющегося количества донорских органов и тканей никогда не будет достаточно для удовлетворения потенциального спроса. Таким образом, для преодоления этой проблемы изучаются возможные альтернативные стратегии: пересадка поджелудочной железы животных человеку и трансплантация стволовых клеток.
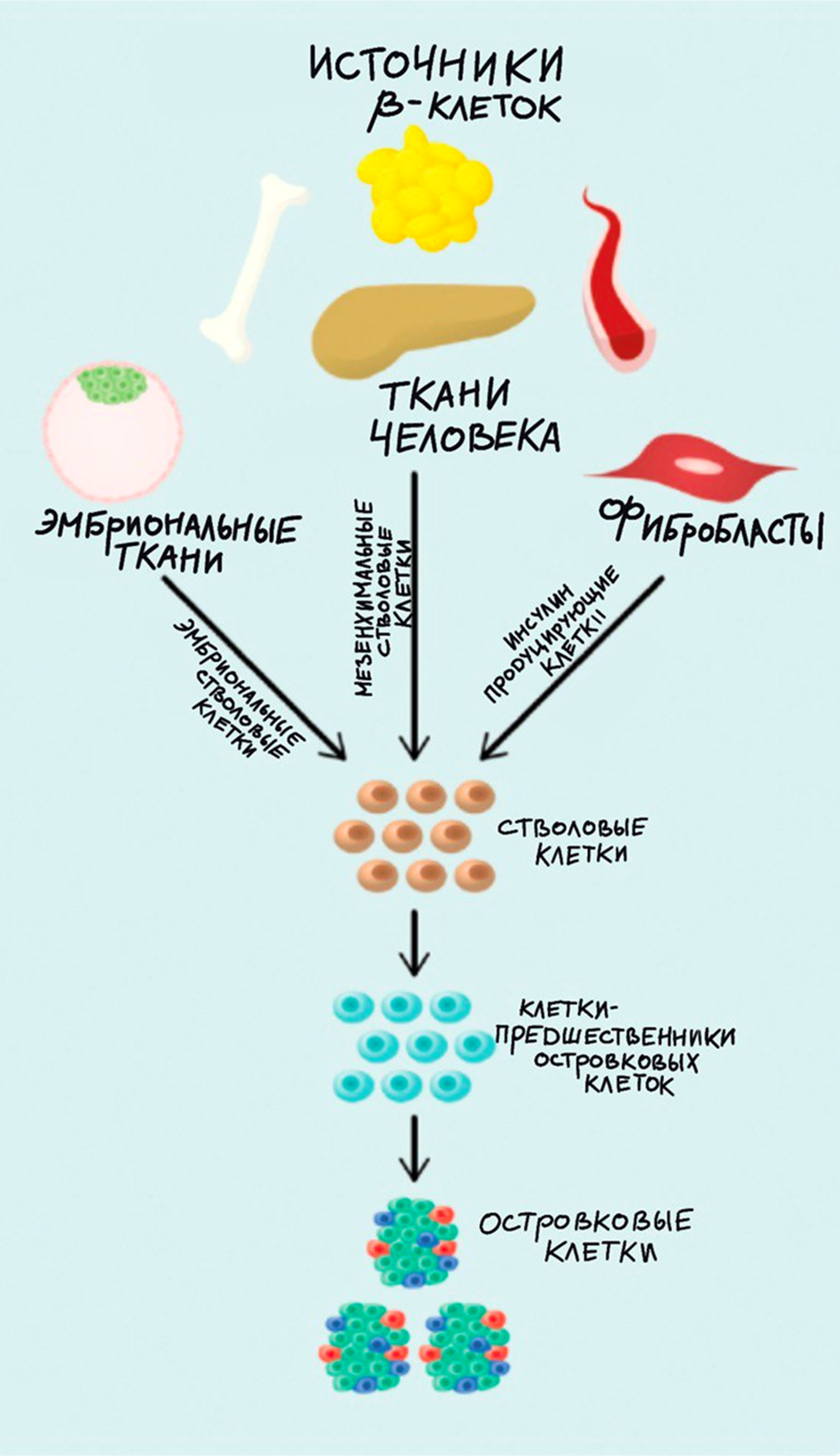
Рисунок 4. Потенциальные источники островковых клеток. Неисчерпаемыми ресурсами островковых клеток могут выступать эмбриональные стволовые клетки, мезенхимальные стволовые клетки (содержатся в различных органах и тканях человека), а также индуцированные плюрипотентные стволовые клетки, которые могут быть получены из обычных фибробластов и клеток крови с помощью «факторов Яманаки».
адаптировано из [21]
Сейчас исследователи находятся в поисках других методов получения островковых клеток без привлечения человеческих донорских органов. Одним из таких методов является применение β-клеток, полученных от животных (ксенотрансплантация). Свиные островки продуцируют инсулин, сходный с человеческим по строению (отличается от человеческого всего лишь одной аминокислотой) и эффективности. Однако, несмотря на явные преимущества, внутривидовые различия способствуют быстрому отторжению трансплантата. Возможность редактирования генома свиньи дает надежду на то, что дополнительные генетические манипуляции с островками могут улучшить совместимость между хозяином-человеком и донором-животным [20].
Но можно попробовать создать островковые клетки «с нуля» (рис. 4) [21].
В качестве альтернативного подхода стволовые клетки могут обеспечивать неисчерпаемый источник β-клеток поджелудочной железы. Направленная дифференцировка островковых клеток из мезенхимальных стволовых клеток является потенциальным решением проблемы нехватки донорского материала [22].
Мезенхимальные клетки можно получить из пуповины, жировой ткани и костного мозга. Мощная способность дифференцироваться в различные типы клеток делает их привлекательным инструментом для регенерации тканей. Полученные из пуповины человека клетки обладают большим потенциалом в регенеративной медицине благодаря их способности самообновляться и дифференцироваться в различные типы клеток, в том числе и в те, которые похожи на β-клетки поджелудочной железы (также называемые инсулин продуцирующие клетки, ИПК) [23]. К сожалению, немногочисленные эксперименты, недостаточная эффективность и непредсказуемый характер дифференцировки мезенхимальных клеток пока что ограничивают применение данной стратегии в лечении СД 1 типа.
Эмбриональные стволовые клетки характеризуются свойствам плюрипотентности (способностью давать начало всем типам клеток организма, в том числе и β-клеткам), а также неограниченной пролиферацией. При использовании эмбриональных клеток потенциально существуют этические проблемы, поскольку исходная популяция клеток получается из человеческих эмбрионов, взятых на стадии бластоцисты [24]. В 2022 году компания Vertex представила результаты своего первого исследования у одного пациента с СД 1 типа, который получил инфузию островков, полученных из эмбриональных клеток. Человек достиг полной инсулинонезависимости [25]. Компания ViaCyte полученные островки из эмбриональных стволовых клеток поместила в специальное устройство, которое затем было имплантировано подкожно. Предварительные результаты 17 пациентов с СД 1 типа, получивших эту трансплантацию, были опубликованы в 2021 году. У шести из 17 пациентов была сохранена продукция инсулина через шесть месяцев после трансплантации [25].
Несмотря на то, что островковые клетки, полученные из ЭСК, решают проблему дефицита донорского материала, реципиенты по-прежнему вынуждены принимать иммуносупрессивную терапию. В 2006 году К. Такахаши и С. Яманака описали использование факторов, названных «факторами Яманаки», которые могут перепрограммировать обычные клетки обратно в их эмбриональную форму, известную как индуцированные плюрипотентные стволовые клетки (ИПСК) [26]. Согласно этой модели, клетки крови пациентов с СД 1 типа могут быть преобразованы в ИПСК, а затем дифференцированы в β-подобные островковые клетки, которые могут быть трансплантированы без иммуносупрессии [27]. Данная технология пока не получила широкого применения из-за небольшого количества проведенных исследований в этой области.
Поиск новых мест для трансплантации
Введение островков в портальную вену печени является «золотым» и пока, к сожалению, единственным рекомендованным местом введения донорских островков. Сразу же после трансплантации без применения иммуносупрессии более 60% массы островковых клеток погибают [28]. Проблема выживания островковых клеток непосредственно связана с врожденным иммунным ответом [29].
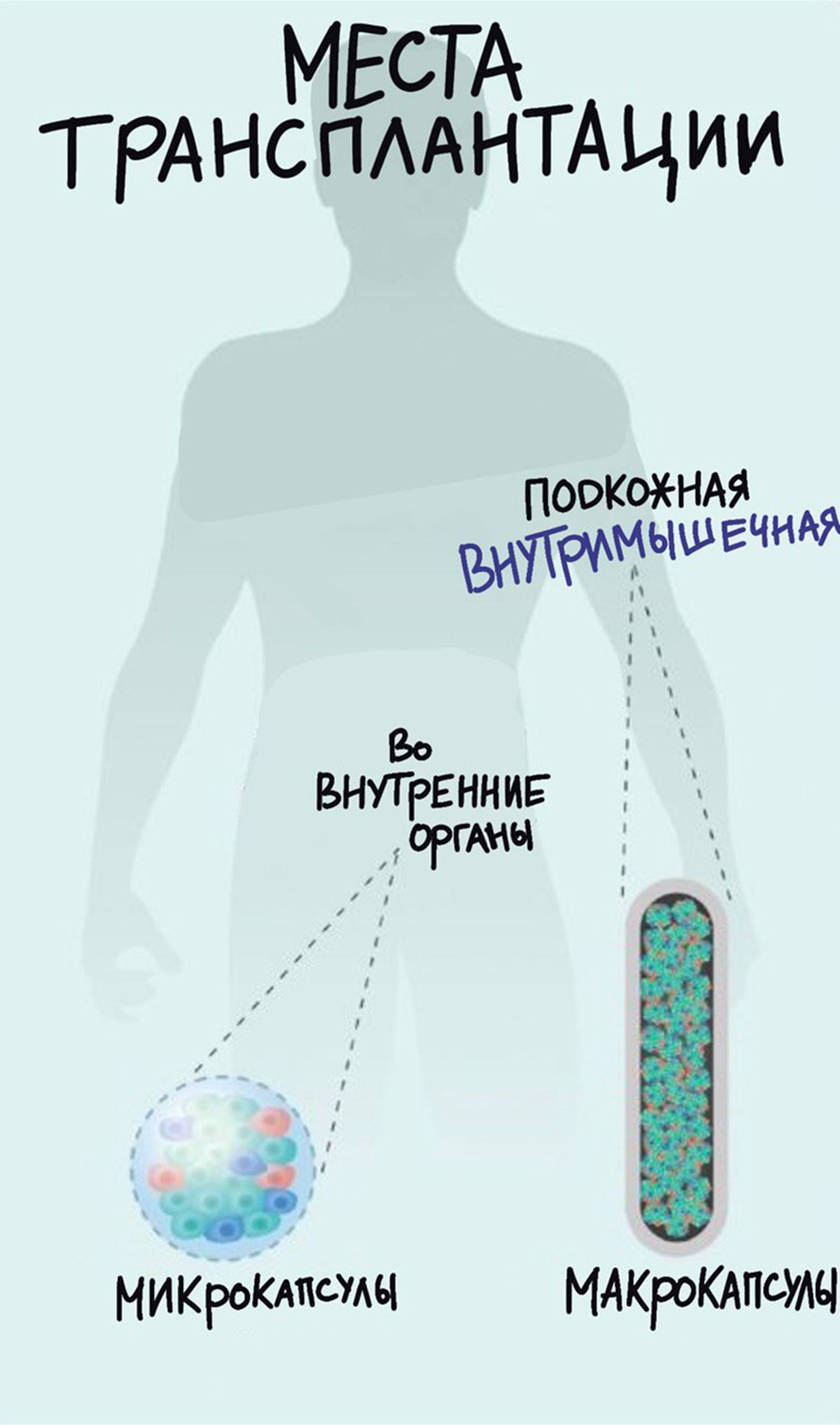
Рисунок 5. Потенциальные места для трансплантации островковых клеток. Можно разделить места трансплантации условно на две большие категории: 1) наружные (подкожная и вниутримышечная трансплантация) и 2) непосредственно внутри организма (трансплантация во внутренние органы).
адаптировано из [21]
Все попытки использовать различные другие места для трансплантации долго оставались безуспешными. Но в настоящий момент активно рассматриваются другие перспективные варианты (рис. 5). Так, использование участка под капсулой почки оказалось очень эффективным у грызунов (но не у людей). Потенциальными местами трансплантации также являются селезенка, красный костный мозг, поперечнополосатая мышечная ткань, сальник и даже органы, которые защищены от нашего собственного иммунитета (яички и глаза) [30]. Самым привлекательным местом, конечно же, остается подкожное пространство, проблема только в том, что оно содержит очень мало сосудов, однако легкодоступно и хорошо подходит для введения островковых клеток [31].
Но поскольку подходящего идеального альтернативного сайта трансплантации в организме человека все-таки пока не найдено, ученые пошли другим путем — изготовление искусственного места трансплантации.
Чтобы предотвратить иммунное отторжение и избежать постоянной иммуносупрессии, возможно использование технологии инкапсуляции, основанной на помещении эндокринных клеток в полупроницаемые контейнеры, которые обеспечивают пассивное прохождение питательных веществ и газов крови, но при этом одновременно защищают от иммунной системы [32]. Инкапсуляцию можно условно разделить на две категории: микро- и макрокапсулирование (рис. 6).
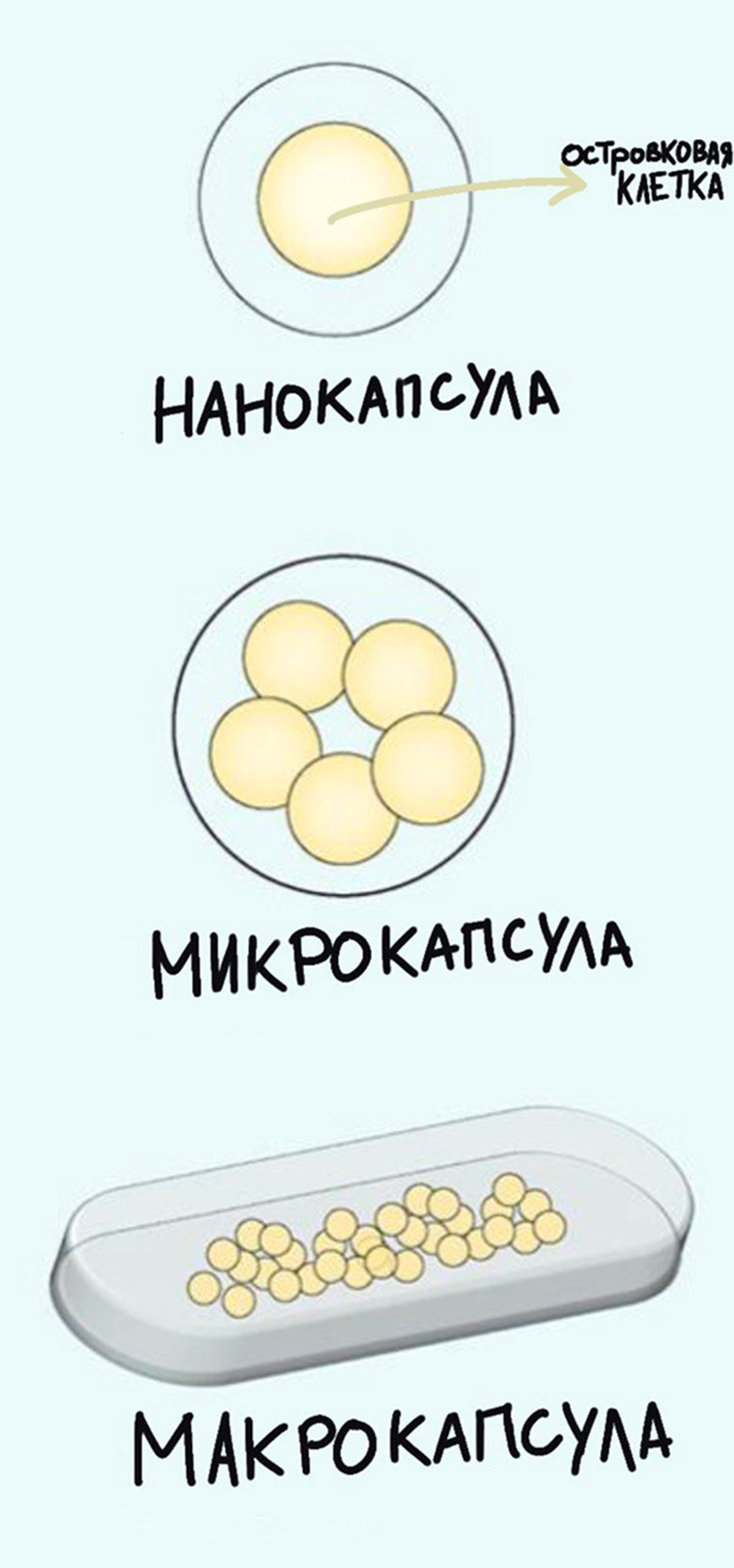
Рисунок 6. Техники инкапсулирования островковых клеток. Существует несколько «уровней» инкапсулирования островковых клеток. Можно поместить единичную островковую клетку в нанокапсулу, группу клеток — в микрокапсулу, а еще проще имплантировать макроустройство, содержащее островковые клетки, ведь его видно невооруженным глазом!
адаптировано из [33]
Микрокапсулирование заключается в покрытии отдельных или групп островковых клеток тонкими природными или искусственными пленками-полимерами [33]. Тем не менее, помещение островков в такие микрокапсулы может приводить к воспалительным иммунным реакциям в ответ на чужеродный синтетический полимер, а инъекционный характер смеси в настоящий момент не позволяет извлечь трансплантат при возникновении аллергических реакций [34].
Были также разработаны наночастицы [35] размером от 1 до 1000 нм, обладающие коллоидными свойствами [36], [37]. Наноинкапсуляция — это технология, позволяющая отдельные островки поместить в тонкие пленки, которые обладают способностями к двунаправленной диффузии кислорода, питательных веществ и метаболитов [38], [39]. Но столь малый размер частиц увеличивает их скорость выведения организмом, что абсолютно противоречит нашему желанию как можно дольше сохранять инкапсулированные клетки. Учитывая этот фактор, необходимо спроектировать соответствующие по размеру частицы, а также вычислить частоту необходимой реимплантации.
Эти проблемы стимулируют моделирование и совершенствование методик макроинкапсуляции, которые предполагают подкожное помещение устройств размером более 1 мм с островковыми клетками. Их можно легко имплантировать, контролировать и извлекать при необходимости. В настоящее время биотехнологические компании работают над тем, чтобы свести к минимуму локальное «слипание» островковых клеток в своих устройствах для поддержания равномерной и адекватной доставки кислорода внутри всего пространства разрабатываемых устройств [40].
Островки Лангерганса составляют около 2% от общей массы поджелудочной железы, но получают до 20% всего кровотока органа [41]. Именно поэтому выживаемость трансплантированных клеток можно повысить с помощью различных методик, усиливающих сосудообразование и повышающих доступность кислорода. Так, добавление факторов, стимулирующих образование новых сосудов (VEGF) в островковый трансплантат, потенциально может устранить дефицит питательных веществ и повысить доступность кислорода для недавно трансплантированных островковых клеток и, в конечном счете, снизить количество повторных трансплантаций [42].
Для достижения полной инсулинонезависимости в настоящий момент требуется выполнение двух-трех процедур введения островковых клеток. Генетическая модификация β-клеток открывает уникальную возможность для коррекции дефицита инсулина, которая может возникать в связи с разрушением островков или введением меньшего количества донорского материала [43].
Варианты решения проблем иммуносупрессии
Трансплантация островковых клеток не будет считаться по-настоящему «лечебной» до тех пор, пока нужно применять препараты, чтобы подавить иммунитет. Различные инфекции [44] и повышенный риск новообразований являются серьезными проблемами, которые существенно ограничивают широкое использование иммуносупрессии. Кроме того, используемые препараты сами обладают прямой токсичностью на β-клетки [45]. В настоящий момент активно изучаются новые подходы преодоления таких нежелательных явлений. Было показано, что введение перед операцией этанерцепта (блокатора TNF-α) и анакинры (антагониста рецептора IL-1) улучшает выживаемость островковых клеток после трансплантации и сводит к минимуму воспалительные реакции [46]. Другим многообещающим средством в этой области является альфа-1-антитрипсин, ингибитор фермента-протеазы, который снижает активацию макрофагов, тем самым улучшая приживление островковых клеток за счет уменьшения воспаления [47].
В настоящий момент необходимы дополнительные терапевтические решения, которые бы предотвращали повторное разрушение вновь трансплантированных островковых клеток [48]. Таким потенциальным методом является введение вместе с трансплантатом регуляторных Т-клеток. Они являются «живыми иммунодепрессантами», которые играют роль в предотвращении отторжения. Их совместное применение с ритуксимабом (анти-CD-20 антитело) замедляло прогрессирование СД 1 типа у детей [49]. Эти многообещающие результаты требуют подтверждения в отношении реципиентов островковых клеток. В случае же успеха данный подход может быть использован как средство предотвращения отторжения без необходимости подавления иммунитета [50].
Заключение
Таким образом, концепция пересадки островковых клеток имеет богатую историю развития. В настоящее время получены довольно убедительные данные, говорящие в пользу эффективности и целесообразности пересадки островковых клеток. Сейчас их трансплантацию стоит рекомендовать пациентам с диабетом (как аутоиммунного происхождения, так и вследствие панкреатита) с тяжелым неконтролируемым течением заболевания: сильными колебаниями уровня глюкозы крови, частыми случаями гипогликемии, неэффективности проводимой терапии несмотря на увеличение количества вводимого инсулина. К сожалению, метод не лишен недостатков, является ресурсо- и трудоемким. Ученые и практикующие врачи всего мира столкнулись с целым рядом сложностей, и теперь их усилия направлены на поиск решений проблем, связанных с пересадкой островковых клеток поджелудочной железы.
Литература
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Gabriel A Gregory, Thomas I G Robinson, Sarah E Linklater, Fei Wang, Stephen Colagiuri, et. al.. (2022). Global incidence, prevalence, and mortality of type 1 diabetes in 2021 with projection to 2040: a modelling study. The Lancet Diabetes & Endocrinology. 10, 741-760;
- Ivan I. Dedov, Marina V. Shestakova, Alexander Yu. Mayorov, Natalya G. Mokrysheva, Olga K. Vikulova, et. al.. (2022). Standards of specialized diabetes care. Edited by Dedov I.I., Shestakova M.V., Mayorov A.Yu. 10th edition. Diabetes mellitus. 24, 1-148;
- Von Mering J., Minkowski O. (1889). Diabetes mellitus after pancreas extirpation. Arch Exp Pathol Pharmakol. 26, 111;
- Camillo Ricordi, Paul E Lacy, David W Scharp. (1989). Automated Islet Isolation From Human Pancreas. Diabetes. 38, 140-142;
- T. B. Murdoch, D. McGhee-Wilson, A. M. J. Shapiro, J. R. T. Lakey. (2004). Methods of Human Islet Culture for Transplantation. Cell Transplant. 13, 605-618;
- A.M. James Shapiro, Jonathan R.T. Lakey, Edmond A. Ryan, Gregory S. Korbutt, Ellen Toth, et. al.. (2000). Islet Transplantation in Seven Patients with Type 1 Diabetes Mellitus Using a Glucocorticoid-Free Immunosuppressive Regimen. N Engl J Med. 343, 230-238;
- Edmond A. Ryan, Breay W. Paty, Peter A. Senior, David Bigam, Eman Alfadhli, et. al.. (2005). Five-Year Follow-Up After Clinical Islet Transplantation. Diabetes. 54, 2060-2069;
- Shaheed Merani, A. M. James Shapiro. (2006). Current status of pancreatic islet transplantation. Clinical Science. 110, 611-625;
- Anissa Gamble, Andrew R. Pepper, Antonio Bruni, A. M. James Shapiro. (2018). The journey of islet cell transplantation and future development. Islets. 10, 80-94;
- Jeremy Quintana, Department of Chemistry & Biochemistry, Baylor University, 101 Bagby Ave, Waco, TX, USA, Alexandra Stinchcomb, Jessica Kostyo, Blair Robichaud, et. al.. (2018). Chemical Strategies for Improving Islet Transplant Outcomes. obm transplant. 2, 1-1;
- Xavier L. Baldwin, Brittney M. Williams, Beth Schrope, Chirag S. Desai. (2021). What Is New with Total Pancreatectomy and Autologous Islet Cell Transplantation? Review of Current Progress in the Field. JCM. 10, 2123;
- Melena D. Bellin, Gregory P. Forlenza, Kaustav Majumder, Megan Berger, Martin L. Freeman, et. al.. (2017). Total Pancreatectomy With Islet Autotransplantation Resolves Pain in Young Children With Severe Chronic Pancreatitis. J. pediatr. gastroenterol. nutr.. 64, 440-445;
- Piemonti L. Islet Transplantation. In: Endotext / ed. by Feingold K. R. et al. South Dartmouth (MA): MDText.com, Inc., 2000;
- Marie-Christine Vantyghem, Eelco J P de Koning, François Pattou, Michael R Rickels. (2019). Advances in β-cell replacement therapy for the treatment of type 1 diabetes. The Lancet. 394, 1274-1285;
- Phil A Hart, Melena D Bellin, Dana K Andersen, David Bradley, Zobeida Cruz-Monserrate, et. al.. (2016). Type 3c (pancreatogenic) diabetes mellitus secondary to chronic pancreatitis and pancreatic cancer. The Lancet Gastroenterology & Hepatology. 1, 226-237;
- Piotr Witkowski, Omid Savari, Jeffrey B. Matthews. (2014). Islet Autotransplantation and Total Pancreatectomy. Advances in Surgery. 48, 223-233;
- Shrouq Khazaaleh, Sumbal Babar, Mohammad Alomari, Zaid Imam, Pravallika Chadalavada, et. al.. (2023). Outcomes of total pancreatectomy with islet autotransplantation: A systematic review and meta-analysis. World J Transplant. 13, 10-24;
- Beata Jabłońska, Sławomir Mrowiec. (2021). Total Pancreatectomy with Autologous Islet Cell Transplantation—The Current Indications. JCM. 10, 2723;
- Marco Carvalho Oliveira, Emilio Valdivia, Murielle Verboom, Yuliia Yuzefovych, Hendrik Johannes Sake, et. al.. (2020). Generating low immunogenic pig pancreatic islet cell clusters for xenotransplantation. J Cellular Molecular Medi. 24, 5070-5081;
- Jesus Paez-Mayorga, Izeia Lukin, Dwaine Emerich, Paul de Vos, Gorka Orive, Alessandro Grattoni. (2022). Emerging strategies for beta cell transplantation to treat diabetes. Trends in Pharmacological Sciences. 43, 221-233;
- Ayat M. Domouky, Ashraf S. Hegab, Amal Al-Shahat, Nermin Raafat. (2017). Mesenchymal stem cells and differentiated insulin producing cells are new horizons for pancreatic regeneration in type I diabetes mellitus. The International Journal of Biochemistry & Cell Biology. 87, 77-85;
- Nancy El-Hossary, Hamdy Hassanein, Abdel Wahab El–Ghareeb, Hisham Issa. (2016). Intravenous vs intraperitoneal transplantation of umbilical cord mesenchymal stem cells from Wharton’s jelly in the treatment of streptozotocin-induced diabetic rats. Diabetes Research and Clinical Practice. 121, 102-111;
- Misganaw Gebrie Worku. (2021). Pluripotent and Multipotent Stem Cells and Current Therapeutic Applications: Review. SCCAA. Volume 14, 3-7;
- Zofia Czarnecka, Nidheesh Dadheech, Haide Razavy, Rena Pawlick, A. M. James Shapiro. (2023). The Current Status of Allogenic Islet Cell Transplantation. Cells. 12, 2423;
- Kazutoshi Takahashi, Shinya Yamanaka. (2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. 126, 663-676;
- Martijn van de Bunt, Majlinda Lako, Amy Barrett, Anna L. Gloyn, Mattias Hansson, et. al.. (2016). Insights into islet development and biology through characterization of a human iPSC-derived endocrine pancreas model. Islets. 8, 83-95;
- Montserrat Biarnés, Marta Montolio, Victor Nacher, Mercè Raurell, Joan Soler, Eduard Montanya. (2002). β-Cell Death and Mass in Syngeneically Transplanted Islets Exposed to Short- and Long-Term Hyperglycemia. Diabetes. 51, 66-72;
- Mazhar A. Kanak, Morihito Takita, Faisal Kunnathodi, Michael C. Lawrence, Marlon F. Levy, Bashoo Naziruddin. (2014). Inflammatory Response in Islet Transplantation. International Journal of Endocrinology. 2014, 1-13;
- Poppy Addison, Karina Fatakhova, Horacio L. Rodriguez Rilo. (2020). Considerations for an Alternative Site of Islet Cell Transplantation. J Diabetes Sci Technol. 14, 338-344;
- Juewan Kim, Kyungwon Kang, Christopher J. Drogemuller, Gordon G. Wallace, P. Toby Coates. (2019). Bioprinting an Artificial Pancreas for Type 1 Diabetes. Curr Diab Rep. 19;
- Mahdieh Alipour, Nima Firouzi, Zahra Aghazadeh, Mohammad Samiei, Soheila Montazersaheb, et. al.. (2021). The osteogenic differentiation of human dental pulp stem cells in alginate-gelatin/Nano-hydroxyapatite microcapsules. BMC Biotechnol. 21;
- Qi Zhang, Carmen Gonelle-Gispert, Yanjiao Li, Zhen Geng, Sandrine Gerber-Lemaire, et. al.. (2022). Islet Encapsulation: New Developments for the Treatment of Type 1 Diabetes. Front. Immunol.. 13;
- Katarzyna Skrzypek, Milou Groot Nibbelink, Jéré van Lente, Mijke Buitinga, Marten A. Engelse, et. al.. (2017). Pancreatic islet macroencapsulation using microwell porous membranes. Sci Rep. 7;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Нанотехнологии — новый союзник в войне с болезнями;
- Franco Centurion, Abdul W. Basit, Jinyao Liu, Simon Gaisford, Md. Arifur Rahim, Kourosh Kalantar-Zadeh. (2021). Nanoencapsulation for Probiotic Delivery. ACS Nano. 15, 18653-18660;
- Наномедицина будущего: трансдермальная доставка с использованием наночастиц;
- Silke Krol, Silvia del Guerra, Maria Grupillo, Alberto Diaspro, Alessandra Gliozzi, Piero Marchetti. (2006). Multilayer Nanoencapsulation. New Approach for Immune Protection of Human Pancreatic Islets. Nano Lett.. 6, 1933-1939;
- Debkalpa Goswami, Daniel A. Domingo‐Lopez, Niamh A. Ward, Jeffrey R. Millman, Garry P. Duffy, et. al.. (2021). Design Considerations for Macroencapsulation Devices for Stem Cell Derived Islets for the Treatment of Type 1 Diabetes. Advanced Science. 8;
- John C. Stendahl, Dixon B. Kaufman, Samuel I. Stupp. (2009). Extracellular Matrix in Pancreatic Islets: Relevance to Scaffold Design and Transplantation. Cell Transplant. 18, 1-12;
- Ruth E. Levey, Fergal B. Coulter, Karina C. Scheiner, Stefano Deotti, Scott T. Robinson, et. al.. (2021). Assessing the Effects of VEGF Releasing Microspheres on the Angiogenic and Foreign Body Response to a 3D Printed Silicone-Based Macroencapsulation Device. Pharmaceutics. 13, 2077;
- Kim Loh, Yan-Chuan Shi, Stacey Walters, Mohammed Bensellam, Kailun Lee, et. al.. (2017). Inhibition of Y1 receptor signaling improves islet transplant outcome. Nat Commun. 8;
- Stephanie M. Pouch. (2015). Infectious Complications of Pancreatic Islet Transplantation: Clinical Experience and Unanswered Questions. Curr Infect Dis Rep. 17;
- Elke Oetjen, Diana Baun, Stephan Beimesche, Doris Krause, Irmgard Cierny, et. al.. (2003). Inhibition of Human Insulin Gene Transcription by the Immunosuppressive Drugs Cyclosporin A and Tacrolimus in Primary, Mature Islets of Transgenic Mice. Mol Pharmacol. 63, 1289-1295;
- Kristen R. Szempruch, Oyshik Banerjee, Rebecca C. McCall, Chirag S. Desai. (2019). Use of anti-inflammatory agents in clinical islet cell transplants: A qualitative systematic analysis. Islets. 11, 65-75;
- Jingjing Wang, Zhen Sun, Wenyu Gou, David B. Adams, Wanxing Cui, et. al.. (2017). α-1 Antitrypsin Enhances Islet Engraftment by Suppression of Instant Blood-Mediated Inflammatory Reaction. Diabetes. 66, 970-980;
- Кровавая драма на островке Лангерганса, или Как новооткрытая химера T- и В-клеток подстрекает аутоиммунный ответ при диабете I типа;
- Maciej Zieliński, Magdalena Żalińska, Dorota Iwaszkiewicz‐Grześ, Mateusz Gliwiński, Matylda Hennig, et. al.. (2022). Combined therapy with
CD4 +CD25highCD127 − T regulatory cells andanti‐CD20 antibody in recent‐onset type 1 diabetes is superior to monotherapy: Randomized phase I/II trial. Diabetes Obesity Metabolism. 24, 1534-1543; - Marcus Bergström, Ming Yao, Malin Müller, Olle Korsgren, Bengt Zur‐Mühlen, Torbjörn Lundgren. (2021). Autologous regulatory T cells in clinical intraportal allogenic pancreatic islet transplantation. Transplant International. 34, 2816-2823.