
У каждого белка свои часы. К вопросу о скорости эволюции белков
19 сентября 2017
У каждого белка свои часы. К вопросу о скорости эволюции белков
- 730
- 3
- 3
Каждый белок — индивидуальность.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В ходе эволюции белки меняются с разными скоростями. Почему? Ученые решают эту головоломку с шестидесятых годов прошлого века. Но установить, какие факторы оказывают определяющее влияние, до сих пор не удалось. Однако новые подходы и растущий объем данных дают надежду на успех.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Белки — биополимеры, выполняющие в организме множество функций, от которых зависит выживание и успешность в размножении. Именно последовательности белков кодируются генами и могут измениться, если где-то в ДНК произошла мутация. Изменения эти могут привести к разным последствиям: от гибели организма до шага к образованию нового вида. Неудивительно, что, как только человечество научилось определять аминокислотные последовательности белков, оно принялось изучать эволюцию этих последовательностей [1]. В 1965 году Эмиль Цукеркандль и Лайнус Полинг обнаружили, что гемоглобин имеет более-менее постоянную скорость накопления изменений во всех доступных тогда для анализа эволюционных линиях [2]. Это наблюдение легло в основу гипотезы молекулярных часов [3]. Однако даже имеющиеся на тот момент данные говорили, что у разных белков часы идут со своей скоростью.
Для того чтобы в белке старая аминокислота заменилась на новую во всей популяции, необходимо две вещи. Во-первых, в соответствующем кодоне (тринуклеотидном участке ДНК, кодирующем одну аминокислоту) на ДНК должна произойти мутация — замена одного нуклеотида на другой, — которая приведет к изменению аминокислоты в соответствующем сайте белка. Во-вторых, новый вариант должен полностью заменить собой старый, то есть закрепиться в популяции. Оба этапа влияют на скорость эволюции белков.
Этап первый: возникновение мутации
В пределах одного организма (например человеческого) скорость мутации варьирует в несколько раз вдоль по геному, при этом близко расположенные гены мутируют с похожими скоростями. Для млекопитающих показано, что скорости эволюции соседних генов также похожи. Значит ли это, что скорость эволюции, в основном, определяется частотой появления мутаций? Не значит. Дело в том, что соседние гены не только имеют похожие скорости накопления мутаций, но и схожи по характеристикам, способным влиять на скорость их закрепления. Возможно, скоро для многих белков будут известны точные, экспериментально установленные скорости мутирования, что позволит оценить роль мутационного фактора отдельно от всех остальных [4].
Хотя выводов о глобальном влиянии различий скоростей мутирования на различия в скоростях эволюции белков ученые пока не сделали, есть множество примеров, показывающих, как повышение этих скоростей в отдельных случаях может ускорить эволюцию белков. Например, у бактерий в новой среде появляются и получают преимущество так называемые гипермутабельные штаммы, у которых быстрое накопление мутаций может привести к появлению полезных в данных условиях изменений, немедленно подхватываемых положительным отбором. Правда, как только полезные приобретения сделаны, оставаться гипермутабельным становится невыгодно из-за накопления мутаций, которые могут оказаться вредными. Такой вывод сделали ученые, сравнивая успех дикого и мутаторного фенотипов Escherichia coli в колонизации кишечника мыши. В одних мышей заселили дикий тип, в других — мутаторный. В популяции быстро мутирующих бактерий полезные мутации появились раньше, что привело к более быстрому росту их популяции. Однако уже через две недели дикий тип догнал мутаторов. Кроме того, при попадании в почву четверть мутаторов погибла, тогда как почти вся популяция дикого типа выжила. Быстро мутирующие бактерии, живя в мыши, накопили много изменений, часть из которых оказалась вредной в новой среде. Таким образом, большая скорость мутирования оказалась полезной для быстрого освоения экологической ниши, но вредной в долгосрочной перспективе [5].
Этап второй: закрепление мутации
Шанс мутаций «прижиться» в белке зависит от того, насколько белок к ним устойчив: если большинство возможных изменений в нем вредные, то отрицательный отбор будет жестко следить за постоянством белковой последовательности. На устойчивость белка к мутациям влияет множество факторов, в числе которых:
- стабильность пространственной структуры (низкая стабильность → сильный отбор против новых нестабильных вариантов → медленная эволюция) [6];
- число взаимодействий с другими белками (много взаимодействий → много важных сайтов, которым нельзя меняться → сильный отрицательный отбор → медленная эволюция) [7];
- необходимость белка для клетки (необходимый белок → больше вреда от повреждающей мутации → строгий отбор → низкая скорость эволюции) [8];
- уровень экспрессии (больше молекул белка на клетку → больше вреда для клетки, если белок неправильный → снова отрицательный отбор → снова замедление эволюции) [9].
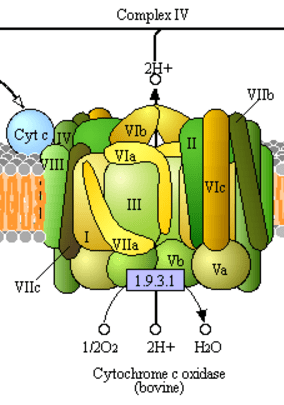
Рисунок 1. Субъединицы комплекса цитохром c-оксидазы работают в тесном контакте.
сайт kodomo.fbb.msu.ru
На данный момент наиболее важную роль в определении скорости эволюции белка отдают его уровню экспрессии [1]. Однако совсем недавно вышла статья, где вовлеченность белка в сигнальные каскады и число его белок-белковых взаимодействий имеют сравнимую с уровнем экспрессии корреляцию со скоростью его эволюции. Авторы воспользовались наиболее полной информацией по белковым взаимодействиям у человека и считают, что предыдущие выводы о слабой корреляции «общительности» со скоростью эволюции белков — результат недостатка в данных [10].
Итак, скорость изменения белков замедляется отрицательным отбором. Но раз есть минус, будет и плюс: есть сила, ускоряющая эволюцию — положительный отбор. Для включения этой силы нужно, чтобы мутация была полезной. Потребность в изменениях возникает, например, при смене обстановки, как у описанных выше гипермутабельных бактерий E. coli. Но и в постоянных условиях она регулярно появляется из-за необходимости компенсировать вредные мутации, которые отрицательный отбор нет-нет, да и пропустит в популяцию. Очень интересный пример: комплекс митохондриальной цитохром c-оксидазы млекопитающих — важного фермента дыхательной цепи, состоящего из тринадцати субъединиц, работающих вместе (рис. 1). Десять из них кодируются в ядре, а три — в ДНК митохондрий (субъединицы I–III). За счет некоторых свойств митохондриальной ДНК кодирующиеся в ней белки имеют обыкновение накапливать слабовредные мутации. Исследователи обнаружили в субъединицах с ядерным кодированием сайты, находящиеся под положительным отбором у приматов, и показали, что замены в этих сайтах скоррелированы по времени с заменами во взаимодействующих с ними участках митохондриально кодирующихся субъединиц. Кроме того, если новая аминокислота в митохондриально кодируемой части изменяла поверхность взаимодействия субъединиц, последующая замена в ядерно кодируемой части восстанавливала его. Получается, что части фермента, кодируемые ядром, «подстраивались» под сложившиеся обстоятельства путем быстрого приобретения так называемых компенсирующих замен под действием положительного отбора. [11].
Разброс скоростей эволюции белков составляет три порядка [12]. То, насколько быстро изменяется белок, может зависеть от его скорости мутирования, скорости рекомбинации, важности, уровня экспрессии, возраста, функции и множества других характеристик. Возможно, когда-нибудь нам все-таки удастся определить «главный» фактор, объясняющий различия в скоростях эволюции белков. Если он есть.
Литература
- Jianzhi Zhang, Jian-Rong Yang. (2015). Determinants of the rate of protein sequence evolution. Nat Rev Genet. 16, 409-420;
- Zuckerkandl E. and Pauling L. Molecular disease, evolution, and genetic heterogeneity. In: Horizons in biochemistry / ed. by Kasha M. and Pullman B. New York, NY: Academic Press, 1962. — P. 189–225;
- Сверим часы;
- Csaba Pál, Balázs Papp, Martin J. Lercher. (2006). An integrated view of protein evolution. Nat Rev Genet. 7, 337-348;
- A. Giraud. (2001). Costs and Benefits of High Mutation Rates: Adaptive Evolution of Bacteria in the Mouse Gut. Unknown journal title.. 291, 2606-2608;
- J. D. Bloom, S. T. Labthavikul, C. R. Otey, F. H. Arnold. (2006). Protein stability promotes evolvability. Proceedings of the National Academy of Sciences. 103, 5869-5874;
- H. B. Fraser. (2002). Evolutionary Rate in the Protein Interaction Network. Unknown journal title.. 296, 750-752;
- D. P. Wall, A. E. Hirsh, H. B. Fraser, J. Kumm, G. Giaever, et. al.. (2005). Functional genomic analysis of the rates of protein evolution. Proceedings of the National Academy of Sciences. 102, 5483-5488;
- D. A. Drummond. (2005). A Single Determinant Dominates the Rate of Yeast Protein Evolution. Molecular Biology and Evolution. 23, 327-337;
- David Alvarez-Ponce, Felix Feyertag, Sandip Chakraborty. (2017). Position Matters: Network Centrality Considerably Impacts Rates of Protein Evolution in the Human Protein–Protein Interaction Network. Unknown journal title.. 9, 1742-1756;
- Naoki Osada, Hiroshi Akashi. (2012). Mitochondrial–Nuclear Interactions and Accelerated Compensatory Evolution: Evidence from the Primate Cytochrome c Oxidase Complex. Unknown journal title.. 29, 337-346;
- Y. I. Wolf, P. S. Novichkov, G. P. Karev, E. V. Koonin, D. J. Lipman. (2009). The universal distribution of evolutionary rates of genes and distinct characteristics of eukaryotic genes of different apparent ages. Proceedings of the National Academy of Sciences. 106, 7273-7280.






