У млекопитающих найден белок, перемещающийся из митохондрий в ядро
13 апреля 2018
У млекопитающих найден белок, перемещающийся из митохондрий в ядро
- 886
- 0
- 1
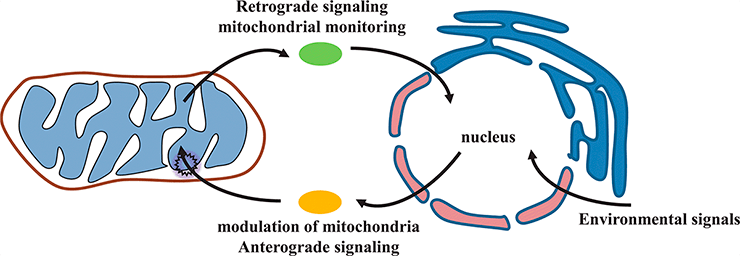
Митохондрии и ядро «общаются» друг с другом, обмениваясь различными белками. Путь из митохондрий в ядро называется ретроградным, а из ядра в митохондрии — антероградным. В деталях этого молекулярного общения многое еще остается неизвестным. Недавно удалось наконец идентифицировать белок ретроградного пути в клетках млекопитающих.
сайт e-sciencecentral.org
-
Автор
-
Редакторы
Темы
Как известно, митохондрии представляют собой эндосимбиотические бактерии, которые обосновались в эукариотических клетках и так прижились, что отдали бóльшую часть своих генов в ядерный геном клетки-хозяина. Но при этом митохондрии оставили за собой право регулировать экспрессию этих генов, ведь без подобного контроля она не была бы согласована с жизнедеятельностью самих митохондрий. И конечно, митохондрии научились сообщать ядру, что у них что-то пошло не так. Для этого они используют особые белки ретроградного транспорта, которые при определенных условиях перемещаются из митохондрий в ядро. Такие белки обнаружили у дрожжей Saccharomyces cerevisiae и нематод Caenorhabditis elegans, а вот у млекопитающих найти их аналоги долгое время не удавалось. И вот наконец появился подходящий кандидат — транскрипционный кофактор GPS2: он перемещается из митохондрий в ядро в ответ на деполяризацию митохондриальной мембраны, которая обычно свидетельствует о крайне напряженной обстановке в этих органеллах. Каким же образом GPS2 может обеспечивать молекулярный диалог митохондрий и ядра в клетках млекопитающих?
Происхождение митохондрий от бактериальных эндосимбионтов сейчас уже не вызывает сомнений [1]. Эндосимбиоз зашел так далеко, что большинство митохондриальных генов перенеслось в ядерный геном. Однако необходимость координировать экспрессию этих генов с жизнедеятельностью митохондрий не отпала. Более того, в митохондриях образуются активные формы кислорода, которые могут представлять опасность для всей клетки. Как же митохондрия может оповестить ядро о неполадках в своей работе? Очевидно, что для этого необходимы специальные молекулы, которые могли бы перемещаться из митохондрий в ядро и регулировать экспрессию избранных «резидентов» ядерного генома — генов митохондриального происхождения и генов, связанных с ответом на стресс. Впервые подобные белки идентифицировали в 1990-х в клетках дрожжей Saccharomyces cerevisiae. Чуть позже показали, что у нематод Caenorhabditis elegans транскрипционный фактор ATFS-1 перемещается из митохондрий в ядро в ответ на протеотоксический стресс — накопление большого количества неправильно уложенных белков. Идентифицировать способные к такому перемещению белки в клетках млекопитающих долгое время не удавалось.
Совсем недавно Мария Кардамоне и ее коллеги из Бостонского и Калифорнийского университетов показали, что у млекопитающих белок GPS2 (G protein pathway suppressor 2) демонстрирует двойную локализацию: он выявляется и в ядре, и в митохондриях [2]. Любопытно, что канонического N-концевого сигнала митохондриальной локализации у GPS2 нет; вместо него роль сигнала митохондриального импорта играет аминокислотная последовательность в средней части белковой молекулы.
В ядре GPS2 связывается с промоторами и изменяет экспрессию генов преимущественно митохондриального происхождения, а также ряда генов, участвующих в ответе клетки на стресс. Таким образом, он выполняет все функции, которые можно было бы ожидать от белка ретроградного пути. Оказалось, что промоторы, с которыми взаимодействует GPS2, характеризуются отсутствием одной из репрессивных эпигенетических меток, а именно — триметилирования по девятому остатку лизина (К9) гистона Н3 (H3K9me3). В отсутствие GPS2 на промоторах его генов-мишеней накапливается РНК-полимераза II, которая не может транскрибировать ДНК из-за «помехи» в виде хроматиновой репрессивной метки H3K9me3. По-видимому, GPS2 препятствует появлению такой метки на промоторах своих генов-мишеней, активируя тем самым их транскрипцию.
Оказалось, что митохондриальная форма белка модифицирована ковалентным присоединением белка SUMO (такая посттрансляционная модификация называется сумоилированием), а в ядро GPS2 перемещается при деполяризации митохондриальной мембраны, то есть при стрессовых условиях (рис. 1) [3].
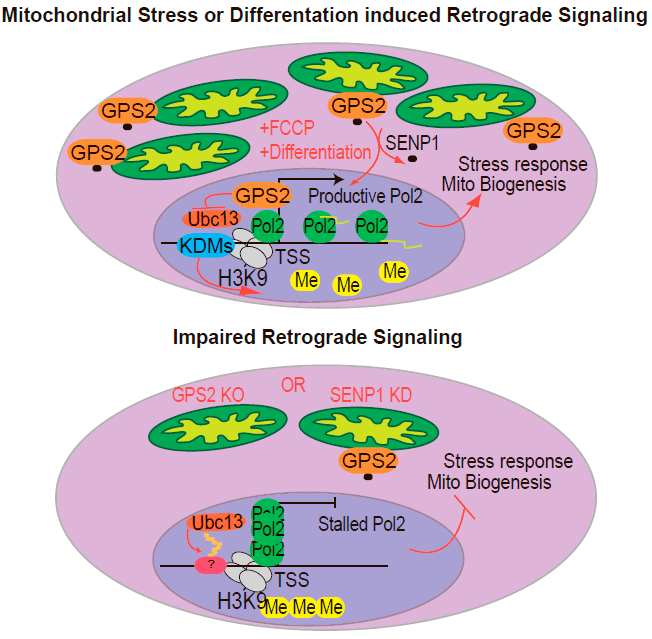
Рисунок 1. Белок GPS2 способен к ретроградному перемещению из митохондрий в ядро. Вверху: GPS2 перемещается из митохондрий в ядро в условиях стресса и при некоторых физиологических процессах вроде дифференцировки адипоцитов. В ядре этот белок взаимодействует с промоторами генов митохондриального происхождения или связанных с ответом на стресс, препятствуя появлению на них репрессивной эпигенетической метки. Внизу: Если GPS2 не может попасть в ядро, промоторы его генов-мишеней блокируются репрессивной эпигенетической меткой, поэтому продуктивной транскрипции этих генов не происходит.
Исследователи предполагают, что именно перемещение GPS2 в ядро при деполяризации мембран митохондрий обеспечивает клеточный ответ на митохондриальный стресс — посредством изменения синтеза ряда митохондриальных и других белков.
Однако перемещение GPS2 из митохондрий в ядро играет важную роль не только в ответе на стресс, но и в некоторых физиологических процессах. Например, в адипогенезе — процессе созревания клеток жировой ткани (адипоцитов). У мышей тканеспецифичное «выключение» гена этого белка приводит к превращению бурой жировой ткани, богатой митохондриями (что частично и придает ей соответствующий цвет), в более бедную митохондриями белую жировую ткань. Замечено, что дефицит GPS2 в жировой ткани связан с развитием в ней воспаления и ожирения у людей. Кроме того, этот белок принимает участие в регуляции инсулиновой сигнализации. Всё это наводит исследователей на мысли о богатом терапевтическом потенциале вмешательств в работу GPS2 [2]. Но мы пока знаем далеко не все аспекты молекулярного «общения» ядра и митохондрий. Не исключено, что и какие-то другие белки способны оповещать ядро об обстановке в митохондриях, меняя митохондриальную локализацию на ядерную.
Литература
- Как появились митохондрии (рассказ, похожий на сказку);
- Maria Dafne Cardamone, Bogdan Tanasa, Carly T. Cederquist, Jiawen Huang, Kiana Mahdaviani, et. al.. (2018). Mitochondrial Retrograde Signaling in Mammals Is Mediated by the Transcriptional Cofactor GPS2 via Direct Mitochondria-to-Nucleus Translocation. Molecular Cell. 69, 757-772.e7;
- SUMO: японская борьба или уникальная посттрансляционная модификация?.