
Ученые опять вылечили волчанку у мышей: когда ждать терапии для человека?
19 марта 2019
Ученые опять вылечили волчанку у мышей: когда ждать терапии для человека?
- 4272
- 0
- 5
«Бабочка» из сыпи на переносице и щеках стала негласным символом системной красной волчанки
-
Автор
-
Редакторы
В начале марта 2019 года публикация в журнале Science Translational Medicine сообщила о том, что ученым удалось успешно применить CAR T-клеточную терапию для лечения системной красной волчанки в мышиной модели заболевания. Как работает новое лечение и что это значит для пациентов с системной красной волчанкой?
Аутоиммунные заболевания
Многие аутоиммунные заболевания не так давно были смертельным приговором, а сегодня их если не излечивают, то значительно повышают качество жизни пациентов. В случае системной красной волчанки (СКВ) препараты — обычно это иммунодепрессанты, кортикостероиды и гидроксихлорохин — помогают облегчить изнуряющую симптоматику болезни. Однако они и сами обладают множеством побочных эффектов, которые в свою очередь могут угрожать здоровью пациента. Более того, химерное моноклональное антитело ритуксимаб, считавшееся самой перспективной разработкой, «провалилось» в двух ключевых клинических исследованиях: EXPLORER [1] и LUNAR [2].
Поэтому новая работа о том, что уже одобренная терапия рака крови успешно была протестирована на животных в модели СКВ [3], — действительно важная новость для нескольких миллионов пациентов с этой болезнью .
Согласно Lupus Foundation of America, в мире на долю пациентов с СКВ приходится 70% от страдающих всеми формами волчанки, что, по минимальным оценкам, составляет 3,5 миллиона человек.
Тестируемое лекарство относится к CAR Т-клеточной терапии. Геном собственных Т-лимфоцитов пациента, выделенных из организма, модифицируют, и клетки, амплифицированные в лаборатории и перенесенные обратно пациенту, начинают экспрессировать химерный антигенный рецептор (chimeric antigen receptor, CAR) (рис. 1). Отсюда и пошло название терапии: CAR T cell.
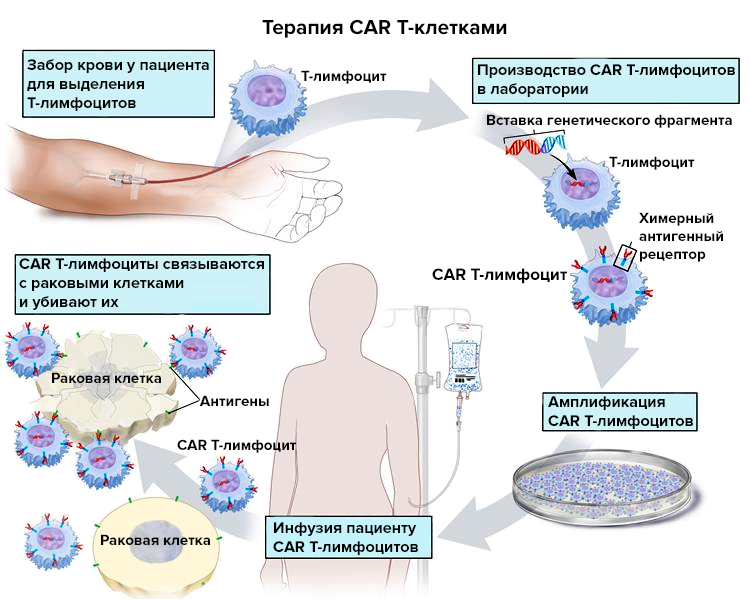
Рисунок 1. Общий принцип получения CAR T-лимфоцитов
В простейшем случае CAR состоит из:
- внеклеточного домена (чаще всего это scFv — single-chain variable fragment), позволяющего Т-лимфоциту распознать специфический антиген;
- трансмембранного домена;
- внутриклеточного домена (обычно это CD3ζ-цепь Т-клеточного рецептора), стимулирующего иммунную клетку.
В итоге «улучшенные» Т-лимфоциты убивают только те клетки, на которые их нацелили [5].
Исследователи научились также использовать различные «надстройки» на эту структуру и усиливать эффективность противоопухолевого лечения, для которого CAR T-клеточная терапия и применяется. Так, например, CAR T-клетки могут нести дополнительные костимулирующие внутриклеточные домены или секретировать провоспалительные цитокины [6].
Важно отметить, что терапия обладает довольно сильными побочными эффектами, которые даже могут угрожать жизни пациентов. Однако, к счастью, в подавляющем большинстве случаев их научились купировать [5].
Подробнее про CAR Т-клетки читайте в статье «CAR T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?» [7].
Поскольку В-лимфоциты играют важную роль не только при заболеваниях крови, но и в аутоиммунных заболеваниях, неудивительно, что нацеленная CAR Т-клеточная терапия вызвала интерес у исследователей, занимающихся СКВ.
Группа под руководством Марко Радича (Marko Radic) провела тестирование CD8+ Т-лимфоцитов с химерным антигенным рецептором, нацеленным на CD19 [3], — ту же самую молекулу, на которую нацеливают одобренную FDA терапию рака крови. Работа была проведена на моделях (NZB × NZW) F1 и MRLfas/fas СКВ.
Модифицированные CAR Т-лимфоциты были введены 41 животному. У 26 мышей терапия успешно уничтожила практически все В-лимфоциты, несущие CD19, и, соответственно, устранила производство аутоантител. Признаки болезни исчезли из селезенки, кожи, почек [10].
CAR Т-лимфоциты были активны как минимум в течение одного года in vivo. Большинство пролеченных животных прожили более года после переноса CAR Т-лимфоцитов, что, по мышиным меркам в данном контексте, очень много. Те же, кто были в контрольной группе и получали плацебо, прожили максимум 8–10 месяцев (рис. 2). Пока не ясно, почему для 15 животных терапия не сработала.
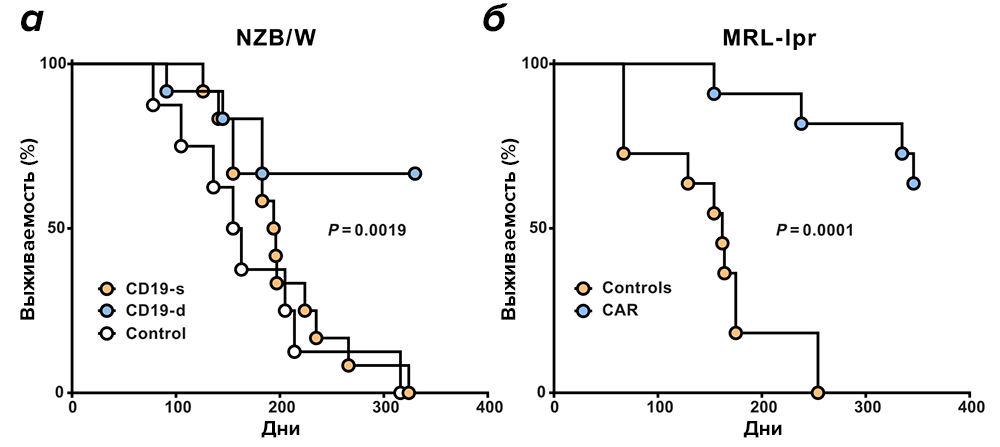
Рисунок 2. Влияние CAR Т-клеточной терапии, нацеленной на CD19, на выживаемость в мышиных моделях системной красной волчанки. а — Кривые выживаемости мышей NZB/W после инфузии CAR Т-лимфоцитов в животных семимесячного возраста. Выживаемость мышей CD19-d (CD19+ B cell depleted, n = 12) сравнивали относительно мышей CD19-s (CD19 sufficient, n = 12). Для сравнения показана выживаемость контрольных мышей (n = 8). б — Кривые выживаемости мышей MRL-lpr из опытной и контрольной групп. Мышей, получивших CAR T-лимфоциты, (n = 11), сравнивали с контрольными мышами MRL-lpr (n = 11).
Остается и самый важный вопрос: а как соотнести эти результаты с потенциальным применением терапии у людей?
С одной стороны, животных активно и успешно используют в изучении СКВ. У некоторых линий мышей, например, New Zealand, MRL и BXSB, спонтанно развивается аутоиммунный синдром, напоминающий человеческую болезнь. Кроме того, манипуляции с мышиным геномом помогли выявить гены предрасположенности к развитию волчанки, среди которых оказались те, что участвуют в регуляции апоптоза и сигналинге через рецепторы В-лимфоцитов [11], [12].
С другой стороны, пока что новое исследование находится на доклинической стадии, и ему предстоит еще много проверок. Как показал опыт с ритуксимабом, о котором шла речь выше, даже при успешном тестирования на ранних стадиях разочарование может ждать в окончательных клинических испытаниях. Однако важно отметить, что моноклональное антитело было нацелено на CD20, а не на CD19 [10], и, возможно, требовало присутствия макрофагов, функция которых может быть изменена при СКВ [13]. CAR T-клеточная терапия же работает с В-лимфоцитами «напрямую».
Не все ученые настроены столь позитивно. Например, Лоуренс Морель (Laurence Morel), иммунолог из Университета Флориды, не принимавший участия в работе, напоминает, что уже многие препараты показывали свою успешность в мышиных моделях, но при этом пока ни один не дошел до продажи на рынке. «Это [новая публикация] должно заставить нас задуматься о новых подходах, которые можно использовать, но все же это только экспериментальное исследование», — говорит Морель и пессимистично добавляет, что в ближайшее время CAR T-терапия не вылечит никого из пациентов с системной красной волчанкой [14].
Что ж, в любом случае новая публикация показала: провал ритуксимаба не означает того, что нужно бросать попытки нацеливания лекарств на В-лимфоциты, и, возможно, исследователи уже на пути к разработке терапии, работающей у людей.
Литература
- Joan T. Merrill, C. Michael Neuwelt, Daniel J. Wallace, Joseph C. Shanahan, Kevin M. Latinis, et. al.. (2010). Efficacy and safety of rituximab in moderately-to-severely active systemic lupus erythematosus: The randomized, double-blind, phase ii/iii systemic lupus erythematosus evaluation of rituximab trial. Arthritis Rheum. 62, 222-233;
- Brad H. Rovin, Richard Furie, Kevin Latinis, R. John Looney, Fernando C. Fervenza, et. al.. (2012). Efficacy and safety of rituximab in patients with active proliferative lupus nephritis: The lupus nephritis assessment with rituximab study. Arthritis & Rheumatism. 64, 1215-1226;
- Rita Kansal, Noah Richardson, Indira Neeli, Saleem Khawaja, Damian Chamberlain, et. al.. (2019). Sustained B cell depletion by CD19-targeted CAR T cells is a highly effective treatment for murine lupus. Sci. Transl. Med.. 11, eaav1648;
- Системная красная волчанка: болезнь с тысячью лиц;
- Hollie J. Jackson, Sarwish Rafiq, Renier J. Brentjens. (2016). Driving CAR T-cells forward. Nat Rev Clin Oncol. 13, 370-383;
- Aleksei Titov, Alexey Petukhov, Alena Staliarova, Dmitriy Motorin, Emil Bulatov, et. al.. (2018). The biological basis and clinical symptoms of CAR-T therapy-associated toxicites. Cell Death Dis. 9;
- CAR-T-клетки, получаемые in situ (in vivo), — путь к удешевлению и широкодоступности технологии?;
- Maria Michela D’Aloia, Ilaria Grazia Zizzari, Benedetto Sacchetti, Luca Pierelli, Maurizio Alimandi. (2018). CAR-T cells: the long and winding road to solid tumors. Cell Death Dis. 9;
- Joyce Chen, Isaac F. López-Moyado, Hyungseok Seo, Chan-Wang J. Lio, Laura J. Hempleman, et. al.. (2019). NR4A transcription factors limit CAR T cell function in solid tumours. Nature;
- Jennifer Couzin-Frankel. (2019). Genetically engineered immune cells wipe out lupus in mice. Science;
- Marie-Laure Santiago-Raber, Catherine Laporte, Luc Reininger, Shozo Izui. (2004). Genetic basis of murine lupus. Autoimmunity Reviews. 3, 33-39;
- Mara Lennard Richard, Gary Gilkeson. (2018). Mouse models of lupus: what they tell us and what they don’t. Lupus Sci Med. 5, e000199;
- A. Ahuja, L. L. Teichmann, H. Wang, R. Dunn, M. R. Kehry, M. J. Shlomchik. (2011). An Acquired Defect in IgG-Dependent Phagocytosis Explains the Impairment in Antibody-Mediated Cellular Depletion in Lupus. The Journal of Immunology. 187, 3888-3894;
- Olena A. (2019). CAR T cells treat lupus in mice. The Scientist.







