Уроки толерантности от летучей мыши: как ужиться с полчищем смертоносных вирусов
05 марта 2021
Уроки толерантности от летучей мыши: как ужиться с полчищем смертоносных вирусов
- 1479
- 0
- 5
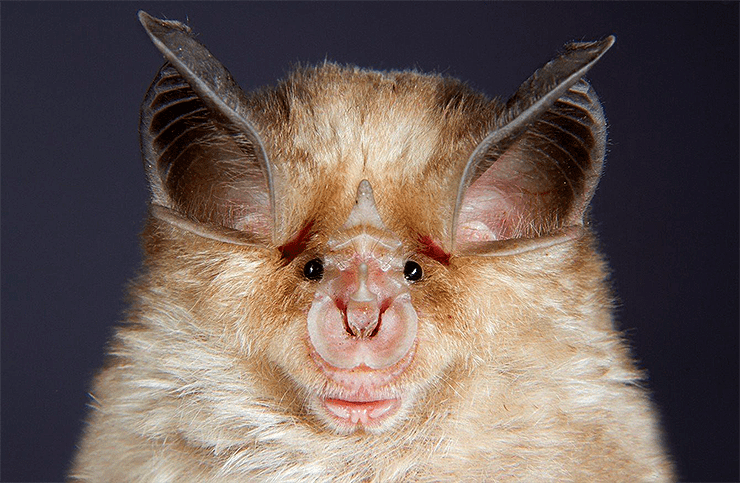
Большой подковонос анфас, относящийся к роду Rhinolophus, от представителей которого, по-видимому, и пришел к нам SARS-CoV-2
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Пожалуй, среди млекопитающих нет другого такого отряда, представители которого могут похвастаться столькими «сверхспособностями». Рукокрылые ― единственные млекопитающие, кто способен к машущему полету. Они виртуозно используют ультразвуковую эхолокацию для ориентации в пространстве. Многие из них обладают кратно большей продолжительностью жизни среди сравнимых с ними по размеру млекопитающих. Недавно в копилку их «сверхспособностей» добавилась еще одна. Миллионы лет совместной эволюции вирусов и их летучих хозяев наделили последних исключительной иммунотолерантностью. Какие же уроки для борьбы с нашими собственными инфекциями мы можем извлечь из устройства их иммунной системы?
Конкурс «Био/Мол/Текст»-2020/2021
 Эта работа заняла первое место в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.
Эта работа заняла первое место в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Приручившие вирусы летучие мыши и их сбежавшие «питомцы»
Представители отряда рукокрылых (Chiroptera) обитают практически на всех континентах, не заселены ими лишь ледяные пустыни Антарктиды. Около 1400 различных видов летучих мышей составляют пятую часть всего видового многообразия млекопитающих. Самой узнаваемой чертой рукокрылых является, конечно же, способность летать. Именно с адаптацией к активному полету многие исследователи связывают развитие у этих животных ряда исключительных черт. Одна из них, в последнее время привлекшая внимание мирового научного сообщества, ― поразительная устойчивость к вирусным инфекциям. В природе летучие мыши являются естественными резервуарами для более чем 200 разных вирусов [1]. Однако в подавляющем большинстве случаев вирусные инфекции у рукокрылых протекают бессимптомно, не причиняя видимого вреда [2]. При этом, многие из этих вирусов обладают чрезвычайно высоким пандемическим потенциалом для других животных, включая человека. Некоторые из них уже «сбегали» от своих хозяев, провоцируя смертоносные эпидемии (рис. 1).
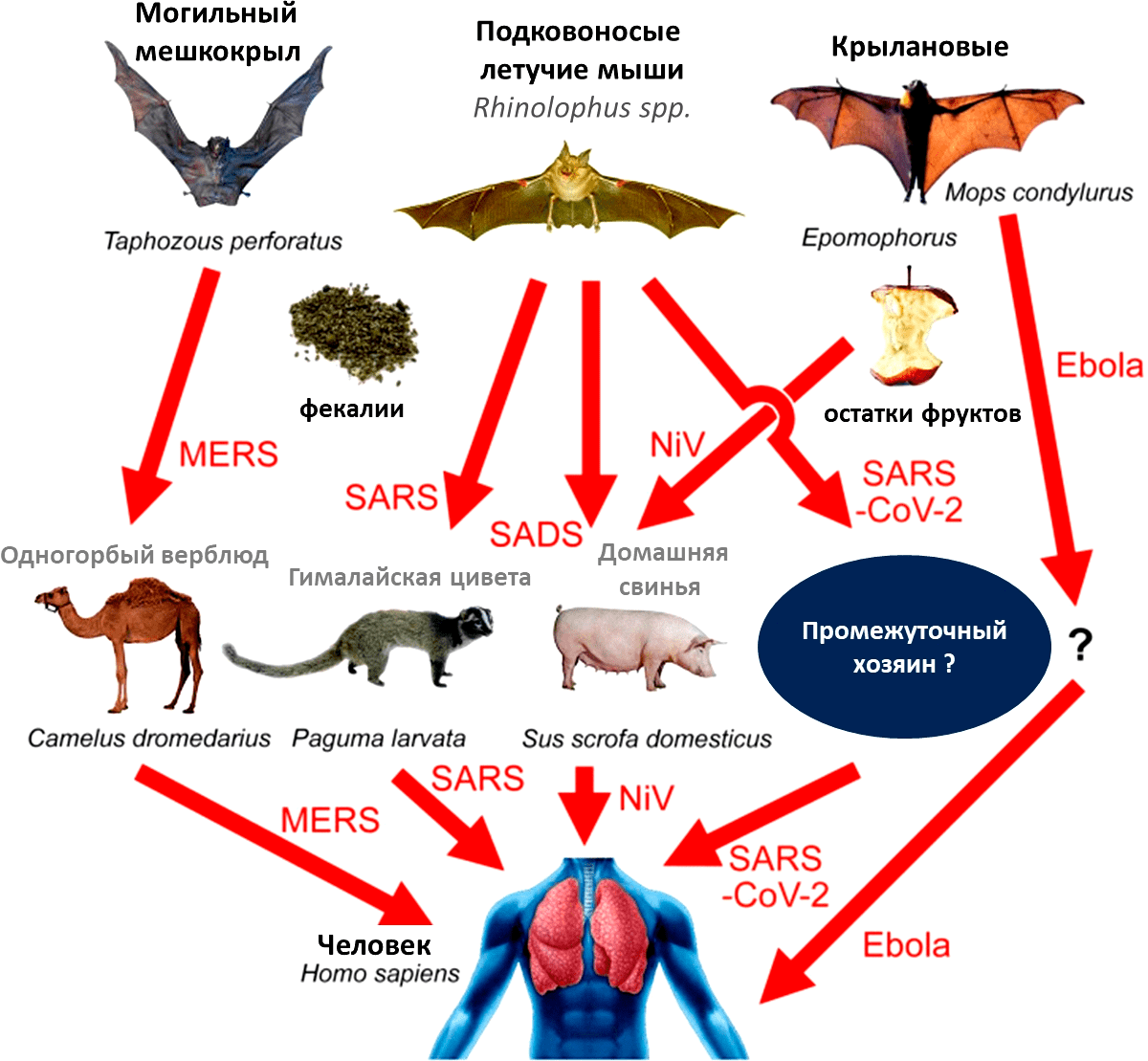
Рисунок 1. Предполагаемые пути передачи вирусов от рукокрылых к людям. MERS: могильный мешкокрыл (Taphozous perforatus) → одногорбый верблюд → человек; SARS: подковоносы → гималайская цивета → человек; SADS (swine acute diarrhea syndrome): подковоносы → домашняя свинья; SARS-CoV-2: подковоносы → неизвестный промежуточный хозяин → человек; вирус Нипах (NiV): крылановые → домашняя свинья → человек; вирус Эбола: ангольский складчатогуб (Mops condylurus) → неизвестный промежуточный хозяин → человек.
[3], рисунок адаптирован
Сегодня все население Земли страдает от одного из таких «сбежавших» от летучих мышей вирусов — SARS-CoV-2, — ставшего причиной пандемии COVID-19 .
На сайте «Биомолекулы» есть целый проект, посвященный новой короновирусной инфекции. Там подробно разобраны разные вопросы, связанные с SARS-CoV-2, включая и происхождение этого вируса.
SARS-CoV-2 был впервые зарегистрирован осенью 2019 года в китайском Ухане (провинция Хубэй) и уже 11 марта 2020 года Всемирная организация здравоохранения объявила о пандемии COVID-19. Этот вирус, по всей вероятности, перешел к нам от подковоносых летучих мышей (род Rhinolophus): SARS-CoV-2, относящийся к бета-коронавирусам (Betacoronavirus), продемонстрировал в недавнем исследовании 96,2% сходство с RaTG13 — штаммом вируса, выделенным из азиатского подковоноса (Rhinolophus affinis) в провинции Юньнань на юге Китая [4]. Как и SARS-CoV-2, коронавирус летучих мышей RaTG13 использует ангиотензинпревращающий фермент 2 в качестве рецептора для проникновения в клетку и также способен инфицировать человека [5].
В начале декабря 2020 года несколько групп исследователей сообщили об обнаружении штаммов вирусов, родственных SARS-CoV-2, за пределами Китая тоже у подковоносых летучих мышей. В Камбодже он был обнаружен у двух особей подковоноса Шамела (Rhinolophus shameli), пойманных на севере страны в 2010 году и впоследствии замороженных. Другая группа обнаружила вирус Rc-o319, идентичный SARS-CoV-2 на 81%, у эндемичного японского подковоноса (Rhinolophus cornutus), пойманного в 2013 году [6]. Эти новые данные указывают на то, насколько обширен может быть естественный резервуар потенциально патогенных для человека коронавирусов. Вполне вероятно, что в условиях пандемии, когда полевые работы сильно ограничены, лабораторные морозильники с хранимыми в них образцами преподнесут нам еще немало сюрпризов.

Рисунок 2. Экзотические для нас зверьки, гималайские циветы ― промежуточные носители вируса атипичной пневмонии, ― активно продавались на влажных рынках Китая ради мяса
SARS-CoV-2 ― далеко не первый коронавирус, пришедший к нам от летучих мышей. Наверняка, многие из вас помнят о недавних эпидемиях SARS (тяжелый острый респираторный синдром) и MERS (ближневосточный респираторный синдром), возбудителями которых также являются бета-коронавирусы . Тяжелый острый респираторный синдром был впервые зарегистрирован у людей в провинции Гуандун на юге Китая в 2002 году, став впоследствии причиной смерти около 800 человек во всем мире. Позже был обнаружен естественный резервуар SARS-CoV, им оказалась популяция уже знакомых нам подковоносых летучих мышей. Исследования SARS-CoV показали, что гималайская цивета (Paguma larvata) с высокой долей вероятности выступила в роли промежуточного хозяина этого вируса. До вспышки SARS содержание цивет было популярным занятием во многих частях Китая. Ко всему прочему, этих хищных зверьков китайцы активно использовали в пищу. Первые заболевшие во всех случаях имели контакт с циветами на влажных рынках (wet markets) или в ресторанах в провинции Гуандун (рис. 2) [7]. Идентичность полноразмерного белка-шипа S коронавируса гималайской циветы и SARS-CoV, выделенного у человека, составляет 98%, отчетливо указывая на то, что именно циветы были промежуточными хозяевами этого вируса (рис. 1) [3].
Здесь и далее по тексту аббревиатуры SARS, MERS и SADS обозначают непосредственно заболевание, а добавка -CoV, в свою очередь, указывает на коронавирус, вызывающий это заболевание.
Первые случаи заболевания MERS были зафиксированы в Саудовской Аравии в начале осени 2012 года. Вирус, вызывающий ближневосточный респираторный синдром, пришел от представителя футлярохвостых летучих мышей, предположительно от могильного мешкокрыла (Taphozous perforatus) [3]. Здесь промежуточным хозяином, вне всяких сомнений, был одногорбый верблюд, или дромадер (Camelus dromedarius) (рис. 1). РНК MERS-CoV, обнаруженная у верблюдов из Саудовской Аравии, Катара и Египта, показала чрезвычайно высокое сходство (>99%) с человеческим MERS-CoV [7]. Стоит отметить, что несмотря на убедительные доказательства того, что нынешний SARS-CoV-2 возник у подковоносых летучих мышей, передался ли он напрямую от летучих мышей к людям или через промежуточного хозяина, остается загадкой.
Еще одним примером болезни, вызванной «сбежавшим» от летучих мышей коронавирусом, может послужить SADS (синдром острой диареи свиней), который в 2016 году стал причиной гибели десятков тысяч свиней на фермах в китайской провинции Гуандун. Этот вирус, по-видимому, также произошел от подковоносых летучих мышей, и родственен штамму HKU2. Обнаруженный в 2005 году коронавирус HKU2 у Rhinolophus sinicus имеет 86%-ное сходство с коронавирусом, вызывающим SADS (рис. 1) [8].
Кроме коронавирусов летучие мыши являются природным резервуаром для большого числа других опасных для человека вирусов. Например, вирус Эбола, относящийся к семейству филовирусов (Filoviridae) и вызывающий одноименную геморрагическую лихорадку у высших приматов, произошел от ангольского складчатогуба (Mops condylurus), хотя его промежуточный хозяин до сих пор неизвестен. Вирусы Хендра и Нипах, относящиеся к роду Henipavirus, перешли к нам от представителей семейства крылановых (Pteropodidae). Вирус Хендра поражает людей и лошадей, вызывая кровоизлияния, отек легких и в тяжелых случаях вирусный менингит, а вирус Нипах у людей приводит к респираторным заболеваниям и нередко тяжелому воспалению головного мозга (энцефалиту) (рис. 1).
Все эти вирусы вызывают серьезные и порою смертельные заболевания у людей, однако летучие мыши сосуществуют с ними, оставаясь целыми и невредимыми. Совместная эволюция рукокрылых с вирусами привела к адаптации их иммунной системы, которая, как оказалось, настроена не на тотальное уничтожение вируса, а на эффективное сдерживание его развития в организме. Этой ее особенности и посвящен первый урок.
Урок #1: не можешь победить ― возглавь
Здесь нам снова необходимо обратиться к способности летучих мышей к активному полету. В 2014 году предложена гипотеза «полета как лихорадки» (‘flight-as-fever’ hypothesis), связывающая способность рукокрылых летать с врожденным противовирусным иммунитетом. Лихорадка ― универсальная защитная реакция организма теплокровных животных на инфекцию. Она сопровождается повышением температуры тела и значительным ускорением обмена веществ. Нечто подобное происходит с организмом во время сильных и продолжительных физических нагрузок. У летучих мышей во время полета это ускорение метаболизма особенно выражено: в 15–16 раз по сравнению с 7-кратным увеличением его скорости у активно бегающих грызунов или 2-кратным у большинства летающих птиц [2]. Так, высокая температура тела летучих мышей, достигающая в полете 40 oC, и ускоренный обмен веществ ежедневно имитируют у них лихорадочное состояние, подавляя развитие вирусов [9]. Но такого термического «воспитания» вирусам оказывается недостаточно, тем более что многие летучие мыши проводят значительную часть жизни в состоянии гибернации, когда температура тела и уровень метаболизма сильно снижены. Здесь на помощь рукокрылым приходят различные молекулярные механизмы системы врожденного иммунитета.
Было обнаружено, что в эволюции летучих мышей положительному отбору подверглись некоторые толл-подобные рецепторы (TLRs), ответственные за распознавание чужеродных нуклеиновых кислот. TLRs — мембранные рецепторы иммунокомпетентных клеток, которые распознают консервативные молекулярные структуры микроорганизмов (вирусов, бактерий, паразитических простейших и грибов) и активируют клеточный иммунный ответ. Они представляют собой первую линию защиты от патогенов. На сегодняшний день у млекопитающих описано 13 толл-подобных рецепторов. Однако у разных видов млекопитающих репертуар функциональных TLRs представлен разным количеством рецепторов, например, у человека имеется 10 их типов (TLR1-TLR10). Среди них в распознавании чужеродных нуклеиновых кислот вирусов участвуют TLR3, TLR7, TLR8 и TLR9. TLR3 распознает двухцепочечную РНК, образующуюся при репликации большинства вирусов; TLR7 и TLR8 распознают вирусную одноцепочечную РНК. TLR9 обнаруживает неметилированные мотивы CpG (цитозин-фосфат-гуанин динуклеотидные мотивы), которыми обогащены ДНК некоторых вирусов и бактерий и крайне бедна ДНК позвоночных [10]. Показано, что у летучих мышей под действием положительного отбора находились TLR7, TLR8 и TLR9, распознающие чужеродный генетический материал. Обнаруженные аминокислотные замены, закрепившиеся в процессе эволюции рукокрылых в этих рецепторах, были локализованы в домене с богатыми лейцином повторами, играющем важную роль именно в распознавании патогенов. Авторы предполагают, что положительный отбор по TLRs летучих мышей был следствием их адаптации к взаимодействия с большим количеством вирусов [11].
Другим универсальным механизмом эукариотических клеток, помогающим в борьбе с вирусами, является аутофагия. Аутофагия, или самопоедание, ― активный процесс уничтожения и переработки собственных белков и органелл клетки, вышедших из строя. Поедаются и перевариваются также и чужеродные объекты, оказавшиеся внутри клетки, например, целые вирусные частицы. На примере бавеанской летучей лисицы (Pteropus alecto) было показано, что в клетках этих рукокрылых базальный уровень аутофагии значительно выше, чем в культуре клеток человека. При заражении клеток летучих лисиц лиссавирусом автралийских рукокрылых, родственным вирусу бешенства, уровень аутофагии дополнительно возрастал. Более того, чем больше была вирусная нагрузка на клетки, тем сильнее индуцировалась аутофагия, демонстрируя лучшую выживаемость клеток летучих мышей по сравнению с клетками человека [12].
Этим противовирусный арсенал летучих мышей не исчерпывается. Исследования показали, что у рукокрылых произошли масштабные изменения в сигнальных путях противовирусных белков интерферонов (IFN). У млекопитающих описаны три типа IFN (I, II и III соответственно), различающиеся по своим аминокислотным последовательностям и рецепторам, через которые они передают сигнал. Интерфероны уничтожают вирусы не напрямую, а активируют сложные молекулярные каскады, приводящие к экспрессии десятков противовирусных генов. В процессе эволюции некоторые летучие мыши утратили часть генов интерферонов. Однако те интерфероны, которые они оставили себе, в частности три функциональных гена IFN-α, экспрессируются в их клетках постоянно, даже в отсутствие вирусной инфекции [13]. То есть интерфероновая защита рукокрылых находится в непрерывном состоянии switched on, выступая мощным фактором, сдерживающим размножение вирусов. Ко всему прочему у летучих мышей сокращено количество звеньев в каскадах индукции противовирусной защиты. В отличие от других млекопитающих их интерфероны напрямую индуцируют экспрессию рибонуклеазы L — фермента, расщепляющего все РНК, включая вирусные, в клетке [14]. Такое быстрое реагирование на вторжение вируса дополнительно повышает эффективность противовирусной защиты летучих мышей.
Недавно изучили профиль экспрессии генов врожденного иммунитета у клеток почки большого бурого кожана (Eptesicus fuscus) при заражении культуры вирусом MERS-CoV. Клетки летучей мыши выживали в течение 126 дней по сравнению с культурой клеток легких человека, погибавшей уже через несколько суток после заражения MERS-CoV . В отличие от клеток человека, где вирус подавлял активацию врожденного иммунитета, в клетках кожана он вызывал устойчивую экспрессию интерферона I, в частности IFN-β. Известно, что одним из ключевых молекулярных игроков в обеспечении противовирусной защиты клеток млекопитающих является регуляторный фактор интерферона 3 (IRF3). Авторы продемонстрировали, что в этом случае ему отведена принципиальная роль: когда уровень белка IRF3 был искусственно снижен путем РНК-интерференции, титр MERS-CoV в среде возрастал на порядок. Спустя 48 часов после обработки возрастала и гибель клеток летучих мышей [15].
Для проникновения в клетку MERS-CoV использует фермент дипептидилпептидазу-4, который экспонирован на поверхности большинства клеток организма, включая клетки легких и почек.
В этой работе ученым, по сути, удалось наблюдать коэволюцию вирусов и клеток-носителей. За время инкубации MERS-CoV приобрел мутацию ΔORF5, позволившую ему более эффективно реплицироваться в клетках летучих мышей. С другой стороны, клетки, постоянно инфицированные мутантом ΔORF5, были устойчивы к инфекции MERS-CoV дикого типа за счет снижения синтеза мембранного фермента дипептидилпептидазы-4, который необходим для проникновения вируса в клетку [15].
В том же году другой коллектив ученых, комбинируя эксперименты in vitro на клеточных линиях летучих мышей и компьютерное моделирование, изучил влияние иммунитета летучих мышей на динамику размножения вируса. Оказалось, постоянно активный IFN-путь защищает клетки от гибели, но, с другой стороны, часть вирусов все же надолго сохраняется в культуре клеток. Исследователи предполагают, что таким образом иммунная защита летучих мышей может стимулировать эволюцию вирусов, делая их устойчивее и потенциально смертоноснее. Хотя летучие мыши хорошо защищены от вредного воздействия своих собственных вирусов, для других животных встреча с такими вирусами может оказаться фатальной. «Отобранные» летучими мышами вирусы, способны проявить чрезвычайную вирулентность при распространении на хозяев, у которых отсутствует мощный сдерживающий противовирусный иммунитет, подобный иммунитету рукокрылых. Здесь, по-видимому, и кроется ответ на вопрос, почему именно летучие мыши часто являются естественным резервуаром смертельных для человека вирусов [16].
Однако гиперактивный врожденный иммунитет имеет свою жестокую цену. У млекопитающих при вирусных инфекциях непрерывное производство интерферонов, способно приводить к широкому неконтролируемому воспалению и опасным иммунопатологиям, например, к цитокиновому шторму. Для эффективного сдерживания вирусов летучим мышам потребовалось научиться решать эту проблему. Этому посвящена следующая важная особенность иммунной системы рукокрылых.
Урок #2: обуздай свое воспаление
Как уже говорилось, универсальной реакцией иммунной системы теплокровных для борьбы с инфекциями является общее повышение температуры тела. Наряду с этим в крови происходит увеличение числа лейкоцитов (лейкоцитоз). На примере складчатогуба Палласа (Molossus molossus) была исследована реакция иммунной системы на введение в организм липополисахарида. Липополисахарид представляет собой основной компонент внешней мембраны грамотрицательных бактерий, а его подкожное или внутривенное введение часто используется в исследовательских целях для того, чтобы спровоцировать сильное системное воспаление. К удивлению исследователей, летучие мыши не демонстрировали ни лейкоцитоза, ни лихорадки в отличие от других млекопитающих. Было зарегистрировано лишь небольшое снижение массы тела складчатогубов [17].
В 2018 году был проанализирован геном египетской летучей собаки (Rousettus aegyptiacus), переносчика вируса Марбург, родственного вирусу Эбола и также вызывающего у людей геморрагическую лихорадку. Оказалось, что летучие собаки имеют отличный от других млекопитающих набор рецепторов у естественных киллеров (NK-клеток) ― лимфоцитов, обеспечивающих врожденный иммунитет. Как это отражено в их названии, NK-клетки уничтожают инфицированные и раковые клетки в организме путем контактного цитолиза. Ответ естественного киллера опосредует баланс сигналов, поступающих как от активирующих рецепторов, которые способствуют уничтожению клетки-мишени, так и от ингибирующих рецепторов, которые подавляют активность NK-клеток. Оказалось, что репертуар рецепторов естественных киллеров летучих собак обогащен ингибирующими мотивами, а имеющиеся активирующие мотивы связаны со сниженной продукцией цитокинов. Это явно указывает на отбор в сторону ослабления провоспалительного ответа. Также было обнаружено, что два гена ингибирующих рецепторов, NKG2-13 и NKG2-14, экспрессируются на высоких уровнях в NK-клетках даже у неинфицированных животных. То есть у летучих собак «по умолчанию» активированы тормозные сигнальные пути в NK-клетках [18]. Спустя год на культуре дендритных клеток того же вида летучих собак было показано, что при заражении вирусом Марбург наблюдается с одной стороны активация интерферонового пути типа I и экспрессия противовирусных генов, с другой ― подавление экспрессии генов, связанных с адаптивным иммунным ответом. В культуре клеток человека, зараженных вирусом Марбург, наблюдалась обратная картина: шло сильное подавление IFN-связанных путей врожденного иммунитета [19].
Другое изменение, связанное с контролем воспаления у летучих мышей, касается одного из членов семейства ядерного фактора транскрипции kB (NF-kB) — c-Rel. Дело в том, что многие РНК-содержащие вирусы во время своей репликации образуют двухцепочечные молекулы РНК, которые совсем нехарактерны для здоровой клетки. Эти РНК распознаются специальными клеточными рецепторами, например, тем же TLR3, и запускают противовирусный ответ. В своей работе авторы использовали синтетический аналог двухцепочечной РНК — полиинозиновую-полицитидиловую кислоту (poly I:C), имитирующую вторжение вируса. На культуре клеток уже известного нам большого бурого кожана и культуре клеток человека с помощью полимеразной цепной реакции в реальном времени (qRT-PCR) исследователи отслеживали изменения количества транскриптов после воздействия. Обе культуры после стимуляции демонстрировали мощную экспрессию IFN-β, но, в отличие от клеток летучих мышей, человеческие клетки активно синтезировали провоспалительные цитокины TNF и интерлейкин-8. Изучив регуляторные последовательности гена TNF у человека и кожана, ученые обнаружили уникальный для летучих мышей фрагмент ДНК, связывающий белок c-Rel. Его удаление значительно повышало количество транскрипта TNF в клетках кожана, демонстрируя способность c-Rel подавлять его экспрессию. Таким образом, летучие мыши приобрели уникальный механизм снижения воспалительной реакции при вирусной инфекции [20].
Системное воспаление могут вызывать не только вирусные нуклеиновые кислоты, но и собственные фрагменты ДНК, оказавшиеся не в том месте. Это происходит, например, при сильном окислительном стрессе, который для рукокрылых в силу образа жизни стал делом привычным. Именно с этим связан следующий урок иммунной системы летучих мышей.
Урок #3: смирись с ДНК в цитозоле своем
Жизнь летучих мышей неразрывным образом связана с полетом, во время которого метаболические потребности организма скачкообразно возрастают. Это, в свою очередь, приводит к повышенной продукции активных форм кислорода и, как следствие, к повреждению ДНК и высвобождению ее фрагментов из ядра и митохондрий в цитоплазму [22]. Как правило, свободная ДНК в цитоплазме (как собственная, так и чужеродная) вызывает сильную иммунную реакцию, активирующую инфламмасому и сигнальный путь интерферона I. В 2013 году группа исследователей из BGI, китайской компании по секвенированию генома, выполнила полногеномное секвенирование с последующим сравнительным анализом двух отдаленно родственных видов рукокрылых: бавеанской летучей лисицы (Pteropus alecto) и степной ночницы (Myotis davidii). Они обнаружили сильное действие положительного отбора на гены, связанные с контролем повреждения ДНК. Кроме этого, оба вида утратили целое семейство генов PYHIN, непосредственно участвующее в распознавании микробной ДНК и образовании инфламмасомы [22]. Спустя три года провели генетический анализ еще восьми видов рукокрылых, относящихся к разным семействам, для семи из них была также показана полная потеря этого семейства генов. Авторы предположили, что в процессе адаптации к активному полету потеря семейства генов PYHIN позволила летучим мышам ограничить неконтролируемую воспалительную реакцию за счет снижения индукции интерферона типа I. У других же млекопитающих при обнаружении фрагментов ДНК в цитоплазме эту реакцию запускают те самые белки PYHIN [23].
Еще одно изменение в механизме рецепции цитоплазматической ДНК произошло у летучих мышей в ДНК-сенсоре cGAS—STING. В ответ на присутствие ДНК в цитоплазме белок cGAS образует циклический гуанозинаденозинмонофосфат (cGAMP) из ГТФ и АТФ, затем cGAMP связывается и активирует стимулятор генов интерферона (STING), индуцируя транскрипцию воспалительных генов. Оказалось, что в активном центре белка STING у летучих мышей произошла замена остатка серина на другую аминокислоту (у разных видов разную). У других млекопитающих серин в этом положении высоко консервативен. У летучих мышей же эта мутация фактически вывела из строя стимулятор генов интерферона STING. Обращение этой мутации путем генноинженерного введения серина в нужное положение восстанавливало функциональность STING у летучих мышей [21], .
Вера Горбунова, Андрей Селуянов и Брайан Кеннеди опубликовали в журнале Cell Metabolism обзор по этой теме, где в частности, коснулись многих описанных выше особенностей иммунной системы летучих мышей [24].
Обратная сторона противовирусной защиты летучих мышей
Как это всегда бывает в биологии, любая адаптация ― это компромисс между множеством факторов. Исключением не стала и способность рукокрылых сдерживать развитие вирусных инфекций. По-видимому, их иммунная система гораздо в меньшей степени приспособлена к борьбе с внеклеточными паразитами. Печальной иллюстрацией этого служит разгоревшаяся в начале XXI века эпидемия «синдрома белого носа» (WNS, white-nose syndrome) в Северной Америке. Сегодня WNS уносит миллионы жизней североамериканских летучих мышей, демонстрируя летальность свыше 90%. Возбудителем этого заболевания является психрофильный (холодолюбивый) гриб Pseudogymnoascus destructans, который заражает зверьков, находящихся в состоянии гибернации (рис. 3). При этом «синдром белого носа» не является системной инфекцией летучих мышей, гриб колонизирует кожные покровы животных в спячке, приводя к их эрозии. Это, в свою очередь, провоцирует частые пробуждения летучих мышей, истощение их жировых запасов, обезвоживание и в конечном итоге смерть [9], [25].

Рисунок 3. Малая бурая ночница (Myotis lucifugus), пораженная «синдромом белого носа»
Предполагается, что P. destructans был завезен в Северную Америку из Евразии, где коэволюционировал с летучими мышами в течение миллионов лет. Этот гриб обнаружен по всему евразийскому континенту и иногда вызывает легкие симптомы WNS у местных летучих мышей. Однако случаев массовой смертности в Старом Свете пока не наблюдалось. Сегодня «синдром белого носа» представляет собой одну из самых серьезных эпидемий диких животных, когда-либо зарегистрированных. В настоящее время не существует практических вариантов сдерживания распространения WNS в Северной Америке, инфекция стремительно распространяется по континенту. Интересно, что, эволюционируя как патоген, гриб утратил некоторые ключевые ферменты репарации ДНК, став чрезвычайно чувствительным к ультрафиолету. Эта обнаруженная уязвимость P. destructans в перспективе может быть использована для лечения летучих мышей с WNS [25].
Усугубляет проблему и то, что в кишечнике зараженных грибом животных наблюдалось в 60 раз больше коронавирусных частиц по сравнению с летучими мышами, не инфицированными грибом. Профиль экспрессии генов инфицированных животных явно свидетельствовал о подавлении врожденного противовирусного ответа. Таким образом, вторичные инфекции у летучих мышей могут значительно увеличивать потенциал распространения вирусов на других животных [26].
Известно, что эта болезнь может передаваться от летучих мышей внутри колонии, но до настоящего времени остается загадкой, каким образом гриб попадает из пещеры в пещеру. Мрачная ирония всей этой истории состоит в том, что, по-видимому, здесь мы поменялись местами, и именно человек выступает переносчиком смертоносной для летучих мышей инфекции.
Другие уроки
Появление трех коронавирусов зоонозного происхождения, вызвавших эпидемии менее чем за два десятилетия, подчеркивает роль изучения животных, являющихся их естественными резервуарами. Опыт развития этих эпидемий учит нас тому, насколько важно информировать людей избегать прямого контакта с дикими летучими мышами. Особенно это касается ситуации, творящейся на влажных рынках не только в Восточной Азии, но и по всему миру. На этих рынках тесный контакт между людьми и различными видами животных связан с серьезным риском переноса потенциально опасных вирусов от видов — естественных резервуаров к людям (рис. 4).

Рисунок 4. Прилавок с тушками летучих лисиц на одном из влажных рынков в Индонезии
Другой серьезный риск распространения вирусов летучих мышей связан с вырубкой лесов и интенсификацией животноводства. Зачастую такая вырубка приводит к уменьшению количества мест для ночевок рукокрылых. Летучие мыши начинают искать убежища в городах и деревнях, где контакт с человеком практически неизбежен. Незащищенность сельскохозяйственных животных от прямого контакта с летучими мышами, потребление ими фруктов, частично съеденных летучими мышами, прямой контакт с фекалиями летучих мышей ― все это также увеличивает риски перехода вирусов рукокрылых к человеку. Подливает масло в огонь и разразившаяся эпидемия «синдрома белого носа», которая увеличивает вирусную нагрузку на зараженных летучих мышей, выступая дополнительным фактором, провоцирующим переносы вирусов от рукокрылых к человеку.
В заключении хочется сравнить образ жизни летучих мышей и современного человека. Многие рукокрылые живут в колониях чрезвычайно высокой плотности и мигрируют на большие расстояния, когда нередки бывают контакты с разнообразными потенциальными патогенами [27]. Схожую ситуацию сегодня мы наблюдаем и в мегаполисах, где плотность населения очень высока, а люди, путешествуя по воздуху, регулярно преодолевают сотни километров. Однако мы эксплуатируем этот образ жизни менее 100 лет, в то время как летучие мыши живут так уже на протяжении 60–70 миллионов лет (рис. 5).

Рисунок 5. Адаптация к высокой плотности населения и воздушным путешествиям. Эволюция людей проходила в небольших группах. Однако за несколько столетий значительное количество людей переехало в крупные города. Массово летать мы научились чуть позже: воздушные путешествия стали для нас реальностью в последние 100 лет. Летучие мыши же эволюционировали в таких условиях в течение 60–70 миллионов лет.
[24], рисунок адаптирован
Иммунная система человека не эволюционировала для того, чтобы справляться с таким частым воздействием различных вирусов, что проявляется в нашей уязвимости для эпидемий [24]. Переносы вирусов от животных к человеку неоднократно происходили в прошлом. Например, те же коронавирусы, давно приобретенные человеческой популяцией, сегодня вызывают всем известные «обычные» острые респираторные заболевания [28]. Нет никаких сомнений, что вспышки заболеваний человека, вызванные распространением вирусов рукокрылых, будут продолжать случаться и в будущем. Увы, мы не можем ждать десятки миллионов лет, пока наш противовирусный иммунитет станет таким же эффективным, как у летучих мышей. Зато можем разработать действенные противовирусные препараты, опираясь на те решения, которые нашли рукокрылые для сдерживания своих вирусов миллионы лет назад.
Литература
- François Enchéry, Branka Horvat. (2017). Understanding the interaction between henipaviruses and their natural host, fruit bats: Paving the way toward control of highly lethal infection in humans. International Reviews of Immunology. 36, 108-121;
- Thomas J. O’Shea, Paul M. Cryan, Andrew A. Cunningham, Anthony R. Fooks, David T.S. Hayman, et. al.. (2014). Bat Flight and Zoonotic Viruses. Emerg. Infect. Dis.. 20, 741-745;
- Shu Yuan, Si-Cong Jiang, Zi-Lin Li. (2020). Analysis of Possible Intermediate Hosts of the New Coronavirus SARS-CoV-2. Front. Vet. Sci.. 7;
- Peng Zhou, Xing-Lou Yang, Xian-Guang Wang, Ben Hu, Lei Zhang, et. al.. (2020). A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 579, 270-273;
- Jian Shang, Gang Ye, Ke Shi, Yushun Wan, Chuming Luo, et. al.. (2020). Structural basis of receptor recognition by SARS-CoV-2. Nature. 581, 221-224;
- Smriti Mallapaty. (2020). Coronaviruses closely related to the pandemic virus discovered in Japan and Cambodia. Nature. 588, 15-16;
- Ben Hu, Xingyi Ge, Lin-Fa Wang, Zhengli Shi. (2015). Bat origin of human coronaviruses. Virol J. 12;
- Nicola Decaro, Alessio Lorusso. (2020). Novel human coronavirus (SARS-CoV-2): A lesson from animal coronaviruses. Veterinary Microbiology. 244, 108693;
- Cara E. Brook, Andrew P. Dobson. (2015). Bats as ‘special’ reservoirs for emerging zoonotic pathogens. Trends in Microbiology. 23, 172-180;
- Найти CpG-мотив, или Тонкая работа толл-подобного рецептора 9;
- Haiying Jiang, Juan Li, Linmiao Li, Xiujuan Zhang, Lihong Yuan, Jinping Chen. (2017). Selective evolution of Toll-like receptors 3, 7, 8, and 9 in bats. Immunogenetics. 69, 271-285;
- Eric Laing, Spencer Sterling, Dawn Weir, Chelsi Beauregard, Ina Smith, et. al.. (2019). Enhanced Autophagy Contributes to Reduced Viral Infection in Black Flying Fox Cells. Viruses. 11, 260;
- Peng Zhou, Mary Tachedjian, James W. Wynne, Victoria Boyd, Jie Cui, et. al.. (2016). Contraction of the type I IFN locus and unusual constitutive expression ofIFN-αin bats. Proc Natl Acad Sci USA. 113, 2696-2701;
- Pamela C. De La Cruz-Rivera, Mohammed Kanchwala, Hanquan Liang, Ashwani Kumar, Lin-Fa Wang, et. al.. (2018). The IFN Response in Bats Displays Distinctive IFN-Stimulated Gene Expression Kinetics with Atypical RNASEL Induction. J.I.. 200, 209-217;
- Arinjay Banerjee, Sonu Subudhi, Noreen Rapin, Jocelyne Lew, Richa Jain, et. al.. (2020). Selection of viral variants during persistent infection of insectivorous bat cells with Middle East respiratory syndrome coronavirus. Sci Rep. 10;
- Cara E Brook, Mike Boots, Kartik Chandran, Andrew P Dobson, Christian Drosten, et. al.. (2020). Accelerated viral dynamics in bat cell lines, with implications for zoonotic emergence. eLife. 9;
- Sebastian Stockmaier, Dina K. N. Dechmann, Rachel A. Page, M. Teague O'Mara. (2015). No fever and leucocytosis in response to a lipopolysaccharide challenge in an insectivorous bat. Biol. Lett.. 11, 20150576;
- Stephanie S. Pavlovich, Sean P. Lovett, Galina Koroleva, Jonathan C. Guito, Catherine E. Arnold, et. al.. (2018). The Egyptian Rousette Genome Reveals Unexpected Features of Bat Antiviral Immunity. Cell. 173, 1098-1110.e18;
- Joseph Prescott, Jonathan C. Guito, Jessica R. Spengler, Catherine E. Arnold, Amy J. Schuh, et. al.. (2019). Rousette Bat Dendritic Cells Overcome Marburg Virus-Mediated Antiviral Responses by Upregulation of Interferon-Related Genes While Downregulating Proinflammatory Disease Mediators. mSphere. 4;
- Arinjay Banerjee, Noreen Rapin, Trent Bollinger, Vikram Misra. (2017). Lack of inflammatory gene expression in bats: a unique role for a transcription repressor. Sci Rep. 7;
- Jiazheng Xie, Yang Li, Xurui Shen, Geraldine Goh, Yan Zhu, et. al.. (2018). Dampened STING-Dependent Interferon Activation in Bats. Cell Host & Microbe. 23, 297-301.e4;
- G. Zhang, C. Cowled, Z. Shi, Z. Huang, K. A. Bishop-Lilly, et. al.. (2013). Comparative Analysis of Bat Genomes Provides Insight into the Evolution of Flight and Immunity. Science. 339, 456-460;
- Matae Ahn, Jie Cui, Aaron T. Irving, Lin-Fa Wang. (2016). Unique Loss of the PYHIN Gene Family in Bats Amongst Mammals: Implications for Inflammasome Sensing. Sci Rep. 6;
- Vera Gorbunova, Andrei Seluanov, Brian K. Kennedy. (2020). The World Goes Bats: Living Longer and Tolerating Viruses. Cell Metabolism. 32, 31-43;
- Jonathan M. Palmer, Kevin P. Drees, Jeffrey T. Foster, Daniel L. Lindner. (2018). Extreme sensitivity to ultraviolet light in the fungal pathogen causing white-nose syndrome of bats. Nat Commun. 9;
- Sonu Subudhi, Noreen Rapin, Vikram Misra. (2019). Immune System Modulation and Viral Persistence in Bats: Understanding Viral Spillover. Viruses. 11, 192;
- Tony Schountz, Michelle L. Baker, John Butler, Vincent Munster. (2017). Immunological Control of Viral Infections in Bats and the Emergence of Viruses Highly Pathogenic to Humans. Front. Immunol.. 8;
- Откуда появились человеческие коронавирусы?.