
Увидевший вирусы в раке. Харальд цур Хаузен
18 октября 2015
Увидевший вирусы в раке. Харальд цур Хаузен
- 3987
- 0
- 2
-
Автор
-
Редакторы
Этот человек родился в фашистской Германии, выжил в бомбежках союзников, работал в Америке, но там ему не понравилось — потому что нравилось ему заниматься только тем, чем он хочет. Именно он доказал, что некоторые виды рака вызываются вирусами. Ему пришлось ждать своей премии четверть века, но и поныне он активен и привлекает новых и новых людей в науку. Речь сегодня пойдет о «медицинском» нобелевском лауреате 2008 года — Харальде цур Хаузене. Формулировка Нобелевского комитета: «за открытие вируса папилломы человека как причины цервикального рака».
Вместо предисловия к биографии нашего героя я хочу сделать признание. Я, конечно, стараюсь быть историком науки, беспристрастно анализировать все... Но для меня все Нобелевские премии по физике, химии и медицине всегда будут делиться на две неравные части: премии до 2006 года и премии с 2006 года включительно. Нет, конечно, можно пофантазировать о том, что я доживу до 2110 года и вот тогда эти части будут равными... Но, положа руку на сердце, — вряд ли. Тем не менее деление это именно таково.
Почему так? Потому что обо всех премиях «моложе» 2006 года я писал сразу же после их присуждения как научный журналист и научный блогер. И вот теперь, «набив» руку на первых десятках лауреатов из первой, большей, части списка, я с неким волнением приступаю к первому герою из второй, меньшей, но уже с личной историей. Итак, знакомьтесь: человек, ставший в один ряд с первооткрывателями вируса иммунодефицита человека (ВИЧ), вирусолог, еще раз показавший, что некоторые виды рака — это инфекционные заболевания. Харальд цур Хаузен собственной персоной...
Наш герой родился в 1936 году в Третьем рейхе, и его детские воспоминания были воспоминаниями о войне. Конечно, в начале войны положение Харальда было комфортным, и ребенок мог развивать свой интерес к живой природе, изучая местных животных и растения, однако с 1943 года его родной Гельзенкирхен начали активно бомбить. По его собственным словам [1], это сильно повредило образованию, и когда он все-таки поступил в гимназию, пробелы начали ощущаться особенно сильно. Закончил школу он тоже поздно — в 1955 году, в 19 лет, уже в Северной Германии, куда его родители переехали в 1950 году.
После окончания школы Харальд был типичным «юношей, обдумывающим житье» — какое-то время он не мог выбрать, куда ему пойти. Его влекло то, что сейчас называется Life sciences, но тогда существовала жесткая граница между «мед» и «био». Цур Хаузен выбрал медицину и поступил на медицинский факультет университета в Бонне. Однако все равно параллельно посещал курсы по биологии.
Но несмотря на то, что герой нашей статьи твердо решил посвятить свою жизнь фундаментальной медицинской науке, он счел необходимым получить статус MD — то есть практикующего врача. В связи с этим его ждали одновременно в Университете Гамбурга и в Дюссельдорфской медицинской академии.

Рисунок 1. Молодой цур Хаузен с лаборантками в лаборатории Хенле (Филадельфия, 1967 г.)
Конец 1960 года. Цур Хаузен теперь уже настоящий доктор, однако он решает быть честным перед собой — и проходит еще два года интернатуры. Хирургия, внутренние болезни и — в самом конце — акушерство и гинекология. Это ему понравилось больше всего. Видимо, уже тогда он обратил внимание на папиллому и рак шейки матки.
Окончив интернатуру, молодой врач наконец-то отправился заниматься наукой — на кафедру медицинской микробиологии и иммунологии Университета Дюссельдорфа, созданного на основе местной медицинской академии.
С радостью он бросился в мир науки и... начал задумываться, а не вернуться ли к медицинской практике. Точно больше денег и, возможно, не так скучно. Вероятно, юного сотрудника долго и нудно мучили теорией, потому что как только цур Хаузен перешел к экспериментам, его «отпустило». Поначалу он занимался вызванными вирусами хромосомными модификациями и одновременно получал новые знания по только нарождавшимся в те годы диагностическим вирусологии и бактериологии.
Тем не менее скоро стала понятна и еще одна причина сомнений нашего героя: не прошло и четырех лет в Дюссельдорфе, как он «уперся» в потолок. Он получил в науке все, что можно было взять в Германии, но этого Харальду было мало. Он всерьез задумался над хорошей позицией постдока, причем в США. Ну, не только в СССР все смотрели «на запад».
Предварительно женившись в 1964 году и родив сына (не сам — жена рожала, конечно, и спешка была, в общем, резонной — во время интенсивной работы постдоком не до этого), в конце 1965 года цур Хаузен переехал в Филадельфию и начал работу в лаборатории Вернера Хенле (рис. 1), где изучали открытый незадолго до этого вирус Эпштейна — Барр (рис. 2а).
Лаборатория занималась разработкой тестов на этот вирус и поиском связи его с другими заболеваниями. Цур Хаузена засадили за работу, хотя, судя по его автобиографии, работать с этим вирусом ему не очень нравилось. Ему даже разрешили поработать с другим вирусом — аденовирусом 12 типа. Но, несмотря на это, именно наш герой продемонстрировал Хенле связь вируса со злокачественной лимфомой Бёркитта (рис. 2б).
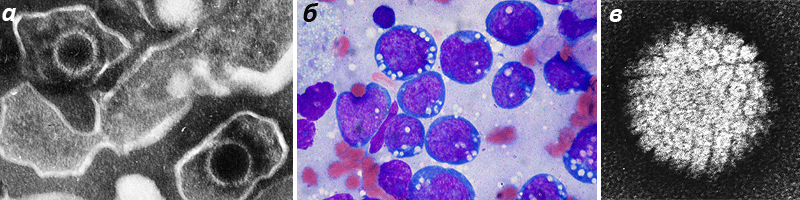
Рисунок 2. Объекты исследования Х. цур Хаузена. а — Две округлые частицы вируса Эпштейна — Барр (122-180 нм) под электронным микроскопом. ДНК вируса кодирует особые белки, позволяющие отсрочить апоптоз пораженной клетки до перехода в стадию латентной инфекции, нередко вызывающей злокачественную трансформацию клетки-хозяина (например, В-лимфоцита). б — Окрашенный препарат лимфомы Бёркитта. Опухоль развивается из трансформированных В-лимфоцитов, быстро прогрессирует и распространяется за пределы лимфатической системы. Характерна преимущественно для Центральной Африки, где и была впервые описана британским хирургом и пропагандистом насыщенного клетчаткой рациона Дэнисом Бёркиттом в 1958 году. Эндемический («африканский») вариант болезни связан с патологическим действием на В-лимфоциты вируса Эпштейна — Барр. Малярия, распространенная в тех местах, снижает устойчивость к вирусу. В случае спорадической («неафриканской») лимфомы связь с вирусом менее очевидна. Ассоциированный с иммунодефицитом вариант иногда развивается после трансплантаций, на фоне приема иммунодепрессантов, а часто — как дебютное проявление СПИДа. В любом случае в клетках опухоли обнаруживают хромосомные транслокации, приводящие к нарушению экспрессии транскрипционного фактора c-Myc. в — Вирус папилломы человека (ВПЧ) под электронным микроскопом. Это маленькая двадцатигранная частица диаметром 52-54 нм. Вирусные частицы содержат одну циклическую молекулу ДНК (~ 8 т. п. н.) в оболочке из 72 звездчатых капсомеров. Особые типы ВПЧ обнаруживаются у 99,7% пациенток с раком шейки матки. Эти типы после встраивания собственной ДНК в геном клетки-хозяина экспрессируют онкогены E6 и E7, нарушая работу «противоопухолевых» белков p53 и pRb.
«Википедия»
Единственным плюсом работы в Америке цур Хаузен называет освоение новых методов работы. Но как только в 1968 году он получил приглашение от Эберхарда Беккера, который возглавил только что основанный в Университете Вюрцбурга Институт вирусологии, с предложением создать свою собственную исследовательскую группу, Харальд сразу же (ну ладно, не сразу — в начале 1969 года) вернулся в Германию.
Как ни странно, но, создав свою группу, цур Хаузен продолжил изучение вируса Эпштейна — Барр. Видимо, все дело было в том, что теперь никто не указывал ему, что делать, и не приходилось сдерживать в себе желание сказать, куда нужно указующему пойти.
И результат был потрясающий — уже к концу года он продемонстрировал, что во всех вариантах клеточных линий лимфомы Бёркитта содержится вирусная ДНК. ДНК вируса Эпштейна — Барр.
Для дальнейших своих экспериментов с поиском вирусов в раковых клетках цур Хаузен использовал технику гибридизации вирусной ДНК in situ. Вот в чем ее суть: РНК-зонд (транскрипт вирусной ДНК), меченный флуоресцентной или радиоактивной меткой, добавляют в препарат биопсии опухолевой ткани. РНК образует прочный комплекс (как говорят — гибридизуется) с вирусной ДНК, содержащейся в ткани. Образовавшийся комплекс легко обнаружить флуоресцентным микроскопом или методом авторадиографии.
В начале 1970-х цур Хаузен вспомнил о своей акушерской юности и о цервикальном раке, с которым он сталкивался как врач. И здесь он тоже решил поискать вирусы герпеса — раз уж повезло с одним раком, можно поискать вирусы и в другом. Однако вирус не находился.
Как акушер, Харальд знал, что во влагалище и в шейке матки изменения вызывает и другой вирус — вирус папилломы человека (ВПЧ, HPV). Да, он считался безобидным. Да, он вызывает только похожие на бородавки образования (кондиломы). Но вдруг?
Первый эксперимент прошел в 1974 году — и неудача. Никакого вируса в клетках цур Хаузен не увидел, ничего не засияло в поле зрения микроскопа. Однако Харальд, во-первых, не отчаялся, а во-вторых, опубликовал результаты своей неудачи, предположив, что есть несколько разновидностей вируса, и что РНК одной разновидности не гибридизуется с ДНК другой.
И именно благодаря публикации отрицательного результата, по-хорошему, цур Хаузен и получил Нобелевскую премию. Потому что первыми ВПЧ в клетках увидели канадцы. Причем — именно увидели: в 1976 году они сфотографировали при помощи электронного микроскопа вирус папилломы в опухолевых клетках (рис. 2в). Ну а дальше пошло-поехало. В 1977 году в лаборатории нашего героя из бородавок выделили три типа ВПЧ, а в 1979 году удалось найти и клонировать ДНК вируса, вызывающего генитальные кондиломы: ВПЧ-6. Эту ДНК использовали в качестве зонда для поиска онкогенных вариантов, но «поймали» тоже кондиломный ВПЧ-11. И уже с его помощью в 1983 году удалось отловить первый онкогенный вирус, 16-го типа, а через год и второй — ВПЧ-18... Сейчас известно более сотни генотипов вируса папилломы человека, но только два из них — ВПЧ-16 и ВПЧ-18 — вызывают более 70 % случаев аногенитального рака у обоих полов [2].
Параллельно с открытиями приходит и новая ответственность. Раз Харальд цур Хаузен — человек, сказавший новое слово в исследовании рака, то ему и возглавлять Германский Центр по исследованию рака. В 1983 году цур Хаузен принимает новое учреждение под свое крыло и работает в нем ровно два десятка лет. В 2003 году он выходит в отставку, оставив себе свою лабораторию и должность главного редактора журнала International Journal of Cancer, на которую заступил тремя годами ранее.
Нобелевская премия пришла в 2008 году [3]. Наш герой получил половину суммы, вторую разделили между собой Люк Монтанье и Франсуаза Барре-Синусси — первооткрыватели вируса иммунодефицита человека (рис. 3). Так Нобелевский комитет в XXI веке наградил одни из самых важных достижений вирусологии века двадцатого. Любопытно, что каждому из лауреатов пришлось ждать своей премии почти четверть века. Впрочем, для нынешних премий это далеко не рекорд. Вспомним Джона Гёрдона [4], ждавшего награды почти полвека или Петра Капицу, потроллившего Нобелевский комитет началом своей нобелевской лекции, заявив, что свои работы по открытию сверхтекучего гелия он за сорок лет забыл, так что слушайте, пожалуйста, про термоядерные реакции...

Рисунок 3. Нобелевские лауреаты 2008 года. Слева — Коллективный фотопортрет, цур Хаузен — второй справа. Справа — Момент вручения награды цур Хаузену.
Впрочем, почти 80-летний лауреат и ныне активен . Он пользуется своим новым статусом для того, чтобы привлекать средства в исследования рака, чтобы читать популярные лекции и заниматься просвещением. Вполне достойный выбор для вершины карьеры ученого.
А результатам его трудов предстояло не раз «воскреснуть» в полезных фармразработках: с 2006 года начали применять первую вакцину от ВПЧ (типов 6, 11, 16, 18) «Гардасил» — детище Merck, в 2009 — вторую, производства GlaxoSmithKline, «Церварикс» (против типов 16 и 18), а в 2014 вышел девятивалентный апгрейд первой вакцины («Гардасил-9»), предупреждающий инфицирование еще и вирусами типов 31, 33, 45, 52, 58.
Вообще, из 170 типов ВПЧ с высоким риском развития неоплазии связывают лишь следующие варианты (они передаются половым путем, и чем беспорядочнее половая жизнь, тем риск выше): 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82. Причем вирусы, провоцирующие появление кондилом, к аногенитальному раку обычно не имеют отношения. Инфицирование даже онкогенными вариантами в большинстве случаев ни к чему дурному не приводит, но в некотором проценте случаев вирус персистирует и вызывает трансформацию эпителиальных клеток. Обнаружение атипичных клеток (в «мазке на онкоцитологию», или ПАП-тесте) — тоже не приговор, но повод насторожиться, провести кольпоскопию (возможно, и биопсию) и избавиться от них.
Считается, что существующие вакцины могут обеспечить почти 100%-ную защиту от ВПЧ, белки которых представлены в препарате. Кстати, «Гардасил» частично (до 38%) эффективен и для предупреждения рака, вызываемого другими онкогенными ВПЧ. Но все это не так безусловно, как иногда экзальтированно представляют в СМИ имеющие отношение к медицине лица. Девушка или юноша (в зрелом возрасте эти вакцины как противораковые не эффективны), с одной стороны, в идеале еще не должны вести половую жизнь, то есть не должны подцепить вирус до развития поствакцинального иммунитета, а с другой — задолго до сáмого рискованного периода прививать тоже нельзя: доказанная продолжительность защитного действия — примерно 6 лет. А протоколы повторной вакцинации не прописаны... Существуют и методологические расхождения, но это не страшно: в большинстве стран вводят препарат в три этапа, в некоторых — в два (так в 2014 году рекомендовала ВОЗ для девочек младше 15 лет — и экономически ощутимо, и побочек, связанных с инъекцией, меньше).
Ну и самое главное: ни в коем случае нельзя полностью полагаться на вакцину, ведь заразиться можно совсем другим, но тоже онкогенным типом ВПЧ (или даже несколькими), да и за «пожизненность» полученного иммунитета никто не поручится. Потому «золотым стандартом» все же должен остаться ПАП-тест — вне зависимости от того, привит ли человек. Со временем, возможно, удастся избавиться от указанных вакцинных «шероховатостей» — если фармкомпании скорректируют свои аппетиты и больше внимания уделят эффективности и безопасности препаратов, а не скорейшей компенсации затрат. Кстати, большие претензии научное сообщество предъявило к агрессивной и не совсем адекватной маркетинговой политике производителей вакцин против ВПЧ (Merck, в частности): вроде как не очень у них с целеполаганием и медицинской этикой [5]. Хотя достоинства самих этих вакцин очевидны, наверное, всегда лучше почитать, поразмышлять и оценить целесообразность в каждом конкретном случае, не следуя слепо совету врача — поликлинического или телевизионного. — Ред.
Литература
- Биография Х. цур Хаузена. Сайт Нобелевского комитета;
- Muñoz N., Bosch F.X., De Sanjosé S., Herrero R., Castellsagué X., Shah K.V. et al. (2003). Epidemiologic classification of human papillomavirus types associated with cervical cancer. N. Engl. J. Med. 348 (6), 518–527;
- Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Rothman S.M. and Rothman D.J. (2009). Marketing HPV vaccine: implications for adolescent health and medical professionalism. JAMA. 302 (7), 781–786.






