
В лунном свете, или Тайная жизнь Ku-антигена
21 октября 2014
В лунном свете, или Тайная жизнь Ku-антигена
- 1348
- 0
- 1
Ku-антиген играет первую скрипку в наиболее распространенном механизме «ремонта» двуцепочечных разрывов ДНК. Однако у этого белка есть «тайная жизнь»: множество разнообразных дополнительных функций, связанных и не связанных с ДНК. Как пониженная, так и повышенная активность Ku-антигена способствует развитию раковых заболеваний.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: ДНК — основное хранилище генетической информации всех живых организмов — подвержена постоянному воздействию разнообразных химических и физических факторов, в результате её структура может нарушиться. Под действием ионизирующего излучения возникают двуцепочечные разрывы — самые опасные повреждения ДНК. В наиболее распространенном механизме «ремонта» таких повреждений главную роль играет Ku-антиген. Кроме того, этот белок имеет множество других удивительных «талантов», изучение которых в настоящее время продолжается. Исследование механизмов взаимодействия Ku-антигена с ДНК дало возможность разработать новый метод регистрации этого антигена, имеющий важные применения в клинике и исследовательской работе.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Своя работа».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
На заре молекулярной биологии считалось, что каждый ген кодирует один белок, а каждый белок выполняет одну функцию. Эта догма господствовала несколько десятилетий, однако в 1980-х годах был открыт альтернативный сплайсинг, и в то же время было установлено, что некоторые белки являются многофункциональными. Среди них можно выделить белки, имеющие одну основную функцию, а также несколько дополнительных, которые зачастую никак не связаны с основной. Такие белки в русскоязычной литературе называют «работающими по совместительству», а в англоязычной — красивым термином moonlighting. Когда белки, работающие по совместительству, были впервые описаны, они считались редкостью, но впоследствии такое свойство было показано для сотен белков разных видов живых организмов. Можно сказать, что обнаружение новых функций у известных белков в последнее время стало тенденцией.
Изнанкой как луна, лицом как солнце
В качестве подзаголовков используются пословицы со словом «луна». — Прим. авт.
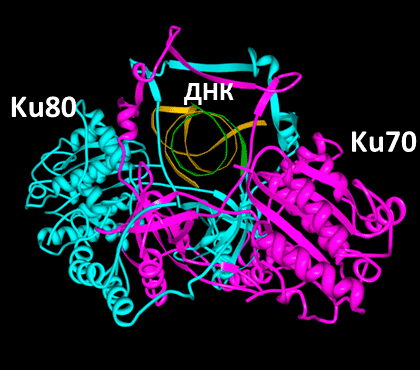
Рисунок 1. Структура Ku-антигена напоминает висячий замок, «надетый» на ДНК
Один из наиболее известных белков с множеством талантов — Ku-антиген, присутствующий практически у всех живых организмов. Ku-антиген человека представляет собой гетеродимер, состоящий из двух субъединиц с молекулярными массами около 70 кДа (Ku70) и 83 кДа (Ku80) (рис. 1). Соединенные друг с другом, они образуют структуру, напоминающую висячий замóк с массивным телом и тонкой дужкой или плетеную корзину с ручкой. Этот «замок» надевается на свободные двуцепочечные концы ДНК и перемещается по ДНК, словно бусина на нитке [1]. Ku-антиген играет ключевую роль в процессе репарации («ремонта») двуцепочечных разрывов в ДНК путем негомологичного соединения концов (НГСК). Двуцепочечные разрывы, возникающие под действием ионизирующего излучения и лекарственных препаратов-радиомиметиков, — самые опасные повреждения ДНК, поскольку они приводят к потере генетической информации и хромосомным перестройкам. Даже одно такое повреждение может вызвать гибель клетки. Кроме того, рядом с разрывом могут появиться дополнительные повреждения, в результате чего возникает так называемое кластерное повреждение, которое практически невозможно исправить без серьезного ущерба для ДНК (рис. 2). Поэтому очень важно, чтобы двуцепочечный разрыв был быстро «отремонтирован». Для этого в клетках используется два основных механизма: гомологичная рекомбинация (в активно делящихся клетках, где в качестве матрицы для повторного синтеза участка ДНК используется его копия) и НГСК (менее точный, но более универсальный способ, рис. 3). В процессе НГСК две молекулы Ku-антигена, подобно двум половинкам магнитной застежки, сближают двуцепочечные концы ДНК в месте разрыва, удерживают их во время репарации и служат «платформой» для других белков репарации двуцепочечных разрывов [1]. Может показаться, что Ku-антиген выполняет только эту функцию, ведь его уникальная структура как нельзя лучше подходит именно для неё. Но не всё так просто. Оказалось, что Ku-антиген по совместительству «подрабатывает», и о его «тайной жизни» постоянно появляются всё новые и новые факты.
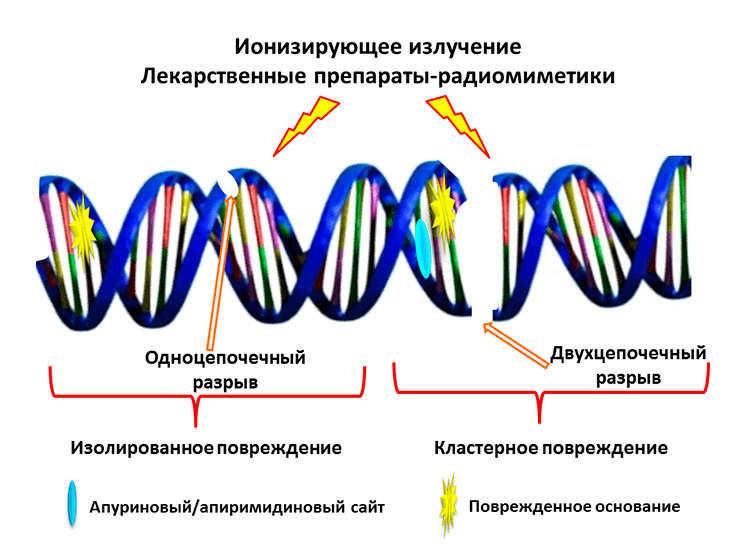
Рисунок 2. Ионизирующее излучение и лекарственные препараты-радиомиметики вызывают двуцепочечные разрывы ДНК и сложные кластерные повреждения
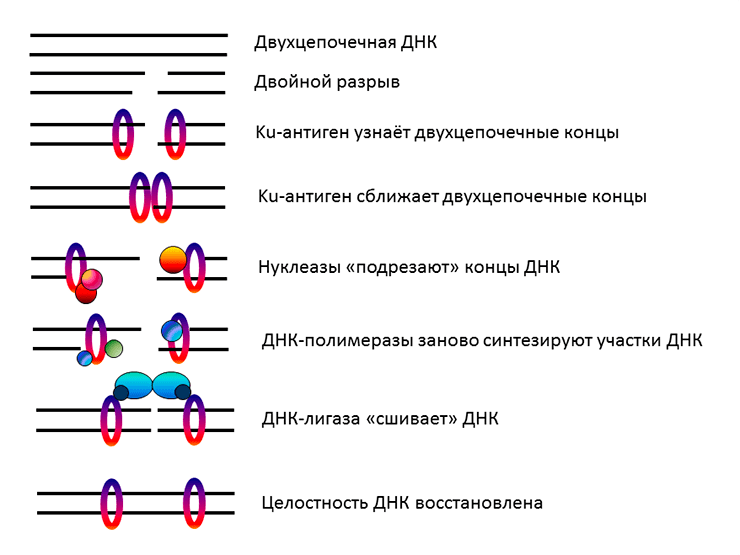
Рисунок 3. Упрощенная схема репарации двуцепочечных разрывов ДНК путем негомологичного соединения концов
Взойдет луна — увидит весь мир
Дополнительные функции Ku-антигена очень многообразны и охватывают многие важные клеточные процессы [2] (рис. 4). Некоторые из этих функций прямо или косвенно связаны с основной — репарацией двуцепочечных разрывов. Такие разрывы могут не только возникать в ДНК клеток под действием повреждающих агентов, но и «намеренно» создаваться специальными ферментами в ходе V(D)J-рекомбинации. Этот процесс происходит во время дифференцировки иммунных клеток, и в ходе него формируются популяции клеток, содержащих различные сочетания сегментов гена, кодирующего вариабельную часть антител; таким образом достигается первичное разнообразие антител. Здесь Ku-антиген занимается «ремонтом» двуцепочечных разрывов ДНК, участвуя в «сшивании» сегментов гена в разных сочетаниях. Поэтому если работа Ku-антигена нарушена, может возникнуть тяжелый комбинированный иммунодефицит. Ku-антиген участвует еще в нескольких процессах, связанных с поддержанием структуры ДНК. Он регулирует репликацию, транскрипцию и петлевую укладку хроматина. Интересно, что в этих случаях не возникает двуцепочечных разрывов ДНК, но происходит легкое плавление двойной спирали. Кроме того, Ku-антиген способствует поддержанию целостности теломер. Но эта функция имеет «обратную сторону»: раковые клетки могут многократно делиться как раз за счет того, что длина их теломер поддерживается на постоянном уровне.
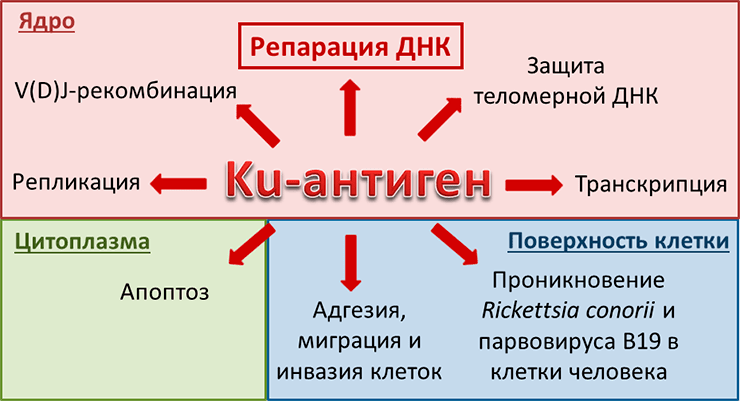
Рисунок 4. Разнообразные функции Ku-антигена в ядре, цитоплазме и на поверхности клетки
Однако Ku-антиген может работать не только в клеточном ядре, где ему полагается находиться по роду своей основной деятельности, но и в цитоплазме, и даже на поверхности клетки! Ku70 (одна из двух субъединиц Ku-антигена), находясь в цитоплазме, участвует в регуляции апоптоза. Ku70 может связываться с белком Bax, не давая ему переместиться в митохондрии и тем самым запустить апоптоз. Интересно, что Ku70 может не только предотвращать апоптоз, но и способствовать ему, удаляя остатки убиквитина с Bax. Ku-антиген, находящийся на внешней поверхности клетки и связанный с цитоплазматической мембраной, участвует в клеточной адгезии, миграции и инвазии, и таким образом способствует распространению метастазов при развитии рака. Кроме того, Ku-антиген способствует проникновению в клетку бактерии Rickettsia conorii и парвовируса B19. Таким образом, Ku-антиген может выполнять не только «полезные» для клетки функции, но и «вредные».
Когда нет солнца, то и луна светит
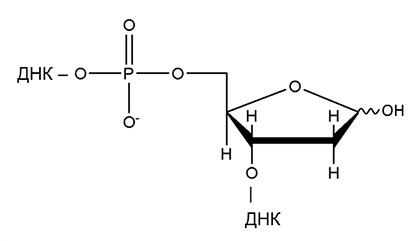
Рисунок 5. Апуриновый/апиримидиновый сайт (циклическая форма)
В Лаборатории биоорганической химии ферментов ИХБФМ СО РАН было установлено, что Ku-антиген взаимодействует апуриновыми/апиримидиновыми (АП-) сайтами, возникающими в клетках в результате спонтанного или катализируемого ферментами гидролиза N-гликозидной связи между азотистым основанием и дезоксирибозой в ДНК (рис. 5). Такие повреждения ДНК — одни из наиболее распространенных, и появляются в клетке с частотой 10–50 тысяч в сутки [3]. АП-сайты мутагенны и цитотоксичны. Мы обнаружили, что Ku-антиген может образовывать основание Шиффа (нестабильный ковалентный интермедиат, рис. 6) с АП-сайтом, находящимся в середине ДНК-дуплекса [4]. Скорее всего, такое взаимодействие имеет защитную или регуляторную функцию. Дело в том, что АП-сайты в ДНК могут расщепляться спонтанно или под действием некоторых белков, в результате чего на их месте образуются одноцепочечные разрывы. В случае, если несколько АП-сайтов находятся на небольшом расстоянии друг от друга в разных цепях ДНК, может образоваться двуцепочечный разрыв — намного более опасное повреждение. Таким образом, связываясь с АП-сайтом, Ku-антиген может защищать его от расщепления другими белками и привлекать белки, ответственные за его «ремонт».
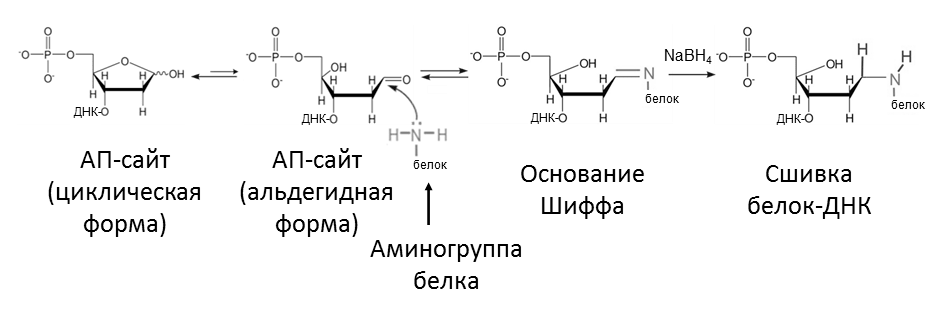
Рисунок 6. Схема сшивки белков с ДНК под действием NaBH4
За репарацию АП-сайтов обычно отвечают белки системы эксцизионной репарации оснований (ЭРО). В большинстве случаев репарация АП-сайтов начинается с гидролиза фосфодиэфирной связи с 5′-стороны от АП-сайта — катализирует этот процесс апуриновая/апиримидиновая эндонуклеаза 1. АП-сайты также могут расщепляться ДНК-гликозилазами, имеющими АП-лиазную активность (в этих случаях происходит расщепление фосфодиэфирной связи с 3′-стороны от АП-сайта) [5]. Однако при некоторых условиях в клетке может быть недостаток этих ферментов ЭРО или их активность может быть слабой. Как осуществляется репарация АП-сайтов в таких случаях? Наши американские коллеги установили, что Ku-антиген может расщеплять АП-сайты, и таким образом инициировать альтернативный путь их репарации [6]. Но эта его активность очень специфична: он расщепляет только АП-сайты, находящиеся вблизи концов ДНК, преимущественно в одноцепочечных выступающих 5′-концах. Зачастую концы ДНК в местах двуцепочечных разрывов бывают «грязными», так как содержат одноцепочечные фрагменты и различные дополнительные повреждения, чаще всего АП-сайты. ДНК-лигаза не может «сшить» такие концы. Поэтому АП-лиазная активность Ku-антигена, вероятно, используется для подготовки концов ДНК к лигированию. Если же АП-сайт находится далеко от концов ДНК, он не попадает в «зону ответственности» Ku-антигена, и за его репарацию отвечают ферменты ЭРО.
На этом наше научное соперничество с американцами не закончилось. Недавно мы показали, что Ku-антиген может расщеплять и АП-сайты, находящиеся далеко от концов ДНК. Для этого АП-сайт должен находиться в двуцепочечном фрагменте ДНК, окруженном длинными одноцепочечными 5′- и 3′-концами [7]. При этом Ku-антиген еще и проявляет специфичность к азотистому основанию напротив АП-сайта, предпочитая тимин или цитозин. Иными словами, Ku-антиген преимущественно расщепляет апуриновые сайты (то есть образовавшиеся в результате потери аденина или гуанина). И хотя известно, что апуриновые сайты возникают в ДНК намного чаще, чем апиримидиновые, причины такой специфичности Ku-антигена нам пока ещё непонятны. Возможно, молекулярное моделирование поможет пролить свет на эту проблему. Необходимы дальнейшие исследования, чтобы определить, как соотносятся функции Ku-антигена в репарации двуцепочечных разрывов и АП-сайтов [8].
И на луне пятна, и у розы шипы
Полученные данные о взаимодействии Ku-антигена с АП-сайтами можно использовать на практике, чтобы определять содержание этого белка в экстрактах клеток человека. Зачем же нужно его «ловить»? Несмотря на все «положительные качества» Ku-антигена, его повышенная активность в клетках может быть вредной. Дело в том, что для терапии рака часто используется ионизирующее излучение, вызывающее двуцепочечные разрывы ДНК, за репарацию которых отвечает Ku-антиген. В клетках некоторых типов опухолей, например В-клеточной хронической лимфоидной лейкемии, содержание Ku-антигена повышено, что приводит к усилению процессов репарации ДНК. В результате устойчивость этих раковых клеток к ионизирующему излучению и другим генотоксическим агентам повышается, и противоопухолевая терапия становится неэффективной. Пониженная активность Ku-антигена тоже не приводит ни к чему хорошему. Так, в клетках множественной миеломы понижено содержание нормальной формы Ku80 и повышено — его укороченной формы, Ku80v, что приводит к блокированию начальных стадий репарации двуцепочечных разрывов.
Кроме того, уровень Ku-антигена может служить маркером эффективности перепрограммирования дифференцированных клеток в индуцированные плюрипотентные стволовые клетки (ИПСК) . Для эффективного использования ИПСК в терапии необходимо обеспечивать поддержание целостности генома этих клеток для предотвращения негативных эффектов, в частности онкотрансформации. Поскольку перепрограммирование не является полностью контролируемым событием, необходимо для всех линий ИПСК, получаемых в терапевтических целях, определять статус стабильности генома. Недавно было показано, что в ИПСК человека уровень белка Ku70 повышен по сравнению с дифференцированными клетками, что потенциально позволяет использовать уровень экспрессии Ku70 в качестве маркера эффективности репрограммирования клеток.
ИПСК являются одной из надежд современной молекулярной медицины и объектом, за который в 2012 году была вручена Нобелевская премия по физиологии и медицине [9], [10]. — Ред.
Палец, указывающий на луну, не есть луна
Для регистрации Ku-антигена в клетках человека в настоящее время используется два основных подхода: ОТ-ПЦР в реальном времени и иммуноферментный анализ (рис. 7). С помощью ОТ-ПЦР можно лишь определить количество матричной РНК, по которой синтезируется белок, в анализируемом материале. Поэтому данный метод не позволяет оценить количество активного белка в клетке и установить факт наличия его укороченной формы Ku80v, неактивной в репарации, поскольку она синтезируется по той же матрице, что и «обычная» форма. Иммуноферментный анализ тоже не дает информации о том, активен ли детектируемый белок. Благодаря обнаруженной нами способности Ku-антигена образовывать ковалентные комплексы с АП-сайтами, стало возможным разработать принципиально иной метод регистрации этого белка прямо на его «рабочем месте» — молекуле ДНК [11] (рис. 8). Основание Шиффа, то есть нестабильный комплекс, который Ku-антиген образует с АП-сайтом в ДНК, можно восстановить с помощью боргидрида натрия (рис. 6). Образующиеся стабильные комплексы белок-ДНК можно разделить по молекулярной массе с помощью гель-электрофореза и затем регистрировать благодаря метке, которую несет ДНК. ДНК-зонды, используемые для регистрации белка, могут содержать радиоактивную или флуоресцентную метку. Однако высокая стоимость и небезопасность радиоактивной метки делают ее применение для анализа в клинике затруднительным. В противоположность этому, флуоресцентная метка относительно недорогая и безопасная в использовании. С помощью данного метода можно определять концентрацию активной формы Ku-антигена (то есть способной связываться с ДНК) и обнаруживать его укороченную форму, неактивную в репарации. Кроме того, регистрация Ku-антигена с использованием ДНК-зондов, содержащих АП-сайты, требует меньших затрат времени и реактивов, чем методы, широко используемые в настоящее время.
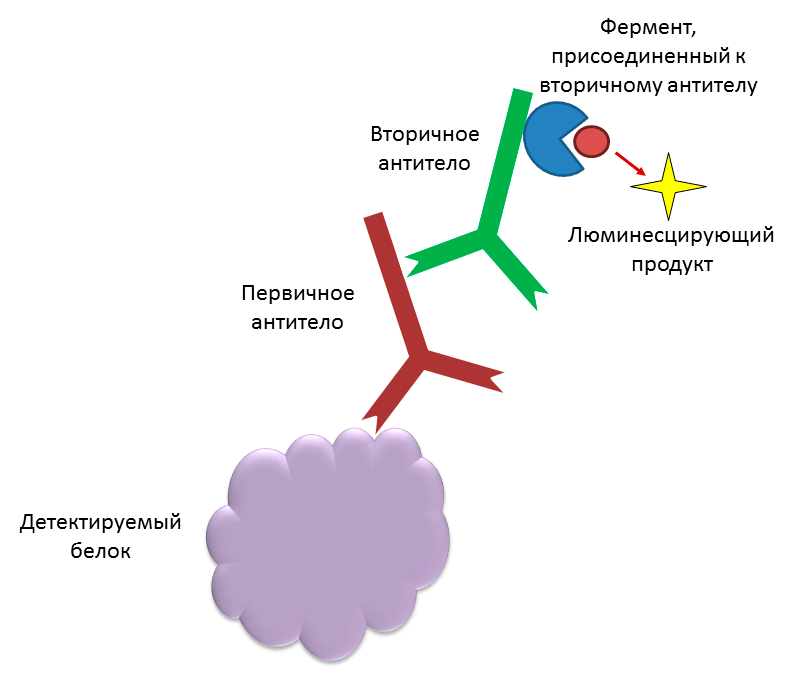
Рисунок 7. Иммуноферментный анализ
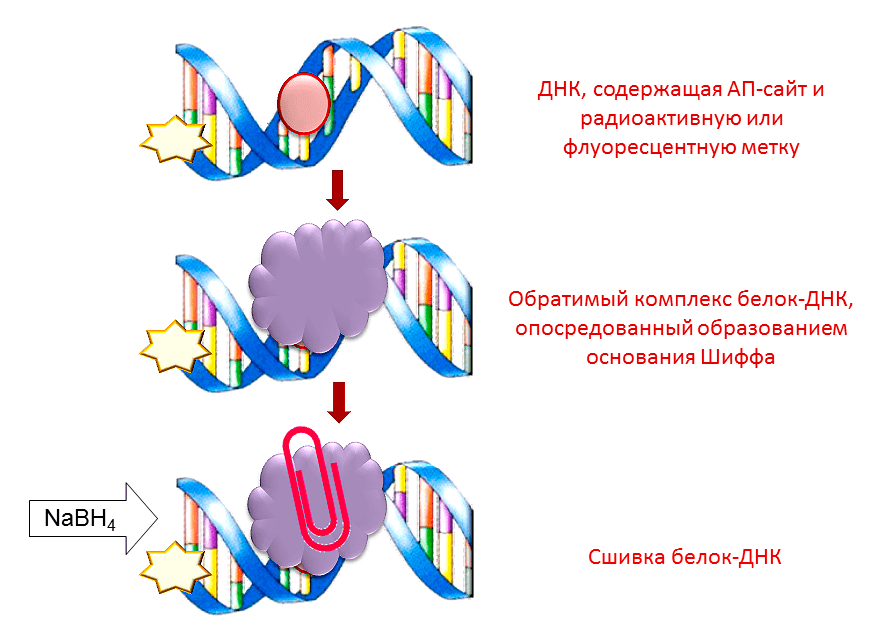
Рисунок 8. Схема регистрации Ku-антигена на основе его взаимодействия с АП-сайтами
С помощью ДНК-зондов, содержащих АП-сайты, можно детектировать не только Ku-антиген, но и другие клинически значимые белки репарации, такие как PARP1 и HMGB1. В настоящее время в нашей лаборатории идет поиск ДНК-зондов, с которыми данные белки могут специфично связываться. Таким образом, исследование взаимодействия Ku-антигена и других белков репарации с АП-сайтами имеет не только фундаментальное, но и прикладное значение.
Литература
- John R. Walker, Richard A. Corpina, Jonathan Goldberg. (2001). Structure of the Ku heterodimer bound to DNA and its implications for double-strand break repair. Nature. 412, 607-614;
- Charles Gullo, Melvin Au, Ge Feng, Gerrard Teoh. (2006). The biology of Ku and its potential oncogenic role in cancer. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1765, 223-234;
- Tomas Lindahl. (1993). Instability and decay of the primary structure of DNA. Nature. 362, 709-715;
- Ekaterina S. Ilina, Olga I. Lavrik, Svetlana N. Khodyreva. (2008). Ku antigen interacts with abasic sites. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1784, 1777-1785;
- Hans E Krokan, Hilde Nilsen, Frank Skorpen, Marit Otterlei, Geir Slupphaug. (2000). Base excision repair of DNA in mammalian cells. FEBS Letters. 476, 73-77;
- Steven A. Roberts, Natasha Strande, Martin D. Burkhalter, Christina Strom, Jody M. Havener, et. al.. (2010). Ku is a 5′-dRP/AP lyase that excises nucleotide damage near broken ends. Nature. 464, 1214-1217;
- A. A. Kosova, S. N. Khodyreva, O. I. Lavrik. (2014). Ku80 interaction with apurinic/apyrimidinic sites depends on the structure of DNA ends. Biopolym. Cell. 30, 42-46;
- Svetlana N Khodyreva. (2014). Ku Antigen Interaction with Apurinic/Apyrimidinic Sites: Nonhomologous End Joining Vs Base Excision Repair. MOJPB. 1;
- Была клетка простая, стала стволовая;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Ekaterina S. Ilina, Svetlana N. Khodyreva, Aleksey E. Berezhnoy, Sergey S. Larin, Olga I. Lavrik. (2010). Tracking Ku antigen levels in cell extracts with DNA containing abasic sites. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 685, 90-96.







