Вампиры внутри нас
09 декабря 2024
Вампиры внутри нас
- 587
- 0
- 4
Рисунок в полном размере.
рисунок Львовой Марии и Кизименко Алены
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В культуре многих народов есть мифы о вампирах. С детства мы читаем книги и смотрим фильмы про вампиров. Они пьют кровь, боятся света, а убить их можно только осиновым колом. Но мало кто задумывался, что в нашей современной жизни человеку не так уж и сложно повстречаться с вампирами и, что еще хуже, они легко могут поселиться в человеке. Кто же они? — Это всевозможные паразиты, питающиеся кровью (паразиты-гематофаги). Их огромное разнообразие — от простейших до насекомых. Без специального лечения некоторые из них могут оставаться в организме хозяина (человека и животных) на долгие годы, причиняя значительный вред его здоровью. Среди таких вампиров есть как широко известные, так и неожиданные паразиты. Однако не все так просто, и, питаясь кровью, такие вампиры подвергаются смертельной опасности.
В этой статье описаны несколько паразитов-гематофагов, которых объединяет одна пищеварительная особенность, позволяющая им легко преодолевать возникающие трудности и вызывать тяжелые заболевания у человека. Корме этого, будет рассказано, как современная медицина использует такие особенности для борьбы с этими вампирами.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
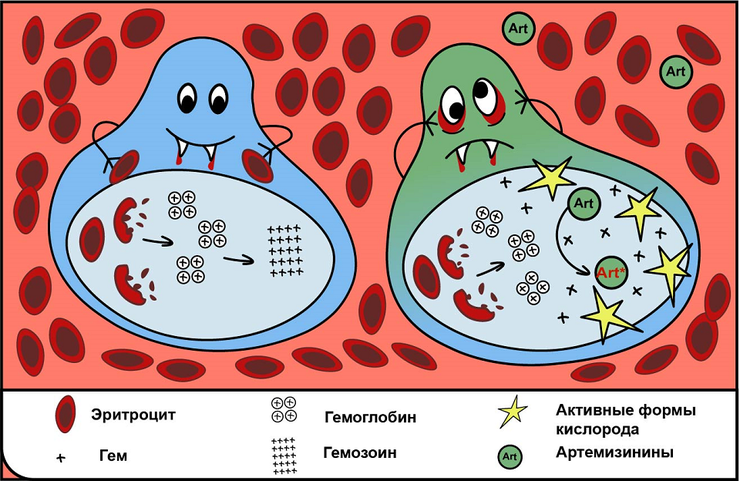
Вампиризм (гематофагия) — широко распространенный среди паразитов способ питания. Компоненты крови для них — это источник питательных веществ. Самыми многочисленными клетками крови являются эритроциты. Гемоглобин составляет около 90% всего белка эритроцитов. В процессе питания кровью паразиты переваривают белковую часть гемоглобина, при этом остается большое количество небелковых железосодержащих компонентов — гема (простетическая группа гемоглобина). Свободный гем является высокотоксичным для окружающих клеток и тканей. Ведь это — источник двухвалентного железа (Fe+2), которое может принимать участие в реакции Фентона (H2O2 + Fe+2 → Fe+3 + OH– + OH.). Эта реакция основана на том, что некоторые металлы, в нашем случае — железо, могут под действием пероксида водорода легко менять валентность, в результате чего образуется гидроксильный радикал (OH.), относящийся к активным формам кислорода (АФК), которые способствуют развитию окислительного стресса (рис. 1) [1].
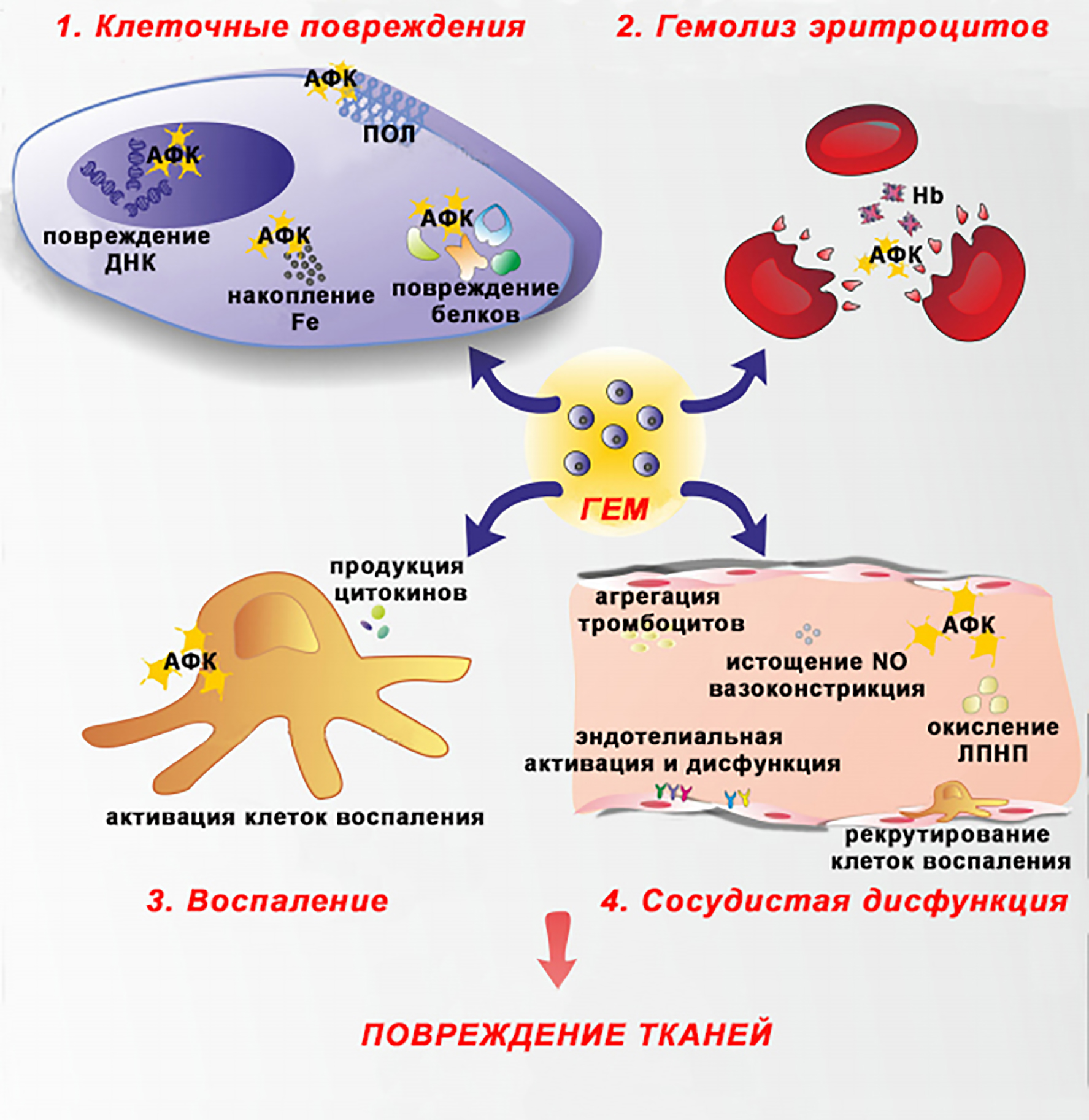
Рисунок 1. Токсические эффекты гема. АФК — активные формы кислорода. ПОЛ — перекисное окисление липидов. ЛПНП — липопротеины низкой плотности. Hb — гемоглобин.
адаптировано из [1]
АФК отличаются очень высокой химической активностью и способны разрушать окружающие органические молекулы. Окисление активных (каталитических) центров ферментов снижает или блокирует их активность; разрыв или повышение чувствительности белковых молекул к действию протеолитических ферментов приводит к уменьшению количества этих белков и/или нарушению их функции. Повреждения нуклеиновых кислот, такие как всевозможные разрывы или образование новых связей в молекулах, окисление азотистых оснований и многие другие, могут привести к запуску программируемой клеточной смерти. Еще одной мишенью для АФК являются липиды — основные компоненты клеточных мембран. Перекисное окисление липидов (ПОЛ), которое инициируют АФК, приводит к нарушению структуры клеточных мембран и повышению их проницаемости. В результате нарушается всевозможный транспорт через мембраны клеток, может возникать дисбаланс веществ внутри и вне клетки [2]. Сами по себе продукты ПОЛ (например, малоновый диальдегид и др.) также участвуют в вышеописанных повреждениях. Таким образом, повреждения в клетке под действием АФК могут расти как снежный ком. Помимо этого, АФК активируют кислород-чувствительные провоспалительные транскрипционные факторы, которые участвуют в регуляции синтеза различных белков в клетке; при этом может нарушаться синтез белков, необходимых для нормальной жизнедеятельности клетки. Все вышеперечисленное приводит к нарушению функционирования, повреждениям и уменьшению жизнеспособности клетки.
Свободный гем благодаря своим липофильным свойствам может связываться с фосфолипидными мембранами клеточных стенок, нарушая их целостность, что способствует разрушению (гемолизу) эритроцитов. Гем привлекает клетки воспаления (например, макрофаги), нарушает функционирование эндотелиальных клеток, выстилающих стенки кровеносных сосудов. Образуется большое количество молекул адгезии и эндотелиальной активации. Все вышеперечисленное способствует избыточной агрегации тромбоцитов и окислению липопротеинов низкой плотности [1], лежащих в основе формирования атеросклеротических изменений в сосудах.
В итоге происходит повреждение клеток и тканей в местах избыточного образования АФК, как у хозяина, так и у паразита. В ходе эволюции у паразитов-гематофагов выработалось несколько способов обезвреживания гема, одним из которых является образование из молекул гема нерастворимых кристаллов, безвредных для паразита. Всех «вампиров», описанных в данной статье, объединяет одна общая черта — одинаковый способ обезвреживания свободного гема. И первый «вампир», про которого хотелось бы рассказать — это малярийный плазмодий, возбудитель малярии.
Малярийный плазмодий
Малярийный плазмодий — это обобщенное название для представителей рода Plasmodium, вызывающих малярию. Паразитами человека являются Plasmodium falciparum, Plasmodium malariae, Plasmodium vivax и Plasmodium ovale.
Возбудители малярии относятся к классу простейших, распространены на обширной территории с тропическим и субтропическим климатом (Африка, Южная и Центральная Америка, Юго-Восточная Азия, Ближний и Средний Восток), но могут встречаться и в умеренных широтах (рис. 2).
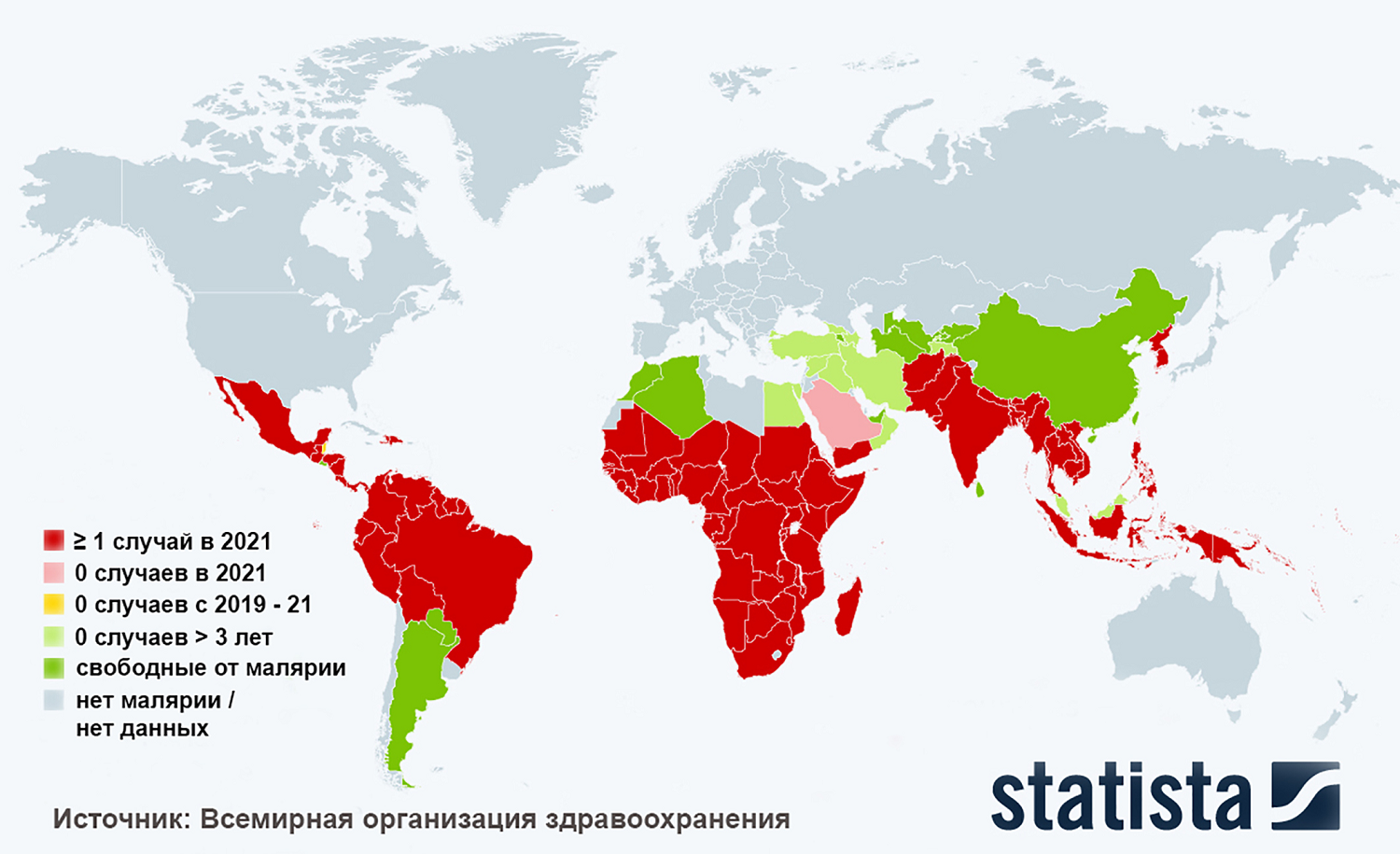
Рисунок 2. Карта мира, показывающая распространение малярии. Случаи малярии, зарегистрированные в 2021 году, подсчитаны по странам, в которых в 2000 году был хотя бы один случай малярии (составлена на основании статистических данных Всемирной организации здравоохранения).
адаптировано на основе данных Statista
Возбудители малярии обладают массой ухищрений для успешного размножения и смены хозяев, а именно — комара и человека [3]. Заражение происходит после укуса инфицированной плазмодиями самки комара рода Anopheles. Отличить такого комара очень непросто. У комаров рода Anopheles задняя пара конечностей достаточно длинная. Они сидят, приподняв брюшко и опустив голову, и имеют явный наклон всего тела вперед на 30–45 градусов. Тогда как у комаров других видов тело практически параллельно поверхности, на которой они сидят (рис. 3). Основная особенность комаров рода Anopheles — то, что длина щупальцев на голове по бокам от хоботка и длина хоботка одинаковые; у комаров других видов такие щупальца ощутимо короче, однако увидеть это можно только при хорошем увеличении.

Рисунок 3. Сравнение положения тела комара рода Anopheles — переносчика малярии — и комара, не являющегося переносчиком этого заболевания (представитель рода Aedes).
Малярийные плазмодии имеют сложный жизненный цикл (рис. 4а) [4].
В организме человека после размножения в клетках печени мерозоиты выходят в кровеносное русло (рис. 4а). Там они проникают в эритроциты, и начинается следующая кровяная стадия жизненного цикла возбудителей малярии. В эритроците плазмодий растет и размножается бесполым путем, питаясь гемоглобином (рис. 4б). Периодически паразиты разрушают эритроцит, снова выходят в кровеносное русло и заражают следующие эритроциты. С этими периодами связаны такие клинические проявления малярии, как лихорадка, озноб, боли в суставах и т.д. Исследования показали, что бессимптомная или легкая форма малярии может длиться годами, вплоть до десяти лет [6]. Тяжелая малярия является основной причиной развития анемии у детей в тропических регионах. Малярийный плазмодий вызывает разрушение (гемолиз) зараженных и незараженных эритроцитов, а также нарушение образования эритроцитов в красном костном мозге (эритропоэз) [7].
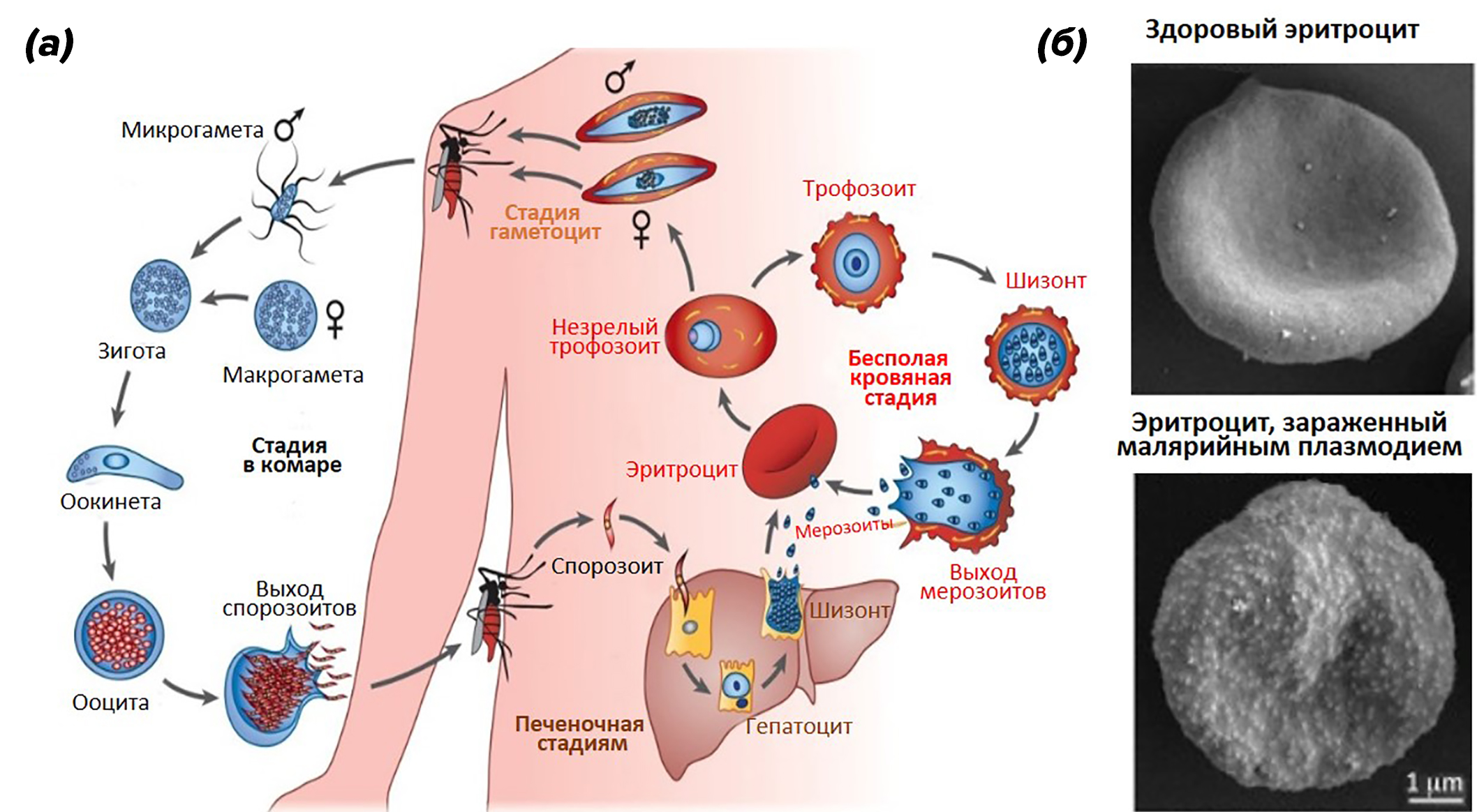
Рисунок 4. (а) — схема жизненного цикла малярийного плазмодия Plasmodium falciparum. (б) — электронная сканирующая микрофотография эритроцита человека здорового и зараженного малярийным плазмодием.
адаптировано из [5]
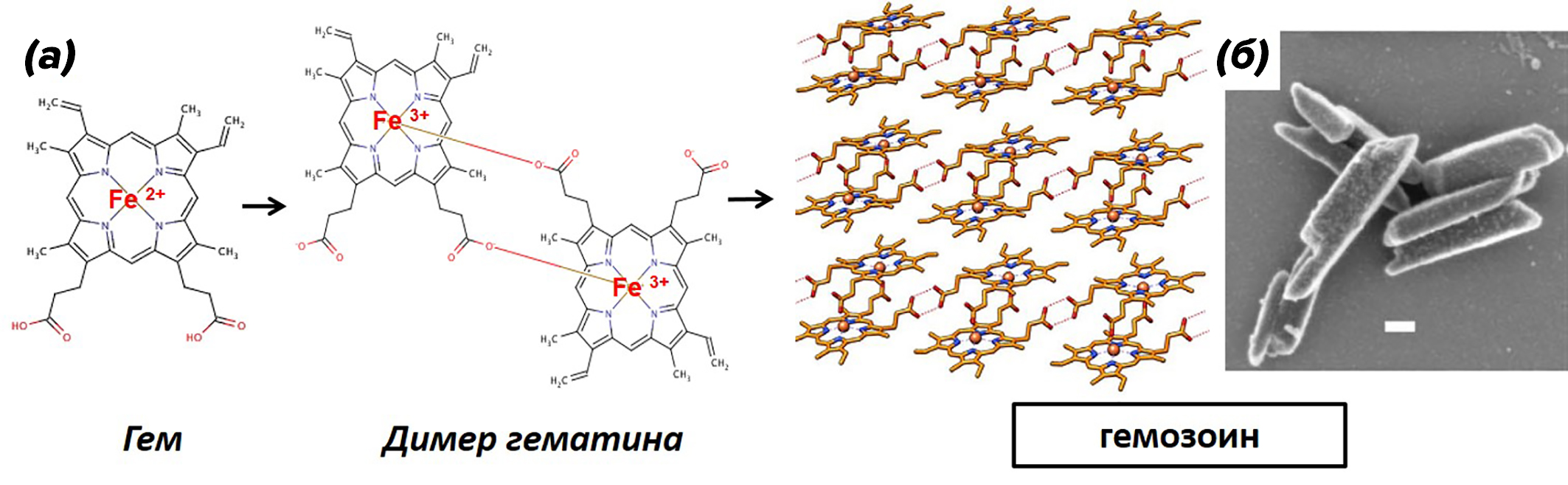
В пищеварительной вакуоли малярийного плазмодия, находящегося в эритроците, впервые в конце XIX века были обнаружены нерастворимые кристаллы. Позднее определили, что это железосодержащий пигмент, который назвали малярийным пигментом, или гемозоином (от греческого haima — «кровь» и zoon — «животное»). В отличие от гема, он не растворим в воде, бикарбонатном буфере (основной буфер крови человека) и обладает парамагнитными свойствами. Кристаллы гемозоина представляют собой димеры гематина (гематин — окисленная форма гема, содержащая трехвалентный атом железа), соединенные координационными связями между Fe3+ одного гема и кислородом карбоксильной группы (COOH) пропионовой кислоты другого (рис. 5а). Далее димеры формируют так называемые «кристаллические решетки» с помощью водородных связей [8].
Механизм образования гемозоина активно изучается. У малярийного плазмодия в пищеварительной вакуоли был обнаружен белковый мультиферментный комплекс, который участвует в расщеплении гемоглобина и формировании гемозоина [11]. По последним данным, формирование гемозоина — это биокристаллиация на внутренней поверхности мембраны пищеварительной вакуоли, и, по мере роста, кристаллы отделяются от мембраны, продолжая расти уже в полости пищеварительной вакуоли [8]. У всех возбудителей малярии млекопитающих гемозоин схож морфологически (рис. 5б) и представляет собой кристаллы, по форме напоминающие параллелепипед, размер которых варьирует в зависимости от вида плазмодия и в среднем составляет 100 нм * 100 нм * 300–500 нм [10] (1 мм = 1000 мкм, а 1мкм = 1000 нм; размер эритроцита у человека в среднем составляет 7— 9 мкм).
Интересно, что такой способ обезвреживания гема характерен не только для простейших — возбудителей малярии, но и для многоклеточных паразитов, например, гельминтов. О них будет рассказано ниже.
Шистосома
Следующий не менее распространенный и опасный «вампир» на нашей планете — это шистосома. Она относится к классу паразитических плоских червей — сосальщиков (трематод). Вызывает заболевание ‒ шистосомоз. Широко распространенными возбудителями шистосомоза являются следующие представители семейства: Schistosoma mansoni, Schistosoma haematobium, Schistosoma japonicum, с которыми можно встретиться в Африке, Азии и Южной Америке (рис. 6) [12]. Наряду с малярией, шистосомоз остается самым распространенным паразитарным заболеванием в мире.
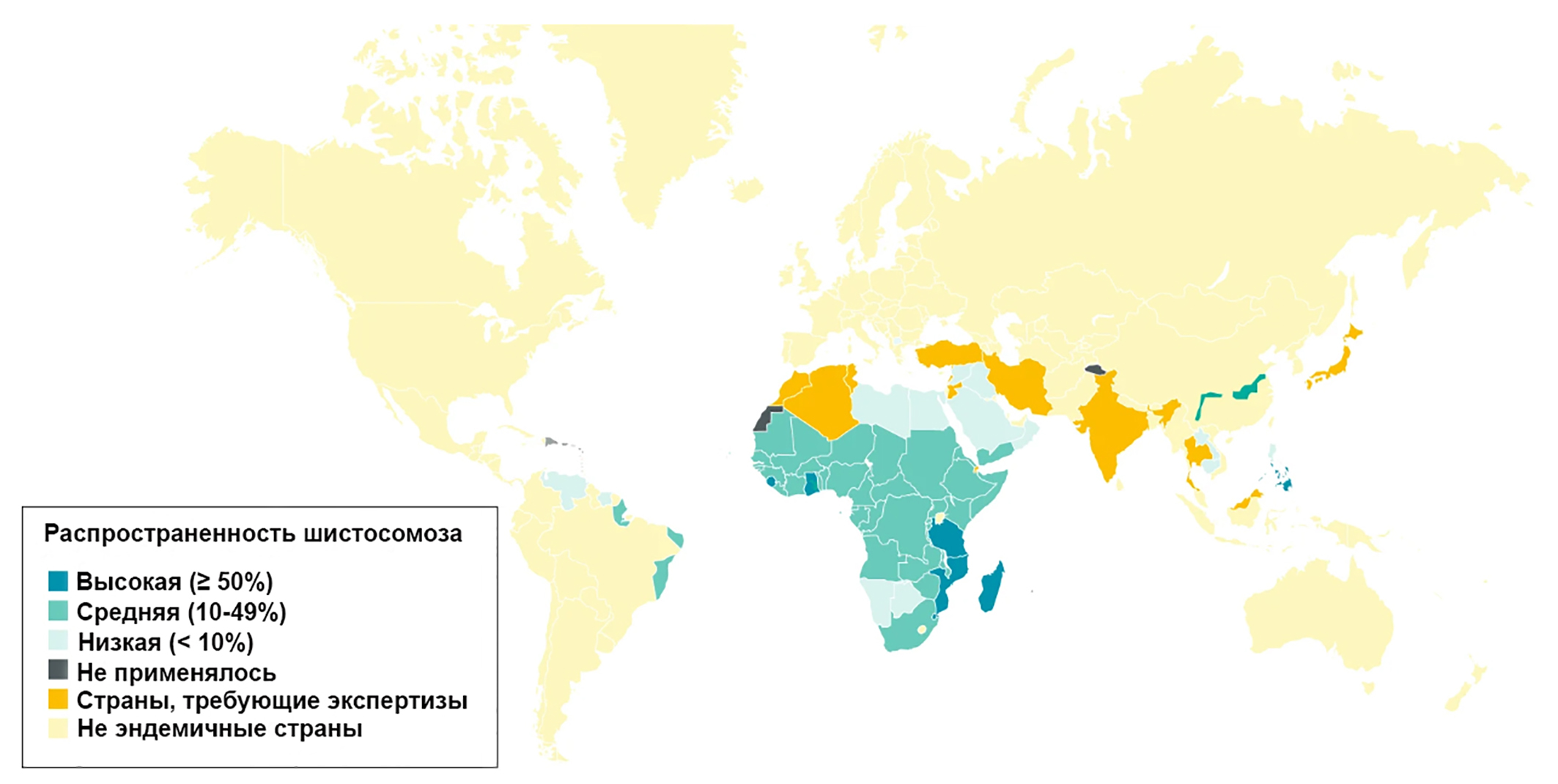
Рисунок 6. Карта мира, показывающая распространенность шистосомоза, по данным Всемирной организации здравоохранения за 2012 год.
адаптировано из [12]
Шистосомы — это раздельнополые гельминты, которые в организме окончательного хозяина паразитируют парами (рис. 7). Самка шистосомы находится в специальном канале, как бы обернутая плоским туловищем самца. Размеры этих гельминтов зависят от вида, но в среднем длина самца составляет 6–15 мм, а ширина — около 1 мм, тогда как самка немного длинней и ýже. Продолжительность жизни этих паразитов в организме человека без лечения составляет в среднем от 3 до 10 лет, но есть отдельные случаи шистосомоза, длившегося до 40 лет [13].
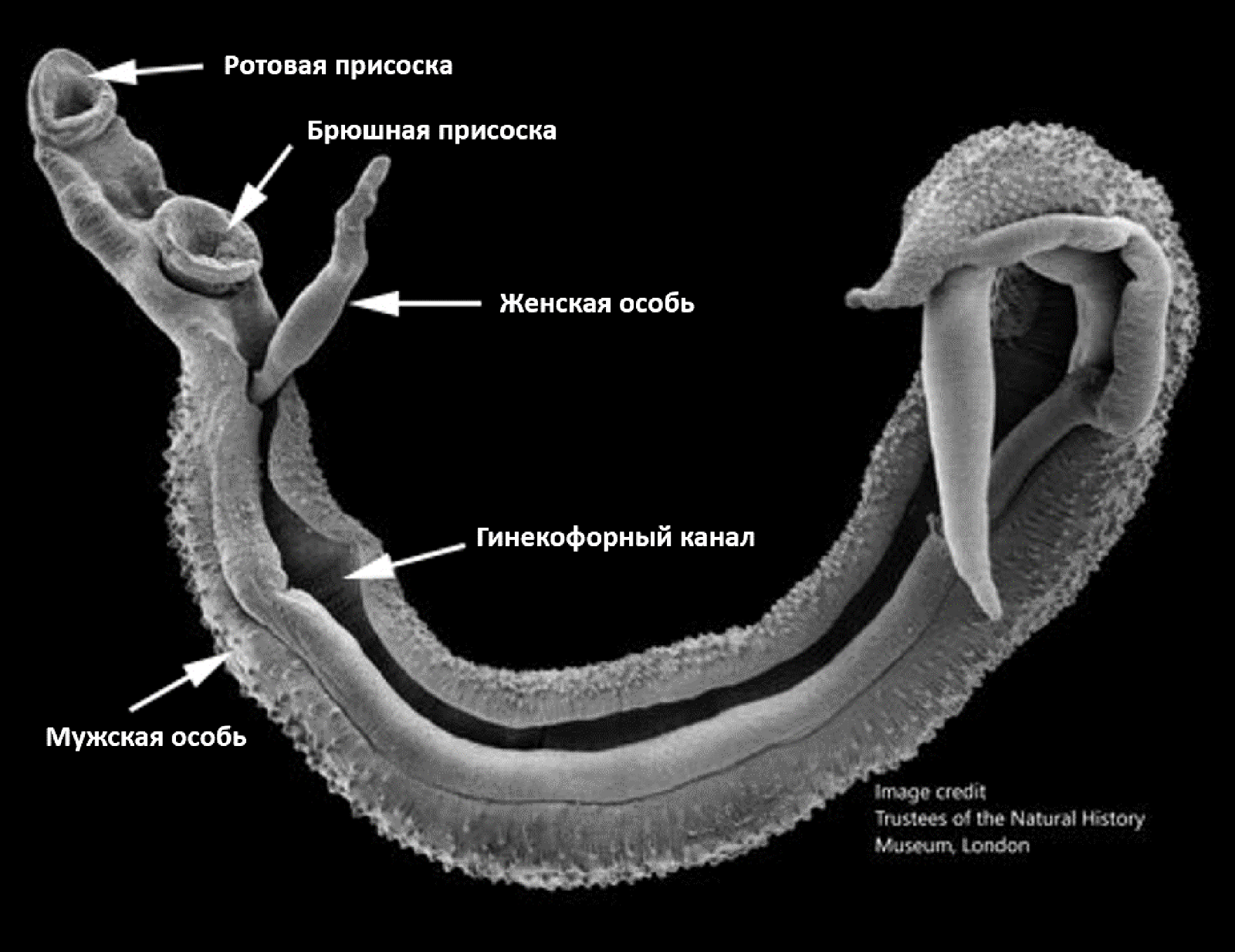
Рисунок 7. Сканирующая электронная фотография пары шистосом.
Все шистосомы имеют схожий жизненный цикл, включающий одного промежуточного хозяина (пресноводную улитку) (рис. 8). Они различаются по месту паразитирования в человеке или других млекопитающих, а именно — в венах брюшной полости или венах мочевого пузыря [14].
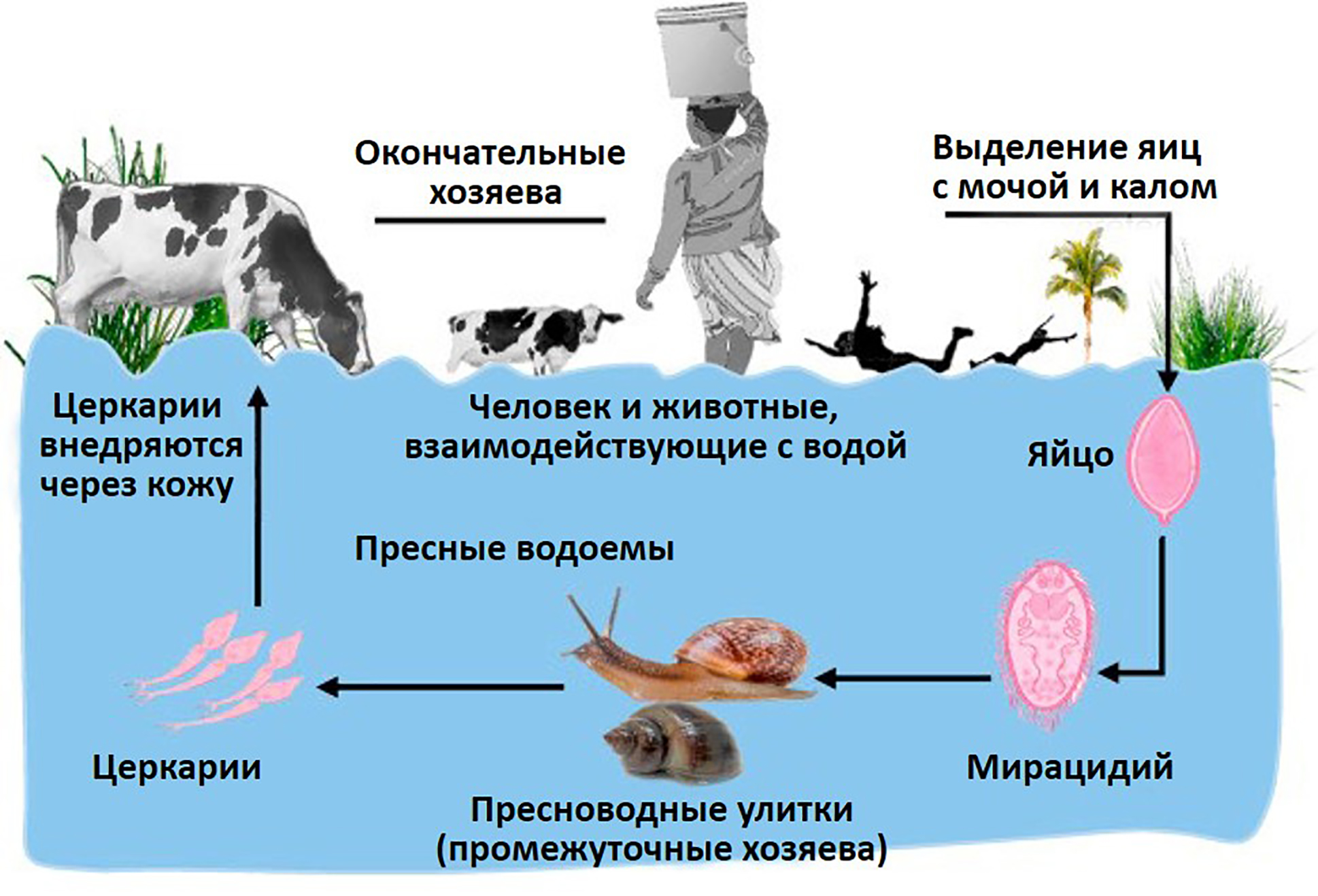
Рисунок 8. Схема жизненного цикла шистосом.
адаптировано из [14]
Заразиться этими паразитами-вампирами очень просто. Достаточно искупаться в водоеме, ополоснуть руки или зайти босиком в воду, содержащую личинки (церкарии) этих гельминтов. Они очень маленькие и не видны невооруженным глазом. Например, у Schistosoma mansoni они в длину 260 мкм. Церкарии проникают через кожу, попадают в кровеносные сосуды, где и паразитируют. Находясь постоянно в кровеносных сосудах, питательные вещества шистосомы получают непосредственно через поверхность своего тела, а также заглатывают кровь в кишечник. Количество крови, поступающее в кишечник гельминта в сутки, превышает объем его тела в четыре раза [15]. При переваривании гемоглобина в кишечнике так же, как и малярийный плазмодий, шистосомы сталкиваются с токсичностью гема, а способ его обезвреживания остается прежним — образование гемозоина.
Кристаллы гемозоина у шистосом округлой формы, их поверхность местами ребристая, размер варьирует в широких пределах — от 50 нм до нескольких мкм в диаметре (рис. 9) [16]. Это и понятно — у малярийного плазмодия (одноклеточного паразита) внутриклеточное пищеварение. Оно происходит в пищеварительной вакуоли, которая расположена внутри паразита, а он сам при этом находится в эритроците, да еще и там же размножается бесполым путем. Налицо серьезная нехватка места. Вероятно, из-за этого кристаллы гемозоина формируются так, чтобы не занимать слишком много места. Тогда как шистосомы (многоклеточные паразиты) имеют внеклеточное пищеварение в просвете кишечника и периодически опорожняют его содержимое в кровеносный сосуд хозяина.

Рисунок 9. (а), (б) — электронные микрофотографии кристаллов гемозоина S. mansoni. Стрелками показаны индивидуальные кристаллы гемозоина, собранные в мультикристаллические структуры.
Связь кристаллов с поверхностью липидной капли и наличие в просвете кишечника последовательных стадий кристаллизации, начиная с формирования на поверхности капли ядра кристаллизации и заканчивая мультикристаллическими комплексами, привели ученых к выводу о том, что формирование гемозоина связано с разделом сред между окружающей жидкостью и поверхностью липидной капли (рис. 10) [17].
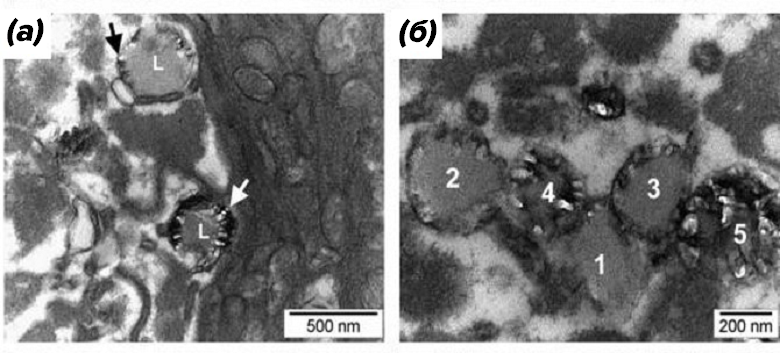
Рисунок 10. Просвечивающая электронная микроскопия просвета кишечника женской особи Schistosoma mansoni.
(а) — липидные капли окружены кристаллами гемозоина (указано стрелками). L — липидные капли.
(б) — последовательные стадии (указаны цифрами 1–5, 1 — начальная и т.д.) формирования гемозоина на липидных каплях.
Шистосомоз редко диагностируют на ранних стадиях заболевания. В эндемичных регионах наиболее распространенной формой является хронический шистосомоз, в том числе это связано и с повторными заражениями. Тяжелый шистосомоз, особенно у детей, может сопровождаться анемией [18]. Ученые предполагают несколько механизмов ее развития. Один из них — это потеря организмом доступного железа в процессе формирования нерастворимых кристаллов гемозоина.
Описторх/Клонорх
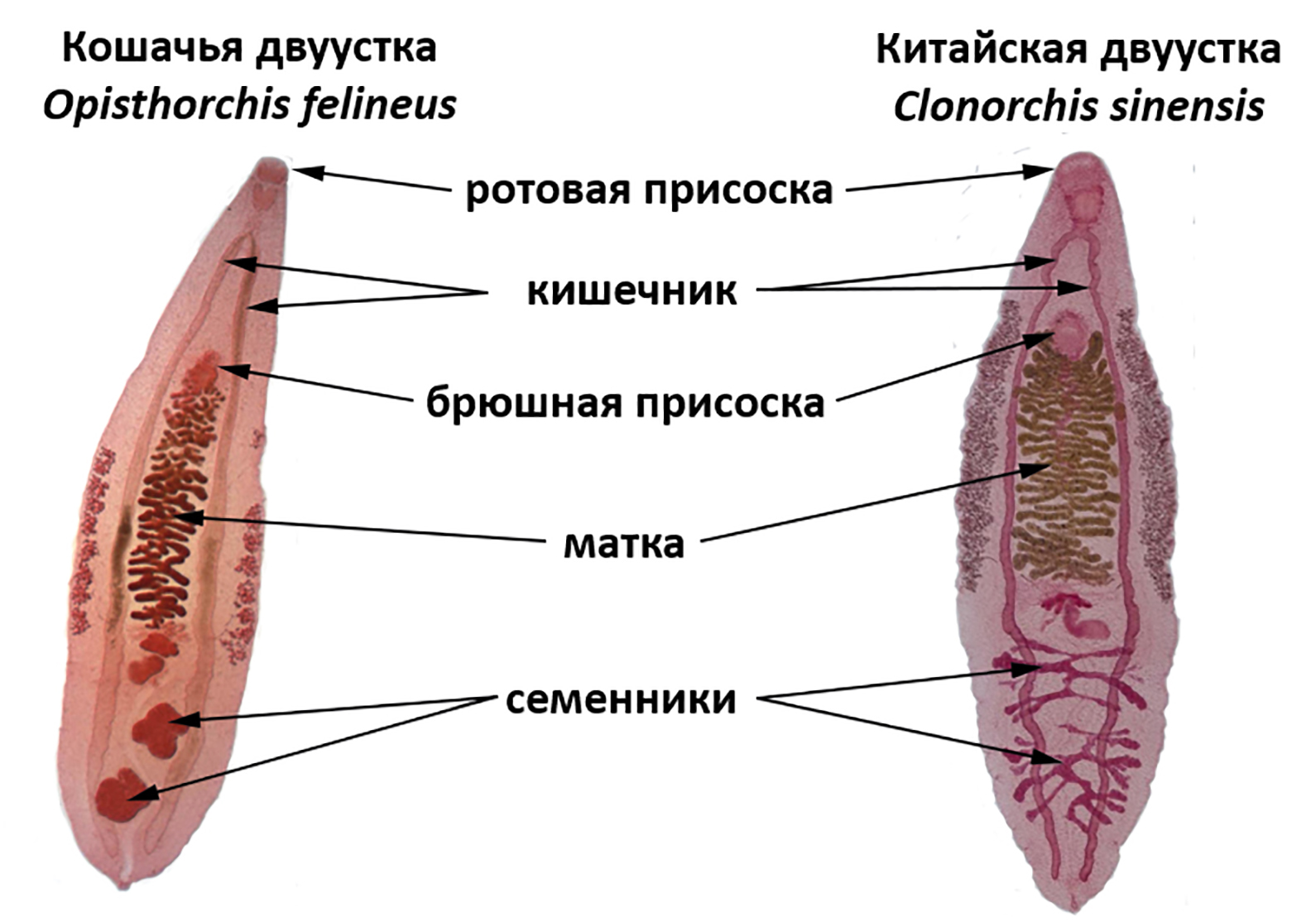
И наконец, пришло время поговорить о неожиданных «вампирах», которые могут подстерегать нас на наших кухнях. Это тоже плоские черви, печеночные сосальщики, относящиеся к одному семейству: описторх (Opisthorchis felineus, кошачья или сибирская двуустка) и клонорх (Clonorchis sinensis, китайская двуустка).
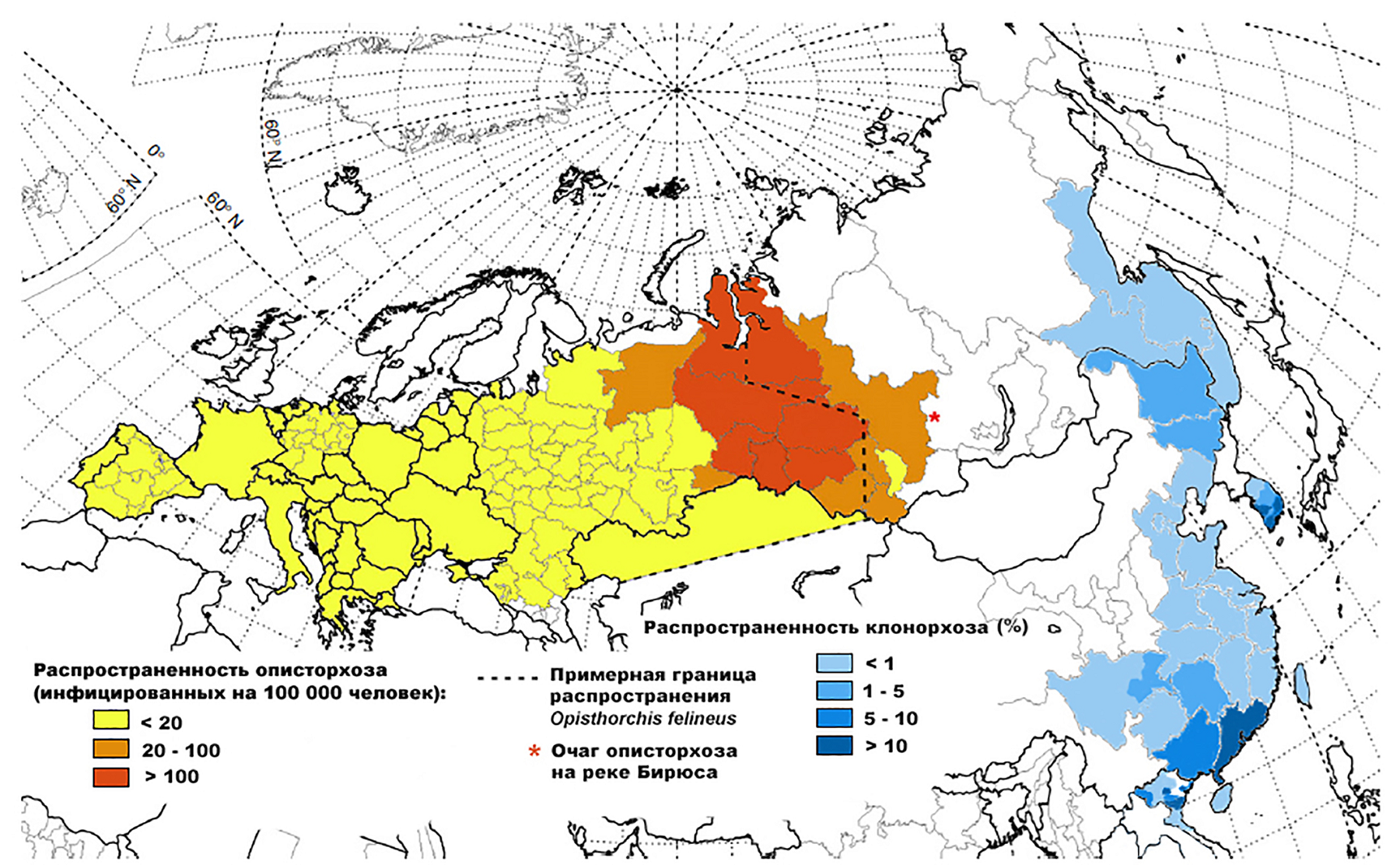
С ними встретиться гораздо проще, чем с вышеперечисленными «вампирами», зачастую даже ехать никуда не нужно. В России расположен самый большой в мире очаг описторхоза — это территории рек Обь и Иртыш в Западной Сибири. Очаги описторхоза находятся в бассейнах рек Волга, Кама, Северная Двина, Дон, Днепр и рек Урала, есть данные о наличии очага низкой интенсивности в бассейне реки Енисей (рис. 11). Также кошачья двуустка встречается на территории стран Восточной и Западной Европы. Близкая родственница —китайская двуустка — распространена на Дальнем Востоке России в бассейне реки Амур, а также в Китае, Корее, Вьетнаме. По данным многих ученых и врачей, статистика по заболеваемости описторхозом и клонорхозом может быть существенно занижена из-за отсутствия специфической симптоматики и трудностей в постановке диагноза как в острую, так и в хроническую стадии инфекций [19–21].
Описторх и клонорх — это мелкие гельминты—гермафродиты (рис. 12) [22], [23]. В среднем длина тела у Opisthorchis felineus — 5,8–13 мм, ширина — 0,75–2,2 мм, у Clonorchis sinensis длина — 8–15 мм и ширина — 1,5–4 мм.
Заразиться этими гельминтами можно при употреблении в пищу сырой, недостаточно термически обработанной (плохо проваренной, прожаренной или промороженной), слабосоленой или вяленой речной рыбы семейства Карповых (язь, сазан, елец и другие).
Несмотря на то, что эти гельминты паразитируют в желчных протоках, желчном пузыре или протоках поджелудочной железы (рис. 13а), они питаются кровью хозяина, повреждая окружающие ткани в местах паразитирования (рис. 13б) [24].
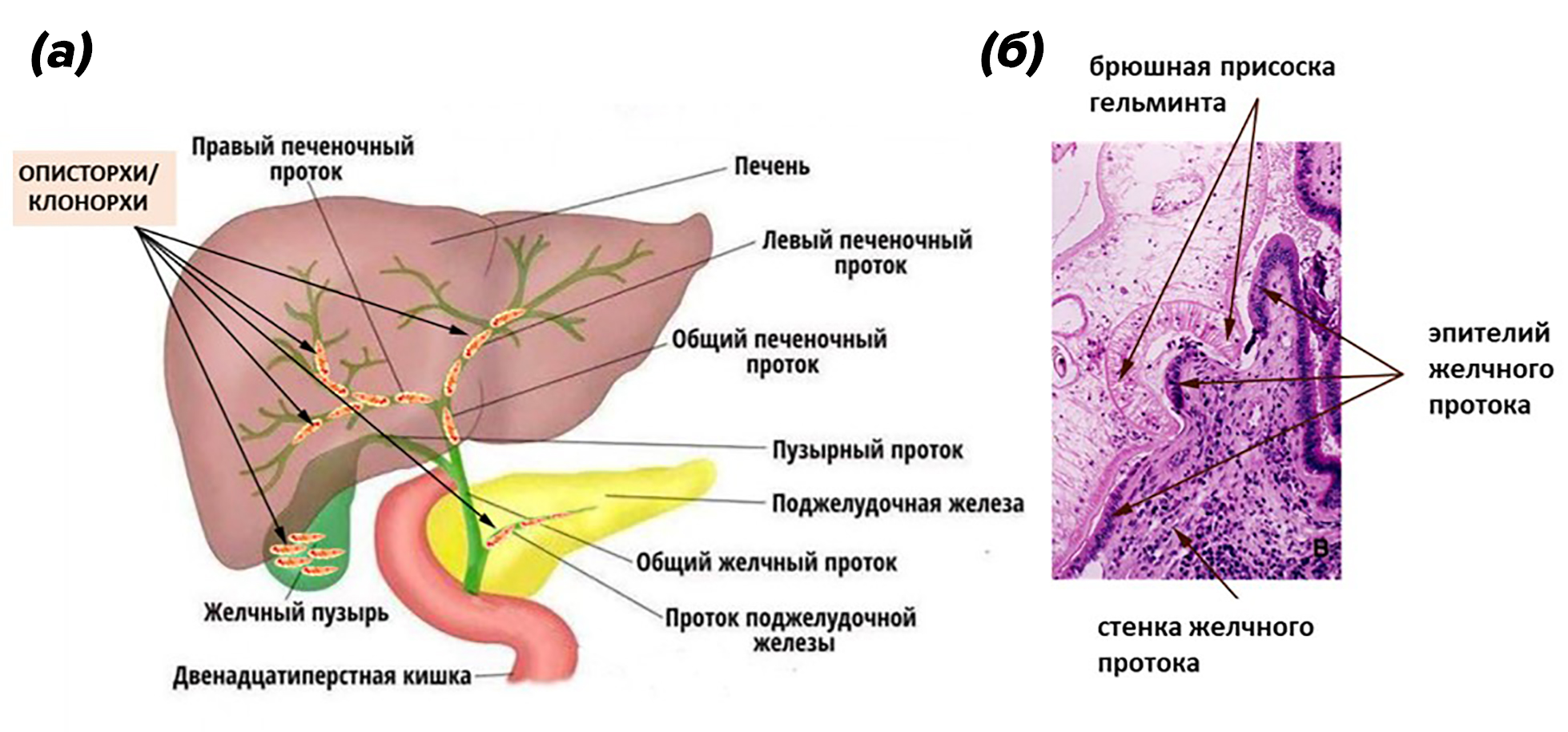
Рисунок 13. (а) — места паразитирования описторхов и клонорхов в организме человека. (б) — механическое повреждение стенки желчного протока брюшной присоской описторха (печень сирийского хомячка, гистологический срез, окраска гематоксилином и эозином).
В просвете кишечника этих печеночных сосальщиков (Opisthorchis felineus и Clonorchis sinensis) обнаружено большое количество разрушающихся клеток крови и гемозоина (рис. 14) [25]. Его кристаллы варьируют по размеру от 50 нм до 2 мкм, округлой формы, слоистой структуры, и схожи с гемозоином шистосом.

Рисунок 14. Просвечивающая электронная микроскопия.
(а) — содержимое кишечника Opisthorchis felineus.
(б) — содержимое кишечника Clonorchis sinensis: Л — липиды, M — мультимембранные структуры. Стрелки указывают на кристаллы гемозоина в просвете кишечника гельминтов. Шкала 1 мкм.
(в) — сканирующая электронная микроскопия кристаллов, выделенных из кишечника Opisthorchis felineus.
(г) — сканирующая электронная микроскопия кристаллов, выделенных из кишечника Clonorchis sinensis. Шкала 1 мкм.
Образование кристаллов гемозоина у описторха и клонорха происходит аналогично процессу, описанному для шистосом на поверхности липидных капель (рис. 15).

Рисунок 15. Стадии формирования кристаллов гемозоина вблизи липидных капель в кишечнике Opisthorchis felineus (а, б, в) и Clonorchis sinensis (г, д, е). Начальная стадия (а, г), промежуточная стадия (б, д), формирование мультикристаллических комплексов вокруг нескольких липидных капель (в, е).
Л — липидные капли. Стрелки указывают на ядра кристаллизации на поверхности липидных капель. Шкала 500 нм.
Без лечения описторхоз/клонорхоз длится десятилетиями, при этом развиваются всевозможные осложнения в органах паразитирования гельминтов, вплоть до онкологических заболеваний. Существует ряд наблюдений о снижении уровня гемоглобина и изменении некоторых характеристик эритроцитов у зараженных кошачьей двуусткой лабораторных животных, а также нарушении образования эритроцитов в костном мозге у зараженных животных и людей с хроническим описторхозом. Однако достоверной информации о связи этих гельминтозов с возникновением анемии на данный момент нет.
Для паразитов гемозоин безвреден, а для хозяина?
Что уже известно.
Кристаллы гемозоина, независимо от вида паразита-вампира, попадают в полости и ткани хозяина, их фагоцитируют («съедают») макрофаги и другие клетки. При шистосомозе гемозоин накапливается в макрофагах печени (клетках Купфера). Его накопление совпадает с очагами выраженного воспаления и разрастания соединительной ткани (фиброза). Ряд авторов предполагает, что существует связь между количеством накопленного в печени гемозоина и выраженностью фиброза в печени при шистосомозе [26]. Накопление гемозоина в макрофагах нарушает их нормальное функционирование и снижает фагоцитарную активность [27]. Предполагают, что как при тяжелой хронической малярии, так и при шистосомозе, макрофаги, заполненные гемозоином и попавшие в костный мозг, нарушают процесс образования эритроцитов, хотя механизм этого до сих пор неясен [28]. При описторхозе/клонорхозе в тканях печени вокруг скопления макрофагов, заполненных гемозоином, формируются гранулемы (четко очерченные скопления макрофагов, заполненных гемозоином, и других клеток), которые способствуют поддержанию воспаления (рис. 16а).
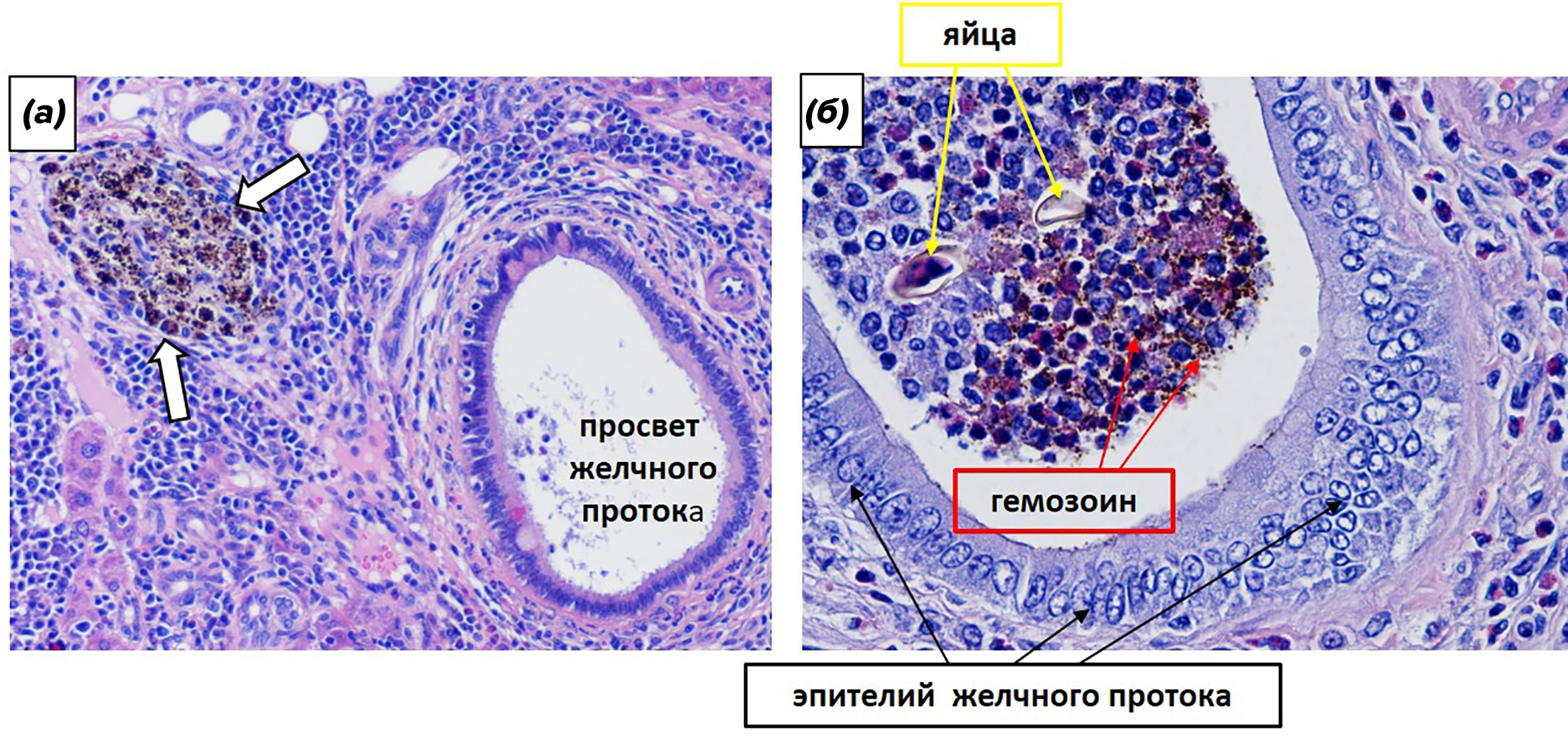
Рисунок 16. Фрагменты печени хомячка через 8 недель после заражения описторхами.
(а) — гранулема возле желчного протока. Стрелками обозначена гранулема с клетками, содержащими гемозоин.
(б) — просвет желчного протока, содержащий кристаллы гемозоина, яйца описторха и различные клетки. Окраска гематоксилином-эозином. Увеличение: (а) x100; (б) х400.
фото автора
Гемозоин, который накапливается в просвете желчных протоков и в желчном пузыре, ухудшает текучесть желчи и вносит вклад в формирование ее застоя (рис. 16б). Это, в свою очередь, формирует благоприятную среду для присоединения вторичной инфекции и образования камней.
Таким образом, гемозоин важен для паразита с точки зрения обезвреживания токсичного гема, а для хозяина гемозоин является дополнительным фактором формирования патологии и играет роль как токсический, иммуномодулирующий, провоспалительный и профибротический агент, который может способствовать развитию анемии. Это особенно актуально, поскольку показано, что гемозоин может оставаться в клетках и тканях хозяина длительное время даже после излечения (удаления паразитов из организма) (рис. 17). В ходе одного эксперимента мышей, зараженных малярийным плазмодием, пролечили хлорохином (8 дней) до выздоровления. Через 9 месяцев после выздоровления преимущественно в селезенке и красном костном мозге у этих мышей обнаружены кристаллы гемозоина [29]. А для мышей 9 месяцев это — половина жизни [30].
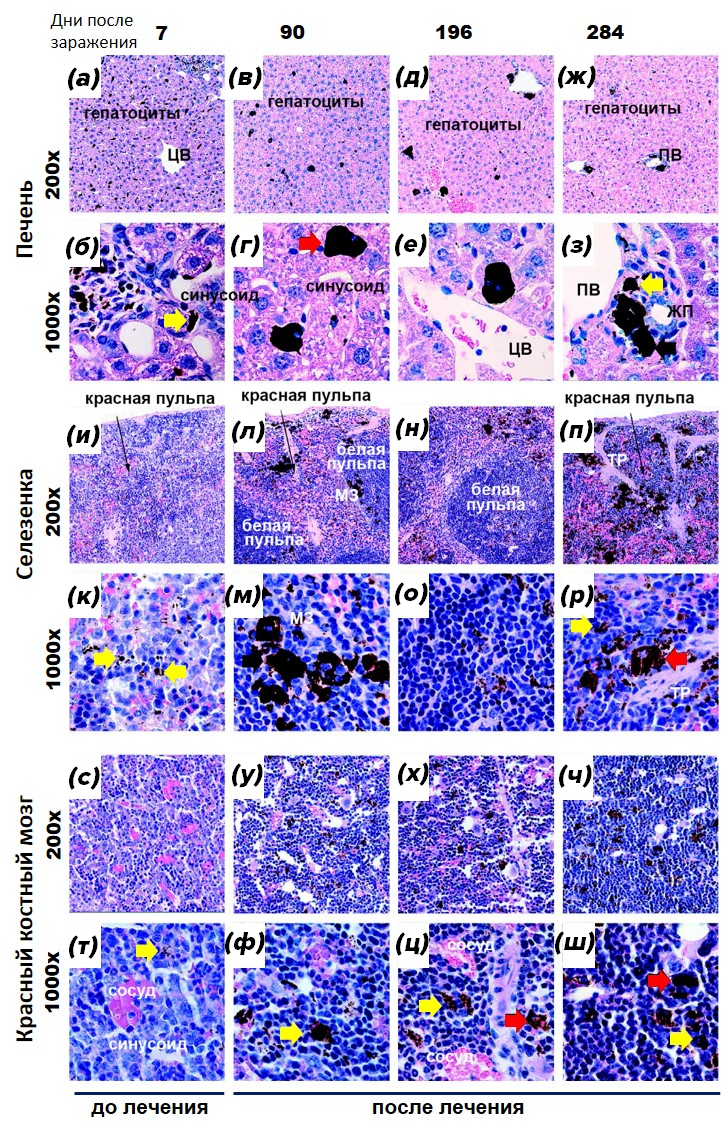
Рисунок 17. Динамика распределения гемозоина (черные включения на фотографиях) в печени, селезенке и красном костном мозге мышей, зараженных малярийным плазмодием и пролеченных до выздоровления.
Первоначально (7 дней после заражения и до лечения) в исследуемых органах отмечено незначительное количество кристаллов гемозоина малого размера (желтые стрелки). Причем в печени гемозоина было больше, чем в селезенке и красном костном мозге. Постепенно (после лечения, 90–284 дни после заражения) размер частиц становится средним и крупным (красные стрелки), с уменьшением количества гемозоина в печени и увеличением в селезенке (н—р) и красном костном мозге (х—ш). При этом к концу наблюдений в селезенке большое количество крупных кристаллов гемозоина накапливалось в области красной пульпы и трабекул, а в красном костном мозге такие кристаллы распределялись практически диффузно.
Обозначения: 200х, 1000х — увеличение микроскопа.
Печень: гепатоциты — основные клетки печени; ЦВ — центральная вена, вена находящаяся в центре печеночной дольки; ПВ — портальная вена или междольковая вена, входит в портальную триаду: вена, артерия и желчный проток (ЖП), кровь из этой вены по синусоидным капиллярам (синусоид) направляется в центральную вену. Селезенка: покрыта плотной соединительнотканной капсулой, от которой внутрь органа отходят трабекулы (ТР), внутри орган состоит из красной (депонирование различных клеток крови), белой (скопление лимфоцитов) пульпы и маргинальной зоны (МЗ), расположенной между ними и характеризующейся скоплением макрофагов. Красный костный мозг: в нем находится большое количество сосудов, тонких капилляров и широких капилляров (синусоиды), через стенки которых в кровеносное русло мигрируют зрелые клетки крови.
Что же делать?
С древних времен люди находили способы борьбы с вампирами. Как ни странно, чеснок, экстракт коры осины (творческое переосмысление использования осинового кола) применяются в народной медицине для борьбы с паразитами и по сей день.
Процесс образования гемозоина является высокоспецифичным и жизненно важным для паразитов, питающихся кровью хозяина. Он же — их ахиллесова пята. Блокирование его образования и последующее повреждение тканей паразита активными формами кислорода — ключевое звено для разработки потенциальных противопаразитарных лекарственных средств.
В 2015 году китайский фармаколог Юю Ту получила Нобелевскую премию по медицине и физиологии за открытие антималярийного вещества артемизинина [31]. Артемизинин выделен из полыни однолетней (рис 18а) и представляет собой сесквитерпеновый лактон, содержащий необычный эндопероксидный мостик, который имеет решающее значение для проявления противопаразитарной активности (рис 18б). Предложен свободнорадикальный механизм действия артемизинина (рис 18в). В исследованиях на малярийных плазмодиях было показано, что в процессе переваривания гемоглобина гем или железо непосредственно восстанавливают пероксидную связь артемизинина, расщепляя эндопероксидный мостик и образуя различные реакционноспособные артемизинин-гем аддукты (различные соединения гема и артемизинина). Они, в свою очередь, препятствуют формированию гемозоина и обеспечивают образование большого количества АФК, которые повреждают клетки и ткани паразитов [32]. Исследования механизмов действия артемизинина и его производных на возбудителей малярии и других паразитов-гематофагов продолжаются.
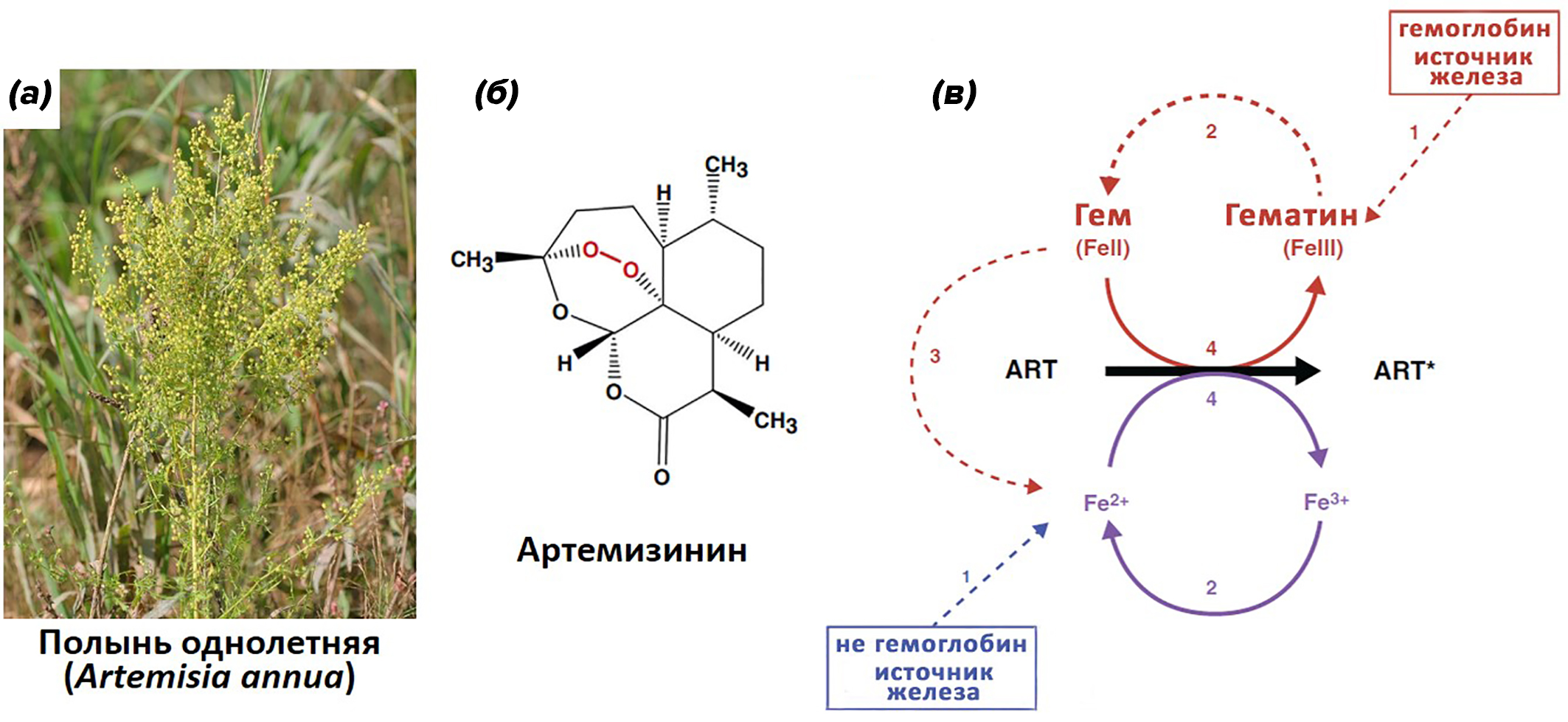
Рисунок 18. (а) — фотография растения Полынь однолетняя. (б) — структура артемизинина; красным выделен эндопероксидный мостик, который отвечает за проявления противопаразитарной активности. (в) — потенциальные пути активации артемизинина (ART). Восстановленное железо (Fe2+) или гем (4) активируют артемизинин (АРТ*). Активаторы могут быть гемоглобинзависимые и негемоглобинзависимые; показано пунктирными линиями на рисунке б. Гематин образуется при разложении гемоглобина (1, красный) в кислой среде. Он может диффундировать в цитоплазму плазмодия, где будет восстанавливаться с образованием гема (2, красный). Некоторые из молекул гема могут расщепляться с высвобождением Fe2+ (3, красный), пополняя пул лабильного железа паразита (1, синий).
Несмотря на эффективность и короткий период полураспада, низкая биодоступность и необходимость выращивания растений для получения артемизинина стимулировали поиск полусинтетических и полностью синтетических альтернатив [34]. Наиболее широко используемыми производными артемизинина являются полусинтетические препараты первого поколения — артесунат и артеметр. Показана их высокая эффективность при лечении малярии, шистосомоза, клонорхоза и других гельминтозов, вызванных паразитами-гематофагами [35].
В настоящее время продолжается работа по изучению антигельминтной эффективности производных артемизиниа (артесуната и артеметра) против описторхоза, вызванного гематофагом Opisthorchis felineus, на модели лабораторных животных.
Эта работа выполняется при финансовой поддержке РНФ и правительства Новосибирской области (грант № 23-25-10093).
Литература
- Deborah Chiabrando, Francesca Vinchi, Veronica Fiorito, Sonia Mercurio, Emanuela Tolosano. (2014). Heme in pathophysiology: a matter of scavenging, metabolism and trafficking across cell membranes. Front. Pharmacol.. 5;
- Richard L Auten, Jonathan M Davis. (2009). Oxygen Toxicity and Reactive Oxygen Species: The Devil Is in the Details. Pediatr Res. 66, 121-127;
- Как понравиться вампиру, или За что комары так любят больных малярией?;
- Малярия. «Болотная лихорадка» тогда и сейчас;
- Alexander G. Maier, Kai Matuschewski, Meng Zhang, Melanie Rug. (2019). Plasmodium falciparum. Trends in Parasitology. 35, 481-482;
- Elizabeth A Ashley, Nicholas J White. (2014). The duration of Plasmodium falciparum infections. Malar J. 13;
- Nicholas J. White. (2018). Anaemia and malaria. Malar J. 17;
- Sergey Kapishnikov, Ernst Hempelmann, Michael Elbaum, Jens Als‐Nielsen, Leslie Leiserowitz. (2021). Malaria Pigment Crystals: The Achilles′ Heel of the Malaria Parasite. ChemMedChem. 16, 1515-1532;
- Keisuke Nakatani, Haruto Ishikawa, Shigetoshi Aono, Yasuhisa Mizutani. (2014). Identification of Essential Histidine Residues Involved in Heme Binding and Hemozoin Formation in Heme Detoxification Protein from Plasmodium falciparum. Sci Rep. 4;
- Gregory S Noland, Noelle Briones, David J Sullivan. (2003). The shape and size of hemozoin crystals distinguishes diverse Plasmodium species. Molecular and Biochemical Parasitology. 130, 91-99;
- Monika Chugh, Vidhya Sundararaman, Saravanan Kumar, Vanga S. Reddy, Waseem A. Siddiqui, et. al.. (2013). Protein complex directs hemoglobin-to-hemozoin formation in Plasmodium falciparum. Proc. Natl. Acad. Sci. U.S.A.. 110, 5392-5397;
- Donald P. McManus, David W. Dunne, Moussa Sacko, Jürg Utzinger, Birgitte J. Vennervald, Xiao-Nong Zhou. (2018). Schistosomiasis. Nat Rev Dis Primers. 4;
- Daniel G Colley, Amaya L Bustinduy, W Evan Secor, Charles H King. (2014). Human schistosomiasis. The Lancet. 383, 2253-2264;
- Joshua Ntajal, Mariele Evers, Thomas Kistemann, Timo Falkenberg. (2021). Influence of human–surface water interactions on the transmission of urinary schistosomiasis in the Lower Densu River basin, Ghana. Social Science & Medicine. 288, 113546;
- Patrick J. Skelly, Akram A. Da'dara, Xiao-Hong Li, William Castro-Borges, R. Alan Wilson. (2014). Schistosome Feeding and Regurgitation. PLoS Pathog. 10, e1004246;
- Marcus F. Oliveira, Stefan W. Kycia, Ariel Gomez, Aaron J. Kosar, D. Scott Bohle, et. al.. (2005). Structural and morphological characterization of hemozoin produced by Schistosoma mansoni and Rhodnius prolixus. FEBS Letters. 579, 6010-6016;
- Juliana B.R. Corrêa Soares, Clarissa M. Maya-Monteiro, Paula R.B. Bittencourt-Cunha, Geórgia C. Atella, Flávio A. Lara, et. al.. (2007). Extracellular lipid droplets promote hemozoin crystallization in the gut of the blood fluke Schistosoma mansoni. FEBS Letters. 581, 1742-1750;
- Jennifer F. Friedman, Hemal K. Kanzaria, Stephen T. McGarvey. (2005). Human schistosomiasis and anemia: the relationship and potential mechanisms. Trends in Parasitology. 21, 386-392;
- Пальцев А.И., Яхина С.В. (2008). Эпидемиология описторхидозов. Терапевтический Архив. 80, 89–92;
- Sithithaworn P., Andrews R.H., Mordvinov V.A., Pakharukova M.Y., Lvova M.N. Opisthorchis viverrini and Opisthorchis felineus. Encyclopedia of Food Safety (Second Edition). Academic Press, 2024. P.: 673–685;
- Men-Bao Qian, Xiao-Nong Zhou. (2021). Clonorchis sinensis. Trends in Parasitology. 37, 1014-1015;
- Irina A. Orlovskaya, Ludmila B. Toporkova, Maria N. Lvova, Irina V. Sorokina, Aleksey V. Katokhin, et. al.. (2018). Social defeat stress exacerbates the blood abnormalities in Opisthorchis felineus-infected mice. Experimental Parasitology. 193, 33-44;
- Byoung-Kuk Na, Jhang Ho Pak, Sung-Jong Hong. (2020). Clonorchis sinensis and clonorchiasis. Acta Tropica. 203, 105309;
- Banchob Sripa. (2003). Pathobiology of opisthorchiasis: an update. Acta Tropica. 88, 209-220;
- Maria Lvova, Mariya Zhukova, Elena Kiseleva, Oleg Mayboroda, Paul Hensbergen, et. al.. (2016). Hemozoin is a product of heme detoxification in the gut of the most medically important species of the family Opisthorchiidae. International Journal for Parasitology. 46, 147-156;
- Shu-hua Xiao, Jun Sun. (2017). Schistosoma hemozoin and its possible roles. International Journal for Parasitology. 47, 171-183;
- Thao-Thy Pham, Tracey J. Lamb, Katrien Deroost, Ghislain Opdenakker, Philippe E. Van den Steen. (2021). Hemozoin in Malarial Complications: More Questions Than Answers. Trends in Parasitology. 37, 226-239;
- Oleksii A. Skorokhod, Luisa Caione, Tiziana Marrocco, Giorgia Migliardi, Valentina Barrera, et. al.. (2010). Inhibition of erythropoiesis in malaria anemia: role of hemozoin and hemozoin-generated 4-hydroxynonenal. Blood. 116, 4328-4337;
- Márcia Boura, Rosangela Frita, Ana Góis, Tânia Carvalho, Thomas Hänscheid. (2013). The hemozoin conundrum: is malaria pigment immune-activating, inhibiting, or simply a bystander?. Trends in Parasitology. 29, 469-476;
- Виварий. Путь лабораторной мыши от заказа до исследований;
- «Элементы»: «Нобелевская премия по физиологии и медицине — 2015»;
- Wenchuan Ma, Victoria A. Balta, Rachel West, Katy N. Newlin, Ognjen Š. Miljanić, et. al.. (2021). A second mechanism employed by artemisinins to suppress Plasmodium falciparum hinges on inhibition of hematin crystallization. Journal of Biological Chemistry. 296, 100123;
- Nectarios Klonis, Darren J Creek, Leann Tilley. (2013). Iron and heme metabolism in Plasmodium falciparum and the mechanism of action of artemisinins. Current Opinion in Microbiology. 16, 722-727;
- Wanxing Eugene Ho, Hong Yong Peh, Tze Khee Chan, W.S. Fred Wong. (2014). Artemisinins: Pharmacological actions beyond anti-malarial. Pharmacology & Therapeutics. 142, 126-139;
- Jennifer Keiser, Urs Duthaler, Jürg Utzinger. (2010). Update on the diagnosis and treatment of food-borne trematode infections. Current Opinion in Infectious Diseases. 23, 513-520.