
Виртуальная гистология: раскраска для ИИ или новый подход к диагностике?
20 января 2026
Виртуальная гистология: раскраска для ИИ или новый подход к диагностике?
- 139
- 0
- 0
Виртуальная гистология — новейший метод, позволяющий при помощи нейросети окрасить образцы тканей, что значительно экономит силы и время врачей и лаборантов.
Рисунок в полном размере.
генерация Gemini 3.0
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Искусственный интеллект (ИИ) все больше входит в самые разные сферы нашей жизни, включая такую сложную и ответственную, как медицина. И пока биоэтики ведут горячие споры о допустимости использования нечеловеческого интеллекта для спасения человеческих жизней, программисты придумали новое применение ИИ в диагностике — виртуальная гистология. Это новая технология, когда ИИ имитирует результат различных гистологических окрашиваний. Нейросеть анализирует фотографию среза ткани, причем образец может быть как неокрашенным, так и уже обработанным каким-либо красителем. Затем нейросеть генерирует картинку, в точности имитирующую результат нужного химического окрашивания. Таким образом, одно стеклышко превращается в бесконечный источник данных, позволяя врачам видеть невидимые структуры без лишних манипуляций.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в спецноминации «Искусственный интеллект в биологии» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания Центральный университет в лице совместной с институтом AIRI Лаборатории ИИ, анализа данных и моделирования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Разные типы окрасок! Как получаются эти разноцветные картинки?
Для начала разберемся, как работает гистологическая окраска.
Представьте себе листок бумаги с рисунком, выполненным белыми восковыми мелками. Если равномерно нанести на него акварельную краску — она останется на бумаге, но не останется на мелках — они оттолкнут краску. И мы сможем увидеть четкий контур (рис. 1а). Затем на тот же листок мы нанесем прозрачный клей и посыпем блестками — после того, как мы стряхнем их с листка, блестки прикрепятся только туда, где был клей, и мы сможем увидеть ранее невидимый контур (рис. 1б). Примерно так работает гистология — краска наносится, связывается с одними структурами и отталкивается от других, затем смывается — и мы видим четкую картинку (рис. 1в, г) [1]. Часто в одной окраске используются два красителя — это позволяет более четко увидеть особенности ткани.
Гистология начала активно развиваться в XIX веке, когда было открыто множество красителей, и биологи начали пробовать их на всех доступных образцах ткани. Это дало возможность различить ранее невидимые структуры клеток (например, ядра, ядрышки и митохондрии). С тех пор методики окрашивания активно прогрессировали, но некоторые красители, впервые опробованные около двух столетий назад, до сих пор используются в научной и клинической практике [2].
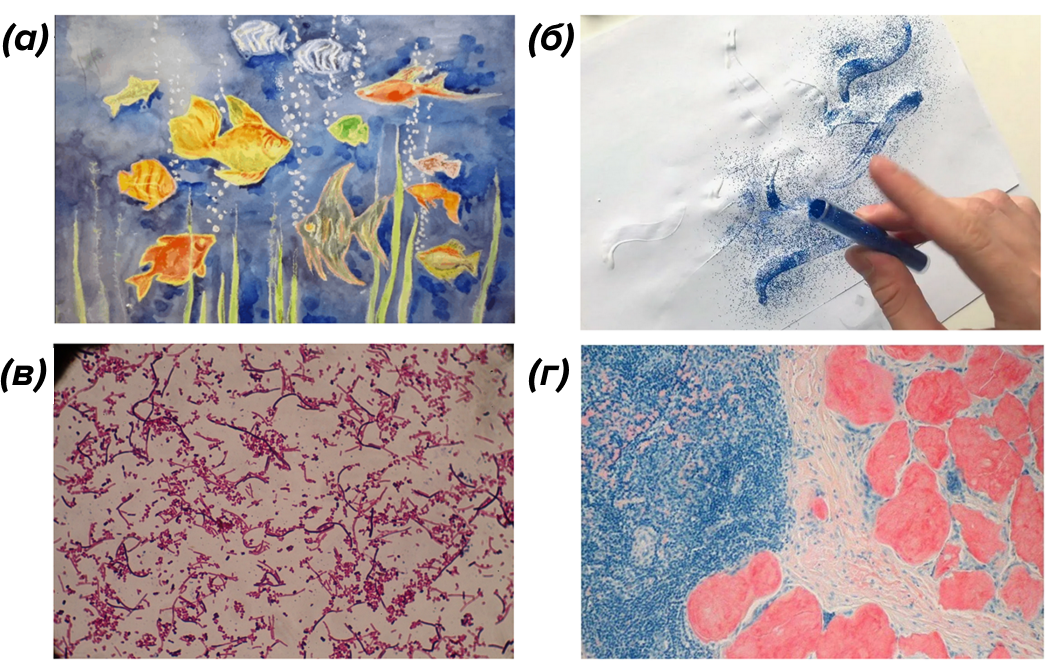
Рисунок 1. Различные типы окраски. (а) — рисунок мелками и акварелью: акварельная краска рисует на чистой бумаге, но не поверх рисунка мелком; (б) — рисунок блестками поверх клея: сначала клеем нанесли невидимый контур, затем посыпали блестками, которые в результате остались только поверх контура; (в) — окраска по Граму: грамположительные бактерии имеют толстую клеточную стенку, которая сохраняет первичную окраску (например, кристаллический фиолетовый). Грамотрицательные бактерии имеют более тонкий слой пептидогликана, который позволяет вымывать кристаллический фиолетовый при добавлении этанола. В результате микробы обесцвечиваются, а затем окрашиваются контрастным красным красителем (фуксином или сафранином); (г) — окраска Конго красным: красный краситель связывается только с амилоидом.
Своеобразной «классикой» в гистологии стала окраска гематоксилином и эозином (рис. 2). Это самый простой и рутинный метод, с которого начинается диагностика. Принцип действия здесь основан на базовых химических свойствах клетки: гематоксилин связывается с кислотами, окрашивая клеточные ядра в насыщенный фиолетовый цвет, а эозин реагирует с белками, придавая цитоплазме и межклеточному веществу различные оттенки розового. Часто этого двухцветного контраста хватает для оценки общей архитектуры ткани, но для сложной диагностики, особенно в онкологии, простой «розово-фиолетовой» картины становится мало. Одной этой окраски редко хватает для окончательного вердикта [3], [4].
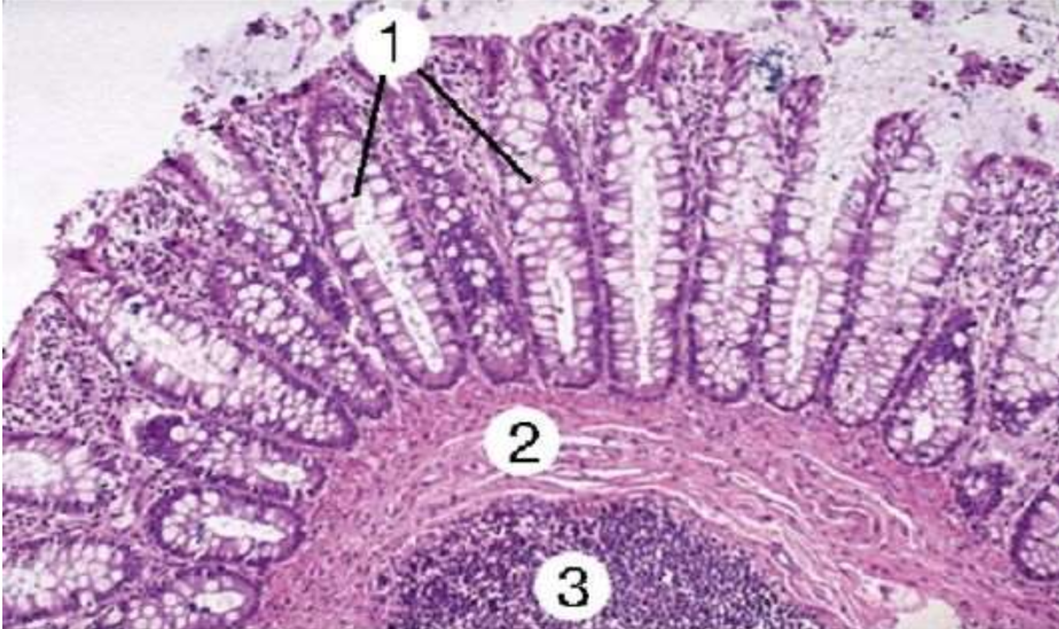
Рисунок 2. Пример окраски гематоксилин-эозином ткани почки. Ядра окрашены фиолетовым, цитоплазма — розовым. В зависимости от структуры ткани, варьируется насыщенность цвета и близость к розовому или фиолетовому.
Когда нужно выделить конкретные компоненты, которые теряются на общем фоне, в дело вступают специальные гистохимические окраски. Цель таких методов — подсветить конкретные структуры. Например, реакция с использованием йодной кислоты и реактива Шиффа позволяет выявить углеводы, а метод трихром Массона используют для четкого выделения соединительной ткани, что помогает врачу увидеть скрытые детали строения органа [1].
Самым же сложным и высокотехнологичным уровнем является иммуногистохимия [5] (ИГХ) (рис. 3). Этот метод был разработан в 1941 году Альбертом Кунсом и с тех пор прошел через множество модификаций, хотя сам принцип его работы остался неизменным [6]. ИГХ критически важна для современной онкодиагностики, так как позволяет определить не только тип ткани, но и многие свойства опухоли: чувствительность к разным лекарствам, скорость роста, вероятность метастазирования. ИГХ работает как «молекулярный детектив»: она выявляет присутствие или отсутствие специфических белков. С помощью подобных технологий исследователи могут «поймать» в срезе ткани почти любые молекулы и понять, сколько их и где именно они находятся [5]. Суть метода заключается в использовании антител, которые распознают уникальные последовательности аминокислот — эпитопы — в ткани. Это работает по принципу «ключ к замку»: если искомый белок в образце есть, антитело связывается с ним [7]. Для обеспечения высокой точности в таких методиках чаще всего применяют моноклональные антитела — идентичные молекулы, которые гарантированно распознают один и тот же участок антигена [5].
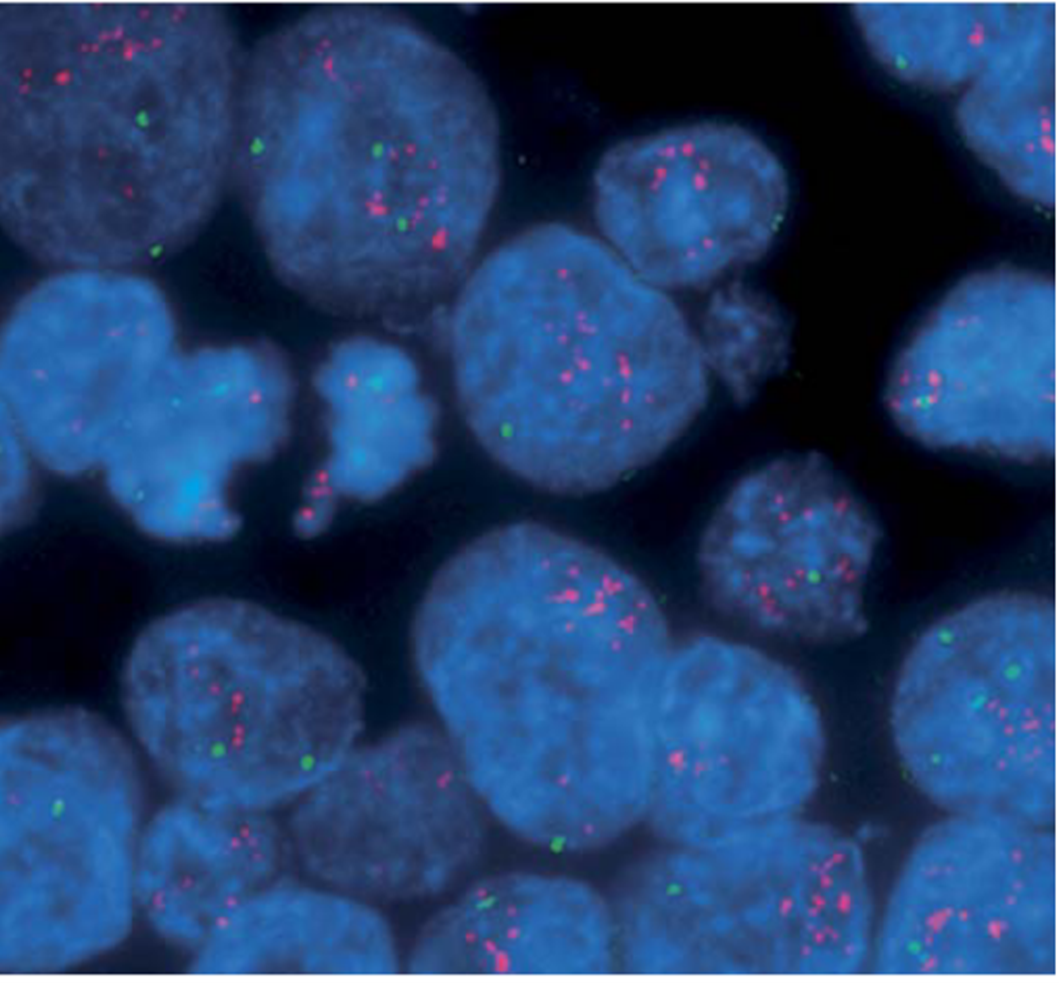
Рисунок 3. Пример иммуногистохимической окраски. Рак молочной железы. Красный цвет — HER2, зеленый — CEN. Цветное свечение создается флюуресцентными метками.
Чтобы врач мог увидеть этот процесс под микроскопом, к реакции добавляют специальные метки: ферменты, создающие цветной осадок, или флуоресцентные молекулы, которые начинают светиться. Высокая специфичность иммуногистохимии позволяет различать подтипы опухолей, которые при обычной окраске выглядят совершенно одинаково, но требуют принципиально разного лечения. Именно поэтому в сложной диагностике редко полагаются на один метод, применяя целый спектр окрашиваний для получения полной картины болезни [7].
Почему так долго? Путь биоптата от пациента до предметного стекла
Путь к диагнозу начинается в операционной, где хирург выполняет биопсию — забирает небольшой фрагмент органа или ткани. Однако просто посмотреть на этот кусочек под микроскопом нельзя: даже если для нашего глаза он очень маленький, для микроскопа биоптат слишком толстый и непрозрачный.
Чтобы превратить биоматериал в препарат, пригодный для изучения, он должен пройти несколько этапов подготовки:
- Фиксация: сразу после биопсии образец обрабатывают специальными растворами (чаще всего формалином). Это останавливает процессы разложения и «консервирует» структуру клеток, сохраняя их максимально близкими к прижизненному состоянию.
- Нарезка: после уплотнения (обычно ткань заливают в парафин) блок режут на тончайшие пластинки — срезы толщиной всего в несколько микрометров.
- Окрашивание: полученные «слайсы» приклеивают на предметные стекла и красят (рис. 4).
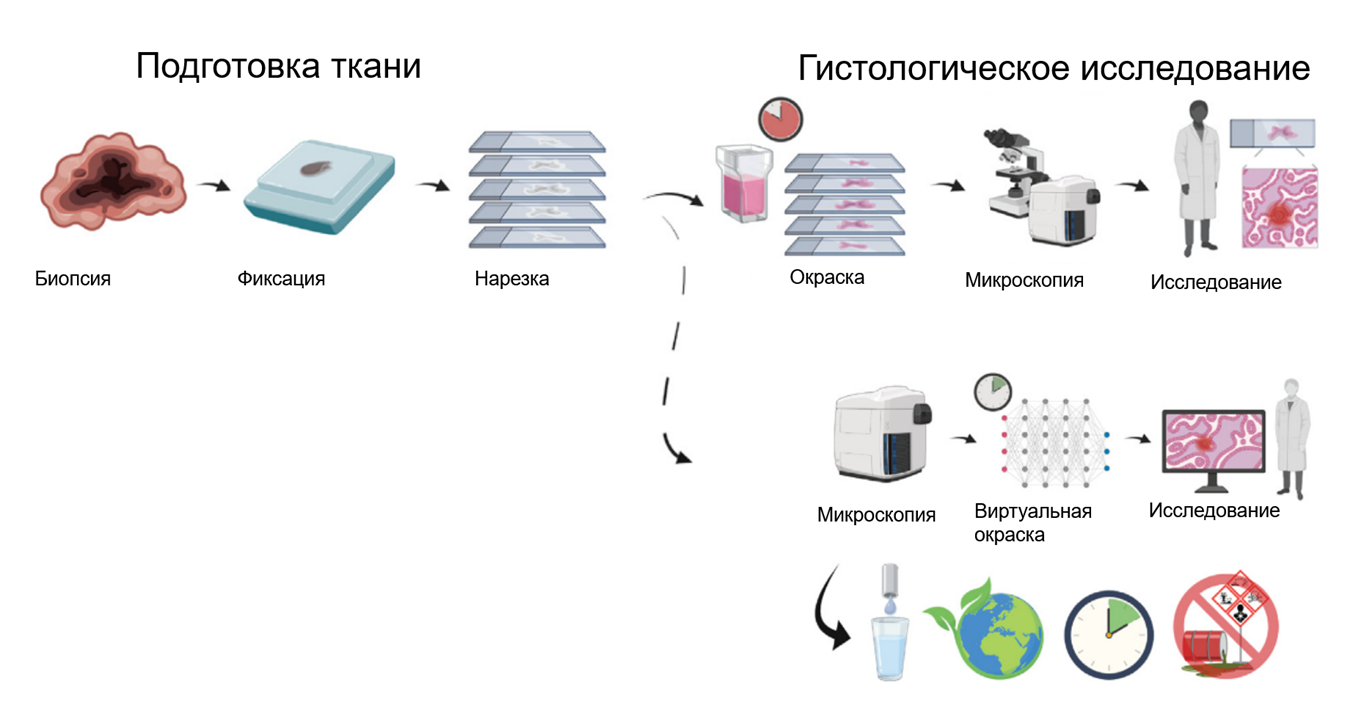
Рисунок 4. Процесс гистологического исследования: классический и с применением ИИ. В обоих методах проводится биопсия, фиксация и нарезка. В классическом методе после этого проводится окраска и микроскопия, потом эти два этапа повторяются многократно для разных красителей. Применение ИИ позволяет провести микроскопию неокрашенного среза, а затем получить «виртуальное» изображение, что дает возможность сэкономить время и реактивы.
адаптировано из [8]
Как мы уже отмечали, одной окраски для полноценного исследования часто недостаточно. Лаборанты обычно готовят целую серию стекол из одного образца — это долгая и кропотливая работа. Каждое из них проходит свою процедуру окрашивания.
Только когда весь набор препаратов готов, они попадают на стол к патологоанатому. Врач изучает срезы под микроскопом, сопоставляет данные с разных стекол и на основе этой полной картины формирует свое заключение [8]. (А в сложных случаях советуется с коллегами по больнице или даже пишет «титулованным» специалистам.)
Так что же может привнести ИИ в гистологию?
Дело в том, что большое количество окрасок — это большие затраты труда, времени и реактивов. Кроме того, лаборанты могут хорошо уметь делать стандартные для их лаборатории окрашивания, но плохо — те, которые последний раз видели в институте; или же новые, недавно введенные в клиническую практику. Это может негативно повлиять на качество диагноза. Использование ИИ позволяет покрасить срез только один раз (а то и не красить вообще), снять на микроскоп и перекрасить в любую нужную окраску [8–10].
Как работает виртуальная гистология?
Допустим, у нас есть черно-белая картинка с лимоном. Даже на таком изображении большинство из нас узнают лимон. И если нас попросят раскрасить картинку — мы уверенно возьмем в руки желтый карандаш.
А что с яблоками? Казалось бы, яблоко можно покрасить и в красный, и в желтый, и в зеленый — а также в любую их комбинацию. Но, например, продавец яблок с 30-летним стажем даже по черно-белой фотографии поймет, где гренни смит, а где ред делишес (рис. 5).

Рисунок 5. Сумеете раскрасить яблоки? (а), (в) — гренни смит; (б), (г) — ред делишес. У яблок разных сортов разная форма, разные семечки, разный узор на кожуре.
Так же и должна работать виртуальная гистология — увидев на неокрашенном или окрашенном гематоксилин-эозином срезе структуру, которая при перекраске даст яркую окраску антителами, нейросеть должна «вспомнить» это — и покрасить препарат правильно.
Таким образом, суть виртуальной гистологии заключается в том, что, увидев большое количество снимков до и после целевой окраски, нейросеть научится выделять специфические паттерны. Это позволит ей генерировать нужное окрашивание самостоятельно.
А теперь углубимся в технические детали!
Обучение моделей виртуальной гистологии — это многоэтапный процесс, который начинается задолго до того, как нейронная сеть начнет работать. Ученые затрачивают максимальные усилия для подготовки данных, ведь качество и количество обучающих данных имеют первостепенное значение (рис. 6).
Ключевую роль играет различие между парными и непарными данными:
- Парные данные: для каждого входного изображения существует соответствующее ему эталонное изображение. Например, один и тот же срез ткани, сфотографированный без окрашивания, а затем химически окрашенный и снова сфотографированный. Этот тип данных идеален для контролируемого обучения (supervised learning), где модель может напрямую сравнивать свои предсказания с «правильным» ответом [9], [10].
- Непарные данные: есть два набора изображений с разными окрасками, но нет идеального попиксельного соответствия между конкретными изображениями из этих наборов. Этот тип данных используется для неконтролируемого обучения (unsupervised learning), где модель учится сопоставлять распределения изображений между доменами [9], [10].
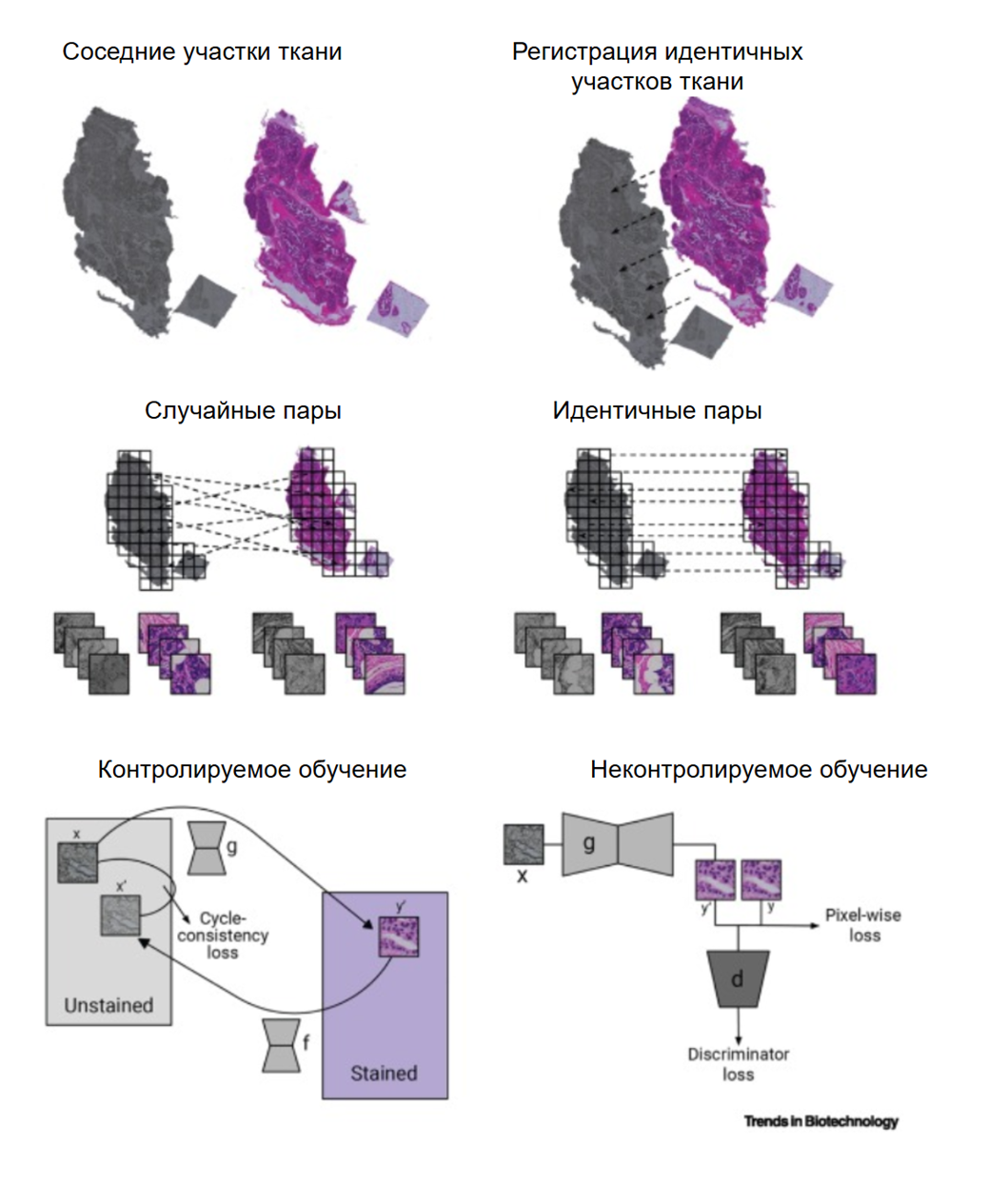
Рисунок 6. Контролируемое и неконтролируемое обучение в виртуальной гистологии. Два подхода к виртуальному окрашиванию различаются тем, как ИИ учится превращать бесцветные снимки в цветные. В неконтролируемом методе используются соседние срезы ткани. Поскольку они похожи, но не идентичны, их нельзя идеально совместить пиксель к пикселю. Снимки просто режут на кусочки и перемешивают, а сложная нейросеть (CycleGAN) учится переносить «стиль» окрашивания с одного изображения на другое, проверяя себя через обратное преобразование. В контролируемом методе один и тот же срез снимают дважды: до и после реального окрашивания. Эти снимки программно накладывают друг на друга так, чтобы каждая клетка совпала идеально. Изображения режут на пары фрагментов с сохранением этого выравнивания. Здесь ИИ работает проще: он раскрашивает бесцветный фрагмент и сразу сравнивает результат с оригиналом, исправляя ошибки в каждом пикселе.
Подготовка данных включает: 1) регистрацию изображений — то есть их выравнивание, достижение максимально возможного соответствия между двумя наборами; 2) нормализацию снимков — снижение вариабельности, например, искусственное приведение всех картинок к одинаковой интенсивности; 3) удаление артефактов — очистка данных от пыли, пузырьков воздуха или деформированных участков ткани, которые могут ввести модель в заблуждение [11] (рис. 6).
Наконец, в дело вступают нейронные сети, способные «выучить» закономерности в изображениях и перенести их из одного представления в другое. Искусственные нейронные сети — математические модели, работа которых отчасти имитирует деятельность человеческого мозга. Они состоят из множества соединенных между собой простых функций — искусственных нейронов, организованных в слои. Эти нейроны принимают сигналы, обрабатывают их и передают дальше, а в процессе обучения веса связей между нейронами корректируются так, чтобы сеть могла находить закономерности в данных [12].
Наиболее распространенными и эффективными архитектурами для данной задачи являются генеративно-состязательные сети (GANs), также могут дополнительно использоваться сверточные нейронные сети (CNNs) [9], [10].
GAN — это архитектура, которая позволяет создавать реалистичные искусственные изображения, почти неотличимые от настоящих гистологических слайдов. Их уникальность заключается в состязательном обучении двух компонентов:
- Генератор: эта сеть обучается преобразовывать любые входные изображения в целевые. Его задача — создать изображение, которое выглядит максимально правдоподобно. В нашем случае неокрашенные срезы тканей превращаются в окрашенные, например, гематоксилин-эозином.
- Дискриминатор: эта сеть, в свою очередь, является «критиком» или «экспертом». Она учится отличать изображения, созданные Генератором, от реальных. Такой подход важен в медицине, потому что восприятие человека часто вносит когнитивные искажения и ошибки, вызванные, например, усталостью [13]. В нашем случае он отличает, например, реальную окраску гематоксилин-эозином от виртуальной имитации.
В процессе обучения Генератор и Дискриминатор долго (т.е. на протяжении большого количества итераций, а не долго по времени) играют в «кошки-мышки»: Генератор пытается обмануть Дискриминатор, создавая всё более убедительные подделки, а Дискриминатор совершенствуется в их разоблачении. Этот антагонистический процесс приводит к тому, что Генератор достигает высоких результатов в создании фотореалистичных изображений [14] (рис. 7).
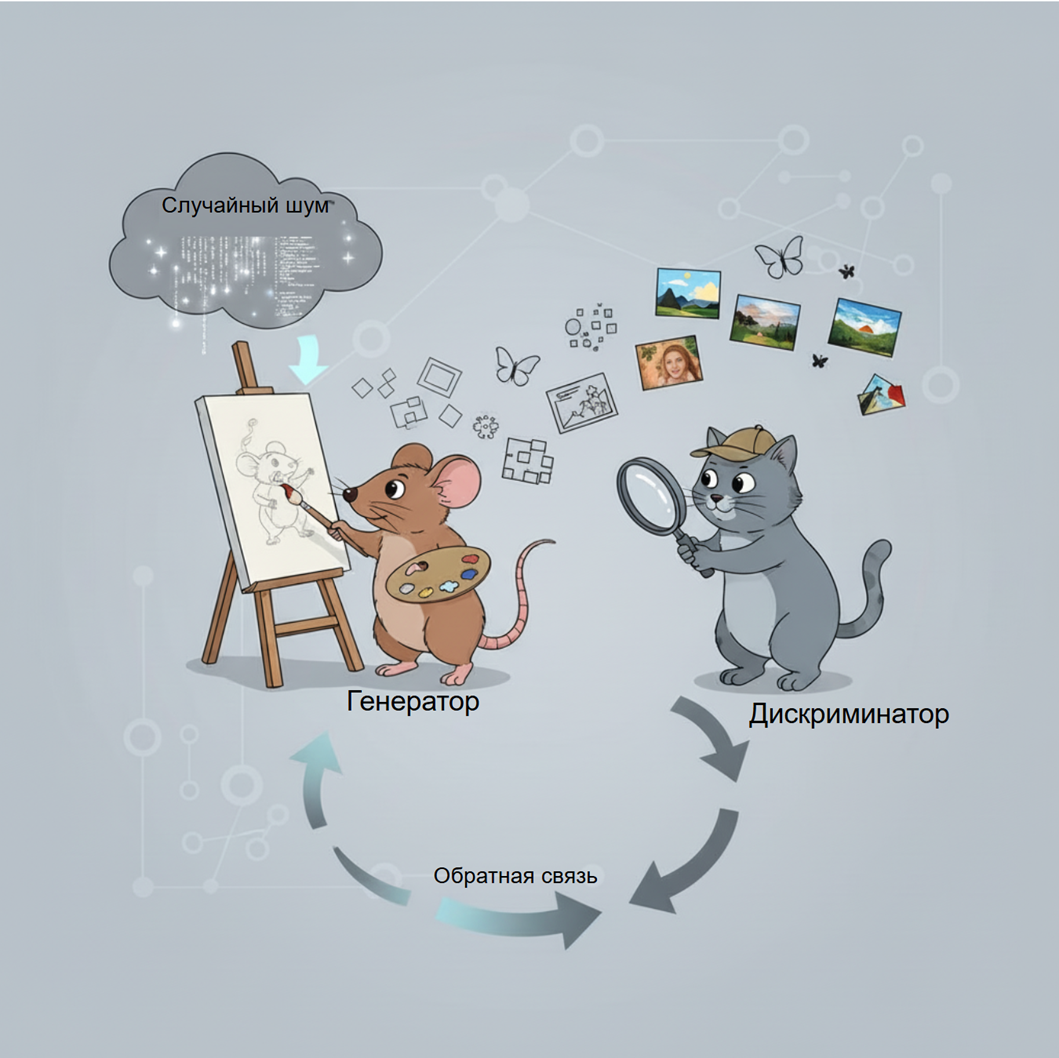
Рисунок 7. Архитектура GAN. Генератор создает изображения из случайного шума, Дискриминатор проверяет их подлинность. Процесс повторяется, пока Генератору не удается обмануть Дискриминатор.
генерация Gemini 3.0
Среди специализированных для виртуальной гистологии архитектур GAN следует упомянуть (рис. 8) [15]:
- Pix2Pix требует наличия парных обучающих данных, то есть для каждого входного изображения должно найтись идеально соответствующее ему целевое изображение. Она учится напрямую отображать из входных данных выходные, что делает ее очень точной при наличии хорошо подобранных пар, но почти бесполезной без выравнивания. Принцип действия Pix2Pix можно сравнить с работой переводчика технических или юридических текстов — им необходимо сохранить все детали, меняя только язык изложения. Так и архитектура Pix2Pix позволяет получить изображения, где меняются только цвета [9], [10], [12].
- CycleGANs: эта вариация используется, когда нет прямых парных изображений — если в лаборатории нельзя получить один и тот же срез ткани, окрашенный двумя разными способами. CycleGANs используют принцип «циклической согласованности», гарантируя, что, если изображение преобразовать из одного стиля в другой, а затем обратно, оно останется максимально похожим на оригинал. Это позволяет «учить» преобразования стилей окрашивания даже при отсутствии идеально совпадающих данных. Если Pix2Pix — это технический переводчик, то CycleGAN — скорее литературный, чья задача адаптировать текст, но сохранить весь его смысл [9], [10], [12].
- Cascaded GAN (C-DNN): это более сложная система, где несколько GANs работают последовательно, каждая из них по-своему улучшает качество преобразования. Например, одна сеть может заниматься общим преобразованием, а следующая — тонкой корректировкой деталей, что особенно полезно для сложных трансформаций окрашивания [9], [10], [12].
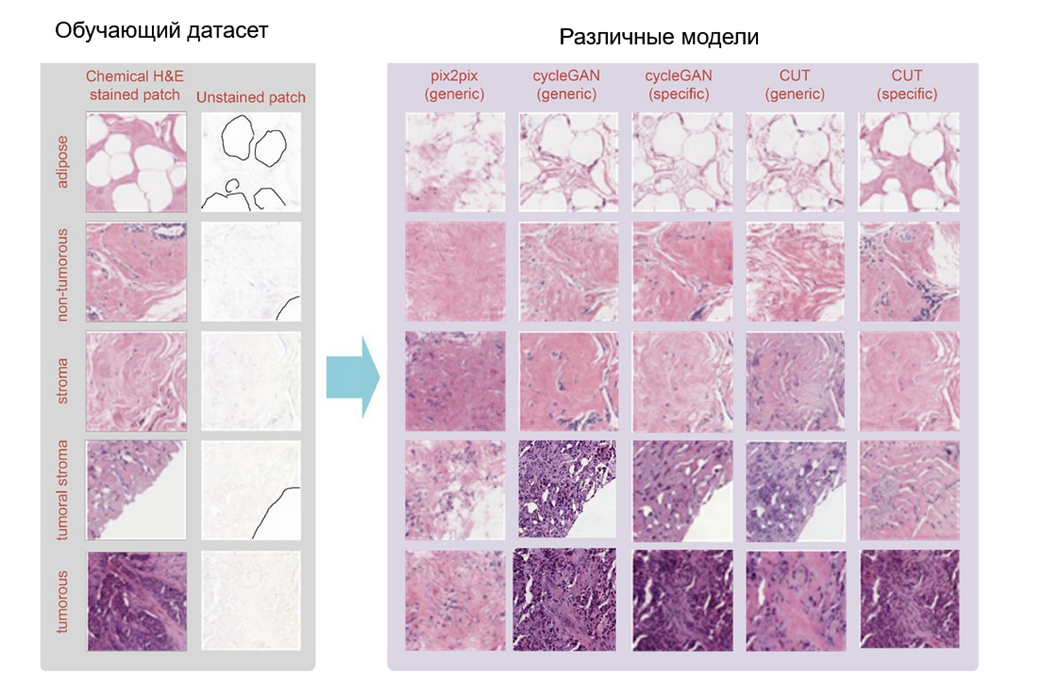
Рисунок 8. Как разные архитектуры справляются с непарным датасетом? Pix2pix менее устойчива по сравнению с CycleGan, поскольку ее работа основана на идеальном соответствии входных изображений. Это видно по различиям между H&E в обучающем датасете и виртуальной окраской.
Сверточные нейронные сети (CNNs) являются фундаментальной технологией в компьютерном зрении и широко используются в виртуальной гистологии благодаря своей способности автоматически изучать иерархические признаки непосредственно из необработанных изображений. Именно благодаря CNN произошел прорыв в 2012 году, когда нейросеть AlexNet выиграла конкурс по распознаванию изображений [13]. В в медицинских задачах такие сети помогают заменить расплывчатые словесные описания врачей на четкие количественные характеристики и измерения по строгому алгоритму [13]. Применение CNN позволяет не только автоматизировать рутинные задачи, но и диагностировать сложные для врачей патологии [16].
CNN могут выявлять сложные закономерности в тканевых структурах без необходимости ручного определения этих признаков человеком [1`]. В задачах виртуальной гистологии они могут выявлять сложные закономерности в тканевых структурах без необходимости ручного определения этих признаков человеком [1`]. Но CNN остается вспомогательной архитектурой, в то время как GAN является основой, к которой добавляются различные элементы.
А судьи кто? Как определить, что нейросеть ошиблась?
Обучение нейронных сетей направляется функциями потерь, которые измеряют «ошибку» модели и указывают, в каком направлении следует корректировать веса сети. В GANs используется адверсариальная потеря — специальная метрика, показывающая, насколько хорошо Генератор смог «обмануть» Дискриминатора. Именно эта функция вынуждает Генератор создавать всё более реалистичные изображения [11].
Также могут использоваться пиксельные функции потерь: они измеряют различия на уровне отдельных пикселей между сгенерированным и эталонным изображениями. Такие потери важны в контролируемом обучении и часто включаются в функцию потерь Генератора, чтобы предотвратить «галлюцинации» и обеспечить точное воспроизведение деталей [8], [9].
В свою очередь, в неконтролируемом обучении CycleGANs используются функции потерь циклической согласованности. Они гарантируют, что преобразование изображения из одной окраски в другую и обратно приводит к изображению, максимально схожему с исходным. Это позволяет модели изучать осмысленные преобразования даже без прямых парных соответствий [9].
Интересным методом являются функции потерь регуляризации: они используются для обеспечения гладкости сгенерированных изображений и подавления шума или артефактов, создаваемых Генератором [8], [9].
Некоторые продвинутые методы используют «перцепционные» потери, которые сравнивают высокоуровневые признаки (извлеченные из предобученных CNN), а не просто пиксели. Это позволяет моделям генерировать изображения, которые выглядят более естественными [8], [9].
После обучения модели ее необходимо тщательно оценить. Различные метрики помогают количественно определить, насколько хорошо виртуально окрашенные изображения соответствуют реальным, сохраняют ли они диагностически важную информацию и насколько они реалистичны.
Когда доступны парные эталонные данные, модели оцениваются по их способности точно воспроизводить эти эталоны [8], [9]:
- Индекс структурного сходства (Structural Similarity Index Measure, SSIM) оценивает сходство двух изображений с точки зрения яркости, контраста и структуры. Высокое значение SSIM (близкое к 1) указывает на то, что виртуально окрашенное изображение не только похоже по пикселям, но и сохраняет ключевые структурные особенности тканей, что критически важно для патологического анализа.
- Пиковое отношение сигнал/шум (Peak Signal-to-Noise Ratio, PSNR) измеряет отношение максимальной возможной мощности сигнала к мощности искажающего шума. Более высокие значения PSNR указывают на лучшее качество изображения с меньшим шумом и искажениями на пиксельном уровне. Чаще используется для оценки общей точности воспроизведения пикселей.
- Средняя абсолютная ошибка (MAE) и среднеквадратичная ошибка (MSE) напрямую измеряют среднее отличие пиксельных значений. Они дают количественную оценку точности на уровне пикселей, но не всегда коррелируют с человеческим восприятием качества изображения так же хорошо, как SSIM.
- Когда парные данные отсутствуют, и модель учится сопоставлять распределения изображений, применяется, например, Fréchet Inception Distance (FID), которая оценивает сходство распределений между признаками реальных и сгенерированных изображений. FID использует признаки, извлеченные из предобученной глубокой нейронной сети, чтобы оценить, насколько «реалистичны» и «разнообразны» сгенерированные изображения. Низкие значения FID указывают на то, что сгенерированные изображения более похожи на реальные по своему распределению, что подразумевает более высокую реалистичность и качество. Это особенно важно для оценки CycleGANs и других моделей, обученных на непарных данных [8], [9].
Помимо численных метрик, критически важна экспертная оценка патологов. Именно они, основываясь на своем опыте, могут подтвердить, сохраняют ли виртуально окрашенные изображения всю необходимую диагностическую информацию и пригодны ли они для клинического применения. Сочетание строгих количественных метрик и экспертного заключения человека является залогом успешного внедрения виртуальной гистологии в медицинскую практику [7–9].
Что же дальше?
Виртуальная гистология — достаточно молодая область исследований. Сейчас выпускается множество статей, разрабатываются и тестируются новые архитектуры и способы улучшения качества данных. К сожалению, идеальной архитектуры так и не было создано: врачи-патологи и их верные лаборанты пока что работают эффективнее даже самых крутых нейросетей. Но это лишь первые шаги, а в будущем виртуальная гистология позволит нам за секунды получать результаты, которые раньше приходилось ждать часами и днями. Кто знает, сколько жизней таким образом будут спасены?
Литература
- Улумбеков Э. Г. Гистология, эмбриология, цитология : учебник для вузов. Под ред. Э. Г. Улумбекова, Ю. А. Челышева. — 3-е изд. Москва: «ГЭОТАР-Медиа», 2012. — 480 с.;
- 12 методов в картинках: микроскопия;
- Иванова В.В. Гистологический практикум: учебное пособие. Томск: Изд-во СибГМУ, 2023. — 81 с.;
- Бойчук Н. В., Исламов Р. Р., Кузнецов С. Л., Челышев Ю. А. Гистология. Атлас для практических занятий. Москва: «ГЭОТАР-Медиа», 2010. — 160 с.;
- 12 методов в картинках: иммунологические технологии;
- Краткая история открытия и применения антител;
- George L. Kumar, Lars Rudbeck. Иммуногистохимические методы: Руководство. Пер. с англ. под ред. Г.А. Франка и П.Г. Малькова. — М.: DAKO, 2011. — 224 с.;
- Leena Latonen, Sonja Koivukoski, Umair Khan, Pekka Ruusuvuori. (2024). Virtual staining for histology by deep learning. Trends in Biotechnology. 42, 1177-1191;
- Muhammad Talha Imran, Imran Shafi, Jamil Ahmad, Muhammad Fasih Uddin Butt, Santos Gracia Villar, et. al.. (2024). Virtual histopathology methods in medical imaging - a systematic review. BMC Med Imaging. 24;
- Bijie Bai, Xilin Yang, Yuzhu Li, Yijie Zhang, Nir Pillar, Aydogan Ozcan. (2023). Deep learning-enabled virtual histological staining of biological samples. Light Sci Appl. 12;
- Yair Rivenson, Hongda Wang, Zhensong Wei, Kevin de Haan, Yibo Zhang, et. al.. (2019). Virtual histological staining of unlabelled tissue-autofluorescence images via deep learning. Nat Biomed Eng. 3, 466-477;
- История развития искусственного интеллекта и его пришествия в биологию;
- Глаза прогресса: как глубокое обучение помогает видеть невидимое для человека;
- Parmida Ghahremani, Yanyun Li, Arie Kaufman, Rami Vanguri, Noah Greenwald, et. al.. (2022). Deep learning-inferred multiplex immunofluorescence for immunohistochemical image quantification. Nat Mach Intell. 4, 401-412;
- Jesus Salido, Noelia Vallez, Lucía González-López, Oscar Deniz, Gloria Bueno. (2023). Comparison of deep learning models for digital H&E staining from unpaired label-free multispectral microscopy images. Computer Methods and Programs in Biomedicine. 235, 107528;
- Народные сказки об искусственном интеллекте в распознавании медицинских изображений.







