
Вирус Зика — глобальная угроза?
23 сентября 2016
Вирус Зика — глобальная угроза?
- 4463
- 0
- 4
Реконструкция оболочки вируса Зика. Карта поверхности вириона (разрешение — 3,8 Å), полученная с помощью программной обработки криоэлектронных микрофотографий, позволяет предположить, как именно вирус поражает те или иные клетки, и вычислить потенциальные мишени для терапии или компоненты для вакцины. Симметрически неэквивалентные мономеры вирусного гликопротеина Е окрашены разными цветами.
-
Автор
-
Редакторы
Десятилетиями научное сообщество не обращало внимания на вирус Зика, поражавший жителей далекой Африки и уж совсем редко — Азии. Да и для тех мест это был «мелкий калибр» — то ли дело холерный вибрион или вирус Эбола! Его практически не изучали, и потому мировое сообщество оказалось неподготовленным к стремительному распространению вируса по всем континентам всего за несколько лет. Насколько опасен вирус Зика? Как он устроен? Что мы можем ему противопоставить и какие выводы сделать из сложившейся ситуации?
Когда в 1947 году вирус Зика (ZIKV) был обнаружен впервые, ему не уделили должного внимания. Вплоть до сообщения 2015 года о бразильской волне микроцефалии новорожденных. Обеспокоенная масштабом вспышки лихорадки Зика и серьезностью ассоциированных с ней дефектов, ВОЗ обнародовала заявление Комитета Международных медико-санитарных правил (ММСП) о чрезвычайной ситуации, связанной с вирусом Зика. Мировое научное сообщество ответило на это заявление потоком исследований, направленных на понимание функционирования вируса Зика и управление им.
В эпоху глобализации из-за свободного перемещения людей по миру проникновение ZIKV в новые регионы становится неизбежным. Там он может длительно сохраняться, передаваясь от животных к животным и изредка вызывая мелкие вспышки болезни у людей, либо циркулировать в человеческой популяции. Угроза, исходящая от любого нового заболевания, зависит от его эпидемиологии, клинических особенностей и способности медицинского сообщества эффективно его контролировать (рис. 1). И сейчас огромные усилия брошены на изучение особенностей вируса Зика и механизмов его воздействия на человеческое здоровье, в особенности — на здоровье беременных [1].

Рисунок 1. Сотрудник муниципальной службы города Ресифи (Бразилия) во время операции по уничтожению комаров Aedes aegypti, переносящих вирус Зика.
сайт inosmi.ru
Хронология событий в Зика-эпопее
В африканской Уганде неподалеку от города-порта Энтеббе у озера Виктория растет тропический лес Зика, чье название на местном лугандийском означает «заросший». Лес этот славится огромным разнообразием растений, бабочек и особенно комаров, которых там насчитали более 40 видов [2].
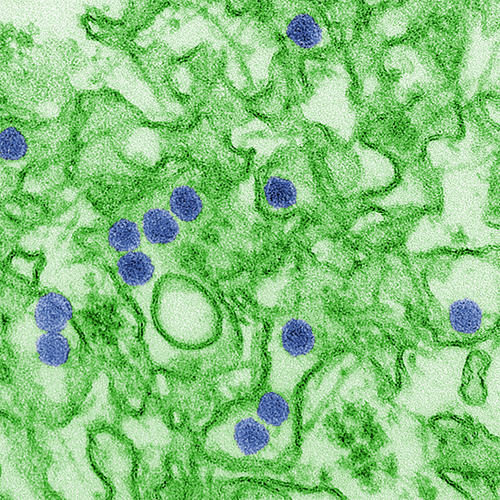
Рисунок 2. Микрофотография вируса Зика, полученная с помощью трансмиссионного электронного микроскопа (ТЭМ). Вирусные частицы размером 40 нм окрашены синим цветом.
В Энтеббе расположен Угандийский исследовательский институт вирусологии (Uganda Virus Research Institute, UVRI), чьи сотрудники в 1947 году при изучении желтой лихорадки в лесу Зика выделили из крови макаки до тех пор неизвестный флавивирус. Ученые описали его как вирус Зика (рис. 2). А на следующий год обнаружили вирус в комарах Aedes africanus [3].
В 1952 году вирус выявили уже у людей — в Уганде и Танзании, а в 1954 году — в Нигерии. ZIKV четко ассоциировался с лихорадкой и кожной сыпью, в связи с чем его окончательно объявили патогенным для человека. Тогда же, в 50-е, экспериментальным путем с участием добровольцев установили основного переносчика вируса — комара Aedes aegypti, обычного переносчика желтой лихорадки, лихорадки денге и чикунгуньи. Позже компанию ему составили и другие виды, в том числе Aedes albopictus [1].
В 60–80-е годы легкие формы инфекции выявляли в странах Африки, Азии и в Индии. Длительное присутствие ZIKV в этих регионах подтверждалось обнаружением вируса в комарах и нечеловекообразных обезьянах. У людей до 2007 года фиксировали не так много клинических случаев, и потому система здравоохранения не спешила бить тревогу [4].
Первую крупную вспышку лихорадки Зика зарегистрировали в 2007 году на острове Яп в тихоокеанских Федеративных штатах Микронезии, где инфицированными оказались 73% населения, однако симптомы у подавляющего большинства были умеренными и недолгими. Следующая вспышка охватила в 2013–2014 годах Французскую Полинезию, где заразились 66% жителей. Одновременная волна заболеваемости синдромом Гийена-Барре подняла вопрос о его ассоциации с вирусом Зика: тогда зафиксировали 42 случая — а это на порядок больше, чем в 2012 году, когда синдром диагностировали у троих [1].
В 2014 году лихорадка Зика распространилась по югу Тихого океана: в Новой Каледонии, на островах Кука и острове Пасхи. В конце года появились сообщения о первых подтвержденных случаях заражения в северо-восточной Бразилии (недавно установлено, что вирус тогда гулял и по Гаити). За следующие несколько месяцев ZIKV распространился по всей Бразилии.
В июле 2015 года предположили его связь с синдромом Гийена-Барре, а в октябре — с микроцефалией. В феврале 2016 года ВОЗ обнародовала первое заявление Комитета ММСП о чрезвычайной ситуации [1], [4]. Весной-летом 2016 связь инфекции с микроцефалией получила первые подтверждения, которые, правда, пока не позволяют утверждать однозначно, что «вирус Зика вызывает микроцефалию человеческого плода».
К 27 июля ZIKV циркулировал уже в 67 странах и территориях (рис. 3). Крупная вспышка заболевания произошла в Колумбии — там заразились 65 000 человек. У многих из них выявлялись неврологические синдромы, отмечались и случаи микроцефалии [1].
В июле 2016 зафиксировали две смерти, связанные с заражением ZIKV: в США и Пуэрто-Рико. Предполагают, что смерти вызвал не сам вирус, а обострившиеся во время лихорадки симптомы хронических заболеваний.
В середине августа 2016 года в Пуэрто-Рико ввели режим чрезвычайной ситуации, поскольку распространение вируса набирало обороты слишком быстро: за полгода (с декабря 2015 по 12 августа 2016) число заразившихся возросло с одного до 10 000 человек.
К 1 сентября в американской Флориде зарегистрировали 47 случаев заболевания, а в Майами-Бич впервые в США обнаружили трех комаров — переносчиков вируса Зика.
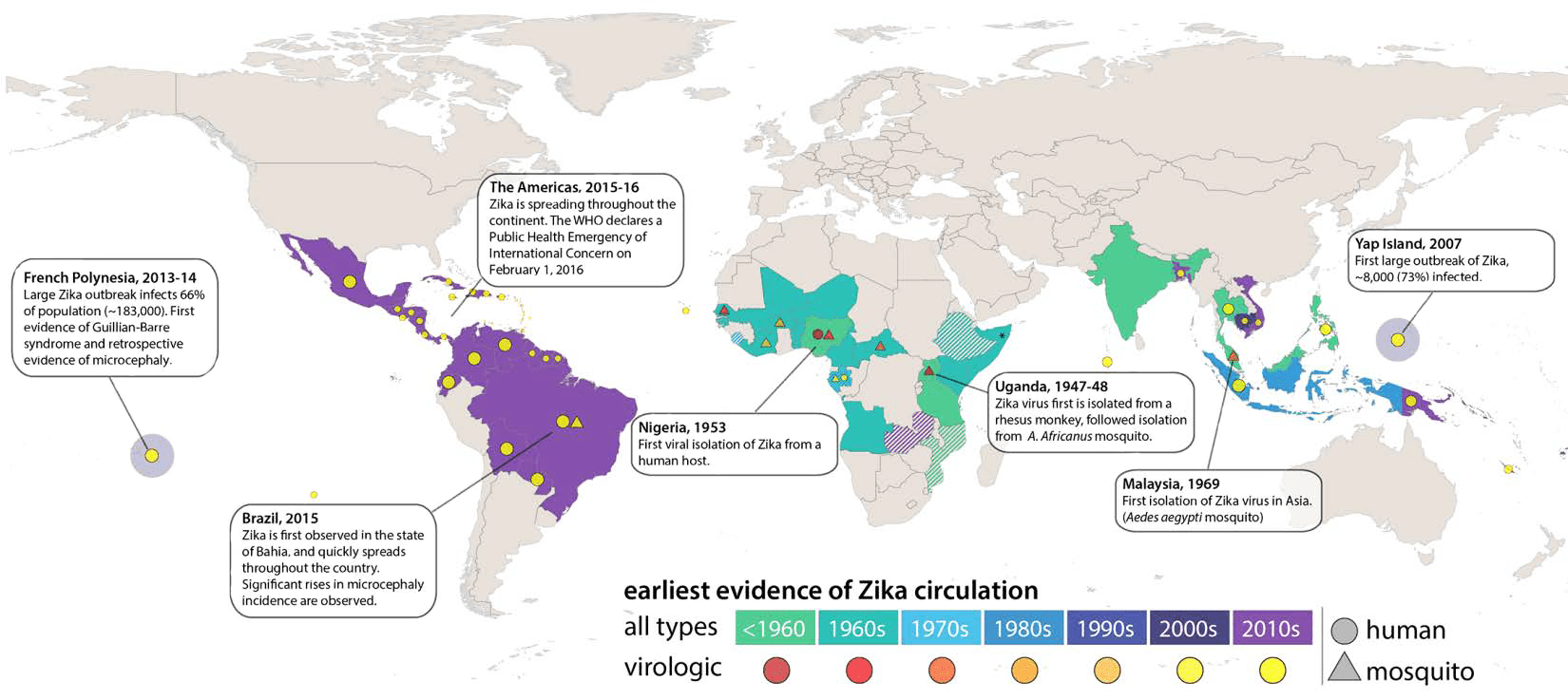
Рисунок 3. История распространения вируса Зика по миру.
В Россию впервые вирус завезли в феврале 2016 года из Доминиканской республики. За прошедшие месяцы отмечены еще 7 случаев. Все — у туристов, вернувшихся из стран, где распространяется ZIKV: большинство — из Доминиканской республики, один — с Карибских островов. Все пациенты благополучно перенесли лихорадку.
Патогенез лихорадки Зика
Передача вируса и развитие болезни
ZIKV передается людям во время укусов зараженных комаров рода Aedes, которые нападают обычно в дневное время с пиком активности ранним утром и вечером. Зарегистрировано несколько случаев передачи вируса Зика половым путем [5–7], не исключена возможность заражения и при переливании крови [4], [8].
Какие-то симптомы появляются у меньшинства инфицированных: на острове Яп лишь 19% заразившихся сообщили о симптомах, а во Французской Полинезии — 26%. Если признаки лихорадки развиваются, то в 95% случаев это происходит через 6–11 суток после заражения (рис. 4). Симптомы сходны с проявлениями других подобных инфекций [1], [4]:
- повышенная температура тела;
- кожная сыпь;
- боль в суставах и мышцах;
- головная боль;
- конъюнктивит;
- отеки;
- иногда рвота;
- общее недомогание.
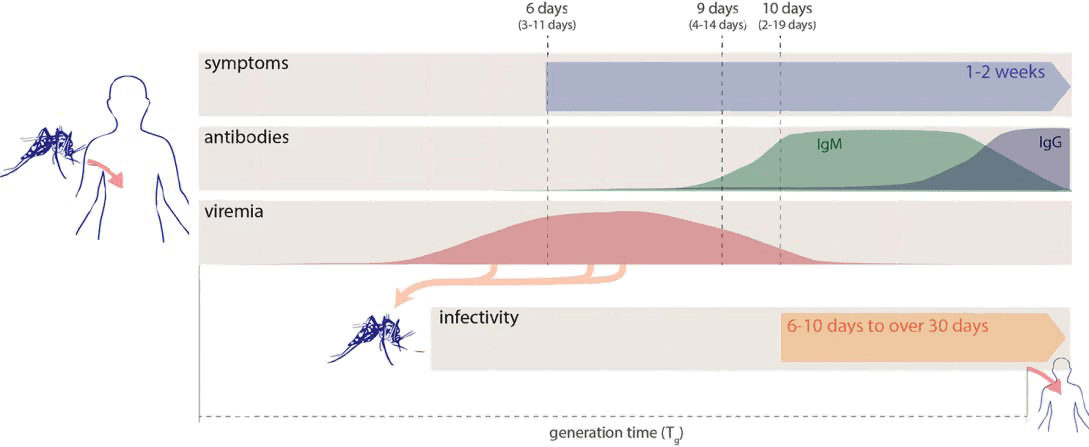
Рисунок 4. Схема протекания инфекции у человека и комара. В среднем признаки развиваются на шестой день после инфицирования. Примерно на девятый день начинается выработка иммуноглобулинов (антител): первым обнаруживают IgM, количество которого позже снижается одновременно с ростом концентрации IgG. Последний сохраняется в крови неопределенное время. Виремия, вероятно, возникает до появления симптомов, и ее продолжительность сказывается на риске инфицирования восприимчивых комаров, кусающих зараженного человека. После определенного инкубационного периода комар приобретает способность передавать возбудителя другим людям. Tg — интервал между эпизодами инфицирования первого и второго человека.
ZIKV присутствует в крови, слюне, моче, сперме, амниотической жидкости и нервной ткани. Его можно выделить из крови в среднем в течение 10 дней после инфекции (у 99% заразившихся кровь полностью очищается от вируса за 24 дня). По некоторым сообщениям, вирус остается в моче 12 дней, а в сперме — более 60. Беременность может продлить срок носительства: одна пациентка, заразившись на 11 неделе беременности, оставалась виремичной еще 10 недель, однако полностью очистилась от вируса за 11 дней после прерывания беременности. Комары становятся заразными примерно через 10 дней после попадания в них ZIKV (рис. 4).
Виремия, или вирусемия — медицинское состояние, когда вирусы попадают в кровоток и могут распространяться по всему телу, — аналогично бактериемии, при которой в кровь попадают бактерии [9]. — Ред.
В клетку вирус Зика проникает, взаимодействуя с определенными рецепторами на ее поверхности. Основной из них — AXL. А посредником выступает рецептор TIM-1, который связывает вирусные частицы и транспортирует их к AXL, способствующему проникновению вируса в клетку. Однако TIM-1 не необходимое звено, он лишь повышает концентрацию вирионов на поверхности клетки и ускоряет их взаимодействие с AXL [10].
Когда вирус оказывается внутри клетки, она отвечает повышенной продукцией интерферонов IFN-α и IFN-β, а также хемокинов CXCL10 и CXCL11, которые играют важную роль во врожденном и адаптивном иммунитете. Эти хемокины привлекают Т-клетки и другие лейкоциты к месту воспаления и даже оказывают прямое антимикробное действие, когда их концентрация в кожных фибробластах сильно повышается [10].
В то же время инфекция ZIKV запускает программу аутофагии [11]. Аутофагия предназначена не только для деградации белков и поврежденных органоидов клетки, но и для противостояния инфекционным агентам, то есть представляет собой иммунный инструмент. Например, при заражении клеток вирусами Сендай, везикулярного стоматита или простого герпеса I типа разрушение вирусных белков посредством аутофагии ограничивает репликацию вирусов и способствует выживанию клетки. С другой стороны, этот процесс может быть повернут вирусами против самой клетки. Так, некоторые флавивирусы (например, вирусы денге и чикунгуньи) используют компоненты пути аутофагии для поддержки своей репликации и распространения за счет «зачистки» клетки. Какое значение имеет аутофагия в цикле вируса Зика, еще предстоит узнать [10].
Антитела к вирусу обнаруживают в крови уже на девятый день после заражения. Продолжительность иммунитета против ZIKV пока не известна, но, судя по другим флавивирусам, можно предположить, что он пожизненный [1].
Смертельные случаи при заражении вирусом Зика крайне редки и отмечаются лишь у пациентов с коморбидностью или иммунодефицитом. Тем не менее у инфицированных повышается вероятность серьезных неврологических осложнений, например развития синдрома Гийена-Барре, который приводит к смерти в 3–10% случаев — вне зависимости от вызвавшей его причины. Были сообщения и о других осложнениях, включая менингоэнцефалит и миелит, но связь с вирусом Зика в этих случаях не была достоверно установлена [1].
Вирус Зика и беременность
Больше всего ученых и общество в целом беспокоит связь вирусной инфекции во время беременности с эмбриональной микроцефалией. От начала вспышки заболевания в конце 2014 до 7 мая 2016 года в Бразилии было зарегистрировано 7438 подозрительных случаев микроцефалии [12]. До этого ежегодно фиксировали не более 200, что, разумеется, наводит на определенные мысли.
Однако установить связь между ZIKV и микроцефалией оказалось достаточно сложно из-за нескольких обстоятельств:
- остается неясным, сколько беременностей затронул вирус — инфекция ведь часто бессимптомна;
- до сих пор нет четкого определения микроцефалии;
- существуют другие инфекционные агенты, вызывающие микроцефалию: цитомегаловирус и Rubella virus (вирус краснухи).
И всё-таки, основываясь на фактах обнаружения вируса Зика в амниотической жидкости и мозге микроцефальных эмбрионов, Центр контроля заболеваний в апреле 2016 года признал связь между ZIKV и микроцефалией. В дальнейшем это заключение подтвердили экспериментальные работы на мышах, показавшие, что вирус легко проникает в плаценту и поражает стволовые нервные клетки эмбриона [1], [13]. Полагают, что вирус Зика предпочитает именно клетки — предшественницы нейронов, поскольку их поверхность больше других насыщена рецепторами AXL [14]. Это предположение подтвердили недавние опыты. Американские ученые на мышиной модели показали, что, заражая беременное животное, вирус устремляется в плаценту, где его концентрация может быть в 1000 раз выше, чем в крови [15]. Китайские исследователи пошли дальше и ввели ZIKV прямо в зачаточный мозг 13-дневных мышиных эмбрионов. В результате произошла задержка развития органа, соответствующая понятию «микроцефалия». При этом вирус заражал почти все клетки мозга, но основной, первичной целью были клетки-предшественницы и незрелые нейроны. Вирус задерживал их деление и дифференцировку, провоцировал апоптоз. Отмиравшие клетки плода за редким исключением были зрелыми и незрелыми нейронами. Проследить постнатальную историю мышат не удалось, поскольку матери не сочли таких потомков достойными заботы и... съели их [16].
Симптомы инфекции у беременных женщин такие же, как и у остальных, но пока не известно, влияет ли на частоту их проявления иммунодефицит, характерный для этого периода. Результаты исследований, касающихся неблагоприятных последствий заболевания для эмбриона, очень разнородны: где-то у 29% беременных с симптомами болезни развивался эмбрион с микроцефалией, а где-то и у 74%. Возможно, такие расхождения возникли потому, что в исследованиях участвовало недостаточное количество пациентов — меньше 50 человек. С определенной уверенностью можно утверждать лишь то, что ZIKV-ассоциированная микроцефалия разовьется у плода одной из ста инфицированных в первый триместр женщин независимо от наличия симптомов, и этот риск становится незначительным во второй и третий триместры [1].
Помимо микроцефалии с вирусом Зика сейчас связывают и другие эмбриональные патологии [1]:
- внутричерепной кальциноз;
- вентрикуломегалию;
- дефекты органа зрения;
- гипоплазию ствола мозга;
- задержку внутриутробного развития;
- мертворождаемость.
Устройство вируса Зика
Организация генома
К концу августа 2016 года в GenBank хранилось 67 полных последовательностей генома ZIKV. Вирус Зика содержит кодирующую молекулу РНК длиной 10,8 т.н. с одной ORF (открытой рамкой считывания), фланкированной нетранслируемыми участками (UTR) — 5′-UTR длиной 106 н. и 3′-UTR длиной 428 н. (рис. 5). ORF кодирует полипротеиновый предшественник, который впоследствии разделяется на три структурных белка (капсидный [С], премембранный [prM] и оболочечный [E]) и семь неструктурных (NS1, NS2A, NS2B, NS3, NS4A, NS4B и NS5). Вирусный полипротеин во время трансляции и/или после нее расщепляется вирусной протеазой, сигнальной пептидазой и неизвестной протеазой клетки-хозяина. Фрагмент pr затем, при производстве зрелых вирионов, обычно отсекается в аппарате Гольджи фурином [17].
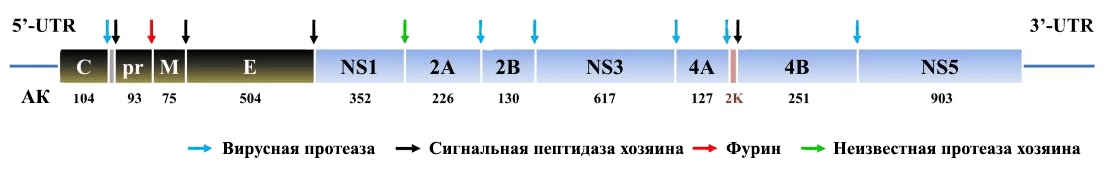
Рисунок 5. Геном вируса (представлен в виде последовательности кодируемых РНК белковых продуктов). Структурные белки окрашены серым цветом, неструктурные синим. Цифрами обозначены длины белков (число аминокислотных остатков). Стрелки указывают на места расщепления полипротеина.
[17], рисунок адаптирован
Основные белки
Белок E — главный поверхностный гликопротеин флавивирусов, а неструктурные белки NS3 и NS5 — основные ферменты вирусной репродукции [17]. Структура этих белков показана на рисунке 6.
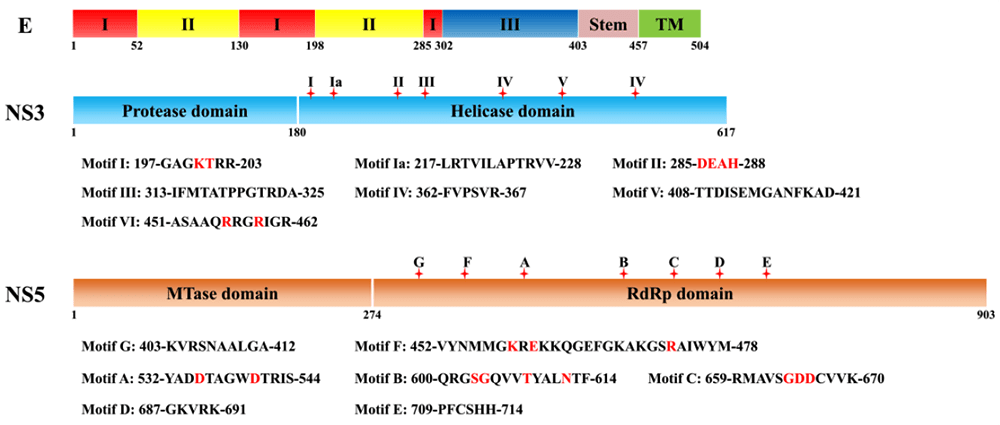
Рисунок 6. Структура главных белков ZIKV.
Белок Е разделен на два структурных региона — стволовой и трансмембранный (на рис. 6 — stem и ТМ) — и три функциональных домена: домен I участвует в организации оболочки (рис. 7), домен II отвечает за взаимодействие мономеров, а домен III связывает клеточный рецептор.
NS3 состоит из протеазного и хеликазо-НТФазного доменов, которые осуществляют процессинг вирусного полипротеина и раскручивание структурированных участков во время синтеза вирусной РНК.
NS5 содержит метилтрансферазный домен, который метилирует 5’-CAP-участок геномной РНК, и домен РНК-зависимой-РНК-полимеразы (RNA dependent RNA polymerase, RdRp).
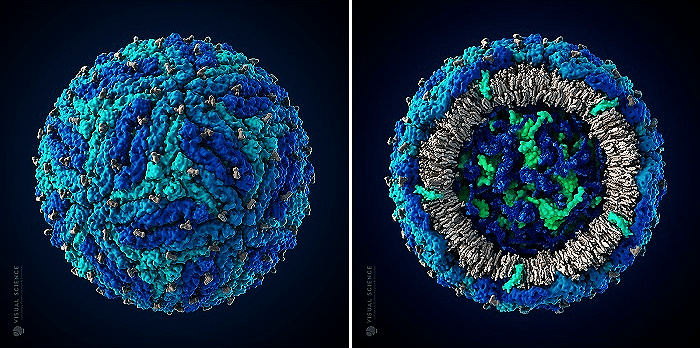
Рисунок 7. Трехмерная модель вируса Зика в атомном разрешении, созданная в студии биомедицинской визуализации Visual Science. Модель построена по данным научных публикаций об организации вируса Зика и родственных вирусов и считается наиболее достоверной на текущий момент.
сайт visual-science.com
Известно, что гликозилирование играет важную роль в инфекционности, созревании и вирулентности флавивирусов [18], [19]. Для вируса Зика предсказаны потенциальные участки для N- и O-гликозилирования в белках prM, E, NS1 и NS4B, которые гликозилируются и в других флавивирусах. Исследования, посвященные роли этих сайтов в жизненном цикле вируса Зика, еще только планируются [17]. Правда, уже обнаружено одно структурное отличие белка Е ZIKV от подобных белков других флавивирусов — выставленная на поверхность вирусной частицы аминокислотная петля, с которой в позиции Asn154 связывается гликан (см. видео). Предполагают, что именно эта петля вместе с прикрепленным сахаром может отвечать за тропизм вируса (взаимодействие с рецепторами определенной группы клеток) и патогенез болезни [20].
Отличие в структуре белка Е ZIKV от гомологичных белков других флавивирусов.
исследовательская группа Университета Пердью, США
Борьба с вирусом Зика
Диагностика
Основные проблемы диагностики ZIKV-инфекции — это значительное количество бессимптомных случаев и неспецифичность симптомов: лихорадка денге и чикунгунья, которые тоже переносятся комарами рода Aedes, проявляются подобным образом. Предположить заражение вирусом Зика можно, если симптомы появляются у человека, который недавно побывал или длительно проживал в районе циркуляции ZIKV [1], [4].
Подтвердить предварительный диагноз можно лишь с помощью лабораторного анализа крови или других биологических жидкостей: мочи, спермы или слюны. Для этого используют метод RT-PCR. Однако для проведения таких анализов очень важно время отбора образцов: вирусную РНК обнаруживают в крови в течение 3–5 дней после появления симптомов (около 10 дней после инфицирования); в других же жидкостях вирус можно «поймать» и позже [1], [4].
Лучшим решением был бы высокоспецифичный тест на антитела, который можно использовать не только для подтверждения инфицированности, но и для проверки иммунитета против вируса Зика в самом начале беременности, что позволило бы женщинам понять степень риска. Однако такое тестирование осложняется кросс-реактивностью с другими флавивирусами. Определенные надежды дает тест ELISA. Например, IgG-ELISA, применяемый во Французской Полинезии, где циркулирует вирус денге, еще до основной вспышки лихорадки Зика выявлял ZIKV-позитивных доноров крови (тогда их было <1%) [1].
Профилактика
Основной способ — это защита от укусов комаров, в том числе и с помощью контроля их распространения.
В регионах циркуляции вируса Зика и потенциально опасных зонах людям рекомендуют носить светлую одежду, закрывающую как можно больше поверхности тела, устанавливать на окна и двери домов противомоскитные сетки, использовать сетку во время сна, а также применять репелленты с ДЭТА, IR3535 или икаридином [4].
Самки комаров Aedes после насыщения кровью откладывают яйца, которые в безводной среде могут сохраняться до года. Даже в минимальном количестве воды из яиц выходят личинки и дальше развиваются во взрослых особей. Потому для контроля численности и распространения комаров необходимо постоянно отслеживать и ликвидировать места их размножения: ведра, бочки, горшки с водой, сточные канавы, использованные автомобильные покрышки. В особых случаях прибегают к распылению инсектицидов [4].
Пример эффективного контроля численности переносчика вирусов — действия Уильяма Горгаса по ликвидации эпидемии желтой лихорадки в Гаване и регионе Панамского канала в начале XX века. Этот американский военврач и его команда устроили жестокую борьбу с антисанитарией и обработали все здания и улицы инсектицидами (от которых, к слову, пострадало и немало жителей). В результате желтая лихорадка была полностью побеждена [21].
В 50-х и 60-х годах в государствах Америки применяли интенсивные меры по контролю переноса возбудителя желтой лихорадки, включая повсеместное распыление ДДТ. Это привело к устранению Aedes aegypti из 18 стран и значительно сократило область распространения заболевания. Позже подобные программы успешно осуществили Сингапур и Куба. Конечно, через некоторое время лихорадка вернулась, но даже краткосрочный период без инфекции имел большое значение для населения [1].
Чтобы сократить риск передачи ZIKV половым путем (особенно во время беременности), мужчинам, проживающим в зонах циркуляции вируса или недавно побывавшим там, ВОЗ рекомендует пользоваться презервативами или воздерживаться от половой активности на всём протяжении беременности партнерши [4].
Лечение
Обычно заболевание протекает в легкой форме и не требует специального лечения. Во время лихорадки необходим отдых и обильное питье, иногда — прием препаратов для устранения боли и других неприятных симптомов [4].
Тем не менее существуют вещества, которые оказывают воздействие и на сам вирус Зика. Например, эффективно подавляет репродукцию вируса in vitro 2′-C-метиладенозин, а 7-деаза-2′-C-метиладенозин (МК-608) ингибирует репликацию ZIKV in vitro и затормаживает развитие болезни в экспериментах на мышах. Препараты 2′-C-метилцитидин, рибавирин, фавипиравир и T-1105 ослабляют цитопатическое действие вируса и снижают его урожай [22], [23].
Разумеется, вакцина решила бы проблему кардинально, но она до сих пор не разработана. Сейчас исследованиями занимаются 18 коммерческих компаний и исследовательских институтов [24–26]. Однако первая фаза клинических испытаний стартует не раньше конца 2016 года, а значит, готовая вакцина появится еще не скоро, и распространение инфекции по миру продолжится [1].
Заключение
Неожиданно широкое распространение вируса Зика — изначально малоинтересного местечкового инфекционного агента — обнажает один неприятный факт: мы очень мало знаем о флавивирусных и других болезнях с промежуточными хозяевами. И ZIKV не единственный пример: за последние десятилетия вирусы денге, чикунгуньи и лихорадки Западного Нила также распространились по земному шару. Но почему именно эти вирусы расширили свой ареал, в то время как другие (например, вирус желтой лихорадки) оказались не в состоянии вторгнуться в потенциально подходящие для них области? Пока ответа на этот вопрос нет. Возможно, новые аналитические методы позволят наконец разобраться в том, что именно делает тот или иной «заурядный» вирус глобальной угрозой. В отношении вируса Зика важно оценивать не только эпидемиологические и экологические факторы, которые ведут к изменению его ареала, но и исследовать взаимодействия ZIKV с другими флавивирусами и влияние на него генетических аппаратов комара и конечного хозяина.
Хотя всевозможные случайности в эволюции вирусов делают точный прогноз пандемий практически невозможным, научный мир пытается повышать скорость реакции на новые угрозы. В ближайшее время усилия биологов и медиков сосредоточатся на разработке единой стратегии, которую в любой момент можно было бы применить к той или иной вспышке заболевания. Такая стратегия позволит быстро разобраться в путях передачи, патогенезе и способах контроля инфекции, чтобы предотвратить ее глобальное распространение.
Литература
- Lessler J., Chaisson L.H., Kucirka L.M., Bi Q., Grantz K., Salje H. et al. (2016). Assessing the global threat from Zika virus. Science. 353, aaf8160;
- Википедия: «Зика (лес)»;
- Википедия: «Лихорадка Зика»;
- Болезнь, вызванная вирусом Зика. (2016). Информационный бюллетень ВОЗ;
- Deckard D.T., Chung W.M., Brooks J.T., Smith J.C., Woldai S., Hennessey M. et al. (2016). Male-to-male sexual transmission of Zika virus — Texas, january 2016. MMWR Morb. Mortal. Wkly Rep. 65, 372–374;
- Venturi G., Zammarchi L., Fortuna C., Remoli M.E., Benedetti E., Fiorentini C. et al. (2016). An autochthonous case of Zika due to possible sexual transmission, Florence, Italy, 2014. Euro Surveill. 21, doi: 10.2807/1560-7917.ES.2016.21.8.30148;
- Foy B.D., Kobylinski K.C., Chilson Foy J.L., Blitvich B.J., Travassos da Rosa A., Haddow A.D. et al. (2011). Probable non-vector-borne transmission of Zika virus, Colorado, USA. Emerg. Infect. Dis. 17, 880–882;
- Boadle A. (2016). Brazil reports Zika infection from blood transfusions. Reuters;
- Википедия: «Вирусемия»;
- Hamel R., Dejarnac O., Wichit S., Ekchariyawat P., Neyret A., Luplertlop N. et al. (2015). Biology of Zika virus infection in human skin cells. J. Virol. 89, 8880–8896;
- Аутофагия, протофагия и остальные;
- Victora C.G., Schuler-Faccini L., Matijasevich A., Ribeiro E., Pessoa A., Barros F.C. (2016). Microcephaly in Brazil: how to interpret reported numbers? Lancet. 387, 621–624;
- Cugola F.R., Fernandes I.R., Russo F.B., Freitas B.C., Dias J.L., Guimarães K.P. et al. (2016). The Brazilian Zika virus strain causes birth defects in experimental models. Nature. 534, 267–271;
- Nowakowski T.J., Pollen A.A., Di Lullo E., Sandoval-Espinosa C., Bershteyn M., Kriegstein A.R. (2016). Expression analysis highlights AXL as a candidate Zika virus entry receptor in neural stem cells. Cell Stem Cell. 18, 591–596;
- Miner J.J., Cao B., Govero J., Smith A.M., Fernandez E., Cabrera O.H. et al. (2016). Zika virus infection during pregnancy in mice causes placental damage and fetal demise. Cell. 165, 1081–1091;
- Li C., Xu D., Ye Q., Hong S., Jiang Y., Liu X. et al. (2016). Zika virus disrupts neural progenitor development and leads to microcephaly in mice. Cell Stem Cell. 19, 120–126;
- Ye Q., Liu Z.Y., Han J.F., Jiang T., Li X.F., Qin C.F. (2016). Genomic characterization and phylogenetic analysis of Zika virus circulating in the Americas. Infect. Genet. Evol. 43, 43–49;
- Kim J.M., Yun S.I., Song B.H., Hahn Y.S., Lee C.H., Oh H.W., Lee Y.M. (2008). A single N-linked glycosylation site in the Japanese encephalitis virus prM protein is critical for cell type-specific prM protein biogenesis, virus particle release, and pathogenicity in mice. J. Virol. 82, 7846–7862;
- Li J., Bhuvanakantham R., Howe J., Ng M.L. (2006). The glycosylation site in the envelope protein of West Nile virus (Sarafend) plays an important role in replication and maturation processes. J. Gen. Virol. 87, 613–622;
- Sirohi D., Chen Z., Sun L., Klose T., Pierson T.C., Rossmann M.G., Kuhn R.J. (2016). The 3.8 Å resolution cryo-EM structure of Zika virus. Science. 352, 467–470;
- Patterson R. (1989). Dr. William Gorgas and his war with the mosquito. CMAJ. 141, 596–597, 599;
- Zmurko J., Marques R.E., Schols D., Verbeken E., Kaptein S.J., Neyts J. (2016). The viral polymerase inhibitor 7-deaza-2’-C-methyladenosine is a potent inhibitor of in vitro Zika virus replication and delays disease progression in a robust mouse infection model. PLoS Negl. Trop. Dis. 10, e0004695;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Cohen J. (2016). Zika vaccine has a good shot. Science. 353, 529–530;
- Abbink P., Larocca R.A., De La Barrera R.A., Bricault C.A., Moseley E.T., Boyd M. et al. (2016). Protective efficacy of multiple vaccine platforms against Zika virus challenge in rhesus monkeys. Science. pii: aah6157;
- Larocca R.A., Abbink P., Peron J.P., Zanotto P.M., Iampietro M.J., Badamchi-Zadeh A. et al. (2016). Vaccine protection against Zika virus from Brazil. Nature. 536, 474–478..





