Волонтер фотосинтеза
19 августа 2013
Волонтер фотосинтеза
- 4232
- 0
- 8
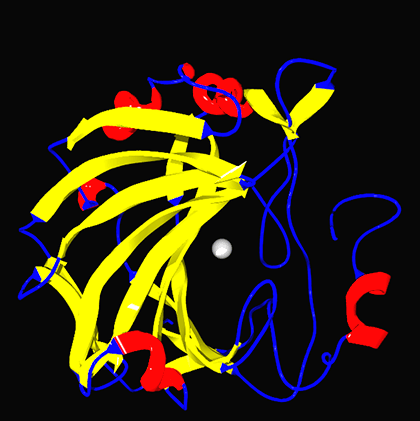
Пространственная структура молекулы эритроцитарной карбоангидразы (II)
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Реакции углекислого газа в форме СО2 или бикарбоната (HCO3−) в клетке контролируются карбоангидразой — самым активным ферментом среди всех известных, ускоряющим обратимую реакцию гидратации атмосферного СО2. В данной статье мы рассмотрим процесс фотосинтеза и роль карбоангидразы в нем.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Разве заронился
Втуне хоть единый
Солнца луч на землю?
Или не возник он,
В ней преображенный,
В изумрудных листьях.
Н.Ф. Щербина [1]
История познания процесса, который испорченный воздух вновь превращает в хороший
Представления о фотосинтезе складывались постепенно, начиная с 16 века. В 18 веке Джозеф Пристли — известный английский ученый-химик — открыл кислород. Как химика Пристли заинтересовал вопрос: почему воздух полей и лесов чище городского? Ученый предположил, что растения очищают его от веществ, выделяемых людьми при дыхании, а также дымящимися трубами заводов и фабрик. С целью проверки своего предположения ученый провел эксперимент над мышью, которую посадил под стеклянный колпак (рис. 1). Вскоре животное погибло. Тогда экспериментатор поместил под такой же колпак другую мышь, но уже вместе с веткой мяты. «Это было сделано в начале августа 1771 года. Через 8 дней я нашел, что мышь прекрасно могла жить в той части воздуха, в которой росла ветка мяты. Побег мяты вырос почти на 3 дюйма...». Опыт заинтересовал ученых. Многие пытались повторить его в своих лабораториях, но результаты получались противоречивыми. Голландский врач Ян Ингенхауз (1730–1799) усомнился в правильности такого использования растений и провел ряд экспериментов с целью проверки действительности этого приема. В результате своих опытов он сделал открытие, что только зеленые части растений могут улучшать воздух, да и то лишь на свету [2].
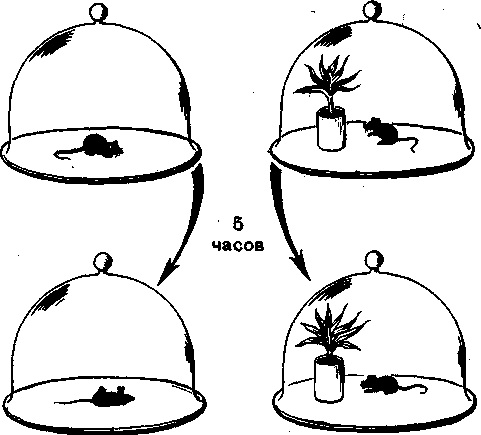
Рисунок 1. Эксперимент Д. Пристли
Сам термин «фотосинтез» был предложен в 1877 году известным немецким физиологом растений Вильгельмом Пфеффером (1845–1920). Он считал, что из углекислого газа и воды зеленые растения на свету образуют органические вещества и выделяют кислород. А энергия солнечного света усваивается и трансформируется при помощи зеленого пигмента хлорофилла. Термин «хлорофилл» был предложен в 1818 году французскими химиками П. Пельтье и Ж. Каванту. Он образован из греческих слов «хлорос» — зеленый — и «филлон» — лист. Позже исследователи подтвердили, что для питания растений требуется диоксид углерода и вода, из которых создается бóльшая часть массы растений [2].
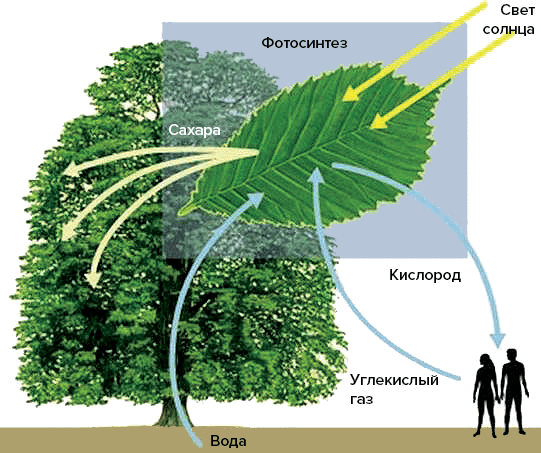
Рисунок 2. Цикл выделения и поглощения углекислого газа и кислорода между животными и растениями
Российский ученый Климент Аркадьевич Тимирязев (1843–1920) показал, что фотосинтез проходит с наибольшей интенсивностью в тех областях солнечного спектра, где находятся максимумы поглощения хлорофилла. К середине 19 века было установлено, что фотосинтез является процессом, как бы обратным дыхательному. Французский ученый Жан Батист Буссенго (1802–1887) в своих работах, опубликованных в это время, утверждал, что в процессе фотосинтеза происходит выделение кислорода из углекислого газа. Это мнение в научной литературе господствовало длительное время. В конце 19 века биохимик Алексей Николаевич Бах (1857–1946) на основе экспериментальных исследований пришел к выводу, что при ассимиляции диоксида углерода источником выделяющегося молекулярного кислорода являются пероксиды, образующиеся из воды. Он же высказал предположение о биокаталитической роли белков-ферментов в фотосинтезе. В 20 веке было установлено, что процесс фотосинтеза начинается на свету в фоторецепторах хлоропластов, однако многие из последующих стадий могут протекать в темноте. В 1941 американский биохимик Мелвин Кальвин (1911–1997) показал, что первичный процесс фотосинтеза заключается в разложении молекул воды под действием света, в результате чего образуются кислород, выделяющийся в атмосферу, и водород, идущий на восстановление диоксида углерода до органических веществ. Используя радиоактивный изотоп углерода 14С, бумажную хроматографию и классические методы органической химии, Кальвин и его группа смогли проследить биосинтетические пути фотохимических процессов. К 1956 году стал ясным полный путь превращения углерода при фотосинтезе, который был назван циклом Кальвина [2].
Фотосинтез — сложный многоступенчатый процесс (рис. 3). На каком именно этапе необходима энергия света? Оказалось, что реакция синтеза органических веществ, включения углекислого газа в состав их молекул непосредственно энергии света не требует. Эти реакции назвали темновыми, хотя идут они не только в темноте, но и на свету, — просто свет для них не обязателен [2].
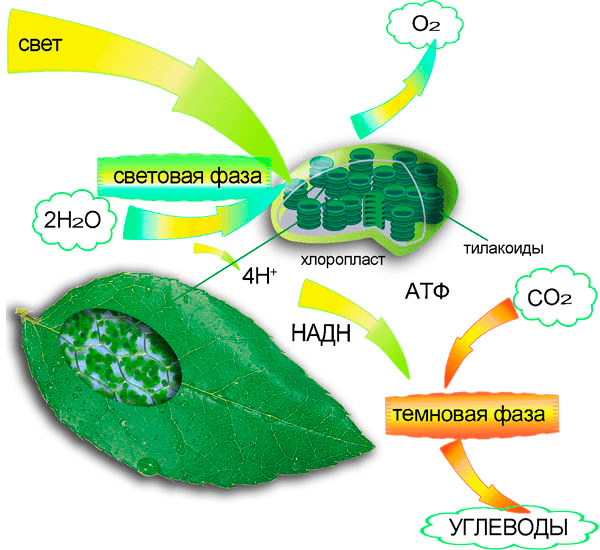
Рисунок 3. Общая схема фотосинтеза
Роль фотосинтеза в жизни человеческого общества
В последние годы человечество столкнулось с дефицитом энергоресурсов. Грядущее истощение запасов нефти и газа побуждает ученых искать новые, возобновляемые источники энергии. Чрезвычайно заманчивые перспективы открывает использование в качестве энергоносителя водорода. Водород — источник экологически чистой энергии. При его сжигании образуется только вода: 2H2+O2 = 2H2O [2]. Водород выделяют высшие растения и многие бактерии.
Что касается бактерий, то большинство из них живет в строго анаэробных условиях и не может использоваться для масштабного производства этого газа. Однако недавно в океане открыли штамм аэробных цианобактерий, очень эффективно вырабатывающих водород. Cyanobacterium cyanothece 51142 совмещает в себе сразу два фундаментальных биохимических пути — это запасание энергии в светлое время суток во время фотосинтеза и азотфиксация с выделением водорода и затратой энергии — ночью. Выход водорода, и так достаточно высокий, удалось в лабораторных условиях дополнительно повысить, «отрегулировав» длительность светового дня. Зарегистрированный выход — 150 микромоль водорода на миллиграмм хлорофилла в час — самый высокий, который удавалось наблюдать для цианобактерий. Если экстраполировать эти результаты на чуть большего размера реактор, выход составит 900 мл водорода с литра бактериальной культуры за 48 часов. С одной стороны, это вроде бы и не много, но если представить себе раскинувшиеся на тысячи квадратных километров экваториальных океанов реакторы с бактериями, работающими в полную силу, то итоговое количество газа может быть впечатляющим [5].
Новый процесс получения водорода основан на преобразовании энергии ксилозы, наиболее распространенного простого сахара. Ученые из Virginia Tech взяли набор ферментов у ряда микроорганизмов и создали уникальный синтетический фермент, аналогов которому не существует в природе, что позволит извлекать большие количества водорода из любого растения. Данный фермент при температуре всего 50 °C освобождает с помощью ксилозы беспрецедентно большой объем водорода — примерно в три раза больше, чем лучшие современные «микробные» методики. Суть процесса сводится к тому, что энергия, запасенная в ксилозе и полифосфатах, расщепляет молекулы воды и позволяет получить высокочистый водород, который можно сразу отправлять в топливные ячейки, вырабатывающие электричество. Получается эффективнейший экологически чистый процесс, который требует немного энергии только на запуск реакции [6]. По энергоемкости водород не уступает высококачественному бензину. Растительный мир представляет собой огромный биохимический комбинат, который поражает масштабами и разнообразием биохимических синтезов [2].
Существует ещё один путь использования человеком солнечной энергии, усвоенной растениями, — непосредственная трансформация световой энергии в электрическую. Способность хлорофилла под действием света отдавать и присоединять электроны лежит в основе работы генераторов, содержащих хлорофилл. М. Кальвин в 1972 году выдвинул идею создания фотоэлемента, в котором в качестве источника электрического тока служил бы хлорофилл, способный при освещении отнимать электроны от одних веществ и передавать их другим. В настоящее время по этому направлению ведется множество разработок [2]. Например, ученый Андреас Мершин (Andreas Mershin) и его коллеги из Массачусетского технологического института создали батареи на основе светособирающего комплекса биологических молекул — фотосистемы I из цианобактерии Thermosynecho coccuselongates (рис. 4). Под обычным солнечным светом ячейки показали напряжение холостого хода в 0,5 В, удельную мощность 81 мкВт/см2 и плотность фототока в 362 мкА/см2. А это, по уверению изобретателей, в 10000 раз больше, чем у любой показанной ранее биофотовольтаики, основанной на природных фотосистемах [7].
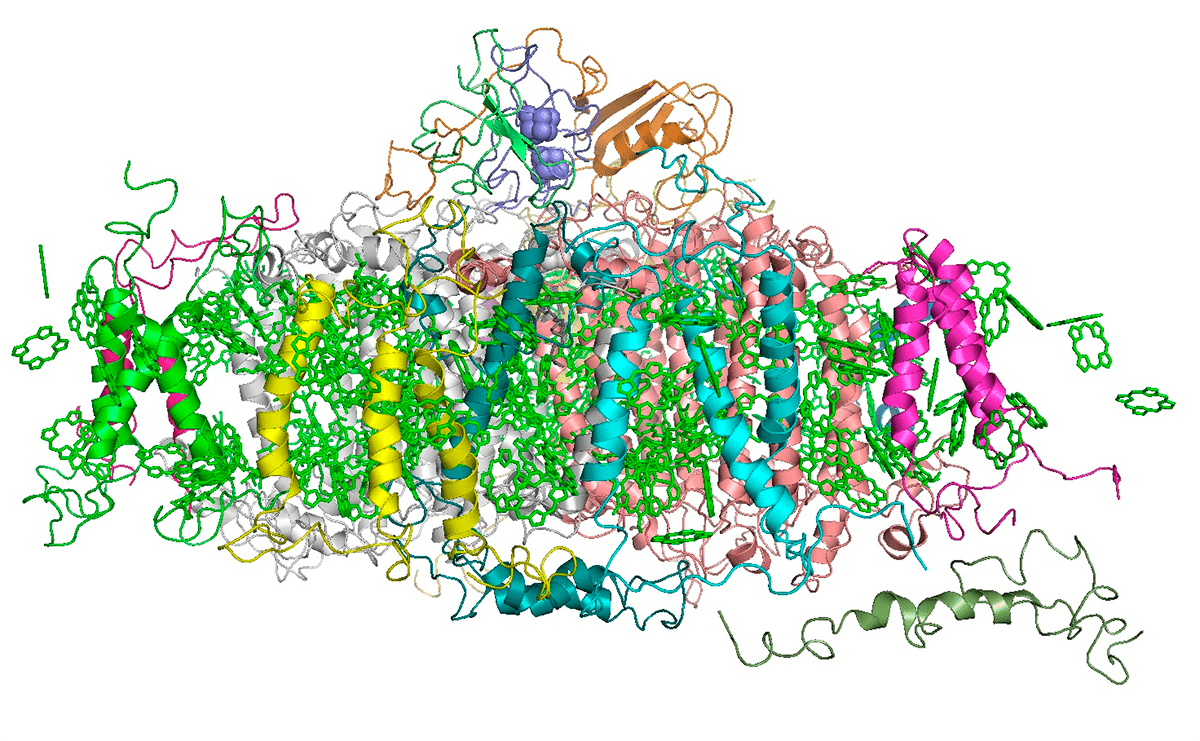
Рисунок 4. Пространственная структура фотосистемы 1 (ФС1). ФС являются важными компонентами комплексов, отвечающих за фотосинтез в растениях и водорослях. Они состоят из нескольких вариаций хлорофилла и сопутствующих молекул — белков, липидов и кофакторов. Общее число молекул в таком наборе — до двух с лишним сотен.
КПД полученных батарей составил всего-то около 0,1%. Тем не менее, создатели диковинки считают её важным шагом на пути массового внедрения солнечной энергетики в быт. Ведь потенциально такие устройства могут производиться с крайне низкими затратами [7]! Создание фотоэлементов — это только начало в промышленном получении альтернативных видов энергии для всего человечества [2].
Ещё одной важной задачей фотосинтеза растений является обеспечение людей органическими веществами. Причем не только для употребления в пищу, но и для фармацевтики, промышленного производства бумаги, крахмала и т.д. Фотосинтез является главной точкой входа неорганического углерода в биологический цикл. Весь свободный кислород атмосферы — биогенного происхождения и является побочным продуктом фотосинтеза. Формирование окислительной атмосферы (так называемая кислородная катастрофа) полностью изменило состояние земной поверхности, сделало возможным появление дыхания, а в дальнейшем, после образованияозонового слоя, позволило жизни существовать на суше. Учитывая значение процесса фотосинтеза, раскрытие его механизма является одной из наиболее важных и интересных задач, стоящих перед физиологией растений [2].
Перейдем же к одному из самых интересных ферментов, работающих «под капотом» фотосинтеза.
Самый активный фермент: волонтер фотосинтеза
В естественных условиях концентрация СО2 довольно низка (0,04% или 400 мкл/л), поэтому диффузия СО2 из атмосферы во внутренние воздушные полости листа затруднена. В условиях низких концентраций углекислоты существенная роль в процессе ее ассимиляции при фотосинтезе принадлежит ферменту карбоангидразе (КА). Вероятно, КА способствует обеспечению рибулозобисфосфаткарбоксилазы/оксигеназы (РБФК/О, или RuBisCO) субстратом (CO2), запасенным в строме хлоропласта в виде иона бикарбоната. РБФК/О — один из важнейших ферментов в природе, поскольку он играет центральную роль в основном механизме поступления неорганического углерода в биологический круговорот и считается наиболее распространённым ферментом на Земле [8].
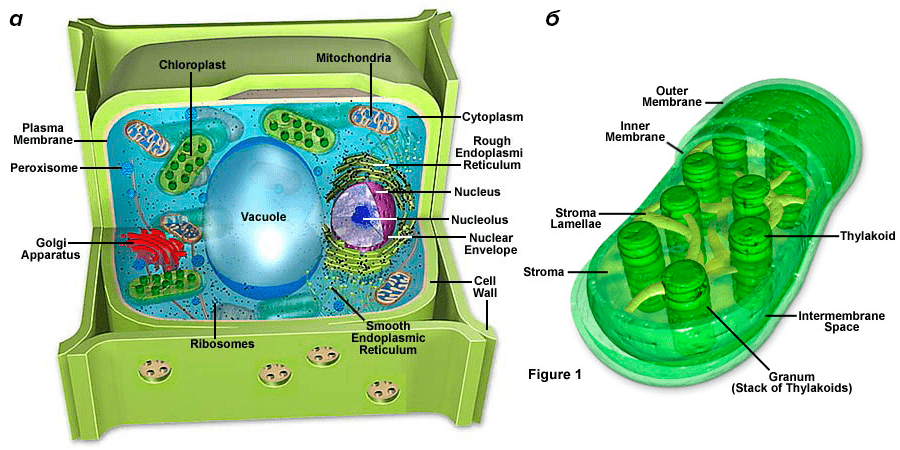
Рисунок 5. Строение растительной клетки (а) и хлоропласта (б)
Карбоангидраза — чрезвычайно важный биокатализатор, относящийся к числу самых активных ферментов. КА катализирует обратимую реакцию гидратации СО2 в клетке:
СО2 + Н2О = Н2СО3 = Н+ + НСО3−.
Карбоангидразная реакция проходит в две стадии. В первой стадии образуется ион бикарбоната НСО3−. Во второй стадии освобождается протон, и именно эта стадия лимитирует процесс [8].
| Фермент | Число молекул |
|---|---|
| Карбоангидраза | 36 000 000 |
| β-Амилаза | 1 100 000 |
| Фосфоглюкомутаза | 1 240 |
Гипотетически КА клеток растений может выполнять различные физиологические функции в соответствии с местом расположения. При фотосинтезе кроме быстрого перевода НСО3− в СО2, который необходим для РБФК/О, она может ускорять транспорт неорганического углерода через мембраны, поддерживать рН-статус в разных частях клеток, смягчать изменения кислотности в стрессовых ситуациях, регулировать транспорт электронов и протонов хлоропласте [10].
Карбоангидраза присутствует практически во всех исследованных видах растений. Несмотря на многочисленные экспериментальные факты в пользу участия карбоангидразы в фотосинтезе, окончательный механизм участия фермента в этом процессе ещё предстоит выяснить [10].
Многочисленная «семья» карбоангидраз
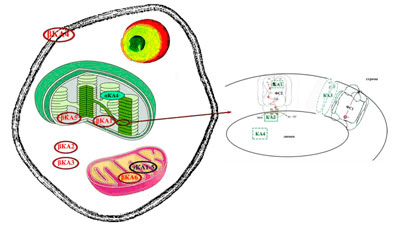
Рисунок 6. Расположение карбоангидраз в клетке высших растений
В высшем растении Arabidopsis thaliana обнаружено 19 генов трех (из пяти установленных к настоящему времени) семейств, кодирующих карбоангидразы. В высших растениях обнаружены КА, принадлежащие к α-, β- и γ-семействам. В митохондриях найдено пять КА γ-семейства; КА β-семейства обнаружены в хлоропластах, митохондриях, цитоплазме, плазмалемме (рис. 6). О восьми α-КА известно только то, что α-КА1 и α-КА4 находятся в хлоропластах. К настоящему времени в хлоропластах высших растений обнаружены карбоангидразы α-КА1, α-КА4, β-КА1 и β-КА5. Из этих четырех КА известно местонахождение только одной, и она находится в строме хлоропласта (рис. 6) [10].
КА относятся к металлоферментам, которые содержат атом металла в активном центре. Обычно таким металлом, который связан с лигандами реакционного центра КА, является цинк. КА полностью отличаются друг от друга на уровне их третичных и четвертичных структур (рис. 7), но особенно удивительно, что активные центры всех КА сходны [11].
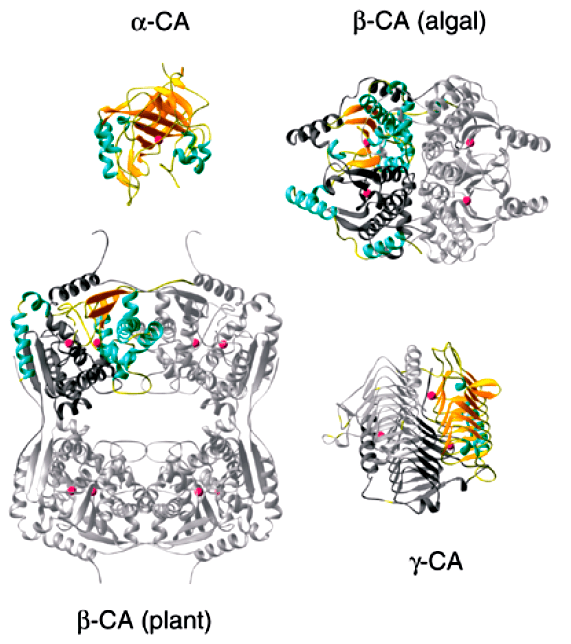
Рисунок 7. Четвертичная структура представителей трех семейств КА. Зеленым цветом обозначены α-спирали, желтым — участки β-складчатости, розовый — атомы цинка в активных центрах ферментов. В структурах α и γ-КА превалирует β-складчатая организация белковой молекулы, в структуре β-КА преобладают α-витки.
Расположение КА в клетках растений
Разнообразие форм КА намекает на множественность функций, которые они выполняют в различных частях клетки. Для определения внутриклеточного местонахождения шести β-карбоангидраз использовали эксперимент, основанный на мечении КА зеленым флуоресцентным белком (ЗФБ) [14]. Карбоангидразу методами генетической инженерии помещали в одну «рамку считывания» с ЗФБ, и экспрессию такого «сшитого» гена анализировали с помощью лазерной конфокальной сканирующей микроскопии (рис. 8). В мезофильных клетках трансгенных растений, в которых β-КА1 и β-КА5 «сшиты» с ЗФБ, ЗФБ-сигнал совпадал в пространстве с флуоресценцией хлорофилла, что указывало на его связь (колокализацию) с хлоропластами [13].
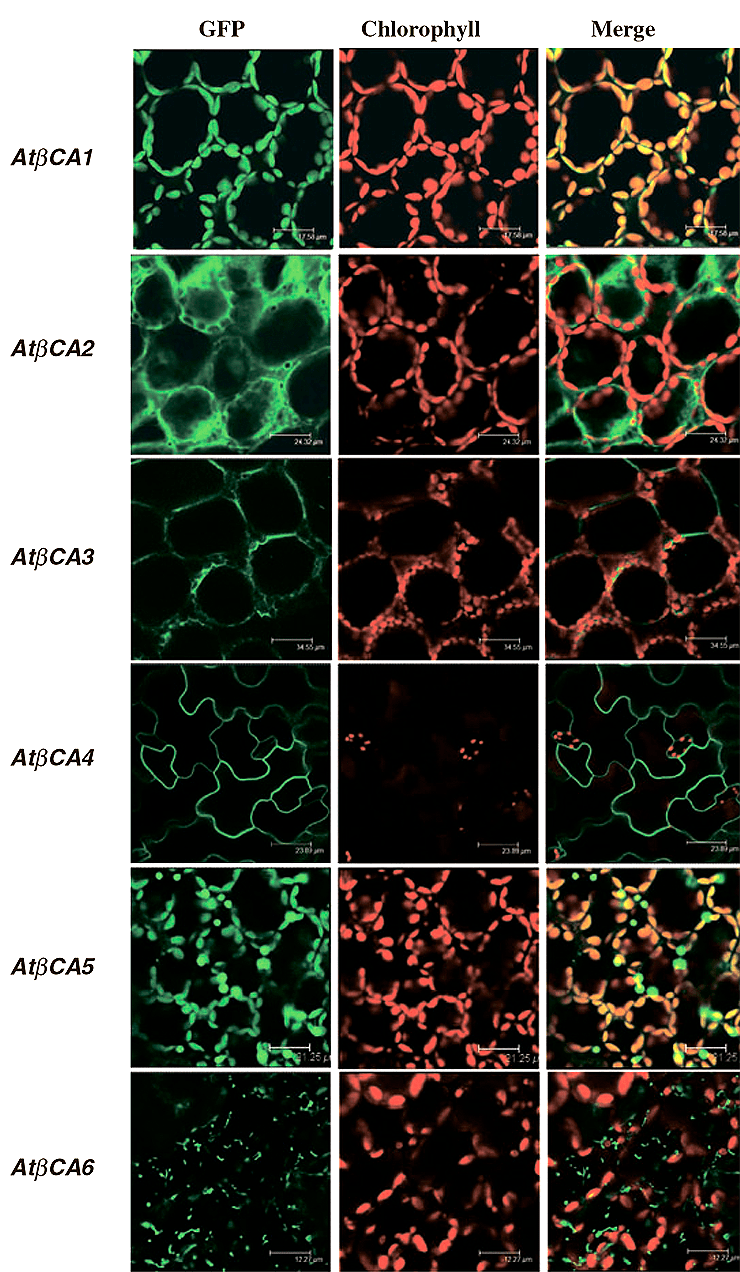
Рисунок 8. Микрофотография клеток с GFP, который «сшит» с кодирующей областью генов β-КА1—6. Зеленый и красный сигналы показывают флуоресценцию GFP и автофлуоресценцию хлорофилла, соответственно. Желтым (справа) показана совмещенная картина. Флуоресценция зафиксирована с помощью конфокального микроскопа.
Использование трансгенных растений открывает широкие возможности для исследования участия карбоангидраз в фотосинтезе.
Какими могут быть функции КА в фотосинтезе?
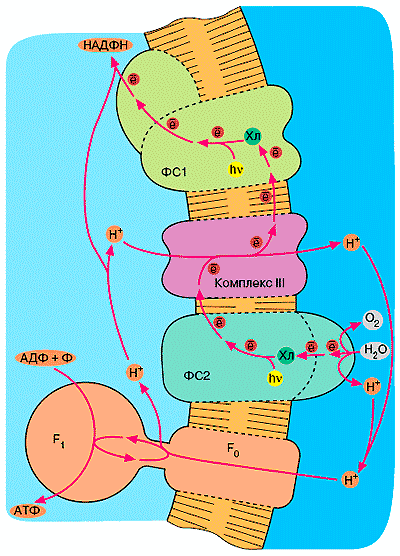
Рисунок 9. Пигментбелковые комплексы ФС1 и ФС2 в тилакоидной мембране. Стрелками показан транспорт электронов от одной системе к другой и продукты реакций.
Известно, что ионы бикарбоната необходимы для нормального транспорта электронов на участке электронтранспортной цепи хлоропластов QA →Fe2+ → QB, где QA — это первичный, а QB — вторичный хиноновые акцепторы, причем QB расположен на акцепторной стороне фотосистемы 2 (ФС2) (рис. 9) [15]. Ряд фактов указывает на участие этих ионов в реакции окисления воды и на донорной стороне ФС2 [16]. Наличие в пигментбелковом комплексе ФС2 карбоангидраз, регулирующих поступление бикарбоната к нужному участку, могло бы обеспечивать эффективное протекание этих реакций. Уже высказывалось предположение об участии КА в защите ФС2 от фотоингибирования в условиях интенсивного освещения [16] путем связывания избыточных протонов с образованием незаряженной молекулы СО2, хорошо растворимой в липидной фазе мембраны. Показано присутствие КА в мультиферментном комплексе, осуществляющем фиксацию СО2 и связь рибулезобисфосфаткарбоксилазы/оксигеназы с мембраной тилакоидов [17]. Высказана гипотеза, согласно которой ассоциированная с мембраной КА дегидратирует бикарбонат, продуцируя СО2 [18]. Недавно показано, что внутритилакоидные протоны, аккумулируемые на свету, используются при дегидратации бикарбоната, добавленного в суспензию изолированных тилакоидов, и сделано предположение, что эта реакция может осуществляться на стромальной поверхности мембраны, если КА обеспечивает канал утечки протонов из люмена [19].
Удивительно то, что от одного кирпичика системы зависит настолько многое. И, раскрыв его местоположение и функцию, можно управлять всей системой.
Заключение
Углекислый газ для животных является неиспользуемым продуктом метаболических реакций, так сказать — «выхлопом», выделяющимся при «сжигании» органических соединений. Удивительно — растения и другие фотосинтезирующие организмы используют этот самый углекислый газ для биосинтеза практически всего органического вещества на Земле. Жизнь на нашей планете строится на основании углеродного скелета, и именно углекислый газ является тем «кирпичиком», из которого строится этот скелет. И именно судьба углекислого газа — включается ли он в состав органики или выделяется при ее разложении — лежит в основе круговорота веществ на планете (рис. 10).
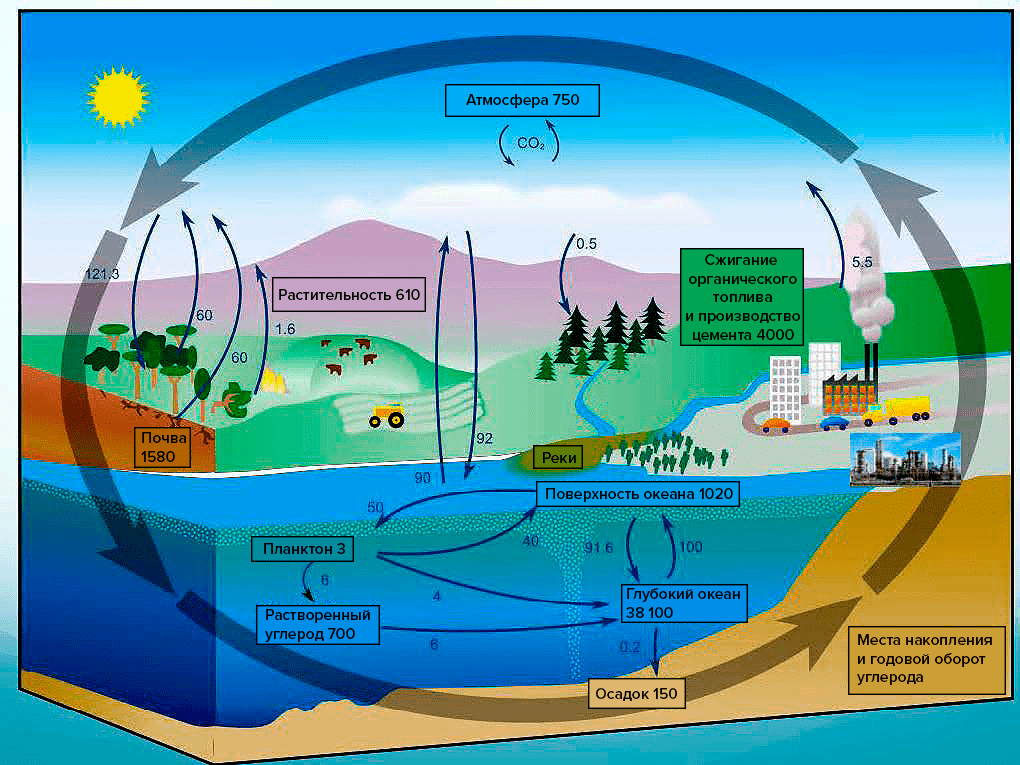
Рисунок 10. Круговорот углерода в природе
Литература
- Тимирязев К.А. Жизнь растения. М.: «Сельхозиз», 1936;
- Артамонов В.И. Занимательная физиология растений. М.: «Агропромиздат», 1991;
- Алиев Д.А. и Гулиев Н.М. Карбоангидраза растений. М.: «Наука», 1990;
- Чернов Н.П. Фотосинтез. Глава: Строение и уровни организации белка. М.: «Дрофа», 2007;
- Бактерии для водородной энергетики;
- Barlow Z. (2013). Breakthrough in hydrogen fuel production could revolutionize alternative energy market. Virginia Polytechnic Institute and State University;
- Andreas Mershin, Kazuya Matsumoto, Liselotte Kaiser, Daoyong Yu, Michael Vaughn, et. al.. (2012). Self-assembled photosystem-I biophotovoltaics on nanostructured TiO2 and ZnO. Sci Rep. 2;
- David N. Silverman, Sven Lindskog. (1988). The catalytic mechanism of carbonic anhydrase: implications of a rate-limiting protolysis of water. Acc. Chem. Res.. 21, 30-36;
- Ленинджер А. Основы биохимии. М.: «Мир», 1985;
- Иванов Б.Н., Игнатова Л.К., Романова А.К. (2007). Разнообразие форм и функций карбоангидразы высших наземных растений. «Физиология растений». 54, 1–21;
- Anders Liljas, Martin Laurberg. (2000). A wheel invented three times. EMBO reports. 1, 16-17;
- Natalia N. Rudenko, Lyudmila K. Ignatova, Boris N. Ivanov. (2007). Multiple sources of carbonic anhydrase activity in pea thylakoids: soluble and membrane-bound forms. Photosynth Res. 91, 81-89;
- NICOLAS FABRE, ILJA M REITER, NOELLE BECUWE-LINKA, BERNARD GENTY, DOMINIQUE RUMEAU. (2007). Characterization and expression analysis of genes encoding ? and ? carbonic anhydrases in Arabidopsis. Plant Cell Environ. 30, 617-629;
- Флуоресцирующая Нобелевская премия по химии;
- Jack J. S. van Rensen, Chunhe Xu, Govindjee. (1999). Role of bicarbonate in photosystem II, the water-plastoquinone oxido-reductase of plant photosynthesis. Physiol Plant. 105, 585-592;
- A. Villarejo. (2002). A photosystem II-associated carbonic anhydrase regulates the efficiency of photosynthetic oxygen evolution. The EMBO Journal. 21, 1930-1938;
- Judith A. Jebanathirajah, John R. Coleman. (1998). Association of carbonic anhydrase with a Calvin cycle enzyme complex in Nicotiana tabacum. Planta. 204, 177-182;
- Pronina N.A. and Semanenko V.E. (1984). Localization of membrane bound and soluble forms of carbonic anhydrase in the Chlorella cell. Fiziol. Rast. 31, 241–251;
- L. K. Ignatova, N. N. Rudenko, M. S. Khristin, B. N. Ivanov. (2006). Heterogeneous origin of carbonic anhydrase activity of thylakoid membranes. Biochemistry (Moscow). 71, 525-532.