
Воздействие на апелинергическую систему как перспективное направление биофармацевтики
26 октября 2018
Воздействие на апелинергическую систему как перспективное направление биофармацевтики
- 661
- 0
- 4
— Ты чё, бабка, совсем сдурела? В твои-то годы и с саркопенией — штангу толкать!..
— Не боись, я на курсе терапии апелином.
— Каким таким еще апельсином?
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Открытый 20 лет тому назад пептид апелин и его рецептор APJ не перестают приятно удивлять фармакологов. Они лежат в основе апелинергической системы, которая, входя в состав гипоталамо-нейрогипофизарно-надпочечниковой оси, регулирует ряд важнейших физиологических процессов. От них зависит в том числе то, как объем и давление крови реагируют на стресс, как работает сердце и многое другое. Но невозможно объять необъятное. Поэтому этот небольшой обзор — только «вершина айсберга» ответов на вопрос, почему эти белки так заинтересовали исследователей. Шутить с айсбергами — дело опасное: они могут в один миг перевернуться. Так и с апелином: его достоинства в зависимости от обстоятельств могут превращаться в недостатки, и наоборот.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.

Партнер номинации — медицинская компания «Инвитро».

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
25-летний юбилей «странного рецептора»
В 1993 году был найден рецепторный белок, названный APJ и очень похожий на рецептор ангиотензина. Оба эти рецептора были белками мембраны, и их трансмембранные домены совпадали на 40–50% [1]. По своей структуре APJ относился к большому семейству трансмембранных рецепторов, сопряженных с G-белком (GPCR), называемых также семиспиральными рецепторами или серпентинами — за то, что они семь раз пронизывают клеточную мембрану . С помощью этих рецепторов организм реагирует на множество внешних сигналов: свет, звук, запахи, химическое чувство и так далее.
«Биомолекула» уже не раз писала про GPC-рецепторы: «Зрительный родопсин — рецептор, реагирующий на свет», «Рецепторы в активной форме», «Новый рубеж: получена пространственная структура β2-адренорецептора», «Структуры рецепторов GPCR “в копилку”» [2–5]. В том числе и про вручение за их изучение Нобелевской премии в 2012 году: «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [6]. — Ред.
Вопреки ожиданиям исследователей этот новый рецептор APJ, хоть и был похож на рецептор ангиотензина, но сам ангиотензин связывать упорно отказывался [1], [7].
Вездесущий апелин
Поиски внешнего сигнала, который активирует рецептор APJ, привели в 1998 году к открытию пептида, названного апелином [7]. C ангиотензином II, как позднее выяснилось, его роднит то, что оба эти пептида являются субстратами для ангиотензинпревращающего фермента 2 (АПФ 2), который их разрушает.
Поскольку апелин секретируется жировыми клетками (адипоцитами), его часто относят к гормонам жировой ткани — адипокинам. Однако самый высокий уровень его синтеза наблюдается в центральной нервной системе, особенно в таламусе и лобной коре головного мозга, а также в спинном мозге и гипофизе.
За 20 лет, прошедших с момента этого открытия, обнаружилось, насколько широко и многообразно поле деятельности этого пептида. Чем только он не занимается! Рецепторы APJ есть практически во всех органах и тканях. Больше всего их в легких, сердце, скелетных мышцах, а также в почках, кишечнике, надпочечниках и стенках кровеносных сосудов. Это связано с тем, что APJ и апелин участвуют в работе гипоталамо-гипофизарно-надпочечниковой оси, которая играет центральную роль в гомеостазе, водно-солевом обмене и деятельности сердечно-сосудистой [8], [9], иммунной, репродуктивной и нервной систем. Эта ось одновременно интегрирует контроль функций нервной и эндокринной систем, что позволяет им сообща реагировать на физические и психосоциальные внешние воздействия. То есть она дает возможность организму эффективно адаптироваться к окружающей среде, использовать ресурсы и оптимизировать выживаемость [10].
Изоформы апелина
Образование апелина — процесс непростой. Первоначально синтезируется препроапелин, состоящий из 77 аминокислот, с сигнальным пептидом в N-концевой области. После транслокации в эндоплазматический ретикулум и отделения сигнального пептида образуется проапелин, состоящий из 55 аминокислот, который может при распаде образовать несколько активных фрагментов:
- 36-аминокислотный пептид, соответствующий последовательности 42–77 препроапелина (апелин-36);
- 17-аминокислотный пептид, соответствующий последовательности 61–77 (апелин-17);
- 13-аминокислотный пептид, соответствующий последовательности 65–77 (апелин-13).
Все эти биологически активные изоформы апелина сохраняют С-концевую область препроапелина, поскольку именно она ответственна за связывание с рецептором и его последующую активацию. Наиболее высокой биологической активностью обладают апелин-13 и чуть более короткий апелин-12 [11].
Два лиганда на один рецептор
В дополнение к апелину недавно нашли еще один лиганд рецептора APJ — ELABELA (ELA), несколько отличающийся по функциям от апелина и не инактивирующийся АПФ 2 (рис. 1). Система из двух лигандов и одного рецептора, очевидно, позволяет организму более точно настраивать регуляцию физиологических процессов [12].
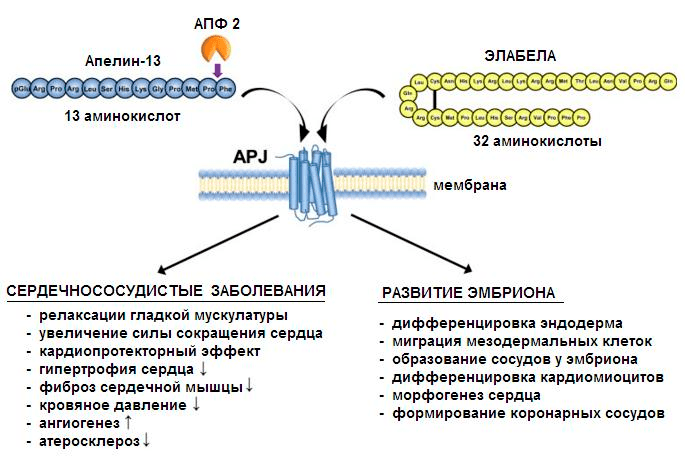
Рисунок 1. Некоторые функции апелинергической системы. Показана роль пептидов апелина-13 и ELABELA в развитии сосудистой сети у эмбриона и в защите сердечно-сосудистой системы от ее заболеваний. Показано, как АПФ 2 (ангиотензинпревращающий фермент 2) может инактивировать апелин-13.
[12], рисунок адаптирован
Апелин как лекарство от диабета, ожирения и болезней почек
Ацилированные аналоги апилин-13-амида оказались устойчивы к деградации ферментами и были предложены в качестве лекарственного препарата: они могут препятствовать ожирению, подавляя чувство голода, и развитию диабета, способствуя секреции инсулина и стимулируя инсулиннезависимое поглощение глюкозы клетками [13], [14].
У мышей, находящихся на диете с высоким содержанием жира, длительное применение ацилированных аналогов апелин-13-амида давало противодиабетический эффект и улучшало липидный профиль [15]. При этом повышались толерантность к глюкозе, секреция инсулина при приеме пищи и чувствительность клеток к инсулину; снижались уровни холестерина ЛПНП и общего жира в организме [16]. Эти и некоторые другие результаты исследований позволяют рассматривать апелинергическую систему как новую терапевтическую мишень в фармакологическом лечении диабета и его осложнений [17].
Поскольку апелинергическая система задействована и в регуляции гомеостаза жидкости в организме, она может быть потенциальной мишенью для лечения заболеваний почек [18].
Апелин и сердечно-сосудистые заболевания
Регуляторная роль рецепторной системы апелин/APJ в сердечно-сосудистой (пато)физиологии делает ее потенциальным объектом исследований, направленных на разработку новых препаратов для лечения сердечной недостаточности и артериальной гипертензии легких.
В отличие от ангиотензина, который вызывает вазоконстрикцию (сужение сосудов) и повышение кровяного давления, апелин при системном введении обычно, наоборот, расслабляет периферические сосуды и снижает артериальное давление [19]. При этом на сосуды головного мозга он действует прямо противоположно — препятствует релаксации церебральных артерий, ингибируя кальций-зависимые калиевые каналы [20].
Такая уникальная способность апелинов подчеркивает их значимость как терапевтического агента, который может одновременно поддерживать сердечную функцию и защищать сердце от гипертрофии и сердечной недостаточности. И всё это в зависимости от конкретной потребности организма.
Апелин, как показано в ряде работ, оказывает устойчивое защитное действие против инфаркта миокарда [21], [22]. В связи с этим в экперименте с мышиными моделями инфаркта миокарда пытались лечить постишемическую сердечную недостаточность путем внутримиокардиальной инъекции мультицистронного лентивирусного вектора. Вектор содержал гены следующих белков:
- FGF2 (фактора роста фибробластов 2) — для стимуляции ангиогенеза;
- апелина — для кардиопротекции;
- SERCA2a (кальциевой АТФазы сарко-/эндоплазматического ретикулума) — для активации сократительной функции.
По заверениям авторов, такое комбинированное лечение увеличивало количество сосудов, улучшало параметры работы сердца, препятствовало развитию фиброза и гипертрофии кардиомиоцитов [23]. Поскольку количественные показатели этих «улучшенных» параметров и данные статистики в работе не были приведены, остается надеяться на результаты последующих экспериментов.
Однако на этом потенциальная польза апелина как многофункционального лекарственного препарата не заканчивается.
Апелин поможет бороться с проявлениями старения организма?
Недавно была выявлена антивозрастная роль эндогенного апелинергического пути. Оказалось, что уровни компонентов сигнального пути апелин/APJ уменьшаются с возрастом, и это понижение ускоряет начало и прогрессирование старения. Мыши с генетически обусловленным дефицитом рецептора апелина или самогό апелина в эксперименте демонстрировали ускоренное старение сердечно-сосудистой, почечной и репродуктивной систем. При этом восстановление уровня апелина повышало продолжительность и качество жизни пожилых мышей [24]. Мыши, получавшие инфузии апелина, проявляли повышенные бодрость и подвижность.
Неожиданным и интересным направлением исследования действия апелина на организм может стать изучение его способности бороться с саркопенией — возрастными дегенеративными изменениями скелетной мускулатуры, приводящими к постепенной потере мышечной массы и силы у пожилых людей. Этот пептид значительно улучшает функционирование мышц за счет того, что:
- активирует образование новых митохондрий, аутофагию и противовоспалительные пути в миофибриллах;
- усиливает способность мышц к регенерации, воздействуя на мышечные стволовые клетки.
В перспективе это, возможно, позволит разработать фармакологическую стратегию предотвращения возрастной слабости мышц и восстановления физической самостоятельности пожилых людей [25].
Приведенные данные указывают на то, что апелин можно рассматривать как геропротектор. Вот только продлевает ли он жизнь или, как гормон роста, только временно улучшает ее качество? Ответ на этот вопрос могли бы дать эксперименты с состарившимися животными, получающими заместительную терапию апелином. Однако есть одна сложность: улучшая качество жизни, апелин одновременно может и вредить.
Роль апелина в развитии воспалительных заболеваний, связанных с окислительным стрессом
В недавно опубликованном обзоре [26] приведены данные о том, что апелин может содействовать развитию атеросклероза, стимулируя окислительный стресс, и усугублять гипертонию, регулируя путь НАДФH-оксидаза 4 → ангиотензин II. Кроме того, он стимулирует пролиферацию раковых клеток [7], [27], [28] и ангиогенез в сетчатке (что приводит ее патологическим изменениям) [29], а также понижает аппетит (что может вызвать истощение организма). Поэтому, чтобы не навредить, нужно четко проработать стратегию терапии апелином.
Заключение
Молекулярные механизмы, которые лежат в основе физиологических процессов, регулируемых апелинергической системой, пока изучены довольно плохо. Тем не менее интересного для биофармакологии материала накопилось много. Поэтому мы, учитывая ограниченность объема обзора, решили не лезть в дебри этих сложных механизмов, а обратить внимание читателей на необычайно широкий круг перспективных направлений фармакологических исследований, которые еще только предстоит провести, чтобы создать лекарственные препараты, воздействующие на организм через апелинергическую систему. Желающих глубже ознакомиться с этой интересной темой отсылаем к подробному обзору, который появится в открытом доступе к концу этого года [30].
Литература
- Brian F. O'Dowd, Michael Heiber, Audrey Chan, Henry H.Q. Heng, Lap-Chee Tsui, et. al.. (1993). A human gene that shows identity with the gene encoding the angiotensin receptor is located on chromosome 11. Gene. 136, 355-360;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Рецепторы в активной форме;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Структуры рецепторов GPCR «в копилку»;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Kazuhiko Tatemoto, Masaki Hosoya, Yugo Habata, Ryo Fujii, Tadao Kakegawa, et. al.. (1998). Isolation and Characterization of a Novel Endogenous Peptide Ligand for the Human APJ Receptor. Biochemical and Biophysical Research Communications. 251, 471-476;
- Xuling Luo, Jiaqi Liu, Hong Zhou, Linxi Chen. (2018). Apelin/APJ system: A critical regulator of vascular smooth muscle cell. J Cell Physiol. 233, 5180-5188;
- Marta B. Wysocka, Katarzyna Pietraszek-Gremplewicz, Dorota Nowak. (2018). The Role of Apelin in Cardiovascular Diseases, Obesity and Cancer. Front. Physiol.. 9;
- Anne-Marie O'Carroll, Stephen J Lolait, Louise E Harris, George R Pope. (2013). The apelin receptor APJ: journey from an orphan to a multifaceted regulator of homeostasis. Journal of Endocrinology. 219, R13-R35;
- M. V. Sidorova, A. A. Az’muko, M. E. Pal’keeva, A. S. Molokoedov, V. N. Bushuev, et. al.. (2012). Synthesis and cardioprotective properties of apelin-12 and its structural analogues. Russ J Bioorg Chem. 38, 30-40;
- Keiji Kuba, Teruki Sato, Yumiko Imai, Tomokazu Yamaguchi. (2018). Apelin and Elabela/Toddler; double ligands for APJ/Apelin receptor in heart development, physiology, and pathology. Peptides;
- Finbarr P.M. O'Harte, Vadivel Parthsarathy, Christopher Hogg, Peter R Flatt. (2017). Acylated apelin-13 amide analogues exhibit enzyme resistance and prolonged insulin releasing, glucose lowering and anorexic properties. Biochemical Pharmacology. 146, 165-173;
- F.P.M. O’Harte, V. Parthsarathy, C. Hogg, P.R. Flatt. (2018). Apelin-13 analogues show potent in vitro and in vivo insulinotropic and glucose lowering actions. Peptides. 100, 219-228;
- Finbarr P. M. O’Harte, Vadivel Parthsarathy, Christopher Hogg, Peter R. Flatt. (2018). Long-term treatment with acylated analogues of apelin-13 amide ameliorates diabetes and improves lipid profile of high-fat fed mice. PLoS ONE. 13, e0202350;
- Vadivel Parthsarathy, Christopher Hogg, Peter R. Flatt, Finbarr P. M. O'Harte. (2018). Beneficial long-term antidiabetic actions of N- and C-terminally modified analogues of apelin-13 in diet-induced obese diabetic mice. Diabetes Obes Metab. 20, 319-327;
- Haoliang Hu, Lu He, Lanfang Li, Linxi Chen. (2016). Apelin/APJ system as a therapeutic target in diabetes and its complications. Molecular Genetics and Metabolism. 119, 20-27;
- Zhen Huang, Lele Wu, Linxi Chen. (2018). Apelin/APJ system: A novel potential therapy target for kidney disease. J Cell Physiol. 233, 3892-3900;
- Amreen Mughal, Stephen T. O'Rourke. (2018). Vascular effects of apelin: Mechanisms and therapeutic potential. Pharmacology & Therapeutics. 190, 139-147;
- Amreen Mughal, Chengwen Sun, Stephen T. OʼRourke. (2018). Apelin Reduces Nitric Oxide–Induced Relaxation of Cerebral Arteries by Inhibiting Activation of Large-Conductance, Calcium-Activated K Channels. Journal of Cardiovascular Pharmacology. 71, 223-232;
- Wang Wang, Shaun M.K. McKinnie, Vaibhav B. Patel, George Haddad, Zuocheng Wang, et. al.. (2013). Loss of Apelin Exacerbates Myocardial Infarction Adverse Remodeling and Ischemia‐reperfusion Injury: Therapeutic Potential of Synthetic Apelin Analogues. J Am Heart Assoc. 2;
- A. Folino, L. Accomasso, C. Giachino, P. G. Montarolo, G. Losano, et. al.. (2018). Apelin-induced cardioprotection against ischaemia/reperfusion injury: roles of epidermal growth factor and Src. Acta Physiol. 222, e12924;
- Edith Renaud-Gabardos, Florence Tatin, Fransky Hantelys, Benoît Lebas, Denis Calise, et. al.. (2018). Therapeutic Benefit and Gene Network Regulation by Combined Gene Transfer of Apelin, FGF2, and SERCA2a into Ischemic Heart. Molecular Therapy. 26, 902-916;
- Rahul Rai, Asish K. Ghosh, Mesut Eren, Alexander R. Mackie, Daniel C. Levine, et. al.. (2017). Downregulation of the Apelinergic Axis Accelerates Aging, whereas Its Systemic Restoration Improves the Mammalian Healthspan. Cell Reports. 21, 1471-1480;
- Claire Vinel, Laura Lukjanenko, Aurelie Batut, Simon Deleruyelle, Jean-Philippe Pradère, et. al.. (2018). The exerkine apelin reverses age-associated sarcopenia. Nat Med. 24, 1360-1371;
- QUN ZHOU, JIANGANG CAO, LINXI CHEN. (2016). Apelin/APJ system: A novel therapeutic target for oxidative stress-related inflammatory diseases (Review). International Journal of Molecular Medicine. 37, 1159-1169;
- Stefanie Kälin, Roland E. Kälin. (2017). Apelin and Cancer. Adipocytokines, Energy Balance, and Cancer. 137-160;
- Yanjie Yang, Shuang-Yu Lv, Wenling Ye, Liang Zhang. (2016). Apelin/APJ system and cancer. Clinica Chimica Acta. 457, 112-116;
- Lele Wu, Linxi Chen, Lanfang Li. (2017). Apelin/APJ system: A novel promising therapy target for pathological angiogenesis. Clinica Chimica Acta. 466, 78-84;
- Kyungsoo Shin, Calem Kenward, Jan K. Rainey. (2017) Apelinergic System Structure and Function.






