Воздушные переносы вирусов клещевого энцефалита Балтийской группы постоянны и системны
24 ноября 2020
Воздушные переносы вирусов клещевого энцефалита Балтийской группы постоянны и системны
- 684
- 3
- 3
Балтийская группа вируса клещевого энцефалита распространена так, будто воздушные переносы патогена постоянны и системны
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Клещевым энцефалитом люди чаще всего заражаются после укуса клеща. Это тяжелое заболевание вызывает вирус клещевого энцефалита (ВКЭ). Недавно мы секвенировали фрагменты геномов изолятов ВКЭ из клещей, собранных в Карелии. Генетическое разнообразие вирусов Балтийской группы ВКЭ в одной деревне оказалось сопоставимым с разнообразием всех представителей этой группы на огромной территории от Финляндии на западе до Челябинской области на востоке. Более того, разнообразие вирусов соизмеримо в каждом отдельном регионе. Иначе говоря, на обширной территории происходило и, возможно, продолжает происходить активное перемешивание вирусов. Наиболее правдоподобным объяснением такому наблюдению является участие летающих животных в распространении ВКЭ.
Конкурс «Био/Мол/Текст»-2020/2021
 Эта статья участвовала в конкурсе «Био/Мол/Текст»-2020/2021 в номинации «Своя работа» и будет опубликована в журнале «Природа».
Эта статья участвовала в конкурсе «Био/Мол/Текст»-2020/2021 в номинации «Своя работа» и будет опубликована в журнале «Природа».

Партнер номинации — Российский научный фонд.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение
Вирус клещевого энцефалита (ВКЭ) — опасный арбовирус, широко распространенный в Северной Евразии. Ареал этого патогена со временем меняется. В начале 2000-х годов численность иксодовых клещей в Карелии увеличилась. Эти клещи могут быть переносчиками разных патогенов. Мы [1] выделили десять изолятов ВКЭ из клещей, собранных в Карелии в 2008–2018 годах. После этого отсеквенировали фрагменты геномов (Е-гены) патогенов. Ожидалось, что эти последовательности будут очень похожи друг на друга. Но разнообразие вирусов Балтийской группы в одной деревне оказалось сопоставимым с разнообразием всех представителей этой группы на огромной территории от Финляндии на западе до Челябинской области на востоке. Как так? Что это значит?
Что такое Балт-ВКЭ-Сиб?
Двадцать лет назад ВКЭ разделили на три основных субтипа, которые назвали согласно известному на тот момент географическому распространению: европейский, сибирский и дальневосточный [14]. В целом, сибирский субтип чаще всего находят в Сибири, европейский в Европе, дальневосточный — на Дальнем Востоке. В то же время известно много вирусов, обнаруженных в не соответствующих своему названию регионах [15]. Вирусы европейского субтипа кроме Европы распространены в Южной Корее [16], на Алтае, в Иркутской области. Представителей сибирского субтипа можно обнаружить в Скандинавии [17], Прибалтике [18], Боснии [19], Средней Азии [20], [21] и на Сахалине [22]. Вирусы дальневосточного субтипа описаны на юге Сибири, на Урале, в Прибалтике и Молдавии [13]. В Крыму найдены все три основных субтипа ВКЭ.
Сибирский субтип (ВКЭ-Сиб) состоит из нескольких подгрупп вирусов [10]. В 2000-х годах на территории Финляндии, Эстонии и Латвии обнаружили вирусы, формирующие отдельную подгруппу этого субтипа [18], [23–25]. Вскоре представителей этой балтийской подгруппы ВКЭ-Сиб (Балт-ВКЭ-Сиб) нашли на территории Ярославской, Вологодской, Ленинградской, Свердловской, Курганской областей и республики Карелия (рис. 2) [17], [26–28].
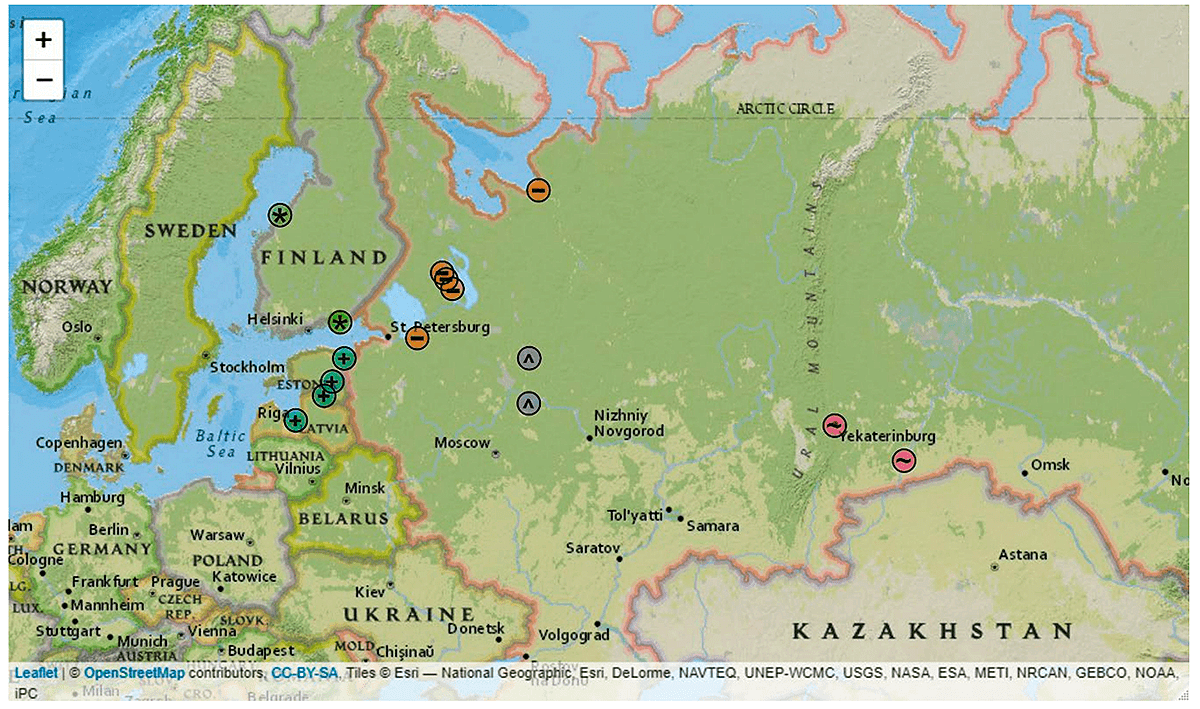
Рисунок 2. Известное распространение Балт-ВКЭ-Сиб. Места сбора клещей, в которых обнаружили Балт-ВКЭ-Сиб, изображены разными символами и цветами: «+» в круге аквамаринового цвета — Эстония, Латвия; «*» в зеленом круге — Финляндия; «–» в оранжевом круге — Архангельская и Ленинградская области, республика Карелия; «^» в сером круге — Вологодская и Ярославская области; «~» в пурпурном круге — Свердловская и Курганская области. Интерактивная карта с подписанными местами сбора клещей доступна по ссылке.
Кто переносит Балт-ВКЭ-Сиб?
Ixodes persulcatus считают основным переносчиком ВКЭ-Сиб [29]. Этого клеща можно обнаружить на широких просторах евразийской тайги от Японии на востоке до Скандинавии на западе. Замечу, что в результате укуса этим клещом можно заразиться не только КЭ, но и, например, анаплазмозом, болезнью Лайма и/или бабезиозом.
В Карелии случаи заболевания человека КЭ регистрируют с 1957 года [30]. В 2000-х годах распространение I. persulcatus в Карелии выросло — клещей этого вида стали находить в тех районах Карелии, где их раньше не регистрировали. Кроме того, численность популяции иксодовых клещей увеличилась, что совпало с ростом заболеваемости людей КЭ [31], [32]. С 2004 года I. persulcatus находят в Финляндии [23], где этот вид стал повсеместно распространенным [33], [34]. В 2015 году таких клещей впервые обнаружили в Швеции [35]. Таким образом, ареал распространения основного переносчика ВКЭ-Сиб с каждым годом увеличивается.
Насколько разнообразны представители Балт-ВКЭ-Сиб в Карелии?
Двенадцать лет назад в Петрозаводске (Карелия) обнаружили зараженных ВКЭ клещей. Благодаря филогенетическому анализу нуклеотидных последовательностей фрагментов генома этих вирусов стало понятно, что ВКЭ-Сиб распространен на юге Карелии [17]. В нашей работе [1] отсеквенировали фрагмент генома одного изолята вируса из клеща, обнаруженного в Петрозаводске, восьми изолятов из клещей, собранных в деревне Гомсельга (37 км к северу от Петрозаводска), одного изолята из клеща, собранного в деревне Педасельга (33 км к югу от Петрозаводска). Мы ожидали, что все эти вирусы произошли от одного общего предка, который относительно недавно появился в Карелии. После анализа нуклеотидных последовательностей эта гипотеза была отвергнута. Среди геномных последовательностей восьми изолятов из Гомсельги нашли отличия вплоть до 4,8% нуклеотидов, что сопоставимо с разнообразием всех представителей Балт-ВКЭ-Сиб. Отмечу, что в геноме ВКЭ за 10 лет меняется примерно 0,1–0,2% нуклеотидов [15], [27], [36].
Какие вирусы больше всего похожи на представителей Балт-ВКЭ-Сиб в Карелии?
Филогенетическое дерево (рис. 3) показывает родство всех известных Балт-ВКЭ-Сиб. Места сбора клещей, в которых когда-либо находили представителей этой группы, искусственно разделили на пять регионов по географическому признаку: 1) Эстония и Латвия (n=11); 2) Финляндия (n=14); 3) Ленинградская и Архангельская области, республика Карелия (n=14); 4) Вологодская и Ярославская области (n=25); и 5) Свердловская и Курганская области (n=7) (рис. 2 и 3).
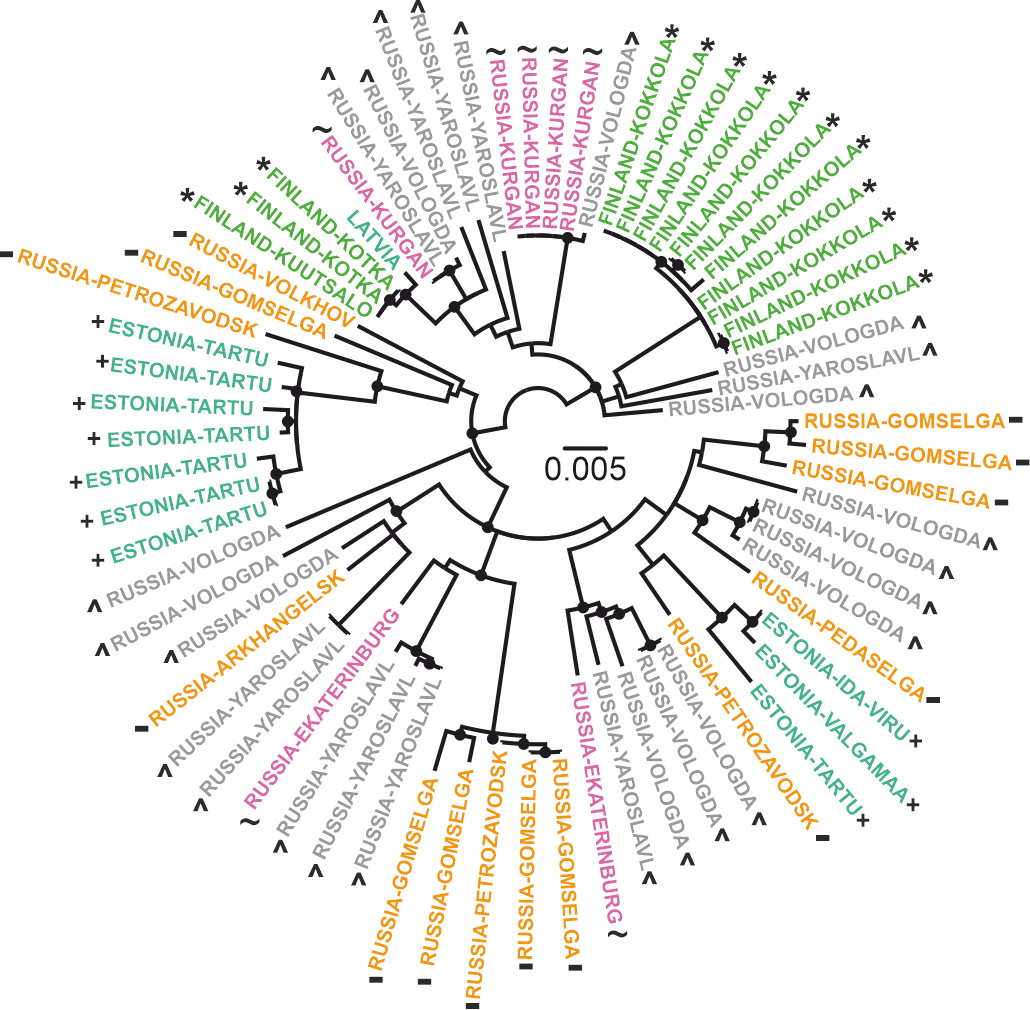
Рисунок 3. Филогенетическое дерево показывает взаимоотношения между Балт-ВКЭ-Сиб из разных географических регионов. Места сбора клещей, в которых обнаружили Балт-ВКЭ-Сиб, изображены разными символами и цветами: аквамариновый, «+» — Эстония и Латвия (n=11); 2) зеленый, «*» — Финляндия (n=14); 3) оранжевый, «–» — Ленинградская и Архангельская области, республика Карелия (n=14); 4) серый, «^» — Вологодская и Ярославская области (n=25); 5) пурпурный, «~» — Свердловская и Курганская области.
Из рисунка 3 видно, что филогенетически ближайшие друг к другу последовательности могут быть получены в разных регионах. Например, четыре изолята из Курганской области (идентификационные номера последовательностей #FJ214128–FJ214131) практически не отличались от ВКЭ из Вологодской области (#FJ214153): 1053 из 1054 нуклеотидов совпали. В то же время изоляты из одной местности могут быть филогенетически дальними. Например, ВКЭ из деревни Гомсельга (республика Карелия) вошли в состав трех разных групп, для каждой из которых были свои «ближайшие родственники».
Каково разнообразие Балт-ВКЭ-Сиб в каждом отдельно взятом регионе в сравнении с картиной в целом?
Распределение попарных генетических расстояний показывает разнообразие Балт-ВКЭ-Сиб как в каждом из пяти отдельно взятых регионов, так и на всей территории распространения патогена (рис. 4). При построении этих диаграмм составили список всех возможных пар последовательностей для каждой выборки. Для каждой пары последовательностей посчитали генетические расстояния. Здесь генетические расстояния рассчитывали как долю несовпадающих нуклеотидов в последовательностях геномов разных изолятов. Для визуализации распределения такой меры филогенетической близости построили гистограммы (рис. 4). Оказалось, что во всех шести выборках генетическое разнообразие сопоставимо. Пара самых непохожих сиквенсов, #MT424736 (республика Карелия, Россия) и #DQ451293 (муниципалитет Коккола, Финляндия), различались в 5,6% нуклеотидов. В то же время последовательности #MT889225 (Петрозаводск, республика Карелия, Россия) и #MT424736 (Гомсельга, республика Карелия, Россия) содержат 5,2% различий. Более того, последовательности двух изолятов из одной деревни Гомсельга (#MT424746 и #MT424737) различались между собой в 4,5% нуклеотидов.
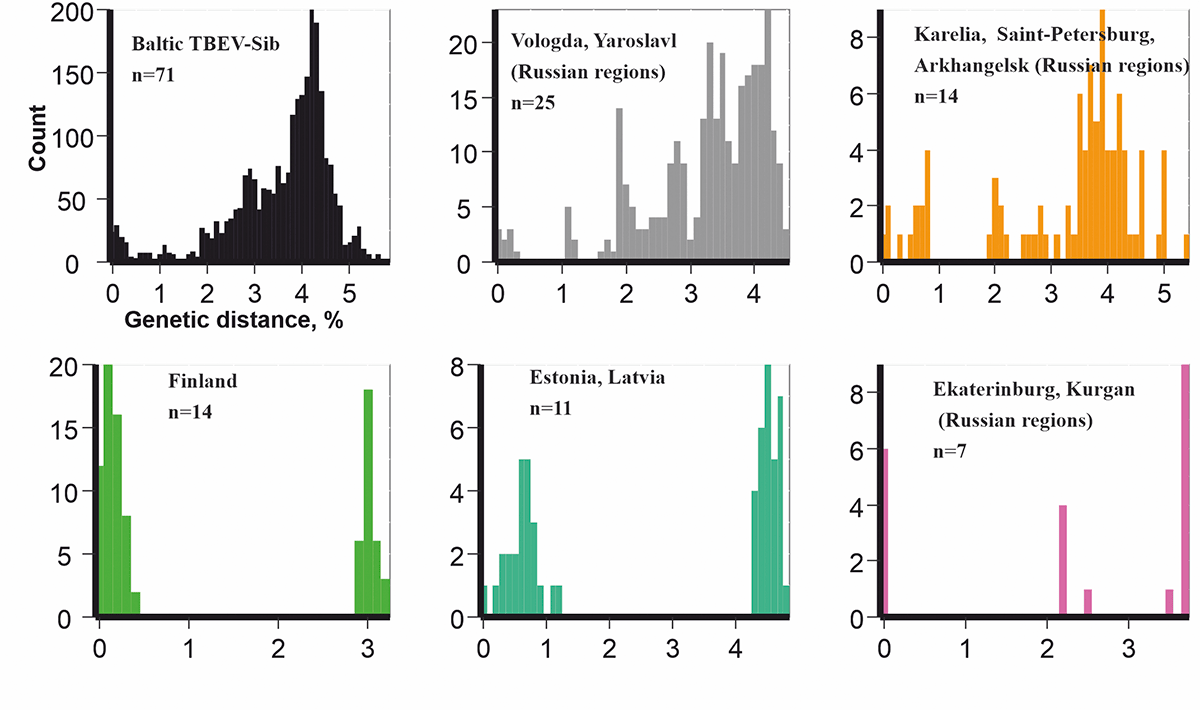
Рисунок 4. Попарные эволюционные расстояния для всех представителей Балт-ВКЭ-Сиб (n = 71), Балт-ВКЭ-Сиб из Вологодской и Ярославской областей (n = 25), Балт-ВКЭ-Сиб из республики Карелия, Ленинградской и Архангельской обласетй (n = 14), Балт-ВКЭ-Сиб из Финляндии (n = 14), Балт-ВКЭ-Сиб из Эстонии и Латвии (n = 11), Балт-ВКЭ-Сиб из Свердловской и Курганской областей (n = 7).
Что означает высокое и примерно одинаковое разнообразие Балт-ВКЭ-Сиб в пяти регионах Евразии?
Системное разнообразие вирусов могло сформироваться за сотни лет независимой эволюции в каждом отдельно взятом регионе. Тем не менее этой гипотезе противоречит то, что в географически далеких локациях находят вирусы с практически идентичными последовательностями генома (рис. 3). Таким образом, вероятнее всего, происходили множественные независимые переносы Балт-ВКЭ-Сиб на дальние расстояния между разными регионами. Клещи не могут самостоятельно далеко мигрировать. Но такие миграции возможны при помощи человека (антропогенный фактор) или другого животного (зоонозный фактор). Известная территория распространения Балт-ВКЭ-Сиб (рис. 2) накладывается на три экологических региона (согласно классификации Всемирного фонда дикой природы): сарматский смешанный лес, скандинавская и российская тайга, тундра и тайга Уральских гор. Российские регионы, расположенные между Свердловской и Ярославской областями (например, Кировская область или Удмуртская республика), принадлежат к этим экологическим зонам и входят в список эндемичных по клещевому вирусному энцефалиту территорий. Район включают в такой список, если там регулярно регистрируют случаи заболевания человека КЭ и находят возбудителя инфекции в клещах. Например, 36 из 160 (22,5%) клещей, собранных в Кировской области в 2016 году, были заражены ВКЭ [37]. К сожалению, в открытом доступе есть всего две последовательности фрагментов генома патогена из Кировской области. Оба изолята — представители другой подгруппы Сибирского субтипа [15]. Таким образом, естественное ограничение нашей работы — это фрагментарность знаний о реальном распространении Балт-ВКЭ-Сиб.
Кроме обозначенных районов I. persulcatus, основной переносчик Балт-ВКЭ-Сиб, распространен в Сибири и на Дальнем Востоке. Если бы зараженные патогеном клещи случайно переносились людьми, то системного разнообразия Балт-ВКЭ-Сиб не наблюдалось бы. Кроме того, в этом случае патоген можно было бы обнаружить в других экологических регионах, где встречается I. persulcatus — ареал этих клещей существенно шире известных зон распространения Балт-ВКЭ-Сиб. Отметим, что более половины всех известных последовательностей генома ВКЭ получены в Приморье и в Новосибирской, а также Иркутской областях. Разнообразие ВКЭ в этих регионах хорошо изучено с точки зрения числа отсеквенированных вирусов. Кроме того, Владивосток, Новосибирск и Иркутск — крупные инфраструктурные центры. То есть при антропогенном распространении Балт-ВКЭ-Сиб представителей этой группы вирусов можно было бы обнаружить в Сибири и на Дальнем Востоке. Тем не менее ни один из примерно 500 отсеквенированных вирусов с этих территорий не принадлежал к Балт-ВКЭ-Сиб.
Согласно актуальным данным, ареал Балт-ВКЭ-Сиб ограничен смешанным лесом и тайгой северо-восточной Европы, а также окрестностями Уральских гор. Такое распространение может быть объяснено вовлечением в жизненный цикл патогена дополнительного животного, чей ареал совпадает с обозначенными экологическими зонами. Если вирус способен к репликации в этом «хозяине», то животное — дополнительный переносчик ВКЭ. Иначе, животное распространяет вирус не напрямую, а путем транспортировки зараженных клещей. Наиболее правдоподобным объяснением активного перемешивания зараженных разными вариантами Балт-ВКЭ-Сиб клещей можно считать вовлечение в жизненный цикл клеща и/или вируса летающего животного.
Сформулируем несколько тезисов, вытекающих из нашего исследования:
- известный ареал Балт ВКЭ-Сиб совпадает с тремя экологическими регионами;
- I. persulcatus, основной переносчик ВКЭ-Сиб, распространен на обширной территории (от Швеции на западе до Японии на востоке) [38];
- Балт-ВКЭ-Сиб не обнаружен в Сибири и на Дальнем Востоке, где разнообразие ВКЭ хорошо изучено;
- Балт-ВКЭ-Сиб — «хорошо перемешанная» популяция вирусов со сравнимым разнообразием в каждом регионе.
Из этих постулатов можно сделать вывод о том, что какое-то летающее животное, способное переносить клещей, выступает в качестве важного звена в циркуляции Балт-ВКЭ-Сиб. Последний общий предок этой группы вирусов существовал сотни лет назад [15]. Если представители Балт-ВКЭ-Сиб способны распространяться без участия мигрирующего в пределах ограниченного ареала животного, то, вероятнее всего, существовали бы следы заносов патогена в Сибирь, чего не наблюдается. Эта группа патогенов характеризуется системными переносами вируса (или зараженных клещей) при помощи неизвестного животного на дальние расстояния в пределах сарматского смешанного леса, скандинавской и российской тайги, тундры и тайги Уральских гор. Отметим, что предположение о возможности репликации ВКЭ напрямую в неизвестном летающем животном спекулятивно и требует экспериментального подтверждения. Существует две группы позвоночных животных, которые могут переносить клещей при полете: летучие мыши [39–41] и птицы [42–47]. Несмотря на то, что по сравнению с птицами летучие мыши мигрируют в среднем на меньшие дистанции [48], дальние перелеты у этих млекопитающих тоже возможны [49–51], хотя и менее вероятны. Роль летучих мышей в распространении ВКЭ сегодня неизвестна. Это может быть вызвано отсутствием актуальных исследований, в которых образцы биоматериала летучих мышей исследовали бы на предмет присутствия ВКЭ. По нашим сведениям, такие работы проводились более сорока лет назад [52–54]. Тем не менее летучие мыши в разной степени вовлечены в циркуляцию некоторых других флавивирусов (вирусов денге, желтой лихорадки, западного Нила, Зика, Усуту, энцефалита Сент-Луис, заболевания леса Кясанур, японского энцефалита) [55]. В совокупности с тем фактом, что летучие мыши могут переносить клещей, нельзя исключать роль этих млекопитающих в распространении Балт-ВКЭ-Сиб.
Клещи, кормящиеся на птицах, бывают заражены ВКЭ [56], [57]. Кроме того, маркеры ВКЭ (вирусная РНК и антиген) [44] или антитела к ВКЭ [58] можно обнаружить непосредственно в биоматериале, полученном от птиц. Это значит, что птицы, вероятно, вовлечены в распространение ВКЭ. Отметим, что некоторых воробьинообразных называют «кольцевыми видами» [59], состоящими из нескольких репродуктивно изолированных подвидов. Например, вид большая синица состоит из четырех подвидов, каждый из которых может рассматриваться как отдельный вид [60]. Эти четыре подвида распространены в разных географических регионах. Интересно заметить, что ареал Балт-ВКЭ-Сиб слегка меньше зоны распространения другого представителя отряда воробьинообразных — западной зеленой пеночки, подвида зеленой пеночки [61]. Тем не менее для того чтобы однозначно подтвердить предположение об активном участии неизвестного летающего животного в циркуляции Балт-ВКЭ-Сиб, требуются дальнейшие полевые исследования.
Выводы
Ограниченный ареал Балт-ВКЭ-Сиб совпадает с активным перемешиванием вирусов между удаленными друг от друга регионами. Это может быть следствием активного распространения ВКЭ летающим животным. Вероятнее всего, это птица, обитающая в пределах сарматского смешанного леса, скандинавской и российской тайги, тундры и тайги Уральских гор. Распространение ВКЭ может происходить опосредованно (при переносе зараженного клеща) или напрямую, если вирус способен размножаться в организме летающего животного.
Работа поддержана грантом РНФ 19-75-00013.
Литература
- Andrei A. Deviatkin, Ivan S. Kholodilov, Oxana A. Belova, Sergey V. Bugmyrin, Lubov A. Bespyatova, et. al.. (2020). Baltic Group Tick-Borne Encephalitis Virus Phylogeography: Systemic Inconsistency Pattern between Genetic and Geographic Distances. Microorganisms. 8, 1589;
- Daniel Ruzek, Tatjana Avšič Županc, Johannes Borde, Ales Chrdle, Ludek Eyer, et. al.. (2019). Tick-borne encephalitis in Europe and Russia: Review of pathogenesis, clinical features, therapy, and vaccines. Antiviral Research. 164, 23-51;
- Julien Beauté, Gianfranco Spiteri, Eva Warns-Petit, Hervé Zeller. (2018). Tick-borne encephalitis in Europe, 2012 to 2016. Eurosurveillance. 23;
- Bohumir Kriz, Zdenek Hubalek, Maly Marek, Milan Daniel, Petra Strakova, Lenka Betasova. (2015). Results of the Screening of Tick-Borne Encephalitis Virus Antibodies in Human Sera from Eight Districts Collected Two Decades Apart. Vector-Borne and Zoonotic Diseases. 15, 489-493;
- Louise Stjernberg, Karin Holmkvist, Johan Berglund. (2008). A newly detected tick-borne encephalitis (TBE) focus in south-east Sweden: A follow-up study of TBE virus (TBEV) seroprevalence. Scandinavian Journal of Infectious Diseases. 40, 4-10;
- Galina B. Maikova, Liubov L. Chernokhaeva, Yulia V. Rogova, Liubov I. Kozlovskaya, Ivan S. Kholodilov, et. al.. (2019). Ability of inactivated vaccines based on far‐eastern tick‐borne encephalitis virus strains to induce humoral immune response in originally seropositive and seronegative recipients. J Med Virol. 91, 190-200;
- Marat Makenov, Lyudmila Karan, Natalia Shashina, Marina Akhmetshina, Olga Zhurenkova, et. al.. (2019). First detection of tick-borne encephalitis virus in Ixodes ricinus ticks and their rodent hosts in Moscow, Russia. Ticks and Tick-borne Diseases. 10, 101265;
- Maya Holding, Stuart D. Dowall, Jolyon M. Medlock, Daniel P. Carter, Steven T. Pullan, et. al.. (2020). Tick-Borne Encephalitis Virus, United Kingdom. Emerg. Infect. Dis.. 26, 90-96;
- Charlotte N Agergaard, Maiken W Rosenstierne, René Bødker, Morten Rasmussen, Peter H S Andersen, Anders Fomsgaard. (2019). New tick-borne encephalitis virus hot spot in Northern Zealand, Denmark, October 2019. Eurosurveillance. 24;
- S.E. Tkachev, I.V. Babkin, G.S. Chicherina, I.V. Kozlova, M.M. Verkhozina, et. al.. (2020). Genetic diversity and geographical distribution of the Siberian subtype of the tick-borne encephalitis virus. Ticks and Tick-borne Diseases. 11, 101327;
- Margriet Dekker, Gozewijn Dirk Laverman, Ankje de Vries, Johan Reimerink, Felix Geeraedts. (2019). Emergence of tick-borne encephalitis (TBE) in the Netherlands. Ticks and Tick-borne Diseases. 10, 176-179;
- F X Heinz, K Stiasny, H Holzmann, M Kundi, W Sixl, et. al.. (2015). Emergence of tick-borne encephalitis in new endemic areas in Austria: 42 years of surveillance. Eurosurveillance. 20;
- Ponomareva E.P., Mikryukova T.P., Gori A.V., Kartashov M.Y., Protopopova E.V., Chausov E.V. et al. (2015). Detection of Far-Eastern subtype of tick-borne encephalitis viral RNA in ticks collected in the Republic of Moldova. J. Vector Borne Dis. 52, 334–336;
- M Ecker, S L Allison, T Meixner, F X Heinz. (1999). Sequence analysis and genetic classification of tick-borne encephalitis viruses from Europe and Asia.. Journal of General Virology. 80, 179-185;
- Andrei A. Deviatkin, Ivan S. Kholodilov, Yulia A. Vakulenko, Galina G. Karganova, Alexander N. Lukashev. (2020). Tick-Borne Encephalitis Virus: An Emerging Ancient Zoonosis?. Viruses. 12, 247;
- Yoshii K., Song J.Y., Park S.B., Yang J., Schmitt H.J. (2017). Tick-borne encephalitis in Japan, Republic of Korea and China. Emerg. Microbes Infect. 6, e82;
- A. E. Jaaskelainen, T. Sironen, G. B. Murueva, N. Subbotina, A. N. Alekseev, et. al.. (2010). Tick-borne encephalitis virus in ticks in Finland, Russian Karelia and Buryatia. Journal of General Virology. 91, 2706-2712;
- Irina Golovljova, Sirkka Vene, Katarina Brus Sjölander, Veera Vasilenko, Alexander Plyusnin, Ake Lundkvist. (2004). Characterization of tick-borne encephalitis virus from Estonia. J. Med. Virol.. 74, 580-588;
- S.E. Tkachev, I.V. Babkin, G.S. Chicherina, I.V. Kozlova, M.M. Verkhozina, et. al.. (2020). Genetic diversity and geographical distribution of the Siberian subtype of the tick-borne encephalitis virus. Ticks and Tick-borne Diseases. 11, 101327;
- Memi Muto, Boldbaatar Bazartseren, Bazartseren Tsevel, Erdenechimeg Dashzevge, Kentaro Yoshii, Hiroaki Kariwa. (2015). Isolation and characterization of tick-borne encephalitis virus from Ixodes persulcatus in Mongolia in 2012. Ticks and Tick-borne Diseases. 6, 623-629;
- Benjamin J. Briggs, Barry Atkinson, Donna M. Czechowski, Peter A. Larsen, Heather N. Meeks, et. al.. (2011). Tick-Borne Encephalitis Virus, Kyrgyzstan. Emerg. Infect. Dis.. 17, 876-879;
- N. M. Pukhovskaya, O. V. Morozova, N. B. Belozerova, S. V. Bakhmetyeva, N. P. Vysochina, et. al.. (2017). Comparative analysis of genomes of tick-borne encephalitis virus strains isolated from mosquitoes and ticks. Voprosy virusologii. 62, 30-35;
- Anu Jaaskelainen, Tapani Tikkakoski, Nathalie Uzcategui, Andrey Alekseev, Antti Vaheri, Olli Vapalahti. (2006). Siberian Subtype Tickborne Encephalitis Virus, Finland. Emerg. Infect. Dis.. 12, 1568-1571;
- Irina Golovljova, Olga Katargina, Julia Geller, Tatjana Tallo, Vassili Mittženkov, et. al.. (2008). Unique signature amino acid substitution in Baltic tick-borne encephalitis virus (TBEV) strains within the Siberian TBEV subtype. International Journal of Medical Microbiology. 298, 108-120;
- Ake Lundkvist, Sirkka Vene, Irina Golovljova, Violeta Mavtchoutko, Marianne Forsgren, et. al.. (2001). Characterization of tick-borne encephalitis virus from latvia: Evidence for co-circulation of three distinct subtypes. J. Med. Virol.. 65, 730-735;
- Maxim A. Khasnatinov, Katarina Ustanikova, Tatiana V. Frolova, Vanda V. Pogodina, Nadezshda G. Bochkova, et. al.. (2009). Non-Hemagglutinating Flaviviruses: Molecular Mechanisms for the Emergence of New Strains via Adaptation to European Ticks. PLoS ONE. 4, e7295;
- S. Yu. Kovalev, D. N. Chernykh, V. S. Kokorev, T. E. Snitkovskaya, V. V. Romanenko. (2009). Origin and distribution of tick-borne encephalitis virus strains of the Siberian subtype in the Middle Urals, the north-west of Russia and the Baltic countries. Journal of General Virology. 90, 2884-2892;
- Погодина В.В., Карань Л.С., Колясникова Н.М., Левина Л.С., Маленко Г.В. и др. (2007). Эволюция клещевого энцефалита и проблема эволюции возбудителя. «Вопросы вирусологии». 52, 16–21.;
- M. LABUDA, P. A. NUTTALL. (2004). Tick-borne viruses. Parasitology. 129, S221-S245;
- Kovalenko A.I., Rubis L.V., Ekimova O.V., Koloda N.I. (2004). Natural foci infections in Republic of Karelia. EpiNorth. 5;
- S. V. Bugmyrin, L. A. Bespyatova, Yu. S. Korotkov. (2019). Long-term dynamics of Ixodes persulcatus (Acari: Ixodidae) abundance in the north–west of its range (Karelia, Russia). Exp Appl Acarol. 77, 229-240;
- Sergey V. Bugmyrin, Liubov A. Bespyatova, Yuri S. Korotkov, Ludmila A. Burenkova, Oxana A. Belova, et. al.. (2013). Distribution of Ixodes ricinus and I. persulcatus ticks in southern Karelia (Russia). Ticks and Tick-borne Diseases. 4, 57-62;
- Maija Laaksonen, Eeva Sajanti, Jani J Sormunen, Ritva Penttinen, Jari Hänninen, et. al.. (2017). Crowdsourcing-based nationwide tick collection reveals the distribution ofIxodes ricinusandI. persulcatusand associated pathogens in Finland. Emerging Microbes & Infections. 6, 1-7;
- Jani J. Sormunen, Tommi Andersson, Jouni Aspi, Jaana Bäck, Tony Cederberg, et. al.. (2020). Monitoring of ticks and tick-borne pathogens through a nationwide research station network in Finland. Ticks and Tick-borne Diseases. 11, 101449;
- Thomas G. T. Jaenson, Kairi Värv, Isabella Fröjdman, Anu Jääskeläinen, Kaj Rundgren, et. al.. (2016). First evidence of established populations of the taiga tick Ixodes persulcatus (Acari: Ixodidae) in Sweden. Parasites Vectors. 9;
- Sergey E. Tkachev, Galina S. Chicherina, Irina Golovljova, Polina S. Belokopytova, Artem Yu. Tikunov, et. al.. (2017). New genetic lineage within the Siberian subtype of tick-borne encephalitis virus found in Western Siberia, Russia. Infection, Genetics and Evolution. 56, 36-43;
- E. A. Bessolitsyna, S. A. Volkov, F. S. Stolbova. (2017). DYNAMICS OF TICKS’ INFESTATION WITH BORRELIA GENUS BACTERIA AND TICK-BORNE ENCEPHALITIS VIRUS IN KIROV REGION. iimm. 7, 171-180;
- Gabriele Margos, Volker Fingerle, Stuart Reynolds. (2019). Borrelia bavariensis: Vector Switch, Niche Invasion, and Geographical Spread of a Tick-Borne Bacterial Parasite. Front. Ecol. Evol.. 7;
- Jizhou Lv, Maria del Mar Fernández de Marco, Hooman Goharriz, L. Paul Phipps, Lorraine M. McElhinney, et. al.. (2018). Detection of tick-borne bacteria and babesia with zoonotic potential in Argas (Carios) vespertilionis (Latreille, 1802) ticks from British bats. Sci Rep. 8;
- Attila D. Sándor, Alexandra Corduneanu, Áron Péter, Andrei Daniel Mihalca, Levente Barti, et. al.. (2019). Bats and ticks: host selection and seasonality of bat-specialist ticks in eastern Europe. Parasites Vectors. 12;
- Jaunbauere G., Salmane I., Spungis V. (2008). Occurrence of bat ectoparasites in Latvia. Latv. Entomol. 45, 38–42;
- Christine Klaus, Jörn Gethmann, Bernd Hoffmann, Ute Ziegler, Martin Heller, Martin Beer. (2016). Tick infestation in birds and prevalence of pathogens in ticks collected from different places in Germany. Parasitol Res. 115, 2729-2740;
- Elena Lommano, Charles Dvořák, Laurent Vallotton, Lukas Jenni, Lise Gern. (2014). Tick-borne pathogens in ticks collected from breeding and migratory birds in Switzerland. Ticks and Tick-borne Diseases. 5, 871-882;
- Tamara P. Mikryukova, Nina S. Moskvitina, Yulia V. Kononova, Igor G. Korobitsyn, Mikhail Y. Kartashov, et. al.. (2014). Surveillance of tick-borne encephalitis virus in wild birds and ticks in Tomsk city and its suburbs (Western Siberia). Ticks and Tick-borne Diseases. 5, 145-151;
- Gunnar Hasle. (2013). Transport of ixodid ticks and tick-borne pathogens by migratory birds. Front. Cell. Infect. Microbiol.. 3;
- Anna Michelitsch, Kerstin Wernike, Christine Klaus, Gerhard Dobler, Martin Beer. (2019). Exploring the Reservoir Hosts of Tick-Borne Encephalitis Virus. Viruses. 11, 669;
- Jonas Waldenström, Ake Lundkvist, Kerstin I. Falk, Ulf Garpmo, Sven Bergström, et. al.. (2007). Migrating Birds and Tickborne Encephalitis Virus. Emerg. Infect. Dis.. 13, 1215-1218;
- Theodore H. Fleming. (2019). Bat Migration. Encyclopedia of Animal Behavior. 605-610;
- Amy L. Russell, Corinna A. Pinzari, Maarten J. Vonhof, Kevin J. Olival, Frank J. Bonaccorso. (2015). Two Tickets to Paradise: Multiple Dispersal Events in the Founding of Hoary Bat Populations in Hawai'i. PLoS ONE. 10, e0127912;
- Billie J. Roberts, Carla P. Catterall, Peggy Eby, John Kanowski. (2012). Long-Distance and Frequent Movements of the Flying-Fox Pteropus poliocephalus: Implications for Management. PLoS ONE. 7, e42532;
- Paul M. Cryan. (2003). SEASONAL DISTRIBUTION OF MIGRATORY TREE BATS (LASIURUS AND LASIONYCTERIS) IN NORTH AMERICA. Journal of Mammalogy. 84, 579-593;
- Havlik O. and Kolman J. (1957). The demonstration of antibodies against the virus of the tick-borne encephalitis in certain bats. J. Hyg. Epidemiol. Microbiol. Immunol. 1, 231–233;
- Drobishchenko N.I., L'vov D.K., Ukbaeva T.D., Kiriushchenko T.V., Karimov S.K. (1978). Eksperimental'noe podtverzhdenie persistentsii virusa kleshchevogo entsefalita u letuchikh mysheĭ v zimniĭ period [Experimental corroboration of the persistence of the tick-borne encephalitis virus in bats in wintertime]. Med. parazitol. 47, 81–82;
- Nosek J., Gresikova M., Rehacek J. (1961). Persistence of tick-borne encephalitis virus in hibernating bats. Acta Virol. 5, 112–116;
- Anna C. Fagre, Rebekah C. Kading. (2019). Can Bats Serve as Reservoirs for Arboviruses?. Viruses. 11, 215;
- Julia Geller, Lidia Nazarova, Olga Katargina, Agu Leivits, Lilian Järvekülg, Irina Golovljova. (2013). Tick-Borne Pathogens in Ticks Feeding on Migratory Passerines in Western Part of Estonia. Vector-Borne and Zoonotic Diseases. 13, 443-448;
- Alisa Kazarina, Kristīne Japiņa, Oskars Keišs, Ineta Salmane, Dace Bandere, et. al.. (2015). Detection of tick-borne encephalitis virus in I. ricinus ticks collected from autumn migratory birds in Latvia. Ticks and Tick-borne Diseases. 6, 178-180;
- Tomáš Csank, Ľuboš Korytár, Terézia Pošiváková, Tamás Bakonyi, Juraj Pistl, Alexander Csanády. (2019). Surveillance on antibodies against West Nile virus, Usutu virus, tick-borne encephalitis virus and Tribeč virus in wild birds in Drienovská wetland, Slovakia. Biologia. 74, 813-820;
- Darren E. Irwin, Jessica H. Irwin, Trevor D. Price. (2001). . Genetica. 112/113, 223-243;
- Laura Kvist, Jochen Martens, Hiroyoshi Higuchi, Alexander A. Nazarenko, Olga P. Valchuk, Markku Orell. (2003). Evolution and genetic structure of the great tit (Parus major) complex. Proc. R. Soc. Lond. B. 270, 1447-1454;
- Miguel Alcaide, Elizabeth S. C. Scordato, Trevor D. Price, Darren E. Irwin. (2014). Genomic divergence in a ring species complex. Nature. 511, 83-85.